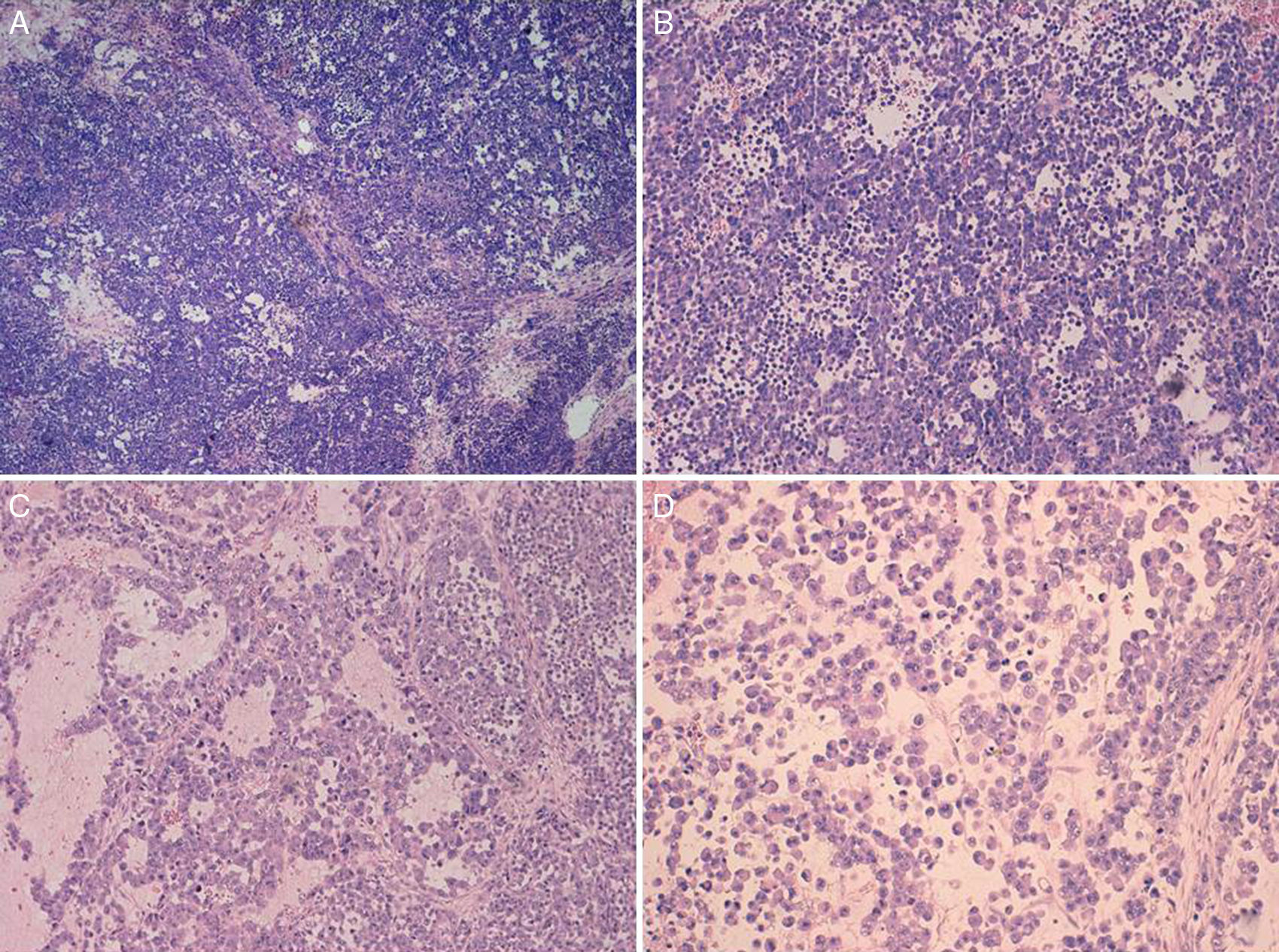
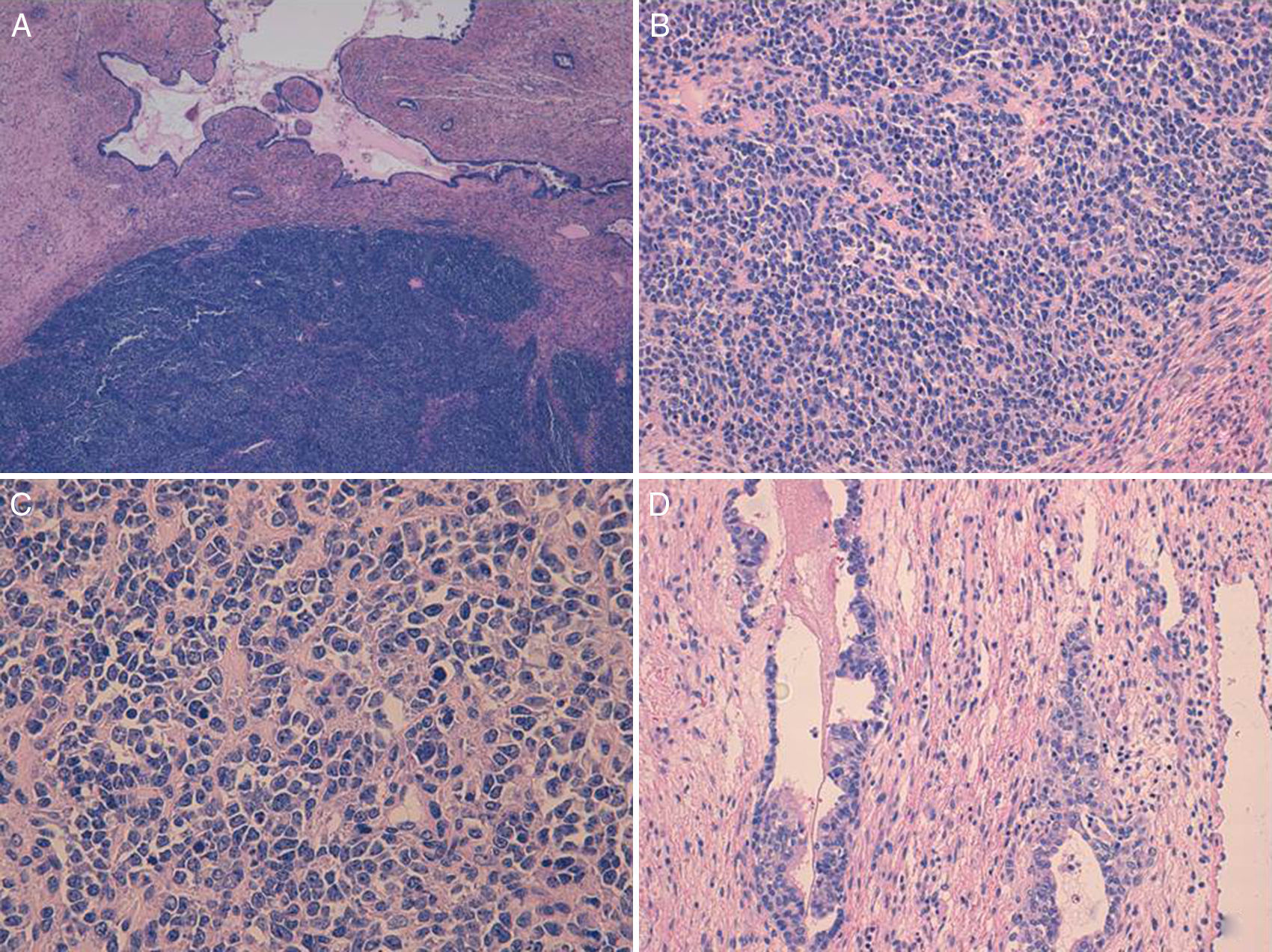
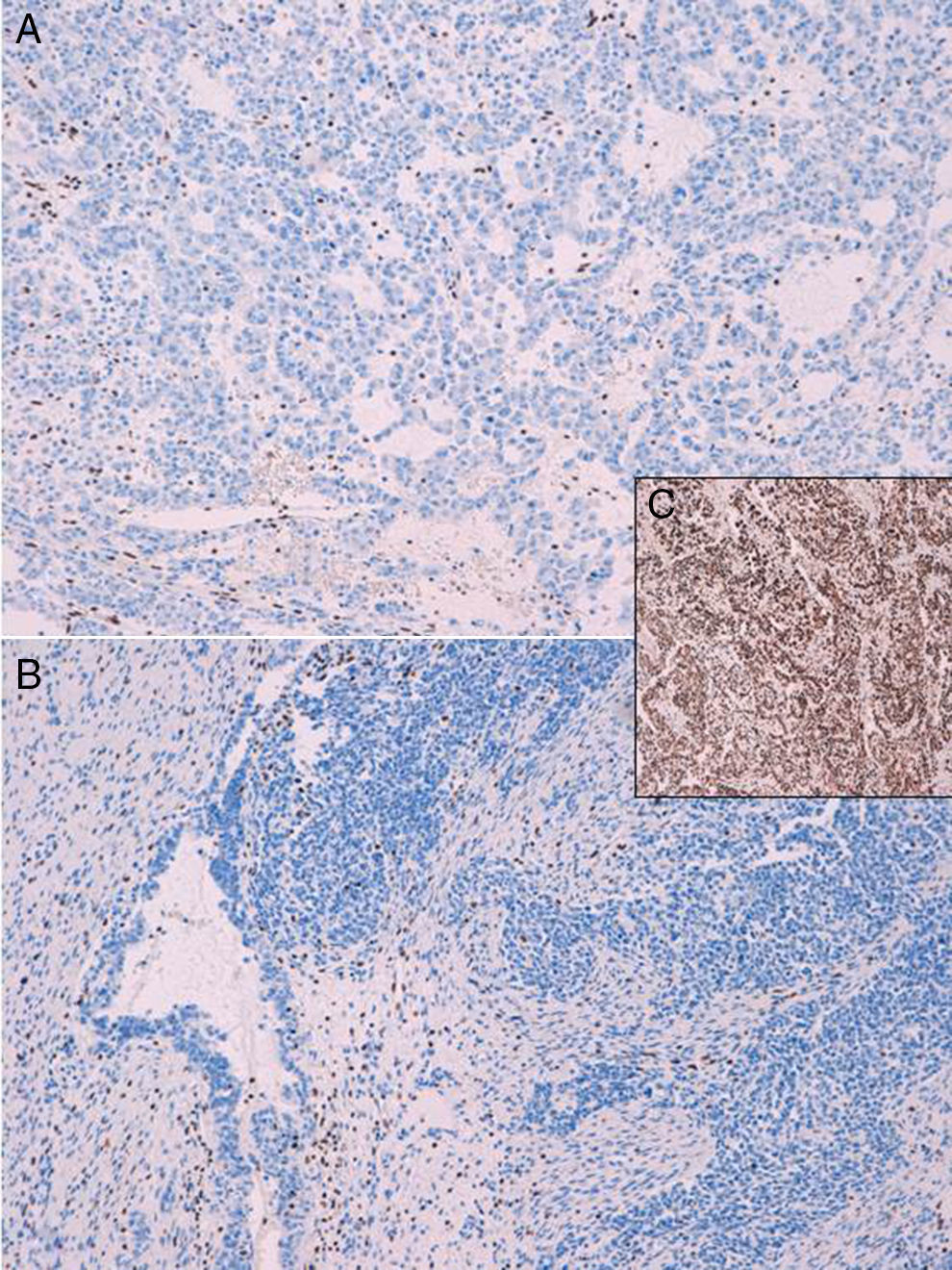
El carcinoma de células pequeñas de ovario variante hipercalcémica se describe dentro de los tumores de origen histológico incierto. Presentamos 2 casos en mujeres de 32 y 29años de edad, respectivamente. En el momento del diagnóstico ambas pacientes presentaban masas de gran tamaño en las que no era posible realizar cirugía completa. Histológicamente los dos tumores mostraban una proliferación celular difusa de células pequeñas con espacios pseudofoliculares. La imagen microscópica, en ambos casos, planteó diagnóstico diferencial con entidades como el tumor de células de la granulosa tipo adulto o juvenil, el carcinoma de células pequeñas de tipo pulmonar, el disgerminoma, e incluso con un tumor neuroectodérmico periférico. Para ello, la ausencia de inmunotinción para SMARCA4/BRG1 en la totalidad de las células tumorales junto a una imagen histológica concreta son de gran utilidad en el diagnóstico de esta entidad.
Small cell carcinoma of ovary-hypercalcemic type is an undifferentiated carcinoma. We describe two cases in women aged 32 and 29. Both presented with large masses and complete surgical extirpation was impossible. Histologically, the images were similar, with diffuse cell proliferation, accompanied by the presence of follicle-like spaces. In both cases it was necessary to make a differential diagnosis with entities such as adult or juvenile granulosa cell tumour, small cell carcinoma of pulmonary type, dysgerminoma and even peripheral neuroectodermal tumour. The absence of SMARCA4/BRG1 immunostaining proved very useful in the diagnosis of hypercalcemic small cell ovarian carcinoma.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora