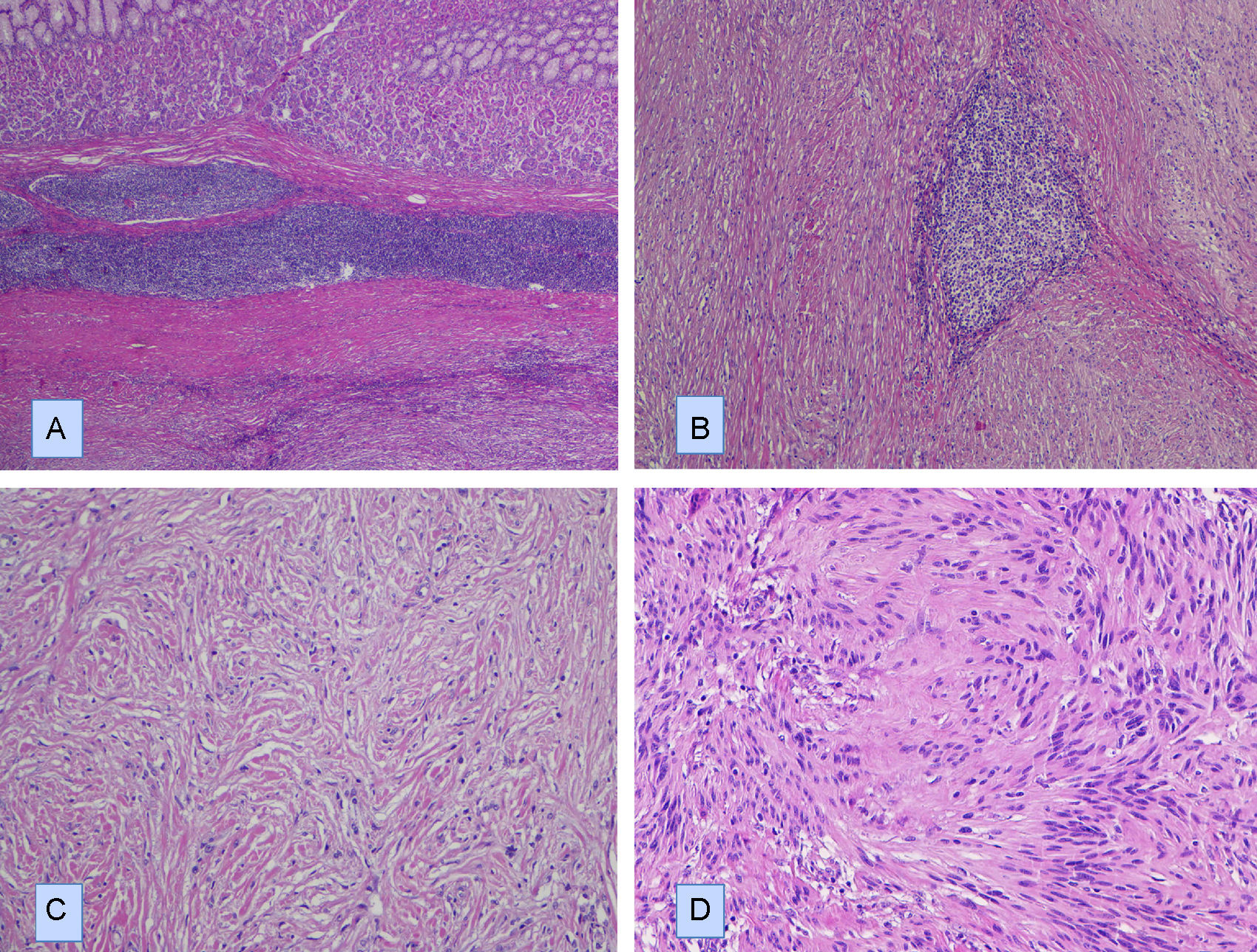
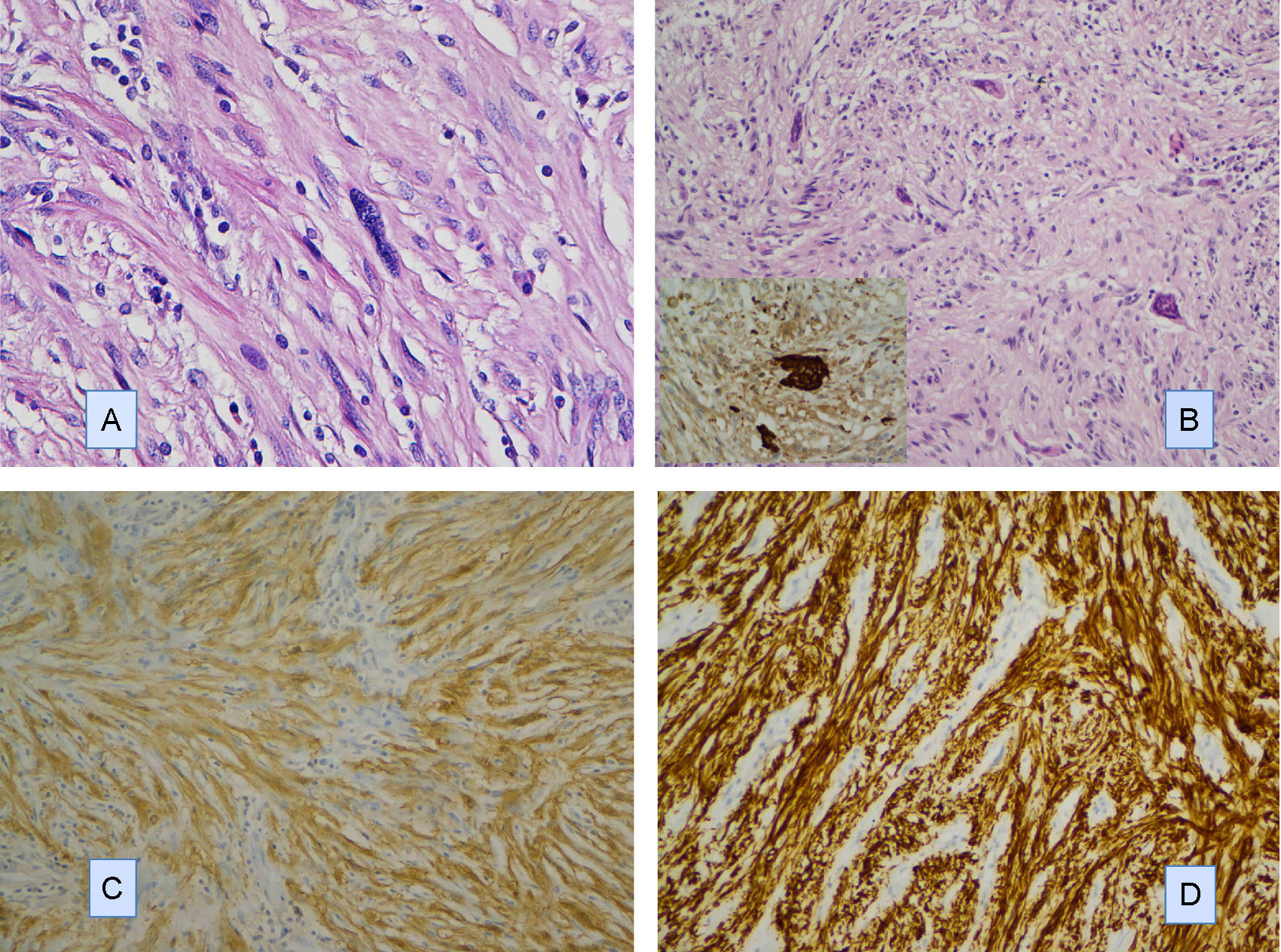
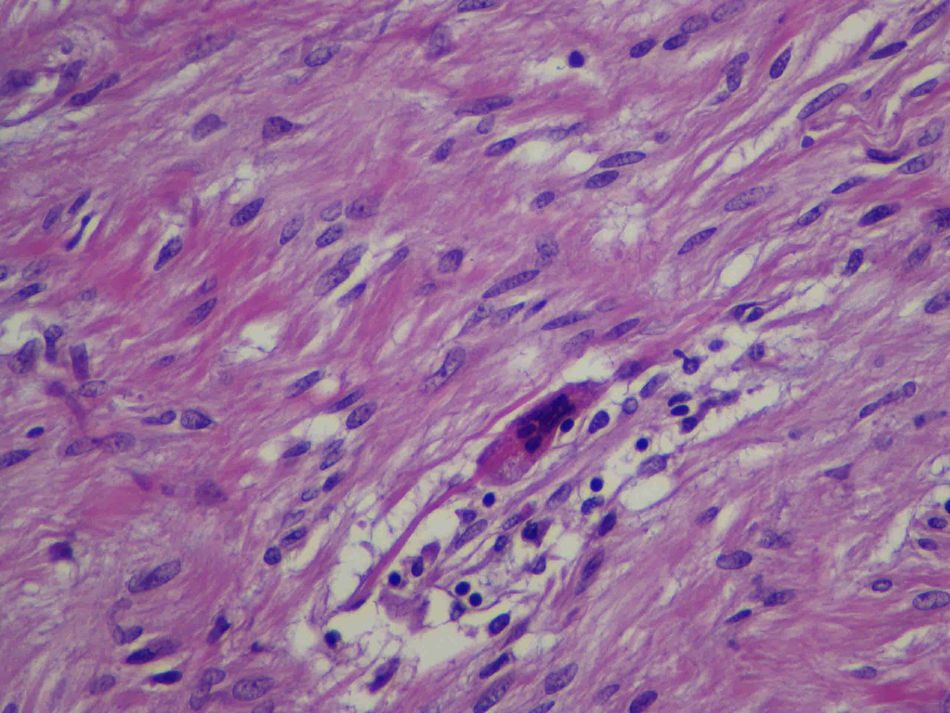
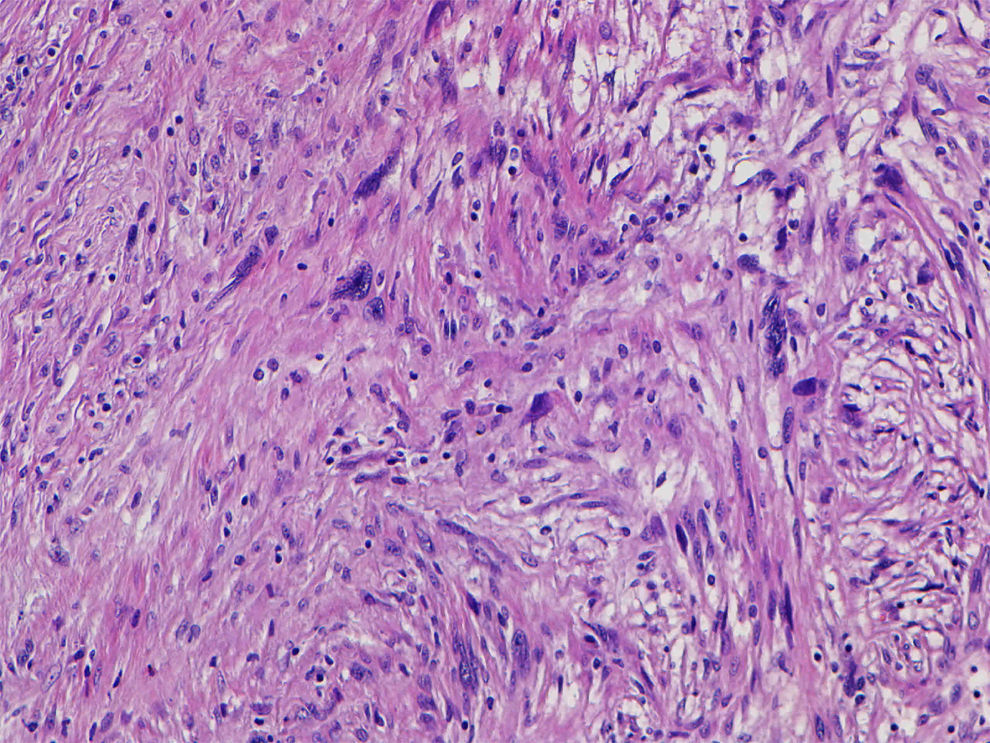
Describimos el caso de un schwannoma gástrico en un paciente de 64 años que clínica y radiológicamente simulaba un tumor del estroma gastrointestinal. Se realizó una gastrectomía parcial y se encontró un tumor de 4cm de diámetro en la pared muscular, con mucosa íntegra. Microscópicamente, presentó un patrón de crecimiento fusocelular con notable presencia de acúmulos linfoides en la periferia e intralesionales. Se observaron escasas formaciones similares a cuerpos de Verocay abortivas. Además, se observaron células gigantes multinucleadas tipo osteoclástico dispersas aleatoriamente. Las células fusiformes mostraron atipia leve focal. No se identificaron figuras de mitosis. Inmunohistoquímicamente, las células fusiformes se tiñeron intensa y difusamente con S-100 y GFAP, mientras que las tinciones de CD34, CD117 y DOG1 fueron negativas. Las células multinucleadas fueron CD68 positivas. Describimos brevemente su diagnóstico diferencial.
We describe a gastric schwannoma in a 64 year-old man which clinical and radiologically simulated a gastrointestinal stromal tumor. A partial gastrectomy was performed showing an intramuscular wall tumour measuring 4cm in diameter with unaffected mucosa. Microscopically the tumour presented a spindle cell pattern showing cuffing of lymphoid aggregates in the periphery and interstitium. Scattered abortive Verocay-like formations were present. In addition, some multinucleated osteoclastic-type cells were evenly dispersed. The spindle cells showed focal nuclear atypia. No mitotic figures were recorded. Immunohistochemically, the fusiform cells were strongly and diffusely positive for S-100 and GFAP, whereas stains for CD34, CD117 and DOG1 were negative. Multinucleated cells were CD68 positive. We briefly discuss the differential diagnosis.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora