El diagnóstico del biomarcador HER2 es un factor imprescindible en el manejo de los pacientes de carcinoma infiltrante de mama. La sobreexpresión del HER2, observada en aproximadamente el 15% de los pacientes, se asocia a mal pronóstico. La determinación del HER2 se realiza o bien por IHQ, o bien por HIS, siendo ambas técnicas válidas, intercambiables y necesarias para los casos equívocos. Las guías clínicas ASCO/CAP son un instrumento útil para la estandarización y mejora del diagnóstico, sin embargo, tienen sus puntos débiles; por ejemplo, la categoría de resultados equívocos genera inconvenientes en la práctica clínica. Al tratarse de documentos vivos y cambiantes, estas guías son susceptibles de cambio bajo la luz de nuevas observaciones.
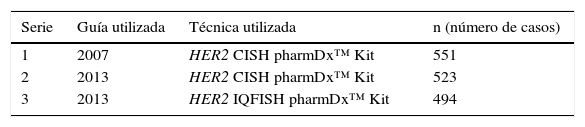
Se realiza el estudio de 3 series consecutivas y distintas de 1.568 casos HER2 equívocos (IHQ 2+) de carcinoma infiltrante de mama, procedentes de distintos hospitales españoles. El objetivo de este estudio es comparar los resultados de HIS obtenidos, en nuestro centro de referencia, al aplicar las distintas guías clínicas para el HER2 (2007 y 2013), además de comparar distintas técnicas de HIS entre sí (CISH e IQ-FISH).
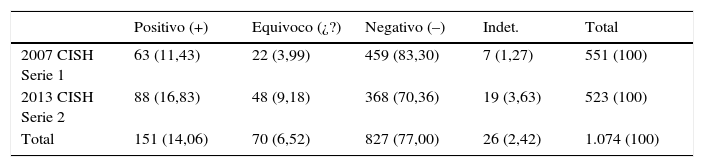
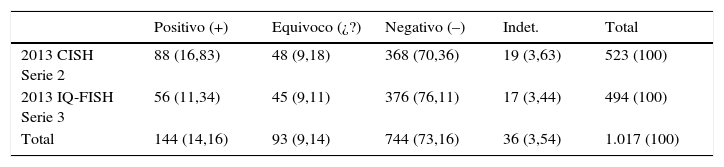
Nuestros resultados indican que la aplicación de la guía 2013 aumenta el porcentaje (%) de resultados equívocos respecto a la del 2007. Y también nos permiten afirmar que cualquiera de las 2 técnicas de HIS es válida para el estudio del HER2.
HER2 biomarker assessment is essential for the correct management of invasive breast carcinoma. Overexpression of HER2, observed in approximately 15% of the patients, is associated with a bad prognosis. HER2 determination can be carried out either by IHQ or by HIS as both are valid, interchangeable and necessary techniques for equivocal cases. Although the clinical guidelines ASCO/CAP are a useful tool for diagnostic standardization and improvement, they have drawbacks; for instance, the category of equivocal results can create problems in routine clinical practice. As they are on-going documents, they are susceptible to change in the light of new observations.
We studied three consecutive and different series of 1,568 HER2 equivocal invasive breast carcinoma (IHQ 2+), from different Spanish hospitals. The aim of this study was to compare both the ISH results in our laboratory when applying the different clinical guidelines for the HER2 (2007 and 2013) and the different ISH techniques (CISH and IQ-FISH).
Our results indicate that the use of the 2013 guidelines increases the percentage of equivocal results with respect 2007. We confirmed that both of the ISH techniques are valid for the study of the HER2 biomarker.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora