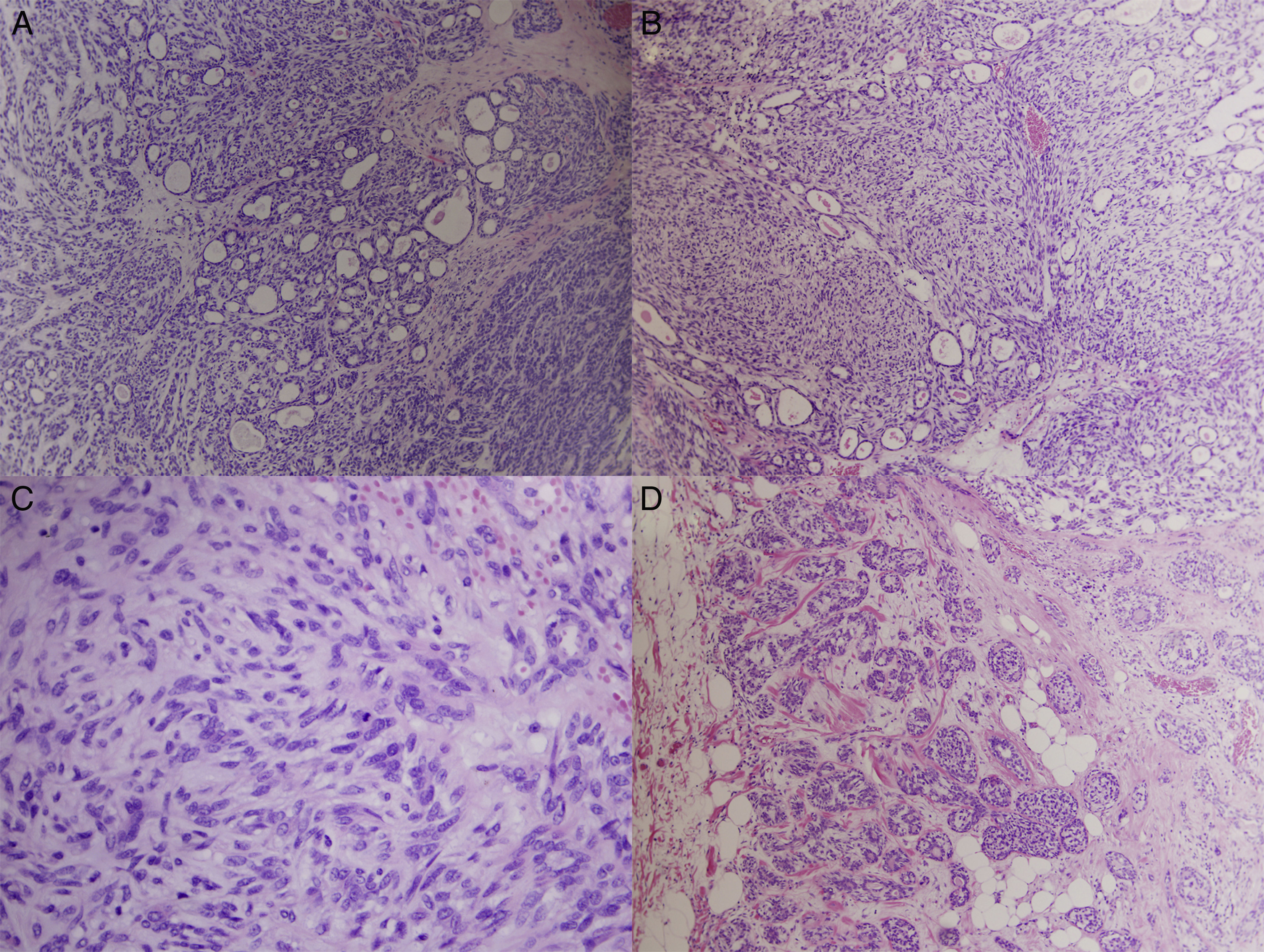
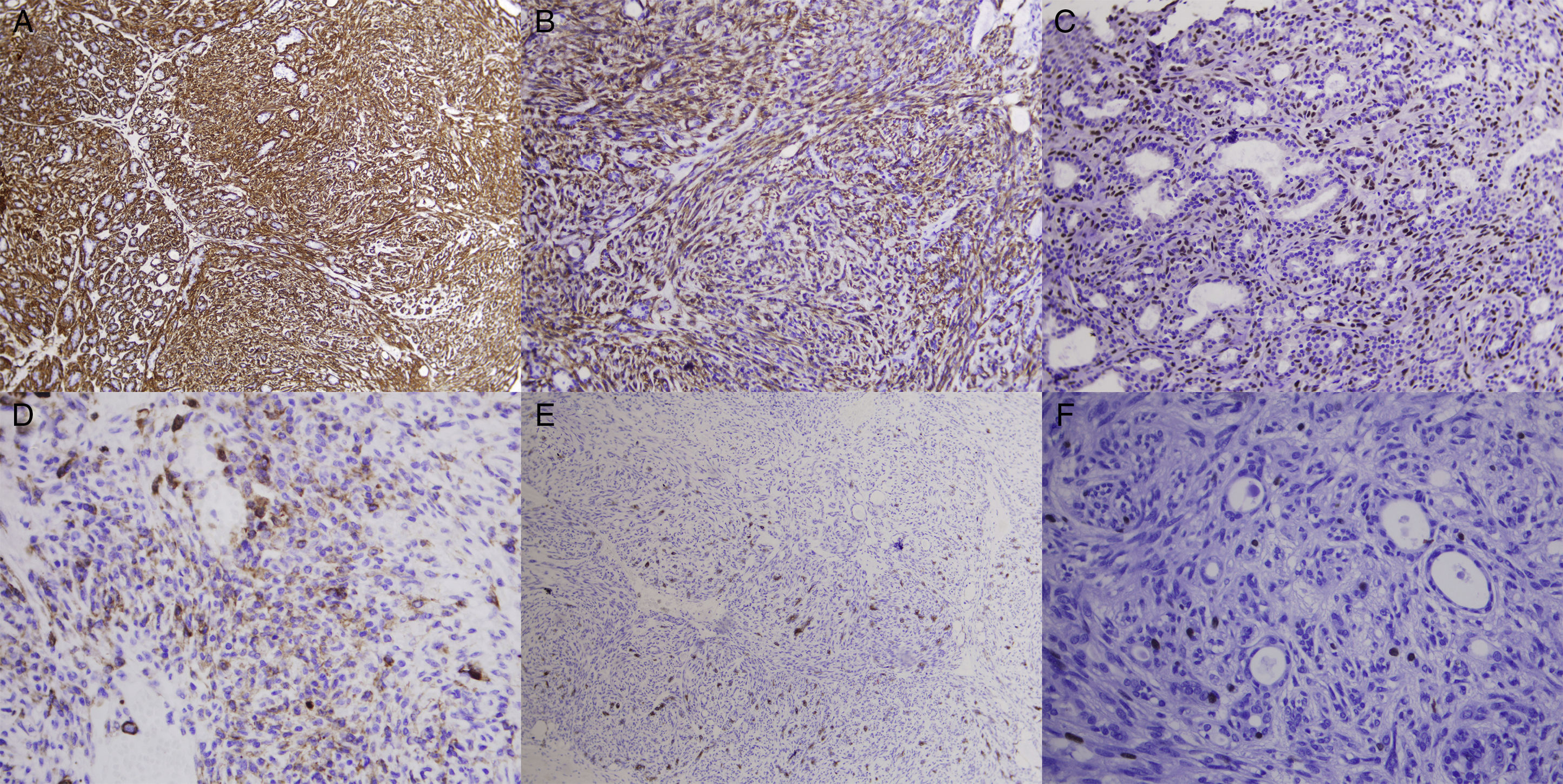
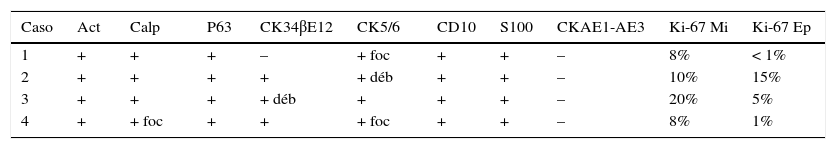
Los adenomioepiteliomas (AME) mamarios son tumores muy poco frecuentes, de histología variable, que pueden simular otras lesiones epiteliales, mioepiteliales y bifásicas de la mama. En el presente estudio analizamos los hallazgos clínico-patológicos de 4 casos de AME diagnosticados en el Hospital Clínico San Carlos en el periodo 2005-2015. La media de edad fue de 57años. Eran nódulos sólidos de bordes irregulares localizados en todos los casos en cuadrantes superiores (3 en mama derecha y uno en mama izquierda), con tamaño medio de 13mm. Microscópicamente 2 de ellos eran variante tubular y 2, lobulada. Se observaron cambios hialinos, áreas mixoides, quísticas, pseudoinfiltración periférica y nódulos satélite en algunos de los casos. Las células mioepiteliales eran fusiformes y fueron positivas para actina, calponina, p63, S100 y CD10 y negativas para CKAE1-AE3, con CK34BE12 y CK5/6 variables. En todos los casos la tumorectomía fue curativa, sin recurrencias ni transformación maligna.
Adenomyoepitheliomas of the breast are infrequent tumors with a variable histological appearance, and they can mimic several epithelial, myoepithelial and biphasic lesions of the breast. We have reviewed four cases of adenomyoepithelioma of the breast diagnosed between 2005 and 2015 in our institution (Hospital Clínico San Carlos). Mean age was 57years. All lesions were solid irregular masses located in the upper quadrants (3 of them in the right breast and one in the left), with an average size of 13mm. Microscopically 2 of them were tubular and the remaining 2 were lobulated subtypes. Hyaline, myxoid and cystic areas, peripheral pseudoinfiltration and satellite nodules were occasionally seen. Myoepithelial cells were fusiform and immunohistochemically they were actin, calponin, p63, S100 and CD10 positive and CKAE1-AE3 negative, with variable CK23BE12 and CK5/6 staining. In all cases lumpectomy was curative, no recurrences or malignant degeneration were observed.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora