La velocidad de la marcha (VM) a paso habitual es una medida fácil, rápida, económica, fiable e informativa. Con un cronómetro, como los que actualmente se encuentran en todos los móviles, dos marcas en el suelo y una mínima estandarización, un profesional sanitario obtiene una medida más objetiva y rápida respecto a muchas de las escalas habituales de valoración de las actividades de la vida diaria, por ejemplo. La VM es uno de los pilares del fenotipo de fragilidad y está fuertemente relacionada con la sarcopenia. Es un potente marcador de caídas, discapacidad incidente y de muerte, útil sobre todo como cribado en el ámbito comunitario o de atención primaria. Paralelamente, en los últimos años empieza a tener evidencia también en el pronóstico de procesos médicos agudos o en el paciente posquirúrgico, y se está estudiando la utilidad de esta herramienta en los pacientes con demencia, a la luz de su relación con las alteraciones cognitivas.
La VM cumple los requerimientos fundamentales para una buena herramienta de cribado. Sin embargo, no se utiliza en la práctica clínica. ¿Por qué? Esta revisión, que no pretende ser sistemática ni exhaustiva, tiene diferentes objetivos: 1)revisar la relación entre VM y fragilidad; 2)revisar las principales técnicas de mediciön; 3)aportar evidencia en diferentes perfiles clínicos (personas mayores aparentemente sanas, con deterioro cognitivo, con cáncer, con otras patologías o problemas de salud) y en diferentes ámbitos (comunitario, hospitalización, rehabilitación), y 4)reflexionar de manera crítica sobre por qué todavía no se utiliza de manera rutinaria y qué faltaría para potenciar esta utilización.
Gait speed (GS), measured at usual pace, is an easy, quick, reliable, non-expensive and informative measurement. With a standard chronometer, like those that currently found in mobile phones, and with two marks on the floor, trained health professionals obtain a more objective and quick measurement compared with many geriatric scales used in daily practice. GS is one of the pillars of the frailty phenotype, and is closely related to sarcopenia. It is a powerful marker of falls incidence, disability and death, mostly useful in the screening of older adults that live in the community. In recent years, the evidence is reinforcing the usefulness of GS in acute care and post-surgical patients. Its use in patients with cognitive impairment is suggested, due to the strong link between cognitive and physical function.
Although GS meets the criteria for a good geriatric screening tool, it is not much used in clinical practice. Why? This review has different aims: (i)disentangling the relationship between GS and frailty; (ii)reviewing the protocols to measure GS and the reference values; (iii)reviewing the evidence in different clinical groups (older adults with frailty, with cognitive impairment, with cancer or other pathologies), and in different settings (community, acute care, rehabilitation), and (iv)speculating about the reasons for its poor use in clinical practice and about the gaps to be filled.
La fragilidad es un estado de vulnerabilidad a padecer eventos adversos de salud como discapacidad, deterioro cognitivo, institucionalización, caídas y muerte1. Fisiopatológicamente se relaciona con una reducción de la reserva de diferentes órganos y sistemas fisiológicos, con la consecuente reducción de la capacidad de respuesta adaptativa ante factores «estresantes», que pueden ser tanto clínicos como psicológicos o sociales. Un individuo frágil presenta una autonomía fundamentalmente preservada pero un riesgo elevado de padecer problemas de salud, que a la vez pueden desencadenar una cascada de dependencia2. Detectar la fragilidad podría permitir instaurar intervenciones preventivas, entendidas inclusive como prevención primaria, por ejemplo de la discapacidad. En cambio, la identificación de personas con pluripatología avanzada o discapacidad a menudo tiene más una finalidad de compensación de la patología o de los déficits, o paliativa. Por otro lado, tanto la discapacidad como sobre todo la fragilidad son reversibles en numerosas ocasiones3, lo que refuerza la necesidad detección precoz para intervenir.
Una herramienta de cribado para detectar fragilidad debe ser rápida, segura, sensible y económica para hacer viable su uso en la práctica habitual. El Cardiovascular Health Study (CHS) analizó los factores pronósticos de mortalidad en población sana de más de 65años residente en la comunidad, y derivó el histórico fenotipo de fragilidad de Fried, que sumaba los déficit de 5 dominios, como la pérdida de peso no intencional, la debilidad muscular, el agotamiento, la actividad física reducida y el enlentecimiento4. Este último se concretaba en una velocidad de la marcha (VM) reducida. Según este modelo, y de acuerdo con diferentes modelos teóricos sobre el proceso de envejecimiento5, la función física representa uno de los pilares del concepto de fragilidad y podría representar la vía final común mediante la que se manifiestan la reducción de la reserva fisiológica de órganos y sistemas, como el sistema nervioso, el cardiovascular o el musculoesquelético, que influyen en el mantenimiento de una función física adecuada, y de muy diversas patologías y situaciones clínicas que los afectan.
La velocidad de la marcha: herramienta para medir la función físicaLa escala Short Portable Performance Battery (SPPB) es una de las más utilizadas para medir la función física. Incluye 3 pruebas, estandarizadas y puntuadas, como la VM a paso habitual, ponerse de pie desde una silla y el equilibrio en 3 posiciones (pies paralelos, semitándem y tándem). En el estudio NHANES, una peor puntuación del SPPB en personas mayores residentes en la comunidad sin discapacidad se asociaba a un riesgo incrementado de padecer discapacidad en los 5años sucesivos6. Estudios sucesivos han investigado la hipótesis de que la VM sea por sí sola tan buen detector de fragilidad como otras herramientas más complejas disponibles, como por ejemplo el SPPB. Según Guralnik et al.7, de las variables de función física disponibles, la VM a paso habitual es la más adecuada para ser aplicada en la práctica clínica para evaluar la población geriátrica. Comparando sensibilidad y especificidad (mediante curvas ROC), la VM por sí sola parece tan buen predictor de discapacidad en las actividades instrumentales de la vida diaria como el SPPB, y el SPPB entero aportaría más información que la VM solo en el subgrupo de individuos funcionalmente más preservados8. Sucesivamente, otros estudios han comparado la VM con otro tests de función física muy conocidos y utilizados, como el Timed Up and Go (TUG) o el performance oriented mobility assessment (POMA), en cuanto a la predicción de eventos adversos, caídas y hospitalizaciones con resultados aparentemente superiores de la VM9,10. También en el ámbito de atención primaria y comunitaria se ha analizado la utilidad de VM como cribado de fragilidad, con buenos resultados11. La VM podría tener inclusive relevancia a nivel de salud pública y planificación, como demuestran los resultados del estudio SHARE aplicados a la población española, en base a los cuales se tendría que revisar el tiempo de activación de los semáforos para adaptarlos a las personas frágiles12.
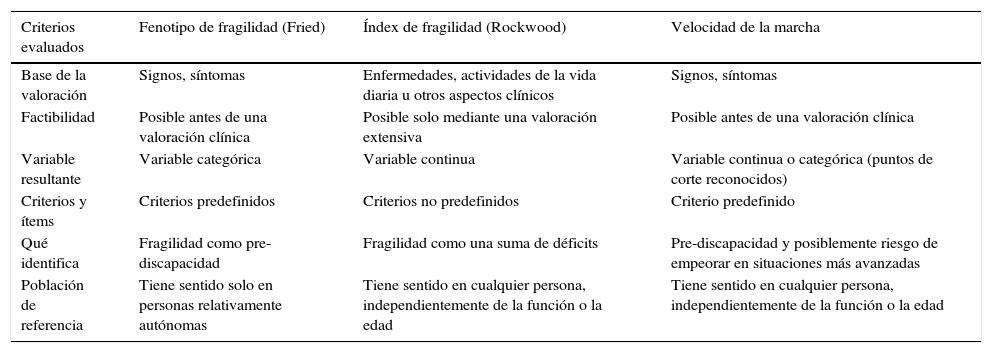
En los últimos años se han dedicado muchos esfuerzos para operativizar el concepto de fragilidad, y no es casual que en diferentes instrumentos validados recientemente tanto en el ámbito comunitario (como el Gerontopole Frailty Screening Tool13) como en el hospitalario (Frailty Trait Scale14) la VM represente uno de los ítems principales. En relación a la definición operativa de fragilidad, sobre la cual no hay todavía consenso y que ha sido criticada recientemente por diferentes trabajos de revisión15, la VM presenta diferentes puntos a favor para que pueda representar quizás un proxy o marcador directo (tabla 1). El rol de la VM como predictor de discapacidad incidente16 añade argumentos a favor de la VM como marcador de fragilidad.
La velocidad de la marcha como marcador de fragilidad. Comparativa con diferentes escalas de fragilidad
| Criterios evaluados | Fenotipo de fragilidad (Fried) | Índex de fragilidad (Rockwood) | Velocidad de la marcha |
|---|---|---|---|
| Base de la valoración | Signos, síntomas | Enfermedades, actividades de la vida diaria u otros aspectos clínicos | Signos, síntomas |
| Factibilidad | Posible antes de una valoración clínica | Posible solo mediante una valoración extensiva | Posible antes de una valoración clínica |
| Variable resultante | Variable categórica | Variable continua | Variable continua o categórica (puntos de corte reconocidos) |
| Criterios y ítems | Criterios predefinidos | Criterios no predefinidos | Criterio predefinido |
| Qué identifica | Fragilidad como pre-discapacidad | Fragilidad como una suma de déficits | Pre-discapacidad y posiblemente riesgo de empeorar en situaciones más avanzadas |
| Población de referencia | Tiene sentido solo en personas relativamente autónomas | Tiene sentido en cualquier persona, independientemente de la función o la edad | Tiene sentido en cualquier persona, independientemente de la función o la edad |
Fuente: adaptado de Cesari et al.15
Pero ¿es posible intervenir en personas frágiles? ¿Cuál es el papel de la VM? Tal y como demostró el grupo de Tom Gill, de la Universidad de Yale, tanto la fragilidad como la discapacidad motora son reversibles en numerosas ocasiones3,17. Que el ejercicio físico sea la clave para obstaculizar y revertir la fragilidad nos lo demuestran estudios recientes de gran impacto. En el ensayo clínico multicéntrico y de grandes dimensiones LIFE, la batería SPPB, que incluye la VM, se utilizaba como cribado para detectar personas frágiles a incluir en el estudio18: en este grupo poblacional, una intervención que combina fuerza, resistencia y flexibilidad mejoraba la autonomía en la deambulación. Paralelamente, una reciente revisión sistemática española demuestra la eficacia del ejercicio en las personas mayores frágiles19. Un abordaje interesante y moderno nos lo proporciona el estudio de intervención frailty intervention trial (FIT), que utiliza los criterios de fragilidad de Fried para detectar dianas susceptibles de una intervención multifactorial, con resultados muy positivos: entre otros aspectos, el escaso rendimiento físico, identificado mediante una marcha lenta, es el desencadenante de una intervención basada en el ejercicio, que contribuye a frenar la fragilidad20,21. Un entrenamiento específico basado en resistencia y un entrenamiento funcional de la función motora también han demostrado resultados positivos en la mejora de la VM, entre otros parámetros de función física, en personas en situación de especial fragilidad, complejidad y dificultad de ser incluidos en programas estándares de ejercicio como con enfermedad de Alzheimer (EA)22.
Técnica de medición y referencias normativasLa forma más habitual de medir la VM es solicitando al individuo que recorra un trayecto predeterminado a la velocidad en la cual se encuentre cómodo (su paso habitual). La longitud del trayecto tiene que permitir que el test se pueda llevar a término en un ámbito clínico de exploración habitual. Están disponibles instrucciones muy detalladas y estandarizadas, que se pueden descargar en la página web del Instituto Nacional de Envejecimiento de Estados Unidos (National Institute on Aging [NIA]), dentro de la guía práctica para realizar un correcto SPPB23. La mayoría de los estudios utilizan distancias entre 4 y 6m. Los 4m parecen ser suficientes para garantizar una buena fiabilidad y es la distancia actualmente recomendada24.
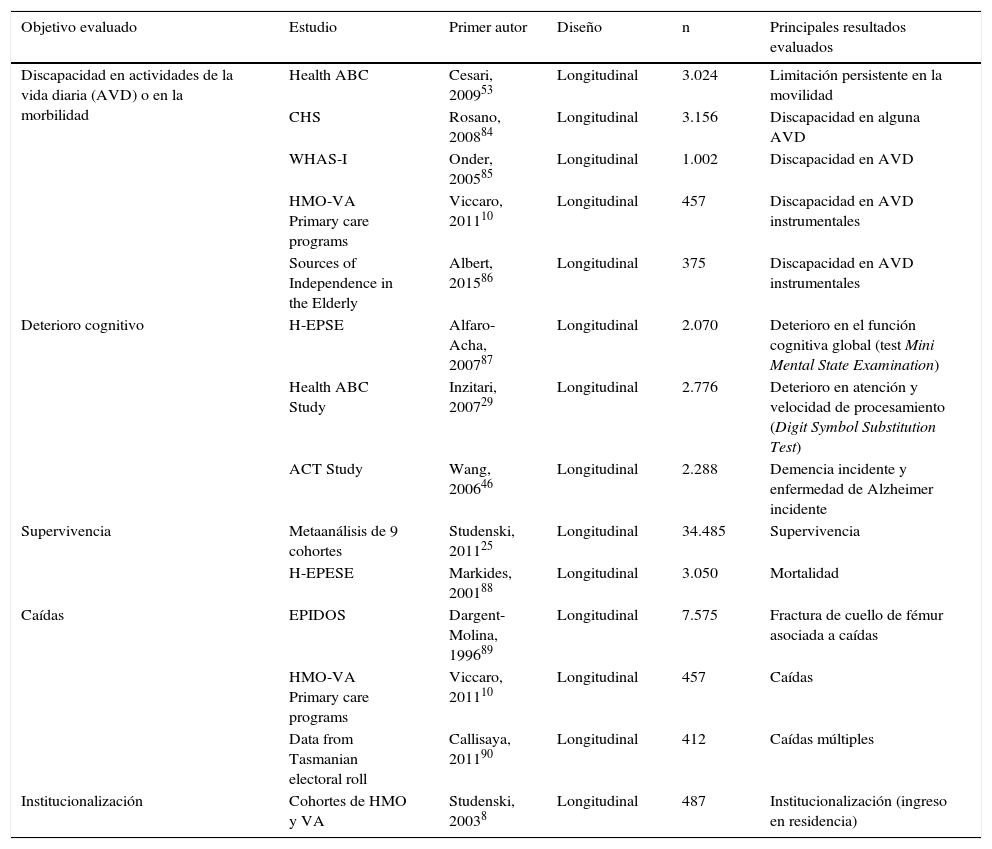
En la literatura se valoran diferentes puntos de corte según el evento que interese predecir. En la tabla 2 reportamos los principales estudios que han evaluado la VM como predictor de diferentes consecuencias de salud relevantes en personas mayores (discapacidad, deterioro cognitivo, caídas, mortalidad, institucionalización). Estos estudios han resultado clave para proponer la definición de valores o puntos de corte de referencia, aspecto que parece ser un requerimiento clave para implementar la utilización de la herramienta en la práctica clínica. Según la propuesta de una task force europea, cuyo trabajo fue publicado por Abellan van Kaan et al.24, velocidades de la marcha de 0,8m/s implican un mayor riesgo de diferentes eventos adversos (y normalmente suponen el punto de corte para definir el fenotipo de fragilidad), mientras que velocidades de 1m/s o superiores se asocian a supervivencias superiores a las estimadas para un subgrupo de edad y sexo. Otro punto de corte relacionado con una salud y estado funcional precarios podría ser representado por una velocidad por debajo de los 0,6m/s. De todas formas, se debe considerar que el trabajo de la task force solo tenía la finalidad concreta de sugerir un abordaje práctico del tema. Sin embargo, este trabajo tenía limitaciones importantes: se basaba en proponer los puntos de corte que hemos citado, y en una revisión y síntesis de diferentes estudios que habían evaluado esta variable en asociación longitudinal con diferentes resultados, utilizando metodología y poblaciones diferentes. Una aportación fundamental y metodológicamente más ortodoxa es la realizada en el trabajo de Studenski et al.25, publicado por la revista JAMA, que ha combinado con una técnica metaanalítica de 9 estudios de población, norteamericanos o europeos, obteniendo una muestra final de 34.485 participantes. Todos los estudios incluidos se dirigían a poblaciones de personas mayores, habían medido la marcha a paso habitual sobre distancias entre los 4 y los 8m, que fueron homogeneizadas previamente al análisis utilizando como referencia la distancia de 4m, y tenían datos de mortalidad a los 5 y 10años. El resultado del análisis es una relación «dosis-efecto» casi perfecta entre una menor VM y el riesgo de mortalidad, independientemente de posibles covariadas. Las gráficas publicadas en el artículo podrían ayudar en la predicción de este riesgo en función de la edad y el sexo, de forma similar a la aplicación de las tablas de riesgo cardiovascular. Con solo estas 3 variables la predicción de la supervivencia ganaba una alta precisión, sin necesitad de una recogida de datos excesivamente extensa, que haría inviable la aplicación de estos modelos en la práctica clínica. En la tabla 3 resumimos los principales puntos de cortes clínicos propuestos en la literatura, y los cambios mínimos en la revaloración de la persona que se consideran significativos. A pesar de estas definiciones orientativas, diferentes estudios, que han analizado aspectos de la VM en relación con resultados de salud específicos, han aportado más evidencia: por ejemplo, según datos del MOBILIZE Boston Study, la relación entre VM y caídas sería en forma de U: una VM<0,7m/s parece predecir caídas al domicilio, y una VM>1,3m/s en la calle (probablemente por la autonomía de la persona y del riesgo de las actividades que realice, en función de su situación global)26.
Principales estudios que hayan demostrado una asociación de de la velocidad de la marcha a paso habitual con diferentes resultados de salud relevante
| Objetivo evaluado | Estudio | Primer autor | Diseño | n | Principales resultados evaluados |
|---|---|---|---|---|---|
| Discapacidad en actividades de la vida diaria (AVD) o en la morbilidad | Health ABC | Cesari, 200953 | Longitudinal | 3.024 | Limitación persistente en la movilidad |
| CHS | Rosano, 200884 | Longitudinal | 3.156 | Discapacidad en alguna AVD | |
| WHAS-I | Onder, 200585 | Longitudinal | 1.002 | Discapacidad en AVD | |
| HMO-VA Primary care programs | Viccaro, 201110 | Longitudinal | 457 | Discapacidad en AVD instrumentales | |
| Sources of Independence in the Elderly | Albert, 201586 | Longitudinal | 375 | Discapacidad en AVD instrumentales | |
| Deterioro cognitivo | H-EPSE | Alfaro-Acha, 200787 | Longitudinal | 2.070 | Deterioro en el función cognitiva global (test Mini Mental State Examination) |
| Health ABC Study | Inzitari, 200729 | Longitudinal | 2.776 | Deterioro en atención y velocidad de procesamiento (Digit Symbol Substitution Test) | |
| ACT Study | Wang, 200646 | Longitudinal | 2.288 | Demencia incidente y enfermedad de Alzheimer incidente | |
| Supervivencia | Metaanálisis de 9 cohortes | Studenski, 201125 | Longitudinal | 34.485 | Supervivencia |
| H-EPESE | Markides, 200188 | Longitudinal | 3.050 | Mortalidad | |
| Caídas | EPIDOS | Dargent-Molina, 199689 | Longitudinal | 7.575 | Fractura de cuello de fémur asociada a caídas |
| HMO-VA Primary care programs | Viccaro, 201110 | Longitudinal | 457 | Caídas | |
| Data from Tasmanian electoral roll | Callisaya, 201190 | Longitudinal | 412 | Caídas múltiples | |
| Institucionalización | Cohortes de HMO y VA | Studenski, 20038 | Longitudinal | 487 | Institucionalización (ingreso en residencia) |
ACT Study: Adult Changes in Thought; CHS: Cardiovascular Health Study; EPIDOS: Epidemiologie de l’Osteoporose Study; Health ABC: The Health, Aging and Body Composition Study; H-EPESE: Hispanic-Established Population for the Epidemiological Study of the Elderly; HMO: Medicare Health Maintenance Organization; VA: Veterans Affairs; WHAS-I: Women Health and Aging Study-I.
Correlación clínica de los puntos de corte más habituales
| Puntos de corte propuestos | Significación clínica |
|---|---|
| Utilización transversal: estratificación y clasificación24 | |
| < 0,6m/s | Alta probabilidad de tener salud y función física pobres |
| < 0,8m/s | Individuos con una supervivencia menor a la estimada para edad y sexo similares |
| ≥ 1m/s | Envejecimiento saludable y supervivencia mayor a la estimada para edad y sexo similares |
| > 1,2m/s | Expectativa de vida excepcional |
| Utilización longitudinal: sensibilidad al cambio91 | |
| 0,03-0,05m/s | Mínimo cambio apreciable (empeoramiento o mejora) |
| 0,08m/s | Cambio clínicamente significativo (empeoramiento o mejora) |
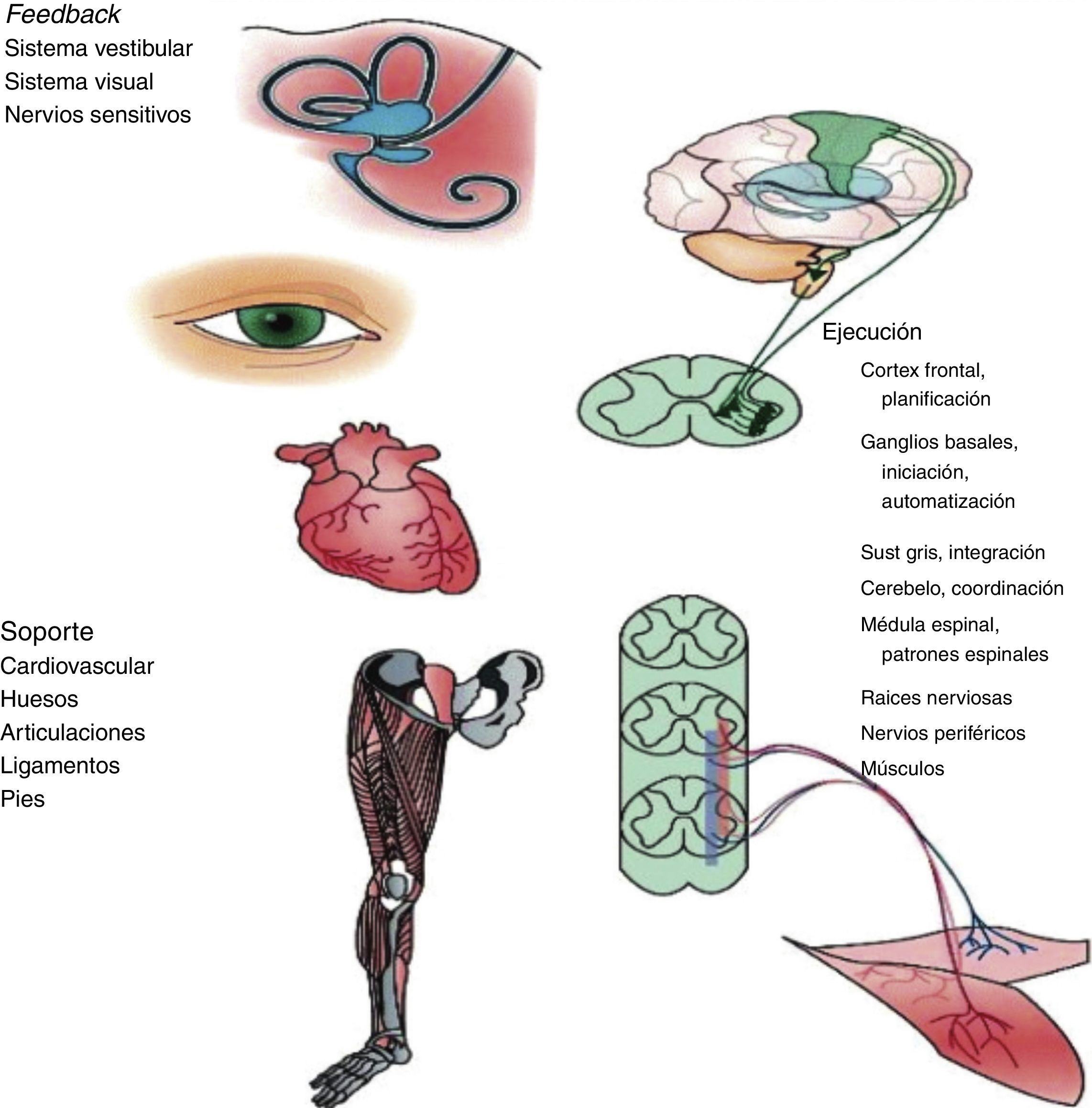
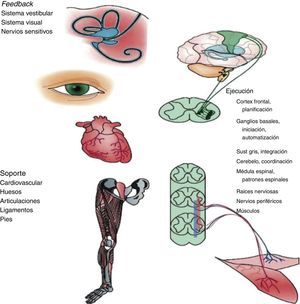
Tal como se ha comentado, midiendo la VM se recoge la función de diversos órganos y sistemas; en la figura 1 aportamos una visión gráfica. La marcha es un acto motor complejo que depende de la integración de múltiples sistemas y donde la función cognitiva juega un papel clave en su regulación, fundamentalmente en ancianos. De hecho, la alteración de estos órganos y sistemas podría explicar la relación de la VM con resultados como la supervivencia y otros eventos adversos. A nivel del sistema musculoesquelético destacan la disminución del número de unidades motoras, la activación muscular alterada y la sustitución de fibras musculares tipoii por fibras tipoi y, por lo tanto, disminución de la velocidad de contracción27,28. Otros estudios longitudinales han demostrado una asociación entre marcadores cerebrales estructurales y funcionales y deterioro de la función cognitiva en diferentes dominios, fundamentalmente función ejecutiva por un lado y enlentecimiento de la marcha por otro lado, en personas mayores sin patologías neurológicas clínicamente evidentes29,30. El aspecto de la regulación central de la marcha, y la consecuente disregulación en presencia de alteraciones, nos parece un aspecto tan relevante y actual que le dedicamos un párrafo específico a continuación. No cabe apuntar que patologías neurológicas como el ictus o la enfermedad de Parkinson determinan alteraciones de la marcha. No obstante, igual que para otros dominios, los estudios citados se han enfocado a la patología subclínica, que podría estar en la base de una parte de los deterioros funcionales aparentemente inexplicados que encontramos en la clínica. Otros autores han sugerido una relación entre neuropatía periférica y una VM reducida27. Si bien los que se han mencionado representan los sistemas fisiológicos más directamente relacionados con una marcha alterada, otros sistemas, como por ejemplo el cardiovascular31 y los órganos de sentido32, podrían estar también implicados en este tipo de alteraciones.
Órganos y sistemas implicados en la regulación de la marcha.
Imagen reproducida de Casas Herrero et al.50.
En base a la evidencia de los estudios epidemiológicos, diferentes autores están examinando mecanismos biológicos que podrían desencadenar los cambios a nivel de órganos y sistemas mencionados, y que aquí no describiremos extensivamente dado el enfoque prevalentemente clínico de este trabajo. Solo destacamos que, entre otros, la inflamación33 y la alteración de los niveles de vitaminaD34 podrían tener efectos sistémicos y son actualmente objeto de gran interés en la investigación tanto clínica como básica.
En resumen, por la multiplicidad de factores que pueden intervenir en la marcha, la VM podría tener un papel de cribado de fragilidad en poblaciones de personas mayores. En función de los resultados, se necesitaría aplicar una valoración geriátrica integral que incluyera exploraciones más dirigidas a los diferentes órganos y sistemas. Este tipo de abordaje, por ejemplo, es propuesto por el European Working Group on Sarcopenia in Older People, que ha consensuado un algoritmo diagnóstico detallado a partir del resultado de la VM, según un punto de corte de 0,8m/s35.
La velocidad de la marcha en el deterioro cognitivo y la demenciaTradicionalmente se ha definido la marcha como un acto motor automático, pero esta afirmación ha quedado en entredicho en trabajos recientes36. Esto por el rol que la regulación cognitiva iría asumiendo, asociado con la edad37-39. Los trastornos de la marcha y el deterioro cognitivo (sobre todo de atención, velocidad de procesamiento, función ejecutiva) parece que están más relacionados entre sí conforme la población envejece y probablemente expliquen el alto riesgo de caídas de este grupo poblacional40. Una pobre función motora en miembros superiores e inferiores es más prevalente en ancianos con demencia que en aquellos sin deterioro cognitivo41. Pruebas de asociación de una tarea cognitiva mientras se camina (contar hacia atrás, tareas de fluencia verbal, etc.), conocidas como pruebas duales, pueden representar un test de estrés capaz de detectar alteraciones de la marcha leves y subclínicas no detectables mediante otras pruebas42,43.
Clásicamente los trastornos de la movilidad y la marcha no son considerados como una presentación clínica característica de la EA; más bien la presencia temprana de los mismos nos podría orientar hacia un diagnóstico improbable, puesto que en las escalas clásicas de diagnóstico y severidad, los trastornos del movimiento suelen aparecer en estadios más avanzados de la enfermedad. En contraste, los trastornos de la marcha son una característica bien conocida de otros tipos de demencia, como las vasculares y las parkinsonianas. Aun así, se ha observado que pacientes con EA muestran un alto riesgo de presentar caídas comparado con ancianos sanos44, y en los últimos años se ha comprobado que las alteraciones de la marcha, aunque sutiles, están presentes desde estadios más precoces en la EA39 e incluso en el deterioro cognitivo leve45. Estudios previos han demostrado que la disfunción física podría incluso predecir el inicio de una demencia, incluida la EA46. En un estudio muy reciente multicéntrico de Verghese et al.47, la asociación de quejas cognitivas (no demencia) y una VM disminuida, en ancianos sin discapacidad (motoric cognitive risk syndrome), se comportó como un predictor precoz de riesgo de deterioro cognitivo y demencia. Estos interesantes resultados abren la puerta a la utilización en la práctica clínica de la VM como una herramienta diagnóstica, pronóstica y de seguimiento sencilla y fácilmente aplicable en los pacientes con deterioro cognitivo desde estadios precoces
Como base fisiopatológica, la atrofia cerebral podría determinar la disfunción de algunas áreas específicas, como el córtex prefrontal48, que están involucradas en los procesos de atención y funciones ejecutivas que, como se ha comentado, tienen un impacto sobre la marcha. Por otro lado, la asociación entre enfermedad cerebrovascular (ECV) y trastornos de la movilidad y la marcha está bien establecida y apoyada por una evidencia consolidada30. La alta prevalencia de ECV en EA ha llevado a distintos estudios a relacionarlas en pacientes ancianos. Por estas razones se puede especular que la ECV puede estar relacionada con la disfunción de la marcha y movilidad en la EA. Se ha observado que pacientes con EA y con ECV asociada presentaban un peor rendimiento físico, particularmente en el área del equilibrio, en comparación con aquellos sin ECV, sugiriendo que la disfunción física puede aparecer muy tempranamente en el proceso de la demencia49. Estas observaciones muestran ser clínicamente relevantes, ya que la ECV es potencialmente prevenible, y la detección de anormalidades en la movilidad en estadios tempranos de la demencia podría orientar al clínico a explorar la ECV y posiblemente a intervenir y reforzar las medidas preventivas. Otras hipótesis, complementarias a un rol de la ECV, explican la asociación entre marcha y cognición por el papel dual del hipocampo y la corteza prefrontal y la relación funcional que mantienen50.
La velocidad de la marcha en pacientes con cáncerEn muchas ocasiones resulta menos probable que al paciente anciano con cáncer se le ofrezca un tratamiento específico que tenga el potencial de mejorar la supervivencia debido a preocupaciones con respecto a tolerancia del tratamiento, y no por ello deben ser automáticamente excluidos del tratamiento estándar específico. Es por eso que en los últimos años ha tomado particular importancia incluir la valoración geriátrica integral en pacientes mayores de 70años con cáncer, sobre todo en aquellos que resulten ser frágiles (estimando su reserva clínica y biológica, y consecuentemente su vulnerabilidad a estresores), para determinar así el tratamiento específico del que se beneficiaría51.
Aunque los resultados clínicos varían dependiendo del tipo de tumor y tratamiento, las características específicas de cada paciente son también importantes predictores de supervivencia y tolerancia terapéutica. Identificar características específicamente mensurables que permitan predecir la toxicidad del tratamiento, la incapacidad posterior y la supervivencia es fundamental para informar sobre la toma de decisiones en pacientes ancianos oncológicos. La función física es un elemento clave en la evaluación de fragilidad en la población geriátrica y puede permitir predecir resultados clínicos en pacientes ancianos con cáncer.
En la práctica oncológica, el estado funcional es estimado típicamente utilizando las escalas de Karnofsky y del Eastern Cooperative Oncology Group (ECOG). Estas escalas son subjetivas y poco sensibles, resultando ser menos útiles para gran parte de ancianos oncológicos, quienes no presentan una discapacidad sustancial al momento del diagnóstico del cáncer, como se observaba en el estudio de Girre et al.52, que, tras evaluar 105 pacientes con cáncer de mama >70años, el 42% requerían ayuda en actividades básicas y el 54% en instrumentales, a pesar de que solo el 7% de las pacientes presentaban un ECOG>2. Por ello, es necesaria una medición de la función física de una manera más sensible y objetiva. Además de las tradicionales escalas de Barthel y Lawton utilizadas habitualmente, durante las 2 últimas décadas se ha dado una creciente importancia a las medidas de rendimiento físico, como la valoración de la VM y la batería SPPB. Se ha demostrado que estas medidas objetivas no son solamente más sensibles a cambios que las escalas subjetivas, sino que se han asociado también con resultados fundamentalmente clínicos (discapacidad, mortalidad, hospitalización, comorbilidad)6,53 e incluso subclínicos (marcadores inflamatorios, composición corporal, estado antioxidativo)54,55. Estas escalas específicas han sido propuestas para utilizarse en la valoración geriátrica en pacientes ancianos con cáncer, dado que añaden una información vital a las escalas de valoración de ECOG y Karnofsky.
La disfunción de la marcha y el equilibrio son comúnmente vistos en pacientes con cáncer y las causas suelen ser multifactoriales. Tanto el cáncer como el tratamiento (radioterapia, quimioterapia) pueden causar efectos tanto a nivel neurológico, musculoesquelético y sistémico, desencadenando efectos sobre la movilidad. Por ello se recomienda una exploración funcional completa para identificar la presencia de alteraciones en la movilidad y determinar así una intervención apropiada56.
El valor predictivo de la función física ha sido valorado en distintos estudios. Klepin et al.57 demostraron que el rendimiento físico de las extremidades inferiores medido a través de la VM se relacionó con supervivencia y progresión de discapacidad o mortalidad en 2años en ancianos con reciente diagnóstico de cáncer. Estas medidas permiten prever una evidencia objetiva de la reserva funcional en el anciano.
La valoración del rendimiento físico en la valoración de la fragilidad es actualmente incluida en el National Comprehensive Cancer Network Guidelines for Senior Adult Oncology58 y las guías de consenso (incluido el National Comprehensive Cancer Network y otras recomendaciones)51,59 recomiendan la valoración del estado funcional además de las escalas de valoración oncológica en la toma de decisiones sobre el tratamiento específico.
Aun así, no existe un consenso en cómo modificar los planes terapéuticos dependiendo del estado funcional de base, siendo necesarios más estudios para evaluar la seguridad y la eficacia del tratamiento estándar enfocado a pacientes oncológicos con déficit funcional y, paralelamente, para evitar la exclusión de los ancianos de medidas diagnósticas o terapéuticas basándose únicamente en un criterio etario.
La velocidad de la marcha en entornos no comunitarios¿Qué valor añade la velocidad de la marcha en el entorno hospitalario?En los últimos años, diferentes estudios sugieren que la marcha podría ser un importante indicador clínico y predictor de resultados clínicos. Al momento del ingreso hospitalario, para los pacientes que puedan deambular, puede proveer información útil en determinar las necesidades de cuidados, tiempo de estancia, planificación al alta y pronóstico tras el alta. Así mismo, puede ser de valor considerable en la identificación de pacientes con alto riesgo que se beneficiarían de una intervención temprana orientada hacia el mantenimiento y la mejoría funcional (autonomía). Diversos estudios han demostrado que gran parte de pacientes ancianos pierden la movilidad durante el ingreso hospitalario y frecuentemente fracasan en la recuperación de la pérdida funcional tras el alta60,61.
La VM ha sido propuesta como parte de la valoración geriátrica integral al ingreso hospitalario, ya que aporta muchas ventajas; entre ellas, permite identificar pacientes ancianos con riesgo de resultados desfavorables, especialmente en aquellos que mantienen una autonomía o mínima dependencia con respecto a actividades de la vida diaria, ya que es más sensible al detectar pequeños cambios en el estado físico o capacidad funcional en el tiempo, en comparación con otros índices utilizados en la práctica clínica (Lawton, Barthel). Realizar valoraciones de la marcha de forma consecutiva durante el ingreso hospitalario puede ayudarnos también a prevenir el declive funcional que muchas veces ocurre como consecuencia de la hospitalización8,62,63, y también a monitorizar la eficacia de las intervenciones (p.ej., programas de ejercicio físico o rehabituación).
Distintos estudios han demostrado que pacientes ancianos que muestran un declive en la habilidad de la marcha durante el ingreso hospitalario se encuentran en un alto riesgo de muerte, reingresos hospitalarios e institucionalización, así como discapacidad tras el alta hospitalaria. Volpato et el.61 valoraron la asociación entre la función física en las primeras 48h de ingreso, medida con el SPPB, que, como hemos comentado, incluye la marcha como un subítem, y la duración de la estancia hospitalaria. Los resultados demostraron que SPPB predecía la estancia hospitalaria independientemente y de forma más sensible respeto a los tradicionales indicadores de pronóstico como la edad, la autonomía (actividades de la vida diaria), el estado cognitivo y la comorbilidad. En otro estudio se observó una relación inversamente proporcional de la VM con días de estancia hospitalaria64.
Dada la probabilidad de que la VM permita reflejar el funcionamiento simultáneo de órganos y sistemas (sistema nervioso central y periférico, musculoesquelético, cardiovascular, respiratorio y sanguíneo), nos puede permitir estimar la carga global de la enfermedad y de esta forma predecir distintos resultados, pudiendo así ser considerada la VM como otro indicador clínico de bienestar del organismo, como un «signo vital». En 752 pacientes en hemodiálisis, la VM predijo la mortalidad en un seguimiento de más de 2años, y también las hospitalizaciones, la discapacidad y la función física en un año65.
En los últimos años la utilización de la VM se ha ido trasladando al entorno preoperatorio, pues los indicadores de fragilidad están demostrando un importante poder predictivo frente a las complicaciones quirúrgicas de diferentes condiciones (cardiovasculares, vasculares periféricas, cáncer de colon, cirugía del cuello, etc.)66-72. Como en otras experiencias previas, la necesidad de identificar biomarcadores sensibles lo más rápidos y económicos posible ha determinado inclusive la utilización de forma aislada de la VM, que ha demostrado buenos resultados para predecir complicaciones y riesgo de ingreso hospitalario en la cirugía programada de personas mayores73.
La velocidad de la marcha en rehabilitación. ¿Predictor o resultado?Parece intuitivo que un parámetro sencillo que defina la marcha de manera cuantitativa, como la velocidad, pueda ser de utilidad en rehabilitación. De hecho, la evidencia sobre su aplicación no falta. En pacientes con ictus, que representa la primera causa de discapacidad en adultos occidentales y uno de los diagnósticos más frecuentes en rehabilitación, VM es un potente predictor de recuperación de la deambulación al regreso en la comunidad74. Estudios recientes sugieren que la VM pueda ser también un indicador útil para la predicción del resultado de procesos postagudos tratados con rehabilitación en la comunidad: en una muestra de más de 350 personas mayores evaluadas con el instrumento Inter-RAI Home Care, la VM predecía la probabilidad de seguir viviendo en el domicilio, de mantener independencia funcional o de ingresar en el hospital6 meses después de la admisión en el programa75.
Se ha demostrado también que intervenciones no tecnológicas, basadas en el ejercicio, mejoran la VM de forma parecida a otras más tecnológicas76. Por otro lado, la VM se puede utilizar como una medida de resultado en rehabilitación geriátrica, habiéndose observado que un incremento de 0,1-0,2m/s representa un indicador sensible de mejora de los pacientes77, inclusive en poblaciones seleccionadas, como la de pacientes posfractura de cadera78,79, ictus80 o con enfermedad pulmonar obstructiva crónica (EPOC)81.
En cambio, la implementación en larga estancia es más compleja, debido a la alta prevalencia de personas con alteraciones de la deambulación que impiden su correcto registro, aunque los pacientes que deambulen muestren una marcha lenta pero funcional82.
¿Por qué la velocidad de la marcha no se utiliza en la práctica? ¿Qué podemos hacer?No obstante todas las evidencias resumidas en este artículo, en la actualidad la medición de la VM es poco utilizada. Tal como sugieren Studenski et al.25, algunas de las aplicaciones posibles son:
- •
Identificar subgrupos de población con alta probabilidad de sobrevivir a los 5 o 10años, y por tanto adecuar la aplicación de estrategias preventivas.
- •
Detectar precozmente individuos con un elevado riesgo de muerte o deterioro funcional (p.ej., utilizando el punto de corte a <0,8m/s) y por lo tanto diseñar precozmente intervenciones para modificar ese riesgo. Y monitorizar su eficacia/respuesta.
- •
Realizar cribado precoz y seguimiento de fragilidad en atención primaria: en este sentido podría representar un parámetro para detectar nuevos problemas que puedan afectar la salud, y al mismo tiempo evaluar los resultados de una intervención. Hay evidencia de que un cambio significativo de la VM (p.ej., 0,08m/s) se asocia a un aumento de la supervivencia83.
- •
En la valoración oncogeriátrica podría resultar útil a la hora de decidir la aplicación de tratamientos oncológicos específicos, ya que estratifica los riesgos que dependen de la fragilidad del enfermo.
- •
En los pacientes con deterioro cognitivo, donde resulta fundamental valorar el riesgo de caída. Una VM menor de 0,8m/s se asocia con riesgo de caídas y fracturas. Además en estadios precoces podría utilizarse como herramienta diagnóstica y pronóstica en cuanto a la predicción de evolución a demencia
- •
Por último, como otras herramientas estandarizadas de la valoración geriátrica integral, permite una mejor comunicación y toma de decisiones entre clínicos.
Se considera que, generalmente, una herramienta de valoración sirve para: a)diagnóstico; b)pronóstico; c)toma de decisiones relativa a tratamientos; d)seguimiento y monitorización de las intervenciones, y e)comunicación entre profesionales. Creemos que la VM es útil para todas estas funciones. ¿Por qué entonces no la utilizamos?
En la actualidad, algunos factores que podrían ir en detrimento de la utilización son:
- •
Falta de conocimiento y de difusión de las evidencias que hemos sintetizado entre los clínicos.
- •
Falta, hasta ahora, de referencias normativas que confieran a esta herramienta una interpretación fácil y directa, y la posibilidad de diseñar estrategias de intervención proporcionadas. En relación con estos 2 primeros aspectos, pensamos que los resultados del metaanálisis de Studenski et al. que se ha citado anteriormente podrían aportar una contribución fundamental.
- •
Dificultad de añadir nuevos elementos a la valoración integral, considerando el poco tiempo a disposición de los profesionales asistenciales y la carga asistencial habitualmente elevada. En relación con este aspecto, reseñar que la medición de la VM sobre 4m, cogiendo el mejor de 2 intentos, es seguramente más rápida que muchas otras pruebas y baterías que pasamos habitualmente cuando evaluamos a una persona mayor (tests cognitivos, funcionales, etc.).
Su uso es escaso también en el ámbito experimental. Sería útil, por ejemplo, como criterio de exclusión para ensayos clínicos en los cuales se quiera seleccionar una población frágil y como indicador intermedio de resultado en estudios de intervención en la población geriátrica.
ConclusionesLa VM es una herramienta eficiente para la detección de fragilidad, y se puede considerar un predictor independiente de eventos adversos relacionados con la salud en personas mayores de la comunidad. Esta variable integra alteraciones clínicamente evidentes pero también subclínicas en múltiples órganos diana, muchos de los cuales afectan la supervivencia, la probabilidad de deterioro funcional y cognitivo, y el riesgo de síndromes geriátricos como las caídas. Desde un punto de vista clínico, al lado de su utilización como herramienta de cribado en personas de la comunidad, se está impulsando su utilización en algunas subpoblaciones concretas de pacientes, como en los que padecen un deterioro cognitivo o una demencia, pero también en los pacientes mayores con cáncer. También se está trasladando del ámbito comunitario a los entornos o niveles asistenciales de rehabilitación, e inclusive a agudos.
La utilización de referencias normativas prácticas, juntamente con un mayor conocimiento de la herramienta entre los profesionales, podría incrementar su utilización en la práctica clínica, como herramienta clave de cribado o como elemento nuclear de la valoración geriátrica integral, dada la sencillez y la rapidez con la cual se puede obtener la medición de este parámetro objetivo, y su sensibilidad al cambio.
En definitiva, abogamos por incrementar su utilización en investigación, sobre todo en ámbitos clínicos, y por incorporar definitivamente esta herramienta en la práctica clínica, adaptando su utilización a los diferentes niveles asistenciales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.