El coenzima Q es un componente esencial para la actividad de la cadena de transporte de electrones mitocondrial. En su síntesis están implicados, al menos, 10 proteínas diferentes que conforman un complejo. Nuestro objetivo ha sido el de determinar la evolución de la expresión de los diferentes genes implicados en la síntesis de coenzima Q durante el envejecimiento en ratones.
Material y métodosEl ARN mensajero (ARNm) de diferentes órganos (cerebro, hígado, riñón y músculo) de ratones jóvenes (8 meses), maduros (18 meses) y viejos (24 meses) fue extraído utilizando Trizol y analizado por PCR a tiempo real (qPCR) utilizando sondas específicas para los diferentes genes COQ que codifican para los miembros del complejo de síntesis del coenzima Q.
ResultadosEl hígado fue el órgano que presentó mayores cambios en cuanto a la expresión de ARNm respecto a la edad, afectando tanto a la amplitud de las variaciones como en la significatividad del cambio. En la mayoría de los genes, los niveles de ARNm fueron mayores en los animales maduros que en los jóvenes. Cuando comparamos los niveles de ARNm de los animales jóvenes y viejos solo se encontraron pequeñas reducciones de expresión. El riñón presentó un patrón similar al hígado en cuanto a la evolución de la expresión, aunque con menores incrementos en los animales maduros que los observados en el hígado. Cerebro y músculo esquelético presentaron las menores variaciones de expresión, siendo el músculo el que menores cambios presentó, aunque se observó un patrón similar al encontrado en hígado y riñón, con ligeros incrementos en animales maduros.
DiscusiónNuestros resultados indican que la edad es un factor importante a tener en cuenta en el análisis de la expresión de los genes COQ. Además, la expresión de estos genes depende del órgano estudiado. Teniendo en cuenta la importancia del coenzima Q en el metabolismo celular y en el envejecimiento, es obligado un mayor estudio de la regulación génica de su maquinaria de síntesis.
Coenzyme Q is an essential component in the activity of the mitochondrial electron transport chain. Its synthesis involves, at least, a complex of ten different proteins. In this study, an attempt is made to determine the evolution of the expression of the genes involved in coenzyme Q synthesis during mouse ageing.
Material and methodsThe messenger RNA (mRNA) of different organs, such as brain, liver, kidney and skeletal muscle from young (8 months), mature (18 months), and old (24 months) mice was extracted by using Trizol and was then analysed by real time PCR (qPCR) using specific primers for all the known components of the coenzyme Q-synthesis complex (COQ genes).
ResultsLiver showed the highest age-dependent changes in mRNA levels of the different components of Q-synthesis complex, affecting the extent of the variation as well as the significance of the change. In most of the cases, mRNA levels of the different components were higher in mature animals compared to young and old animals. When mRNAs of young and old animals were compared, only minor reductions of mRNA levels were found. Kidney showed a pattern similar to that found in liver as regards the changes in expression, although with lower increases in mature animals than those observed in the liver. Brain and skeletal muscle showed low variations, with muscle being the tissue with less changes, although a pattern similar to that found in liver and kidney was found, with slight increases in mature animals.
DiscussionThe results of this study indicate that ageing is an important factor affecting COQ gene expression, but its effect depends on the organ, and that mature animals show higher levels of mRNA than young and old animals. Taken into consideration the importance of coenzyme Q in cell metabolism and ageing, a more detailed study is needed to understand the gene regulation of the coenzyme Q-synthesis mechanisms during ageing.
El coenzima Q (Q) es un lípido presente en todas las membranas celulares de los organismos, desde bacterias hasta mamíferos. El coenzima Q está formado por una cola isoprenoide que en humanos consta de 10 unidades y por una cabeza polar formada por un anillo bencénico con 2 grupos hidroxilos en su forma reducida o cetónicos en la oxidada. El Q es un componente esencial de la cadena de transporte mitocondrial, siendo el único lípido presente en este complejo sistema formado, además, por 4 complejos proteicos y citocromo c y que transfiere electrones desde compuestos intermediarios del metabolismo como el NADH o el FADH2 hasta el oxígeno, formando finalmente agua. Mediante este sistema se consigue establecer un gradiente de protones en la mitocondria que es utilizado para sintetizar ATP, componente esencial para el funcionamiento de células, tejidos y órganos1. Pero el Q también cumple una función esencial en el resto de membranas celulares actuando como principal miembro de un sistema antioxidante que previene la peroxidación de lípidos y probablemente la regulación de actividades asociadas a estas membranas, como mecanismos de apertura de canales de membrana o la regulación de sistemas de señalización celular2-4.
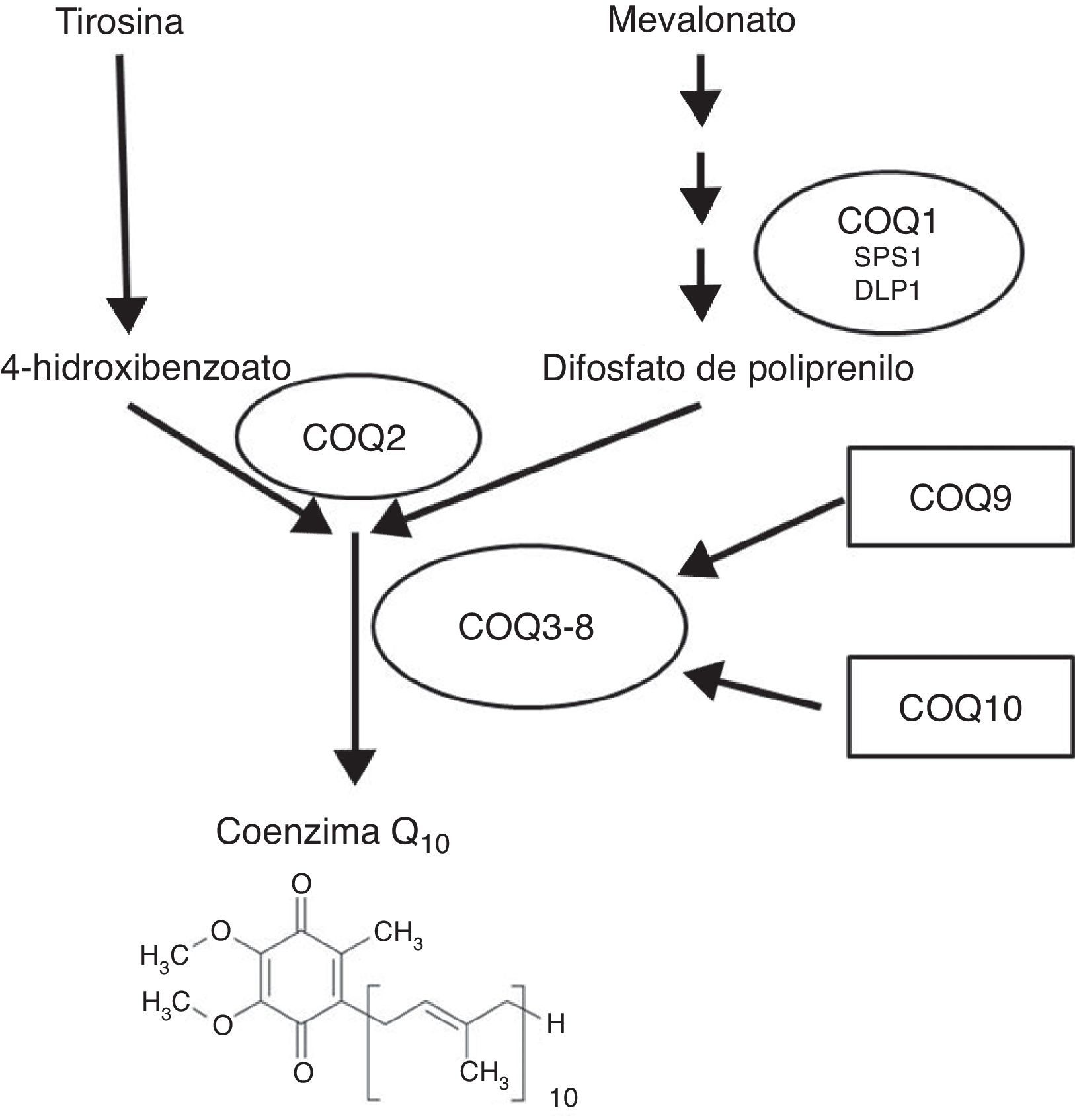
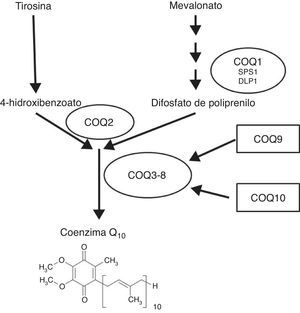
Prácticamente todas las células de nuestro organismo son capaces de sintetizar Q. La síntesis de este componente lipídico depende de un complejo de, al menos, 8 proteínas, aunque en los últimos años se han descrito hasta 3 componentes más a los que se les ha asignado posibles capacidades reguladoras. Las evidencias parecen demostrar que la mayor parte de las proteínas que forman este complejo se encuentran dentro de la mitocondria, unidas a la membrana interna o en la matriz mitocondrial, aunque el primer componente puede estar asociado al retículo endoplasmático, donde interviene en la síntesis de la cola isoprenoide, y el segundo se encarga de ensamblar la cola isoprenoide con la cabeza polar de la molécula (fig. 1). La forma en la que estos componentes se ensamblan, se estructuran y se regulan aún no está clara5,6 y tampoco se conoce su regulación a lo largo de la vida del individuo.
Papel de los genes COQ en la síntesis de Q. Los genes implicados en la síntesis de coenzima Q actúan desde la formación del precursor de la cola isoprenoide (COQ1, formado por 2 subunidades diferentes, SPS1 y DLP1), la fusión de esta cola isoprenoide con la cabeza polar originada a partir del aminoácido tirosina (COQ2) y la posterior modificación de la cabeza polar en la mitocondria por los componentes COQ3-8. A los componentes 9 y 10 se les ha asignado funciones reguladoras.
La importancia del Q para la supervivencia celular y de los seres humanos ha quedado patente en los recientes descubrimientos de familias que presentan mutaciones en los diferentes miembros del mecanismo de síntesis de Q. En la mayoría de los casos, la deficiencia en la síntesis de este componente produce ataxia, sordera, miastenia, deficiencia renal y finalmente un fallo multiorgánico7-11.
El Q es conocido como un agente antienvejecimiento no solo por su conocida aplicación en cremas antienvejecimiento, sino también en múltiples estudios relacionados con el envejecimiento. No obstante, no existen datos claros sobre la evolución de los niveles de Q durante el envejecimiento. Los estudios más claros muestran una posible disminución de los niveles de Q en mitocondria en músculo esquelético y posiblemente una bajada al principio del envejecimiento en cerebro12,13. Todos estos estudios han sido desarrollados en roedores. Utilizando este modelo, el objetivo del presente estudio es determinar la evolución de los niveles de ARNm de los genes que codifican para los diferentes componentes del complejo de síntesis de coenzima Q en ratones jóvenes, maduros y viejos, con el fin de conocer si existe una evolución que explique una posible disminución de la capacidad de síntesis de Q asociada al envejecimiento.
Materiales y métodosMantenimiento de animales y alimentaciónUn total de 10 ratones macho C57BL/6J (Harlan) por grupo de edad fueron usados en este estudio. Los animales fueron alimentados con autoclavable Teklad Global 14% protein rodent maintenance diet (Teklad Global Diet Chow 2014S, Harlan Teckad). Esta dieta contiene un 14,3% de proteína, un 4% de grasa (grasa de soja), un 48% de hidratos de carbono provenientes principalmente de maíz y de trigo y un 4,1% de fibra, entre otros componentes, enriquecida con vitaminas y minerales según indicaciones del fabricante (http://www.envigo.com/resources/data-sheets/2014s-datasheet-0915.pdf). Los animales fueron estabulados en cajas de policarbonato a razón de 4 animales por caja en una sala termostatizada (22±3°C) y con humedad controlada bajo un ciclo de 12h de luz/oscuridad (12:00am-12:00pm). Los animales fueron recibidos con diferentes edades: 2 meses (jóvenes), 12 meses (maduros) y 18 meses (viejos); y, tras un periodo de adaptación, alimentados en condiciones normales de animalario con pienso estándar para roedores durante otros 6 meses. La edad de los animales al final del experimento fue de 8 meses (jóvenes), 18 meses (maduros) y 24 meses (viejos). Los animales fueron sacrificados mediante dislocación cervical y los órganos extraídos en el menor tiempo posible, inmediatamente congelados en nitrógeno líquido y mantenidos a –80°C hasta su procesamiento. Todos los animales fueron mantenidos y manipulados según los protocolos aprobados por el comité ético de la Universidad Pablo de Olavide de Sevilla en su sesión 04/12 y resolución de 15 de febrero de 2012 y siguiendo las normas internacionales relativas a la investigación animal.
Extracción de ARN totalPara la determinación de los niveles de ARN para cada uno de los genes implicados en la síntesis de Q, ARN total procedente de cada órgano fue aislado utilizando TRIzol (Invitrogen, Life Technologies, España) siguiendo las instrucciones del fabricante. Brevemente, entre 50 y 100mg de tejido fue homogenizado en 1ml de TRIzol para posteriormente extraer el ARN con cloroformo mediante mezcla con vórtex. La fase superior se mezcló con etanol hasta alcanzar una proporción de 35% etanol y el ARNm purificado mediante columnas PureLink® RNA Mini Kit (Invitrogen, Estados Unidos). Una vez obtenido el ARN se llevó a cabo una cuantificación con NanoDrop® ND-1000 (Thermo Scientific, Estados Unidos) de su concentración y de su grado de pureza mediante las ratios 260/280 y 260/230. En ambos casos se aceptó un grado igual o mayor que 1,8. Posteriormente el ARN fue tratado con DNasa libre de RNasa (Deoxyribonuclease 1 Amplification Grade, Sigma-Aldrich, España) para eliminar posibles restos contaminantes de ADN genómico.
Para la síntesis de cDNA, el ARN fue retrotranscrito usando el iScript cDNA synthesis kit (Biorad, Estados Unidos) utilizando un iCycler Thermal termociclador (Biorad, Estados Unidos) siguiendo las indicaciones del fabricante.
Para la determinación de los niveles específicos de ARNm para cada gen se utilizó un sistema de PCR a tiempo real (RT-PCR) utilizando un iTaq Universal SYBR Green Supermix en un sistema CFX Connect (Biorad, Estados Unidos). Los cebadores utilizados para la determinación (tabla 1) fueron diseñados utilizando el Beacon Designer software (BioRad, Estados Unidos) y adquiridos mediante Eurofins MWG-Synthesis GmbH (Alemania). Para la referencia se utilizaron 4 genes constitutivos, β-actina, HSP90, HPRT y 18S. Para la selección del mejor gen de referencia se utilizó el programa RefFinder (http://fulxie.0fees.us/?i=1), que utiliza un sistema de comprobación de 4 diferentes métodos para determinar el gen de referencia más estable14.
Cebadores usados en la qPCR en este estudio
| Gen | Sentido (5′–3′) | Antisentido (5′–3′) |
|---|---|---|
| mSPS1 | 5′-CATCAAAGGACACCAGCAATGT-3′ | 5′-GCACCACAATAATCGGTCTAAAGG-3′ |
| mDLP1 | 5′-ATGCTGACCTCCAGCCTTTT-3′ | 5′-GTCACACCTTTGCCAGCTTT-3′ |
| mCoq2 | 5′-GCCCACCAGCAGGACAAGAAAGAC-3′ | 5′-AGCCACAGCAGCGTAGTAGG-3′ |
| mCoq3 | 5′-GTGAGCCACCTGGAAATGTT-3′ | 5′-CCCACGTATGAGTGCCTTTT-3′ |
| mCoq4 | 5′-GGGGAGACCACAGGATGC-3′ | 5′-GTCGAGGGTAGACAGCGAGAT-3′ |
| mCoq5 | 5′-GGATTCCTTGGGAGGTTCA-3′ | 5′-GGGCAGTTCTTCAGCGTCT-3′ |
| mCoq6 | 5′-CGACGTGGTGGTGTCAGC-3′ | 5′-AGTTTCTCCAGGGCTTTCTTT-3′ |
| mCoq7 | 5′-TGATGGAAGAGGACCCTGAGAAG-3′ | 5′-GCCTGTATCGTGGTGTTCAAGC-3′ |
| mCoq8 | 5′-AGCAAGCCACACAAGCAGATG-3′ | 5′-CCAGACCTACAGCCAGACCTC-3′ |
| mCoq9 | 5′-CCCGAGTTTTCCCGTCC-3′ | 5′-TGGGCTCCTTCAGCAATG-3′ |
| mCoq10 | 5′-TAAACAGAACCCTTCCACCG-3′ | 5′-CGAAATGCTGATAGTCCTCCA-3′ |
| β-actina | 5′-TGACCGAGCGTGGCTACAG-3′ | 5′-GGGCAACATAGCACAGCTTCT-3′ |
| HSP90 | 5′-GTGCCTGGAGCTCTTCTCC-3′ | 5′-CGTCGGTTAGTGGAATCTTCAT-3′ |
| mHPRT | 5′-CAGTCAACGGGGGACATAAA-3′ | 5′-AGAGGTCCTTTTCACCAGCAA-3′ |
| m18S | 5′- TGACTCAACACGGGAAACCT-3′ | 5′-AACCAGACAAATCGCTCCAC-3′ |
Todos los resultados son expresados como la media±el error estándar de la media (SEM). La comparación entre los diferentes grupos de edad fue realizada mediante el test ANOVA acompañado de un post-hoc test de Bonferroni, utilizando para ello un programa SigmaStat 3.5. Las gráficas y figuras fueron realizadas mediante un programa SigmaPlot 10.0 (Systat Software, Estados Unidos). El nivel crítico de significatividad α fue de 0,05 y el nivel estadístico significativo fue definido como p≤0,05.
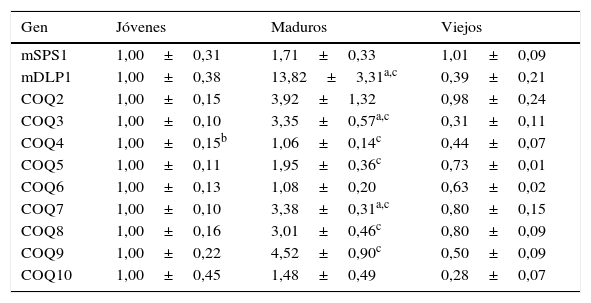
ResultadosLos niveles de ARNm de órganos con capacidad regenerativa presentan grandes diferencias dependientes de la edad del organismoEstudiamos los niveles de ARNm de los genes COQ en 2 órganos con capacidad regenerativa, el hígado y el riñón. Tomando como referencia los valores obtenidos en los animales jóvenes (8 meses), comprobamos que en el hígado de animales viejos se producía un descenso en los niveles de ARNm en algunos, pero no en todos los genes. Los genes afectados fueron COQ3, COQ4, COQ6, COQ10 y mDLP1 (uno de los miembros del primer componente del sistema de síntesis de Q). No obstante, el único descenso significativo entre los niveles encontrados en hígado viejos respecto a los niveles de los hígados jóvenes se obtuvo en el caso del COQ4; en el resto de genes solo observamos descensos considerables aunque no estadísticamente significativos. El resto de genes no mostraron ninguna modificación (tabla 2). Cuando tuvimos en cuenta los niveles de ARNm en animales maduros (18 meses), comprobamos que la mayoría de los genes presentaban unos niveles más altos a esta edad que en jóvenes o viejos. Los incrementos observados fueron de más de 10 veces en el caso de mDLP1, mientras que en los casos de COQ2, COQ3, COQ7, COQ8 y COQ9 los niveles fueron de alrededor de 4 veces sobre los observados en animales jóvenes. No se observaron cambios significativos en el caso de los genes COQ4, COQ6 o COQ10. Si tenemos en cuenta la variación entre animales maduros y viejos, la diferencia fue mucho más drástica, evidenciándose un descenso que afectaba a 7 de los 11 genes estudiados. Solo mSPS1, COQ2, COQ6 y COQ10 no mostraron diferencias significativas, aunque solo en el caso de COQ6 esta falta de variación fue clara, mientras que en los otros 3 genes pudimos comprobar que existía una tendencia a la disminución de expresión entre animales viejos y maduros.
Variación en la expresión de genes relacionados con la síntesis de Q en hígado de ratón
| Gen | Jóvenes | Maduros | Viejos |
|---|---|---|---|
| mSPS1 | 1,00±0,31 | 1,71±0,33 | 1,01±0,09 |
| mDLP1 | 1,00±0,38 | 13,82±3,31a,c | 0,39±0,21 |
| COQ2 | 1,00±0,15 | 3,92±1,32 | 0,98±0,24 |
| COQ3 | 1,00±0,10 | 3,35±0,57a,c | 0,31±0,11 |
| COQ4 | 1,00±0,15b | 1,06±0,14c | 0,44±0,07 |
| COQ5 | 1,00±0,11 | 1,95±0,36c | 0,73±0,01 |
| COQ6 | 1,00±0,13 | 1,08±0,20 | 0,63±0,02 |
| COQ7 | 1,00±0,10 | 3,38±0,31a,c | 0,80±0,15 |
| COQ8 | 1,00±0,16 | 3,01±0,46c | 0,80±0,09 |
| COQ9 | 1,00±0,22 | 4,52±0,90c | 0,50±0,09 |
| COQ10 | 1,00±0,45 | 1,48±0,49 | 0,28±0,07 |
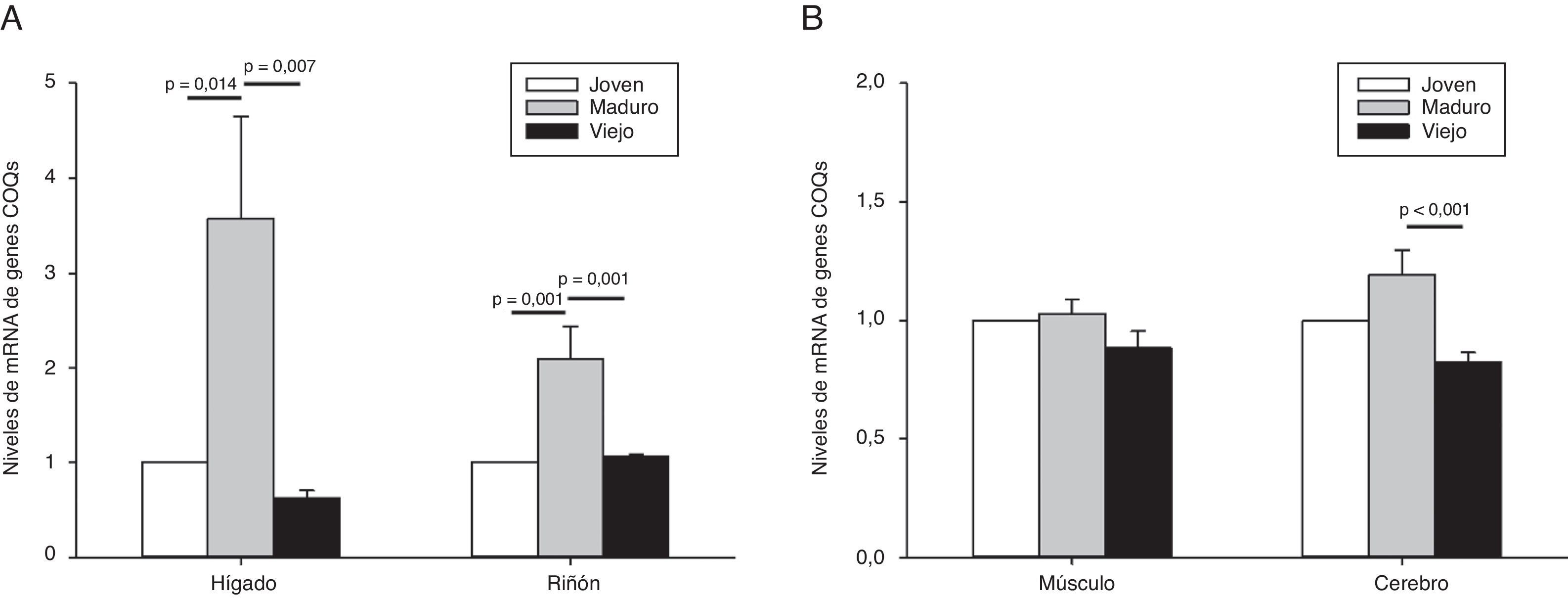
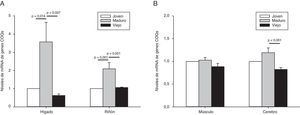
El análisis estadístico de la variación de todos los genes implicados en la síntesis de Q en conjunto demostró que los animales maduros presentaron un incremento de 3,57±1,08 veces respecto a los niveles observados en animales jóvenes. Estos niveles bajaban significativamente en los animales viejos alcanzando tan solo 0,63±0,08 veces los niveles de los jóvenes. Es decir, alrededor de un 40% de descenso de media (fig. 2).
Evolución de la expresión de los genes codificantes para el complejo de síntesis de Q durante el envejecimiento en órganos mitóticos (A) o posmitóticos (B). Los datos representan la media de los niveles de ARNm del conjunto de genes que codifican para los componentes del complejo de síntesis de Q respecto a los niveles de los animales jóvenes que son tomados como referencia. Los valores son mostrados como la media±SEM. La significatividad estadística está indicada en cada uno de los casos.
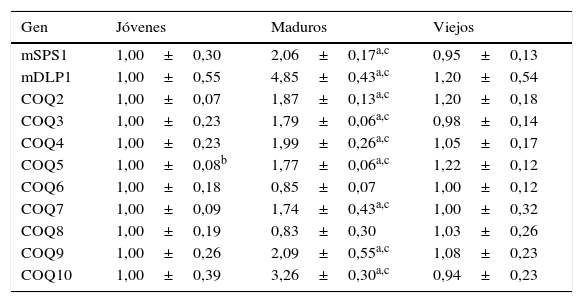
Cuando realizamos el mismo análisis en riñón encontramos 2 hechos diferentes respecto a lo observado en hígado. El primero, que no se encontraron diferencias en cuanto a los niveles de ARNm de estos genes cuando se compararon los animales jóvenes con los viejos. Solamente en el caso de COQ5 hubo diferencias, pero con un mínimo de incremento en animales viejos respecto a jóvenes. El segundo hecho diferencial consistió en que, aunque el patrón de expresión es muy similar al observado en hígado cuando tuvimos en cuenta los animales maduros, los niveles de expresión alcanzados fueron algo menores en riñón. Con la excepción de COQ6 y COQ8, que no mostraron ninguna variación con la edad de los animales, el resto de genes mostraron un mayor nivel de ARNm en los animales maduros que en el resto de animales (tabla 3). En riñón, los niveles de expresión a esta edad fueron de alrededor de 2-3 veces sobre los obtenidos en jóvenes, excepto en el caso de mDLP1, que alcanzó 5 veces más niveles de ARNm.
Variación en la expresión de genes relacionados con la síntesis de Q en riñón de ratón
| Gen | Jóvenes | Maduros | Viejos |
|---|---|---|---|
| mSPS1 | 1,00±0,30 | 2,06±0,17a,c | 0,95±0,13 |
| mDLP1 | 1,00±0,55 | 4,85±0,43a,c | 1,20±0,54 |
| COQ2 | 1,00±0,07 | 1,87±0,13a,c | 1,20±0,18 |
| COQ3 | 1,00±0,23 | 1,79±0,06a,c | 0,98±0,14 |
| COQ4 | 1,00±0,23 | 1,99±0,26a,c | 1,05±0,17 |
| COQ5 | 1,00±0,08b | 1,77±0,06a,c | 1,22±0,12 |
| COQ6 | 1,00±0,18 | 0,85±0,07 | 1,00±0,12 |
| COQ7 | 1,00±0,09 | 1,74±0,43a,c | 1,00±0,32 |
| COQ8 | 1,00±0,19 | 0,83±0,30 | 1,03±0,26 |
| COQ9 | 1,00±0,26 | 2,09±0,55a,c | 1,08±0,23 |
| COQ10 | 1,00±0,39 | 3,26±0,30a,c | 0,94±0,23 |
Teniendo en cuenta todos los genes, los animales maduros presentan un incremento significativo de alrededor del doble de niveles que los animales jóvenes o viejos (fig. 2A).
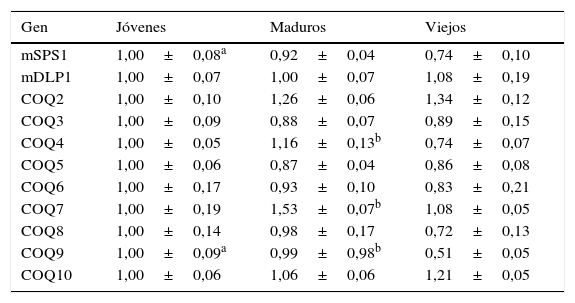
Los niveles de ARNm de órganos posmitóticos presentan una gran estabilidad a lo largo del envejecimientoLos tejidos más afectados por el descenso en los niveles de Q son el tejido nervioso y el muscular esquelético. Realizamos el mismo análisis sobre los niveles de ARNm para estos genes en ambos tejidos utilizando muestras de cerebro completo y de músculo gastrocnemio de ratón. En el caso del músculo, apenas observamos variación en cuanto a la expresión de los genes en animales viejos respecto a los jóvenes. Solo los genes COQ9 y mSPS1 presentaron un descenso significativo, mientras que en COQ4 solo encontramos una tendencia a disminuir en animales viejos. Cuando tuvimos en cuenta a los genes de los animales maduros, los niveles de expresión apenas se vieron afectados y solo en el caso de COQ7 observamos un incremento de alrededor de un 50% sobre los niveles de los animales jóvenes (tabla 4). Cuando comparamos la variación de todos los genes en su conjunto a lo largo de la vida de los animales no encontramos diferencias significativas, aunque un leve descenso en animales viejos parecía indicar una tendencia. Estos datos indican que los niveles de ARNm de estos genes son muy estables en músculo esquelético.
Variación en la expresión de genes relacionados con la síntesis de Q en músculo de ratón
| Gen | Jóvenes | Maduros | Viejos |
|---|---|---|---|
| mSPS1 | 1,00±0,08a | 0,92±0,04 | 0,74±0,10 |
| mDLP1 | 1,00±0,07 | 1,00±0,07 | 1,08±0,19 |
| COQ2 | 1,00±0,10 | 1,26±0,06 | 1,34±0,12 |
| COQ3 | 1,00±0,09 | 0,88±0,07 | 0,89±0,15 |
| COQ4 | 1,00±0,05 | 1,16±0,13b | 0,74±0,07 |
| COQ5 | 1,00±0,06 | 0,87±0,04 | 0,86±0,08 |
| COQ6 | 1,00±0,17 | 0,93±0,10 | 0,83±0,21 |
| COQ7 | 1,00±0,19 | 1,53±0,07b | 1,08±0,05 |
| COQ8 | 1,00±0,14 | 0,98±0,17 | 0,72±0,13 |
| COQ9 | 1,00±0,09a | 0,99±0,98b | 0,51±0,05 |
| COQ10 | 1,00±0,06 | 1,06±0,06 | 1,21±0,05 |
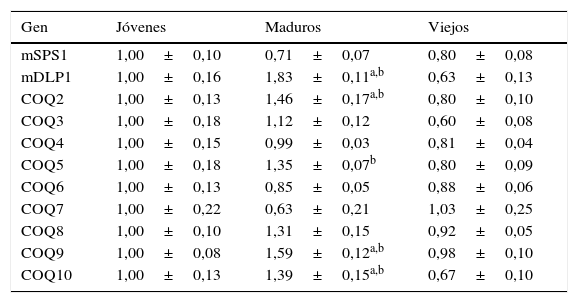
Por otro lado, el cerebro también presentó niveles de ARNm muy similares entre jóvenes y viejos sin que encontrásemos ninguna diferencia significativa. No obstante, cuando estudiamos los niveles de ARNm respecto a los animales maduros, comprobamos que en 5 de los genes: mDLP1, COQ2, COQ5, COQ9 y COQ10 observamos un incremento respecto a los animales jóvenes, pero sin alcanzar valores por encima del 75% de incremento (tabla 5).
Variación en la expresión de genes relacionados con la síntesis de Q en cerebro de ratón
| Gen | Jóvenes | Maduros | Viejos |
|---|---|---|---|
| mSPS1 | 1,00±0,10 | 0,71±0,07 | 0,80±0,08 |
| mDLP1 | 1,00±0,16 | 1,83±0,11a,b | 0,63±0,13 |
| COQ2 | 1,00±0,13 | 1,46±0,17a,b | 0,80±0,10 |
| COQ3 | 1,00±0,18 | 1,12±0,12 | 0,60±0,08 |
| COQ4 | 1,00±0,15 | 0,99±0,03 | 0,81±0,04 |
| COQ5 | 1,00±0,18 | 1,35±0,07b | 0,80±0,09 |
| COQ6 | 1,00±0,13 | 0,85±0,05 | 0,88±0,06 |
| COQ7 | 1,00±0,22 | 0,63±0,21 | 1,03±0,25 |
| COQ8 | 1,00±0,10 | 1,31±0,15 | 0,92±0,05 |
| COQ9 | 1,00±0,08 | 1,59±0,12a,b | 0,98±0,10 |
| COQ10 | 1,00±0,13 | 1,39±0,15a,b | 0,67±0,10 |
A nivel general, no encontramos un incremento significativo de todos estos genes en animales maduros respecto a los jóvenes. No obstante, sí que encontramos un descenso en los animales viejos de alrededor del 20% respecto a los jóvenes, siendo este descenso significativo en el caso del cerebro respecto a los animales maduros (fig. 2B).
Posible existencia de una correlación en la variación de los genes implicados en la síntesis de QUn análisis general de la expresión de los genes implicados en la síntesis de Q aporta una visión general de qué genes podrían presentar una variación coordinada en su expresión. Aunque algo preliminar, el análisis de los datos obtenidos indica que algunos genes como COQ2, COQ3 y COQ5 podrían presentar una expresión coordinada, ya que la correlación entre sus respectivas variaciones en cerebro, hígado y riñón, donde encontramos ciertas variaciones, es bastante alta. Sin embargo, otros genes, como COQ8, parecen no presentar ninguna correlación con otro gen en ninguno de los tejidos estudiados. Al parecer existe una aparente especificidad de ciertos genes en algunos tejidos, como por ejemplo COQ4, que no presenta modificaciones en ningún tejido excepto en riñón, mientras que COQ7 presenta modificaciones en su expresión en todos los tejidos excepto en músculo. Estos resultados nos sugieren que se debe realizar un mayor estudio de estos genes tejido a tejido para determinar si existe una coordinación general en la expresión de estos genes o si, por el contrario, hay una especificidad dependiente de tejido para algunos de ellos, lo que sería interesante para explicar las variaciones en el fenotipo encontrado en diferentes enfermedades raras asociadas a deficiencia en la síntesis de Q.
En general, estos resultados indican que existe un efecto dependiente de la edad sobre la expresión de los genes implicados en la síntesis de Q, pero sin que se afecten todos los genes por igual y, además, con una dependencia del órgano estudiado.
DiscusiónNuestros resultados indican que, por lo general, los niveles de ARNm de los diferentes componentes que intervienen en la síntesis de Q presentan una gran variación que depende del órgano o tejido y de la edad del organismo. Aquellos órganos con capacidad regenerativa como el hígado o el riñón mostraron grandes variaciones en los niveles de ARNm a lo largo de la vida del animal. Por lo general, podríamos decir que hay un gran descenso en los niveles de ARNm de estos genes cuando se comparan los niveles de animales viejos respecto a maduros, pero sin encontrar grandes diferencias entre animales viejos y jóvenes.
Nuestros resultados parecen estar en consonancia con recientes estudios que demuestran que el perfil transcriptómico en personas centenarias es similar al de personas jóvenes, mientras que septuagenarios u octogenarios muestran un perfil más diferente con los otros 2 grupos de edad15,16. Queda por aclarar si esta diferencia se debe a que los organismos más longevos presentan un perfil de expresión génica más parecido al de organismos más jóvenes o si se debe a una respuesta biológica que tiende a modificar la expresión génica para mantener los sistemas de supervivencia más adecuados. Estas respuestas pueden estar reguladas por mecanismos epigenéticos que afectan a la disponibilidad de los genes para su expresión17.
Otro aspecto a tener en cuenta es si esta diferente expresión está relacionada con los niveles de Q en estos tejidos. Pocos estudios han abordado cómo los niveles de Q evolucionan a lo largo de la edad de los animales. El más interesante es el estudio de Beyer et al. en 198518, que demostró que los niveles de Q en diferentes órganos aumentan en las ratas maduras para luego sufrir un descenso considerable en animales viejos. Este grupo utilizó animales de diferentes edades y comprobó que los niveles de Q mostraban descensos importantes en corazón, músculo esquelético y riñón respecto a los animales maduros, alcanzando niveles similares a los obtenidos en los jóvenes. Interesantemente, el cerebro mostró niveles muy estables a lo largo de la vida de los animales. Otros estudios han corroborado en parte esta evolución, como el que demostró que se producía un incremento de Q en la mitocondria de músculo esquelético en ratones maduros y un posterior descenso en ratones viejos12. Estos estudios indican que puede existir una relación entre los niveles de expresión de los genes que codifican para el sistema de síntesis de Q y los niveles de este coenzima en los tejidos y, especialmente, en la mitocondria. No obstante, existe una aparente discrepancia entre la casi nula modificación de la expresión de los genes implicados en la síntesis de Q en músculo esquelético y la disminución asociada a la edad indicada por otros autores12,18. Podemos especular sobre el hecho de que un deterioro debido a la edad en la dinámica mitocondrial y en la renovación de las mitocondrias podría estar asociado con el descenso en los niveles de Q mientras que no existe respuesta en la expresión de los genes implicados en su síntesis, por lo que la desviación del equilibrio llevaría a una pérdida neta de Q en el tejido.
La expresión de estos genes puede ser modulada por factores que influyen en la longevidad. Así, la restricción calórica induce o reprime la expresión de estos genes en un efecto dependiente del órgano estudiado. Incluso en tejidos cercanos, como el músculo cardiaco y el músculo esquelético, el efecto depende del tipo de tejido, produciendo efectos contrarios en algunos de los genes estudiados19. En estos estudios, realizados en animales jóvenes, el cerebro presentó la menor capacidad de modificación en la expresión de sus genes, en consonancia con los resultados obtenidos en el presente trabajo.
Nuestros resultados indican que, por lo general, se produce un descenso muy significativo de expresión entre la población madura y la vieja, afectando especialmente a órganos como el hígado o el riñón. Este tipo de respuesta podría estar condicionada por la capacidad de regeneración de la mitocondria en estos órganos, ya que se ha sugerido que la capacidad de renovación de este orgánulo desciende durante el envejecimiento20. De hecho, recientemente se ha asociado la actividad de las proteínas de fusión mitocondrial, en concreto mitofusina 2, con el mantenimiento de los niveles de Q21. El acoplamiento de la capacidad de renovación de la mitocondria con la expresión de estos genes explicaría este tipo de renovación. Otros factores a tener en cuenta tendrían que ver con la regulación de la vida media del ARN tal y como ha sido sugerida en estudios anteriores22 o con la vida media de las proteínas que forman el complejo de síntesis del Q.
Nuestro estudio presenta la limitación de haber sido realizado en una población de animales macho, por lo que no podemos descartar un posible efecto dependiendo del género y, en especial, dependiente de las modificaciones hormonales asociadas a la edad, mucho más importantes en hembras que en machos. Teniendo en cuenta la influencia de estas hormonas en la dinámica y el metabolismo mitocondrial23, y el efecto de esta dinámica sobre los niveles de Q21, posibles efectos dependientes del género sobre la expresión de estos genes no pueden descartarse y, de hecho, suponen un interesante aspecto a tener en cuenta en futuras investigaciones. Además, estas variaciones en los niveles de ARNm pueden mostrar un reflejo en los niveles de proteína de los componentes del complejo de síntesis de Q. No obstante, algunos estudios han mostrado que, en ocasiones, esta relación no es tan clara. La carencia de anticuerpos y herramientas adecuadas para estas determinaciones están retrasando este análisis, aunque consideramos importante hacer un estudio de niveles de proteína en el futuro.
Dada la importancia del Q como antioxidante3 y molécula implicada en la bioenergética celular y su posible importancia en la disminución de la capacidad antioxidante y regulación energética durante el envejecimiento3, se hace necesario un estudio más completo de la regulación y función de estos complejos a edades avanzadas. Teniendo en cuenta que la ruta de síntesis de Q depende de la ruta de síntesis del mevalonato24, al igual que el colesterol, y el masivo y crónico uso de estatinas, conocidos fármacos anticolesterol en la población mayor, el efecto de estas sustancias sobre los niveles de Q25,26 y posibles efectos secundarios asociados como mialgias26,27 harían necesario el uso de suplementación con Q a edades avanzadas para evitarlos, tal y como ha sido sugerido en recientes estudios26-28.
FinanciaciónEste trabajo ha sido financiado por fondos FEDER (European Commission) a través del grupo Bio177 del PAIDI (Junta de Andalucía) y del proyecto DEP2012-39985 (Ministerio de Economía, Gobierno de España).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.