La osteoporosis (OSP) es una enfermedad progresiva del esqueleto, caracterizada por la disminución de la resistencia ósea que facilita el desarrollo de fracturas. Constituye el segundo problema sanitario asistencial en el mundo después de las enfermedades cardiovasculares, según la Organización Mundial de la Salud. Su prevalencia va en aumento dado el progresivo envejecimiento de la población.
Durante el envejecimiento continúa la pérdida de masa ósea, tanto a nivel de la columna vertebral como de la cadera, que se ha iniciado en la posmenopausia en las mujeres y alrededor de los 60 años en los varones. En la senectud es además cuando se producen la gran mayoría de las fracturas por fragilidad ósea, cuya incidencia aumenta exponencialmente en los mayores de 75 años.
En la actualidad disponemos de diversos tratamientos para la OSP que han demostrado su eficacia en aumentar la densidad mineral ósea y disminuir el riesgo de fracturas. Sin embargo, no deja de ser sorprendente que la evidencia científica respecto a la eficacia y seguridad de estos tratamientos en los pacientes de mayor edad es mucho más escasa en comparación con la de poblaciones más jóvenes. Así, son escasos los datos respecto a su efecto frente a las fracturas no vertebrales y en concreto la fractura de cadera en los pacientes mayores. Por ello, con esta revisión pretendemos analizar las evidencias científicas en cuanto al diagnóstico y tratamiento de la OSP, y en particular la eficacia antifractura en pacientes mayores de 75 años de los distintos fármacos antiresortivos y osteoformadores que tenemos en la actualidad disponibles para el tratamiento de la OSP.
Osteoporosis is a progressive skeletal disease characterized by a decrease in bone strength and an increase in the number of fractures. This disease is considered by the World Health Organization to be the second most important health problem in the world after cardiovascular disease. The prevalence of osteoporosis is increasing due to population aging.
With age, the loss of bone mass in the spine and hip, which starts at menopause in women and around the age of 60 years in men, continues. Old age is when most fragility fractures occur and the incidence of these fractures is increasing exponentially in persons aged more than 75 years.
Several treatments with demonstrated effectiveness in decreasing fracture risk and increasing bone mineral density are currently available for osteoporosis. Nevertheless, the scientific evidence on the safety and efficacy of these treatments is much scarcer in older people than in young populations. There are few reports on the efficacy of these treatments in non-vertebral – specifically hip – fractures in the elderly. Consequently, the present review aims to analyze the scientific evidence on the diagnosis and treatment of osteoporosis, and particularly the evidence on the antifracture efficacy of distinct antiresorptive agents and anabolic drugs in people older than 75 years.
El envejecimiento es un proceso de gran trascendencia, con importantes implicaciones socioeconómicas y asistenciales. Existe una íntima relación entre la edad y la pérdida ósea, tanto en las mujeres como en los varones. La osteoporosis (OSP) de las personas mayores, que se configura alrededor del eje fragilidad ósea – riesgo de caída, constituye uno de los síndromes geriátricos más relevantes y es la enfermedad metabólica ósea más frecuente en ancianos. Se caracteriza por una baja masa ósea y un deterioro de la micro arquitectura del tejido óseo que conduce a un hueso frágil y a un aumento del riesgo de fractura. A pesar de que es una enfermedad prevenible y tratable, la principal manifestación clínica es ya la existencia de una complicación que es la fractura. Aunque se trata de una enfermedad sistémica, la localización más frecuente de las fracturas osteoporóticas es a nivel de fémur proximal, vertebral y antebrazo distal1.
Las fracturas en el anciano aparecen no solo por la presencia de una masa ósea baja sino también asociadas a otros factores como son las caídas2,3 lo que hace al anciano más susceptible a las fracturas en comparación con pacientes más jóvenes para un mismo valor de densidad mineral ósea (DMO). Las caídas son un marcador de fragilidad en el paciente de edad avanzada. En la etiología de las caídas cabe considerar los factores intrínsecos al individuo, relacionados con el envejecimiento, con las enfermedades que sufre y con los fármacos que recibe, y los extrínsecos, relacionados con su entorno y con las actividades que realiza.
Sin ningún género de duda, la fractura de cadera, constituye la complicación más grave de la OSP4. La mortalidad durante el tiempo de hospitalización se ha cifrado en un 6% y en el mes siguiente a la fractura en un 8%; la mortalidad se eleva al 30% al cabo del año. Se estima que un 45% de estos enfermos sufren una pérdida de capacidad funcional y que un 30% requieren cuidados y asistencia especializada.
La OSP y su principal consecuencia, la fractura, son causa de una gran morbimortalidad. Por otra parte, el impacto económico de la fractura osteoporótica es enorme. La combinación de todos estos elementos, la actual y futura prevalencia tanto de la OSP como de la fractura osteoporótica y las repercusiones de esta a nivel personal, económico y social, enfatizan la importancia de esta enfermedad y subrayan la necesidad de identificar los pacientes de riesgo para iniciar medidas preventivas y de tratamiento. Sin embargo, existen datos de que esta enfermedad es infradiagnosticada e infratratada en los pacientes geriátricos.
La existencia de una fractura por fragilidad en vértebra, cadera o antebrazo distal constituye una indicación clásica de realización de densitometría; no obstante, se estima que se realiza un estudio densitométrico solo a un 35% de los pacientes. Por otro lado, la presencia de una fractura previa constituye un factor de riesgo de nuevas fracturas. Así, en la fractura de cadera, la tasa de recurrencia a los 5 años de la primera fractura se sitúa en un 8% y a los 10 años en un 15%. Desafortunadamente, aún son pocos los pacientes de edad avanzada que reciben un tratamiento encaminado a evitar la aparición de una nueva fractura.
DiagnósticoEn todo paciente con sospecha clínica de OSP se debe realizar anamnesis, exploración física y una serie de exploraciones complementarias, en gran medida orientadas a identificar posibles procesos subyacentes determinantes de formas secundarias de la enfermedad.
El diagnóstico de la OSP puede realizarse a partir de la presencia de una fractura por fragilidad (traumatismo de baja intensidad), pero es muy importante diagnosticar la enfermedad antes de que esta complicación aparezca. Por ello, en la actualidad el término OSP se emplea cada vez más para describir los casos de disminución de la DMO antes de que se haya presentado alguna fractura, denominando OSP grave o establecida a los casos que ya han sufrido alguna. La condición asintomática entonces de la OSP hace que el diagnóstico dependa de, por un lado, la estimación individual del riesgo de fractura y, por otro, mucho más objetivo, de métodos que cuantifiquen la masa ósea y valoren la calidad del hueso. La estimación del riesgo de fractura resulta complicada por la cantidad de factores que participan en la etiopatogenia de la enfermedad, esto junto a la falta de técnicas que midan la calidad del hueso, hace que en la actualidad debamos basar el diagnóstico de OSP principalmente en la valoración de la DMO.
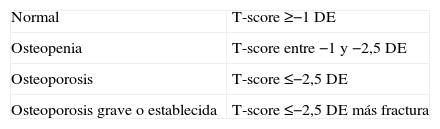
La única técnica de medición ósea actualmente reconocida y validada por la OMS es la densitometría de doble haz. Los criterios densitométricos establecidos por la OMS establecen el diagnóstico de OSP según el valor del T-score (tomando como referencia el pico de masa ósea o valor máximo poblacional, que es la media del adulto joven) (tabla 1)5.
Es necesario tener en cuenta que en estas edades puede ser útil evaluar la DMO femoral, ya que la DMO lumbar puede aparecer falsamente normal por interferencias como la calcificación aórtica, osteofitos, sindesmofitos y aplastamientos vertebrales.
Los marcadores de remodelado son fundamentalmente productos liberados durante la formación o la degradación del colágeno tipo 1, principal proteina que forma la matriz orgánica del hueso, que se pueden determinar en sangre según el proceso de formación y resorción de hueso denominado remodelado óseo. Estos marcadores del remodelado óseo proporcionan información adicional y complementaria al estudio de la DMO sobre la dinámica del recambio óseo. Así, entre los marcadores de formación ósea destacan la osteocalcina, la fosfatasa alcalina ósea y los propéptidos carboxi y aminoteminal del procolágeno tipo I (PICP y PINP) y entre los de resorción, la piridinolina (PIR), la deoxipiridinolina (D-PIR) y los telopéptidos carboxi y aminoterminal del colágeno I (CTX en sangre y orina y NTX en orina). Estos marcadores superan en sensibilidad y especificidad a los marcadores clásicos, fosfatasa alcalina total e hidroxiprolina. Los marcadores óseos no son útiles para el diagnóstico y teniendo en cuenta la evidencia disponible actualmente no se recomienda su determinación sistemática en la evaluación del paciente con OSP. Sin embargo, su medición puede ser útil para identificar, junto a otros factores de riesgo, los pacientes con un mayor qriesgo de fractura y especialmente para valorar de forma precoz la respuesta a un tratamiento, tanto antirresortivo como osteoformador6.
Eficacia de los tratamientos antiosteoporóticos en pacientes mayores de 75 añosEn la actualidad, es indiscutible que la eficacia de un fármaco antiosteoporótico se determina sobre la base de su eficacia antifractura, es decir en su capacidad de hacer disminuir la incidencia de fracturas, evitando tanto las fracturas vertebrales como las no vertebrales, entre ellas la fractura de cadera.
A la hora de abordar la terapéutica de la OSP en el anciano es preciso considerar tres circunstancias diferenciales: el problema de la adherencia al tratamiento suministrado, la relevancia de las medidas no farmacológicas, y la importancia de la suplementación con calcio y vitamina D. Sin embargo, en esta revisión abordaremos principalmente lo referente a los tratamientos farmacológicos.
Las decisiones con respecto al tratamiento antiosteoporótico específico, antiresortivo u osteoformador, se deben basar en el cálculo del riesgo absoluto para fractura del paciente. Con este objetivo la OMS ha desarrollado una herramienta de evaluación de riesgo de fractura conocida como FRAX® (Fracture Risk Assessment Tool)7–10. El FRAX® proporciona el cálculo de riesgo de las fracturas osteoporóticas más importantes (cadera, vertebral, antebrazo, húmero) y de fractura de cadera específicamente, a 10 años. Este cálculo puede hacerse con los factores de riesgo exclusivamente o bien incluir la DMO (tabla 2 y fig. 1). El FRAX® no es aplicable a pacientes por debajo de 50 años de edad.
Variables incluidas en la escala FRAX para el cálculo del riesgo absoluto de fractura osteoporótica en los siguientes 10 años (disponible en http://www.shef.ac.uk/FRAX)
| Edad | El modelo acepta edades entre 40 y 90 años. Si se introducen edades inferiores o superiores, el programa calculará probabilidades a 40 y 90 años, respectivamente |
| Sexo | Hombre o mujer. Introduzca lo que corresponda |
| Peso | Deberá introducirse en kilogramos |
| Estatura | Deberá introducirse en centímetros |
| Fractura previa | Una fractura previa hace referencia a una fractura ocurrida en la vida adulta de manera espontánea o a una fractura causada por un trauma que, en un individuo sano, no se hubiese producido. Introduzca sí o no (ver también notas sobre factores de riesgo)¿ |
| Padres con fractura de cadera | Preguntas sobre la historia de fractura de cadera en la madre o padre del paciente. Introduzca sí o no |
| Fumador activo | Introduzca sí o no, dependiendo de si el paciente fuma tabaco en la actualidad (ver también notas sobre factores de riesgo)¿ |
| Glucocorticoides | Introduzca sí o no si el paciente está actualmente expuesto a glucocorticoides orales o ha estado expuesto a glucocorticoides orales durante más de 3 meses, con una dosis diaria de 5mg o más de prednisolona (o dosis equivalentes de otros glucocorticoides) (ver también notas sobre factores de riesgo)¿ |
| Artritis reumatoide | Introduzca sí, en caso de que el paciente tenga diagnóstico confirmado de artritis reumatoide. De lo contrario, introduzca no (ver también notas sobre factores de riesgo)¿ |
| Osteoporosis secundaria | Introduzca sí, en caso de que el paciente tenga un trastorno asociado estrechamente con osteoporosis. Esto incluye diabetes tipo 1 (insulinodependiente), osteogénesis imperfecta en adultos, hipertiroidismo crónico no tratado, hipogonadismo o menopausia prematura (<45 años), malnutrición crónica o malabsorción y enfermedad crónica del hígado |
| Alcohol, 3 o más dosis por día | Introduzca sí, en caso de que el paciente beba 3 o más dosis de alcohol por día. Una dosis de alcohol varía ligeramente entre países de 8–10g de alcohol. Esto equivale a una caña de cerveza (285ml), una copa de licor (30ml), una copa de vino de tamaño mediano (120ml), o 1 copa de aperitivo (60ml) (ver también notas sobre factores de riesgo)¿ |
| Densidad mineral ósea (DMO) | La DMO del cuello femoral se introduce como T-score o Z-score. Se deberá dejar el campo en blanco para pacientes sin determinación de DMO (ver también notas sobre factores de riesgo)¿ (provided by Oregon Osteoporosis Center) |
¿Notas sobre factores de riesgo en la web http://www.shef.ac.uk/FRAX
Una cuestión clave con el FRAX® es que no conocemos el umbral de indicación de tratamiento o evaluación densitométrica (cuando no se ha hecho previamente); para establecer este umbral se necesita conocer los resultados en coste-efectividad del país correspondiente. Según un estudio sobre este tema, por ejemplo al menos para varones hay datos de que resulta coste-efectivo tratar a varones de 80 años con OSP cuando tengan un riesgo de fractura de cadera a 10 años del 6,5%. También estaría indicado tratar a los mayores de 65 años con historia de fractura previa y a los mayores de 80 años con o sin fractura previa. En los varones menores de 70 años, sin fractura previa, el tratamiento sería coste efectivo solo cuando el coste de la terapia oral con un bifosfonato esté por debajo de 500$ por año11.
Calcio y vitamina DLa suplementación de la dieta con 1.200mg/día de calcio se ha visto que es efectiva en prevenir la aparición de fracturas osteoporóticas solo en aquellos pacientes mayores que cumplen bien dichos suplementos12.
La vitamina D es muy importante para la salud ósea, principalmente por su papel facilitador de la absorción de calcio como sugiere el rápido aumento de las concentraciones de la osteocalcina trás la administración de vitamina D activa. De hecho, la expresión de una gran cantidad de proteínas necesarias para la absorción intestinal del calcio se encuentra controlada por la vitamina D.
Es común la existencia de déficits de vitamina D en la población geriátrica, así el estudio europeo SENECA mostró que el 47% de los ancianos tenían niveles deficientes de vitamina D13. Curiosamente esta deficiencia, niveles de calcidiol inferiores a 12ng/ml según este estudio, era mayor en los países mediterráneos (hasta el 83%) frente a los del norte de Europa (18%). Diversos estudios españoles han evidenciado esta insuficiencia y deficiencia en vitamina D de la población geriátrica española14–17.
La administración de suplementos de calcio y vitamina D reducen la incidencia de fracturas no vertebrales y de cadera en la población geriátrica y personas institucionalizadas. Así, un metaanálisis en personas mayores de 60 años describió una reducción del 26% en las fracturas de cadera y del 23% en el conjunto de fracturas no vertebrales, con el empleo de 700–800UI/día de vitamina D18. La dosis de 400UI/día no resultó suficiente para la prevención de fractura. Sin embargo en el estudio Women's Health Initiative (WHI)19, en el que se utilizaron suplementos de 1.000mg de calcio elemental y 400UI de vitamina D diarias se observó una reducción significativa de nuevas fracturas de cadera en las pacientes mayores de 60 años y en las cumplidoras del tratamiento, en un 21–29%, respectivamente. El último metanálisis publicado al respecto confirma efectivamente que la prevención de fracturas no vertebrales con vitamina D es dosis dependiente y una mayor dosis, superior a 400UI/d, reduciría las fracturas en al menos un 20% en sujetos de 65 años y mayores20.
Un efecto beneficioso extraesquelético de la vitamina D y análogos, que podría influir en las fracturas no vertebrales, es la reducción de caídas. Estudios recientes muestran que 770UI/día de vitamina D3 más 500mg de calcio se asocian a una reducción de la incidencia de caídas (OR: 0,54, IC del 95%: 0,30–0,97) en mujeres mayores de 65 años21,22. Por tanto, las evidencias disponibles alertan de la importancia de la detección del déficit de vitamina D como parte también de un programa de prevención de las caídas en el anciano23.
Por otra parte, la mayoría de los estudios que han demostrado eficacia antifractura con los diferentes antiresortivos y osteoformadores han incluido una suplementación de calcio y vitamina D, habiéndose demostrado que los diferentes fármacos antiosteoporóticos son menos eficaces cuando se administran en pacientes con niveles insuficientes de calcio y vitamina D. Así por ejemplo la existencia de un hiperparatiroidismo secundario a estos déficits se ha visto que disminuye la respuesta en términos de ganancia de DMO en respuesta a alendronato (ALN) en los pacientes mayores24. Por tanto, todos los pacientes tratados con fármacos antirresortivos o anabólicos deben recibir suplementos adecuados de calcio y vitamina D.
Aunque la vitamina D suele administrarse de forma oral, en algunos estudios se ha utilizado por vía intramuscular o intravenosa. No presenta efectos adversos incluso si se administra a dosis dobles o triples de las dosis recomendadas por la Food and Nutrition Board (200UI/día, 400UI/día para sujetos de 51 a 70 años y 600UI/día en mayores de 70 años). Aunque como indicamos previamente, para la prevención de fracturas en pacientes con OSP las dosis recomendadas son de 800UI/día. Dosis superiores a 5000UI/semana pueden ocasionar hipercalciuria, hipercalcemia y sus manifestaciones asociadas (nausea, debilidad, estreñimiento, somnolencia, etc.).
CalcitoninaNo existen estudios que analicen la eficacia de la calcitonina en poblaciones exclusivamente mayores de 75 años. Dada la eficacia probada de otros fármacos antiosteoporóticos, la calcitonina en la actualidad, tiene escasas indicaciones en el tratamiento de la OSP y según las Guías Clínicas podría considerarse su utilización en pacientes mayores de 75 años como una segunda o tercera opción de tratamiento6,25,26.
AlendronatoEl ALN está aprobado en España como tratamiento de la OSP en mujeres postmenopáusicas. No está aprobado para varones aunque hay datos de que es también eficaz en ellos.
Existen múltiples estudios que han demostrado la eficacia de Alendronato, dando lugar a un incremento de la DMO en columna lumbar del 4,9–8,8% y en cuello femoral del 2,5–5,9%, con una reducción de fracturas vertebrales del 46–48% y del 51% en fracturas de cadera27–31. En un estudio con 327 mujeres con OSP y fractura previa de una edad media de 78.5 años (rango: 65–91 años), el tratamiento con ALN durante 2 años mejoró significativamente la DMO32.
En el ensayo inicial de Liberman et al, a 3 años, que incluía mujeres osteoporóticas de 45 a 80 años de edad con o sin fractura vertebral, se encontró que Alendronato redujo significativamente el riesgo de nuevas fracturas vertebrales en un 48% (RR: 0,52, IC del 95%: 0,28–0,95) y que esta reducción era similar en pacientes menores de 65 años que en los ≥65 años, siendo el efecto más pronunciado en mujeres mayores de 65 años con fracturas vertebrales previas. Sin embargo en este estudio no fueron significativos los cambios encontrados para el riesgo de fracturas no vertebrales, 21% (RR: 0,79, IC del 95%: 0,52–1,22)27.
Ensrud K. et al, basándose en el análisis de los resultados obtenidos a partir del estudio Fracture Intervention Trial (FIT)28,33, evaluaron los efectos de alendronato sobre la incidencia de fracturas vertebrales en subgrupos de mujeres con alto riesgo de fractura. Entre los grupos del subanálisis se incluía uno en función de la edad (<75 años vs. ≥75 años). Así, se analizaron 539 mujeres de entre 75–82 años de edad y todas ellas con una fractura vertebral ya previa. Se vio que la reducción del riesgo de nuevas fracturas vertebrales era constante dentro de estos subgrupos definidos en función de la edad (RR: 0,62 en mujeres de ≥75 años y RR: 0,49 en las <75 años).
Hochberg MC et al también realizaron un análisis teniendo en cuenta la edad al evaluar el efecto sobre la reducción de fracturas de cadera, vertebral o de antebrazo en mujeres osteoporóticas tratadas con ALN34. El estudio incluyó 3.658 mujeres del estudio FIT que fueron agrupadas según edad en grupos de: 55–65, 65–70, 70–75 y 75–85 años de edad y fueron seguidas de 3 a 4,5 años. Las reducciones en el riesgo de fractura de cadera y vertebral fueron independientes de la edad, siendo de: 53% (RR: 0,47; p<0,01) y 45% (RR: 0,55; p<0,01) respectivamente. Se observó además que las reducciones del riesgo absoluto aumentaron con la edad para cada tipo de fractura.
En conclusión, podemos decir entonces que ALN es eficaz, en lo que se refiere a incrementos de masa ósea y a reducción de fracturas vertebrales en las mujeres de más edad. De momento no disponemos de datos para esta población respecto a su eficacia antifractura no vertebrales, incluida cadera, ni en varones ancianos.
En España disponemos de varias presentaciones de ALN: ALN 10mg de toma diaria, ALN 70mg en toma única semanal, ALN 70mg combinado con 2.800UI de colecalciferol (vitamina D3) en toma única semanal, ALN 70mg combinado con 5.600UI de colecalciferol (vitamina D3) en toma única semanal.
RisedronatoEl risedronato (RSN) está aprobado en España para el tratamiento de la OSP posmenopáusica y del varón.
Hay varios estudios que demuestran que RSN produce, en pacientes con OSP postmenopaúsica, un incremento en la DMO del 5,4–5,9% en columna lumbar y del 1,6–3,1% en cuello femoral, y una reducción de fracturas vertebrales del 41–49% y del 40% en fracturas de cadera35–38.
Boonen et al39, han realizado un estudio en la población de mujeres mayores de 80 años de edad, mediante un análisis post hoc combinando los 3 grandes ensayos clínicos aleatorizados, doble ciego, realizados paralelamente con RSN a 3 años: el estudio HIP38, el estudio VERT-NA35 y el estudio VERT-MN36. Recordemos que ambos estudios VERT fueron diseñados teniendo como objetivo determinar el efecto de RSN sobre el riesgo de fracturas vertebrales en mujeres posmenopáusicas, mientras que el estudio HIP fue diseñado para determinar el efecto de RSN sobre el riesgo de fractura de cadera en mujeres mayores. De esta forma los autores consiguen reunir un total de 1.392 mujeres con 80 o más años de edad, de ellas 704 recibieron RSN 5mg/d y 688 recibieron placebo. En este estudio, RSN redujo el riesgo de fractura osteoporótica vertebral a un año en un 81% (RR: 0,19, IC del 95%: 0,09–0,40; p<0,01), y a los 3 años en un 44% (RR: 0,56, IC del 95%: 0,39–0,81; p=0,003), Esto supone un NNT de 12 al año y de 16 a los 3 años. Sin embargo, en este estudio no hubo una disminución significativa en el riesgo de fracturas no vertebrales, con una incidencia de 14% frente a 16,2% en el grupo placebo (p=0,66). Es posible que esta falta de efecto sobre el riesgo de fractura de cadera en pacientes mayores de 80 años se deba a la existencia de otros factores de riesgo no esqueléticos para este tipo de fracturas, como por ejemplo la frecuencia de caídas, ya que el aumento de la comorbilidad en estos pacientes puede aumentar de por sí el riesgo de caídas. También un inadecuado poder estadístico ha podido contribuir a estos resultados.
Heaney RP et al, examinan el riesgo de una primera fractura vertebral en mujeres postmenopaúsicas con una baja DMO en columna (T-score ≤−3,3) y sin fracturas vertebrales previas, incluidas en cuatro ensayos clínicos clásicos placebo-control de RSN y estratificadas por edad40. Se vieron similares reducciones en las pacientes con una media de edad de 64 años (RR: 0,30, IC del 95%: 0,1–0,92; p=0,030) y las de una media de edad de 76 años (RR: 0,2, IC del 95%: 0,04–0,93; p=0,024). De este modo el estudio demuestra que el tratamiento con RSN reduce significativamente la aparición de la primera fractura vertebral en mujeres postmenopaúsicas, con una magnitud similar del efecto con edades más próximas o más lejanas a la menopausia.
Para ver el efecto de RSN en fracturas no vertebrales, incluyendo fractura de cadera, tenemos por tanto que recurrir nuevamente al estudio HIP que evaluó el efecto a 3 años con RSN en dos grupos de mujeres: grupo 1, que comprendía mujeres entre 70 a 79 años con OSP establecida (n=5.445; edad media: 74 años) y grupo 2, mujeres de 80 o más años de edad con al menos un factor de riesgo para fractura de cadera o disminución de DMO en cuello femoral (n=3.886; edad media: 83)38. En este estudio el tratamiento con RSN redujo un 30% las fracturas no vertebrales (RR: 0,70, IC del 95%: 0,5–0,9; p=0,01), así como el riesgo de fractura de cadera en un 40% (p=0,009) en las mujeres con OSP y en un 60% (p=0,003) en mujeres con OSP y al menos una fractura vertebral (grupo 1). Sin embargo no hubo una disminución de este riesgo para las mujeres del grupo 2, es decir en las mujeres mayores de 80 años y sin criterios diagnósticos de OSP.
Nos parece interesante además comentar otros estudios con RSN, en los cuales se analizaron poblaciones también de mayor edad y con alto riesgo de fractura por presentar enfermedades neurológicas como enfermedad de Parkinson, enfermedad de Alzheimer, y accidentes cerebrovasculares. El primero es un estudio que valora la eficacia del RSN en la prevención de fracturas no vertebrales, incluyendo fractura de cadera, en mujeres con enfermedad de Alzheimer41 donde se incluyeron 500 mujeres afectadas de esta enfermedad, con edad media de 77,7 años, distribuidas aleatoriamente para recibir durante 18 meses, 2,5mg/día de RSN o placebo, junto con 1.000UI/día de ergocalciferol y 1.200mg/día de calcio. Se vio una disminución del 72% del riesgo de fractura de cadera (RR: 0,28; IC del 95%: 0,1–0,69). En el estudio prospectivo de 121 pacientes con enfermedad de Parkinson que recibieron durante 2 años RSN 2,5mg diarios y 1.000UI de vitamina D durante 2 años el riesgo relativo de fractura de cadera (RR: 0,33, IC del 95%: 0,09–1,20) y la DMO aumentó un 2,2% en el grupo tratado con RSN (p<0,0001)42. Por último, un estudio43,44 con 280 pacientes varones mayores de 65 años que presentaban una hemiplejía tras un accidente cerebrovascular donde se distribuyeron aleatoriamente para recibir 2,5mg/día de RSN o placebo, junto a 1.000UI de ergocalciferol y 1.200mg de calcio elemental. Tras un seguimiento de 18 meses, se evidenció que el tratamiento con RSN redujo un 81% el riesgo de fractura de cadera (RR: 0,19; IC del 95%: 0,04–0,89).
En conclusión, RSN ha demostrado ser eficaz en los pacientes mayores aumentando la masa ósea y disminuyendo las fracturas vertebrales. Sin embargo solo ha demostrado disminuir el riesgo de fracturas de cadera en algunos grupos de población de alto riesgo como son los ancianos con enfermedades neurológicas y en mujeres de 70–79 años con OSP establecida, pero no ha demostrado una reducción significativa de estas fracturas en las mujeres mayores de 80 años sin fractura previa.
En España disponemos de varias presentaciones de RSN: 5mg/día, 35mg en toma única semanal y 75mg en dos días consecutivos al mes (2DCM). Esta última pauta mensual podría facilitar la adherencia al tratamiento aportando la misma eficacia. En un estudio fase III, aleatorizado, doble ciego en que se comparó a un año el tratamiento con esta nueva pauta (n=616) frente a RSN a 5mg/día (n=613) en mujeres postmenopáusicas con OSP45 se concluyó que RSN 75mg 2DCM no es inferior y es igualmente bien tolerado a la dosis diaria en esta población cuya edad media fue de 65 años.
IbandronatoSe trata de un bisfosfonato de tercera generación, aprobado solo para el tratamiento de la OSP en mujeres postmenopáusicas. Las formas comercializadas son: una presentación en dosis oral única mensual de 150mg y una forma de administración intravenosa en dosis de 3mgrs cada 3 meses con la que existe todavía poca experiencia. Con estas posologías, este fármaco puede aportar comodidad y mejorar la adherencia de los pacientes al tratamiento. Los estudios publicados con ibandronato demuestran su eficacia en producir un incremento en la DMO de columna lumbar del 5,7–6,5% y cuello femoral del 2,9–3,4%, y una reducción de fracturas vertebrales del 50–62%46,47, sin embargo no existen estudios cuyo objetivo sea analizar su eficacia y seguridad en la población mayor de 75 años. Según los datos comunicados, no parecen existir diferencias, según la edad, en cuanto a la reducción en el riesgo de fractura vertebral ni en cuanto a seguridad. En un estudio en que se estratificó a mujeres de <70 años frente a igual o mayores de 70 años, se demostró una reducción de nuevas fracturas vertebrales del 50–65% frente al grupo placebo y la incidencia de efectos adversos, incluyendo esofagitis y dispepsia, fue similar en ambos grupos y comparable a placebo48. Los datos disponibles en cuanto a su eficacia en la prevención de fracturas no vertebrales, incluyendo fractura de cadera derivan de estudios observacionales y metaanálisis pero no de ensayos clínicos cuyo objetivo primario fuera la reducción de riesgo de este tipo de fracturas49–51.
En conclusión, existen todavía pocos datos para el empleo de este fármaco en población geriátrica así como de su eficacia en reducir el riesgo de fracturas de cadera, aunque es una opción si se piensa que puede mejorar la adherencia del paciente al tratamiento.
Ácido zoledrónicoEste es el primer bifosfonato aprobado para tratamiento intravenoso en dosis única anual para el tratamiento de la OSP en mujeres posmenopáusicas y también en varones. En el estudio de Black et al con mujeres posmenopáusicas de las cuales 1.497 eran mayores de 75 años de edad no se han publicado los resultados en este subgrupo de pacientes. En el total de pacientes tratadas que fueron 3.889 pacientes con una edad media de 73 años recibiendo una infusión anual de ácido zoledrónico (ZLN) 5mg durante 3 años hubo una reducción del riesgo de fractura vertebral morfométrica a los 3 años del 70% (RR: 0,30, IC del 95%, 0,24–0,38; p<0,001) y también redujo la incidencia de fracturas no vertebrales y en concreto el riesgo de fractura de cadera en un 41% (HR: 0,59, IC del 95%: 0,42–0,83 p<0,001)52. Interesantes son los datos que aporta el estudio de Lyles et al en que 1.065 pacientes con una edad media de 75 años de los cuales 586 tenían ≥75 años53, fueron tratados a los 90 días de haber sufrido una fractura de cadera con una infusión de ZLN 5mg y con un seguimiento de 1,9 años. Se demostró un importante beneficio en términos de reducción de fractura vertebral, fractura no vertebral y también en la mortalidad. Los únicos efectos adversos observados en este grupo tratado fueron pirexia, mialgias, y dolor músculoesqulético. No hubo casos de osteonecrosis manibular, ni de consolidación en la fractura. La aparición de fibrilación auricular u otros efectos cardiovasculares fue similar respecto al grupo control.
Por tanto, podemos decir que ZLD es un fármaco que ha demostrado reducir de forma importante el riesgo de fracturas vertebrales, no vertebrales y de cadera tanto en mujeres postmenopáusicas como en varones con OSP. Aporta la ventaja de ser una dosis anual para pacientes por ejemplo polimedicados, con demencia, encamados o con problemas gastrointestinales, o en pacientes no cumplidores. La desventaja es que requiere la disponibilidad de un hospital de día o equivalente para su administración.
TeriparatidaEl fragmento recombinante N-terminal de la hormona paratiroidea (PTH) (hPTH 1-34), ha sido el primer fármaco con acción estimuladora sobre la formación ósea aprobado para el tratamiento de la OSP posmenopaúsica. Además en el momento actual cuenta también con las indicaciones para el tratamiento de la OSP en varones con riesgo aumentado de fractura y para la OSP corticoidea.
La PTH estimula la aposición de nuevo hueso en las superficies trabeculares, endocorticales y periostales en los primeros meses de tratamiento, lo que se traduce en un incremento de la resistencia o sea y la reducción de fracturas.
Con la dosis de 20μg en inyección diaria por vía subcutánea. y un promedio de 21 meses de tratamiento, el estudio de Neer et al54, que incluía 1.637 mujeres osteoporoticas con una o más fracturas vertebrales, ha demostrado que PTH reduce las fracturas vertebrales y no vertebrales en un 7.753% respectivamente. Esto se asocia con un incremento significativo de la DMO en columna lumbar (9,7%) y fémur total (2,8%) El efecto sobre la DMO se mantiene incluso después de retirar el medicamento, permaneciendo la DMO estable a 4 años, y la reducción del riesgo de fractura se mantiene igualmente al menos hasta 18 meses55.
En otro estudio realizado en mujeres posmenopáusicas con fracturas vertebrales severas, el tratamiento con teriparatida, comparado con placebo, reduce en un 80% el riesgo de nuevas fracturas vertebrales y en un 95% las fracturas vertebrales moderadas y severas56.
Para evaluar la relación entre edad y respuesta al tratamiento con PTH, contamos con estudios en que se han estratificado a las pacientes según edad por subgrupos: <65 años, 65–75 años, y >75 años57,58. Comparado con placebo la DMO vertebral aumentó significativamente en el grupo tratado con PTH en todos los grupos de edad, aunque el porcentaje de aumento fue mayor en las pacientes pertenecientes a los subgrupos de mayor edad (interacción del tratamiento por edad, p=0,037). En este estudio se observó un incremento de DMO incluso entre los pacientes de mayor edad tratados con placebo, lo que puede significar el hecho de que existiera una deficiencia de calcio y vitamina D en las pacientes mayores al iniciar el estudio. Debido a ello, deducimos que la ganancia en DMO en las pacientes >65 años tratadas con PTH pudo sobreestimarse. En cambio no se encontraron diferencias según la edad en cuanto a la reducción en el riesgo de fractura vertebral (interacción del tratamiento por edad, p=0,558). Se analizó también la respuesta de PTH según diferencias basales en DMO y número de fracturas previas. Con ello, se demostró que PTH es eficaz en reducir el riesgo de nueva fractura vertebral en aquellas pacientes de más riesgo en la situación basal, es decir, mujeres con más de 75 años, con DMO de OSP severa y con dos o más fracturas vertebrales previas. Estos estudios concluyen por tanto que la edad no afecta a la eficacia de PTH en mujeres postmenopaúsicas.
No existen estudios específicos con PTH para fractura de cadera.
En conclusión, PTH ha demostrado tener la misma eficacia en los pacientes mayores que en los más jóvenes, aumentando la masa ósea y reduciendo el riesgo de fracturas vertebrales y no vertebrales.
PTH solo tiene presentación como pluma inyectable precargada con 28 dosis de 20mcg/día y de administración subcutánea. El tiempo máximo de administración aprobado para su uso es de 24 meses.
Hormona paratiroidea intactaLa hormona paratiroidea intacta (PTH [1–84]) también es un fármaco con acción osteoformadora aprobado para el tratamiento de la OSP posmenopaúsica con alto riesgo de fracturas, no está aprobado en el tratamiento de la OSP masculina pues no existen estudios con PTH (1–84) en varones. No existen estudios que analicen por subgrupos de edad la eficacia de este fármaco y tampoco existen estudios respecto a su valor frente a la fractura de cadera. En el estudio de Greenspan et al donde se trataron 2.532 mujeres posmenopáusicas PTH (1–84) aumentó la DMO un 6,9% en CL y un 2,1% en cadera. También fue eficaz en disminuir el riesgo de fractura vertebral (RR: 0,60, IC del 96%: 0,36–1; p=0,05). Los efectos secundarios encontrados con su administración fueron: hipercalcemia, hipercalciuria y nauseas59.
En conclusión, no existen datos de la eficacia de PTH (1–84) en la población de más edad ni al respecto de las fracturas no vertebrales y de cadera.
PTH (1–84) solo tiene presentación como pluma inyectable precargada con 28 dosis de 100mcg/día y de administración subcutánea. El tiempo máximo de administración aprobado para su uso es de 24 meses.
Ranelato de estroncioEl estroncio actúa tanto en la formación, estimulando los osteoblastos, como en la resorción, inhibiendo los osteoclastos. Por tanto tiene una acción dual sobre el hueso, con un efecto desacoplador de la remodelación ósea.
Como indicaciones aprobadas solo tiene la de la OSP en mujeres posmenopáusicas. Sobre la DMO el ranelato de estroncio ha demostrado en mujeres posmenopáusicas con dosis de 1g/día durante 2 años, un efecto positivo con incrementos de la DMO en columna lumbar del 5,53%, en cuello femoral del 2,4% y fémur total del 3,2%. Recientemente se ha publicado la extensión de este estudio a 5 años y a 8 años donde se demuestra que los efectos del fármaco se mantienen a este tiempo60–63. En cuanto al efecto antifractura, se han realizado dos grandes estudios a 3 años de tratamiento con 2g diarios de ranelato de estroncio via oral en pacientes osteoporóticas posmenopáusicas: el estudio SOTI64 y el estudio TROPOS65. La edad de las pacientes incluidas en el estudio TROPOS fue de ≥74 años (o ≥70 años con factores de riesgo). Por ello, el estudio TROPOS nos sirve como referencia para estudiar a una población de dicha edad. Los resultados de este estudio en cuanto a fractura vertebral, que no era objetivo primario del estudio, demostraron que el tratamiento con ranelato de estroncio reduce un 45% (RR: 0,55; IC del 95%: 0,42–0,72 p<0,001) la aparición de la primera fractura vertebral y un 39% (RR: 0,61; IC del 95%: 0,51–0,73 p<0,001) la presencia de una nueva fractura vertebral. En cuanto a la fractura de cadera, analizando una subpoblación de este estudio con mayor riesgo de padecer este tipo de fracturas, mujeres de ≥74 años y con DMO en cuello femoral ≤3 DE, el tratamiento con estroncio demostró reducir en un 36% el riesgo de padecer fracturas de cadera en este grupo de pacientes (RR: 0,64, IC del 95%: 0,412–0,997; p=0,046).
El estudio de Seeman et al aporta más concretamente los datos sobre la eficacia del estroncio en pacientes de mayor edad, pues realizaron un subanálisis con las pacientes de ≥80 años de edad incluidas en los estudios SOTI y TROPOS (n=1.488)66. A los 3 años el tratamiento con estroncio redujo un 32% el riesgo de fractura vertebral (RR: 0,68, IC del 95%: 0,50–0,92; p=0,013) y un 31% el riesgo de fractura no vertebral (RR: 0,69, IC del 95%: 0,52–0,92; p=0,011).
El ranelato de estroncio se presenta en forma de sobres que contienen granulado para su disolución en agua y se administra vía oral 2h después de la cena. No tiene efectos sobre el tracto esofagogástrico y por tanto también es una buena opción en pacientes con contraindicación por esta razón para tomar un bifosfonato. Solo se han descrito como reacciones adversas reacciones cutáneas, diarrea y cefalea fundamentalmente.
En conclusión, podemos decir que el ranelato de estroncio es un fármaco de probada eficacia en la población de mayor edad desmostrando una disminución sostenida de la incidencia de fracturas vertebrales, no vertebrales y de cadera.
DenosumabDenosumab es un fármaco próximo a comercializarse, cuyo mecanismo de acción es totalmente diferente a los ya mencionados. Se trata de un anticuerpo monoclonal IgG2 completamente humano que se une con alta afinidad y especificidad al ligando del receptor activador del factor nuclear Kappa B (RANKL) y evita que sea reconocido por su receptor RANK, lo que resulta en una disminución de la resorción ósea. En el estudio publicado recientemente con 7.868 pacientes posmenopáusicas con edades comprendidas entre los 60 a 90 años tratadas con 60mg de denosumab o placebo de forma subcutánea cada 6 meses y durante 3 años, se observó una disminución del 68% en el riesgo de nuevas fracturas vertebrales (RR: 0,32; IC del 95%: 0,26–0,41; p<0,001) y una disminución del riesgo de fractura de cadera del 40% (HR 0,60; IC del 95%: 0,37–0,97; p=0,04). Denosumab disminuyó el riesgo de las demás fracturas no vertebrales en un 20% (HR 0,80; IC del 95%: 0,67–0,95; p=0,01)67.
No se han publicado los resultados por subgrupos de edad donde podamos comparar su efecto en la población de mayor edad y como decíamos, es un fármaco aún no comercializado en nuestro país.
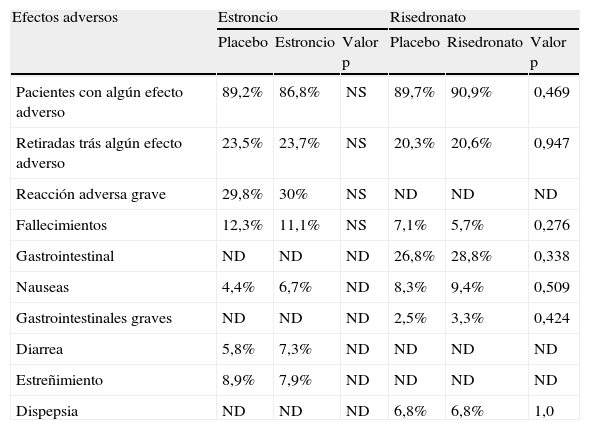
Seguridad de los tratamientos antiosteoporóticos en pacientes mayores de 75 añosLos estudios sobre reacciones adversas con estos fármacos en pacientes mayores son muy limitados. La mayor parte de los datos publicados son respecto a RSN39 y ranelato de estroncio66 y se resumen en la tabla 3. En ella podemos ver que los efectos adversos con estroncio fueron similares a los publicados en el estudio global con pacientes más jóvenes. Con RSN parece haber un ligero aumento no significativo de los efectos gastrointestinales. Con PTH se han publicado algunos datos68 en los que la diarrea fue más frecuente en los pacientes mayores respecto a los más jóvenes. Mientras que frente a placebo los efectos más frecuentes en los pacientes tratados fueron: dolor de espalda, cataratas y prurito.
Efectos adversos de fármacos antiosteoporóticos en pacientes de 80–100 años
| Efectos adversos | Estroncio | Risedronato | ||||
| Placebo | Estroncio | Valor p | Placebo | Risedronato | Valor p | |
| Pacientes con algún efecto adverso | 89,2% | 86,8% | NS | 89,7% | 90,9% | 0,469 |
| Retiradas trás algún efecto adverso | 23,5% | 23,7% | NS | 20,3% | 20,6% | 0,947 |
| Reacción adversa grave | 29,8% | 30% | NS | ND | ND | ND |
| Fallecimientos | 12,3% | 11,1% | NS | 7,1% | 5,7% | 0,276 |
| Gastrointestinal | ND | ND | ND | 26,8% | 28,8% | 0,338 |
| Nauseas | 4,4% | 6,7% | ND | 8,3% | 9,4% | 0,509 |
| Gastrointestinales graves | ND | ND | ND | 2,5% | 3,3% | 0,424 |
| Diarrea | 5,8% | 7,3% | ND | ND | ND | ND |
| Estreñimiento | 8,9% | 7,9% | ND | ND | ND | ND |
| Dispepsia | ND | ND | ND | 6,8% | 6,8% | 1,0 |
Tomado de: Inerjeeth C.A. et al74.
ND: no disponible; NS: no significativo.
Los estudios han demostrado que es coste-efectivo tratar a las mujeres con OSP de mayor edad con los fármacos actualmente disponibles, pero asumiendo que estos son igualmente eficaces en la población de esta edad69–71.
Uno de estos estudios indica que el tratamiento no sería coste-efectivo en pacientes de más de 80 años de edad si no se estratifica a estos pacientes además por otros factores de riesgo71. Según las guías clínicas está claramente recomendado el tratamiento antirresortivo para los pacientes con 75 años o más que tienen OSP con fractura osteoporótica previa72. Sin embargo para los pacientes que no han tenido todavía fracturas, es decir prevención primaria, con lo publicado no es posible hacer la recomendación de utilizar los bifosfonatos38. Recientemente se ha publicado un estudio que demuestra que el estroncio es un tratamiento coste-efectivo en mujeres mayores de 75 años con OSP73. No existen estudios donde podamos ver si estaría justificado el uso en prevención primaria de otros fármacos como por ejemplo teriparatide. Con todo ello, debemos concluir que es muy importante la valoración individual del riesgo absoluto de fractura de cara a justificar el tratamiento.
ConclusionesEl tratamiento de la OSP en los pacientes mayores de 75 años incluye medidas farmacológicas y no farmacológicas. La suplementación de la dieta con calcio y vitamina D es una medida de coste relativamente bajo que reduce el riesgo de fracturas. Podemos decir que la evidencia científica apoya el beneficio que aportan los bifosfonatos (ALN, RSN, ibandronato y ácido zoledrónico), teriparatide y el ranelato de estroncio en la reducción de las fracturas vertebrales en pacientes mayores, aunque disponemos de menos datos sobre la reducción de fracturas no vertebrales y de cadera en esta población de alto riesgo. En los pacientes de más edad, mayores de 80 años, el ranelato de estroncio es el primer fármaco con eficacia demostrada y sostenida a 8 años en ambos tipos de fracturas, tanto vertebrales como no vertebrales. Por tanto, y también de acuerdo con las revisiones sobre este tema publicadas últimamente74–77, todos estos fármacos constituyen opciones terapeúticas eficaces en los pacientes geriátricos. De todos modos, quizás sea necesario adoptar diferentes estrategias en el manejo de pacientes mayores con OSP y riesgo de fractura, que pueden ser distintas a las aplicadas a poblaciones más jóvenes. Además a pesar de que la edad no debe de ser una barrera para un adecuado manejo de la OSP, es importantísimo por ejemplo la prevención de las caídas como aspecto relevante para disminuir el riesgo de fracturas en el anciano, la correción de las deficiencias en calcio y vitamina D así como el cálculo del riesgo absoluto individual para fractura que es lo que debe hacernos establecer el umbral terapéutico78.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.