La anemia es un problema frecuente en las personas mayores y está relacionada con un aumento de la morbilidad y mortalidad. En las personas ancianas aunque la anemia tiene una prevalencia elevada, existen diversos aspectos como el umbral de hemoglobina por debajo del cual debemos preocuparnos o la identificación de las causas de la misma que no son fáciles de establecer. La presente revisión se centra en conocer lo que se considera niveles de hemoglobina normales en los adultos, las causas más frecuentes de la anemia y sus posibles consecuencias en pacientes de edad avanzada. Se aporta un algoritmo diagnóstico y una aproximación al tratamiento en que se abordan nuevas posibilidades terapéuticas como el hierro parenteral y los agentes estimulantes de la eritropoyesis.
Anemia is a common disorder in the elderly and is associated with increased morbidity and mortality. In elderly subjects, in whom anemia is highly prevalent, there are several aspects, such as a hemoglobin at a level which should concern us limit, or identifying its causes, that are not easy to establish. This review focuses on knowing what is considered to be normal hemoglobin levels in adults and the common causes and potential consequences of anemia in elderly patients. It provides a diagnostic algorithm and an approach to treatment that addresses new treatments such as parenteral iron drugs and erythropoiesis-stimulating agents.
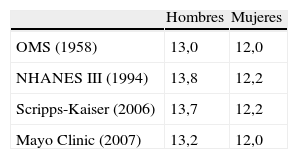
Para la correcta definición de anemia debemos utilizar la concentración plasmática de hemoglobina (Hb), y rechazar otros parámetros como por ejemplo el hematocrito ya que este se halla sometido a variaciones en función de la volemia. Los puntos de corte empleados son específicos de género y se basan en la distribución estadística de las cifras de Hb de una población «aparentemente» sana (media de Hb±2 DE). En función de la muestra empleada para obtener dichos puntos de corte disponemos de diferentes criterios diagnósticos de los cuales, los más conocidos y utilizados son los de la Organización Mundial de la Salud (OMS) que datan de 1958, aunque existen otros (tabla 1)1. En los criterios de anemia más recientes obtenidos de bases de datos americanas como NHANES III, Scripps-Kaiser y Mayo Clinic las cifras de Hb son discretamente más elevadas que en los de la OMS. Sin embargo, en la mayoría de casos, la población anciana no está específicamente representada en esas bases de datos que dan origen a los criterios diagnósticos. Aunque todos los criterios se basan exclusivamente en datos epidemiológicos y estadísticos existen algunas evidencias experimentales que aportan cierta relevancia clínica a dichas cifras. Así, cuando la Hb desciende por debajo de 12g/dl la producción de eritropoyetina se incrementa significativamente al igual que las complicaciones en pacientes posquirúrgicos mientras que la sensación de calidad de vida global evaluado con escala validadas (SF-36, EuroQol-5D, etc.) desciende de forma importante en esos pacientes1,2.
En todo caso, es importante subrayar que los criterios de anemia que utilicemos deben ser los mismos tanto en la población anciana como en la población joven. Según el estudio NHANES III, la concentración de Hb es discretamente inferior en mujeres mayores de 65 años respecto a varones de su misma edad y por lo tanto los umbrales diagnósticos de anemia son diferentes en hombres y mujeres. Sin embargo, algunos autores plantean dudas sobre si desde el punto de vista clínico tiene sentido mantener criterios diagnósticos de anemia diferentes según el sexo en personas mayores de 65 años. Parece evidente que en mujeres premenopáusicas los criterios de anemia dependerán del género mientras que en las postmenopáusicas (como las ancianas) podría ser independiente del sexo. Sin embargo, esta última afirmación no tiene el consenso general de los expertos1.
Los resultados de estudios observacionales publicados sugieren que los criterios de la OMS son excesivamente permisivos y que los mejores resultados en términos de morbimortalidad se alcanzan con cifras de Hb más elevada. De ahí que los criterios de NHANES III y Scripps-Kaiser hayan recogido un mayor consenso en los últimos años. Sin embargo, no disponemos de estudios de intervención y por lo tanto con la mayor evidencia científica que confirmen estos hallazgos.
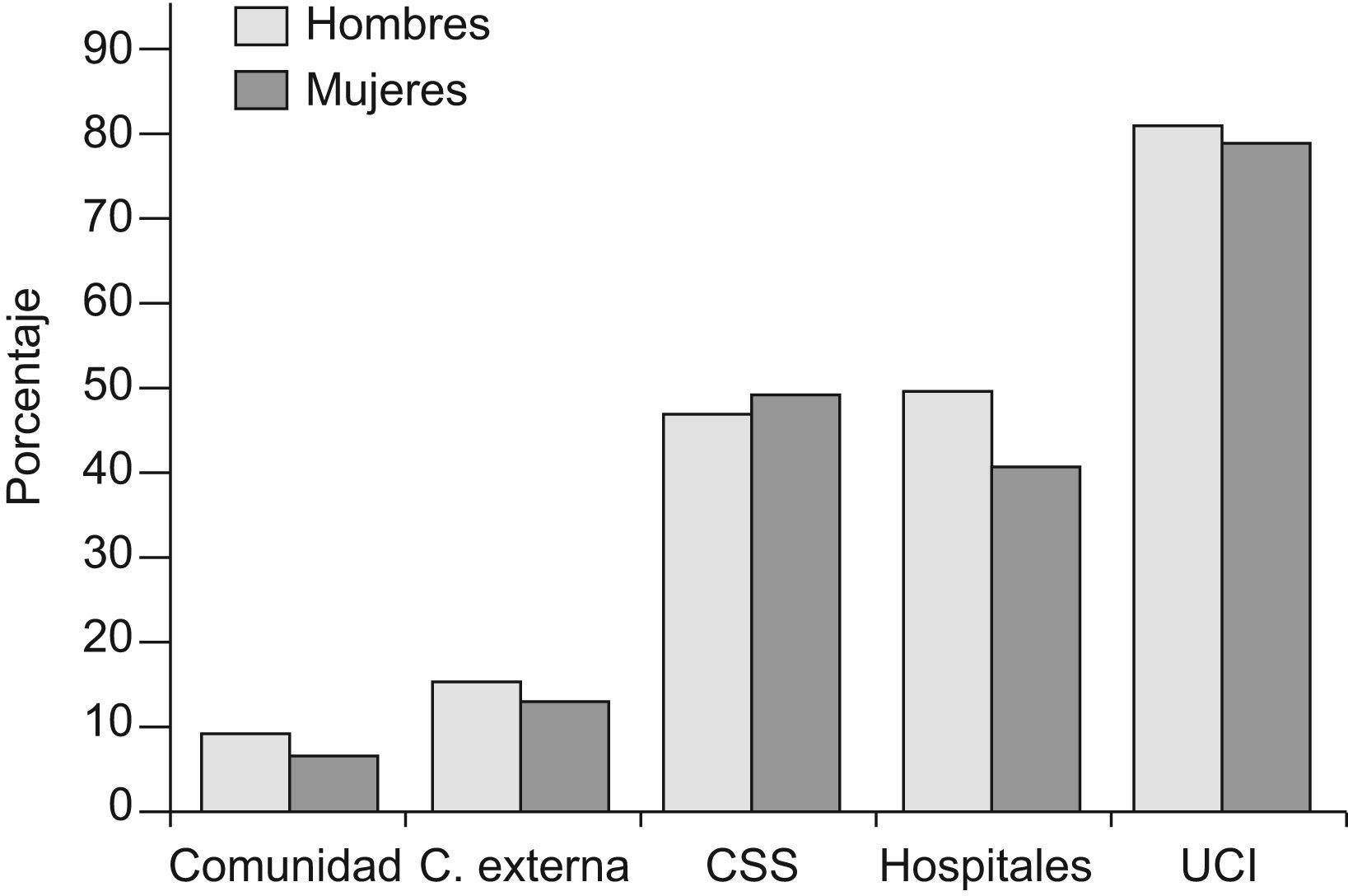
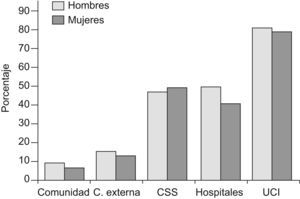
PrevalenciaLa prevalencia de anemia se incrementa con la edad y según las características específicas de los ancianos analizados por lo que los datos que se disponen ofrecen enorme variabilidad2–4. Así, si evaluamos ancianos de la comunidad la detectaremos entre el 5 y 10% en pacientes de 65 a 70 años mientras que esa cifra se incrementa hasta 15–25% en pacientes de más de 80 años5. Por el contrario, si nos centramos en ancianos (≥65 años) que cumplen criterios de fragilidad la prevalencia es mucho mayor y puede oscilar entre el 48 y el 60% según datos del National Geriatrics Research Consortium y del Beverly Healthcare Data Warehouse5. No obstante, debe subrayarse que la prevalencia de anemia grave (Hb<10g/dl) es relativamente baja (11–13%) en esta población. Sin embargo, de estos datos no debemos cometer el error de pensar que la anemia es un hecho fisiológico del envejecimiento sino que es indicativa de una o más enfermedades subyacentes y se asocia a mal pronóstico vital y funcional a medio-largo plazo. En la figura 1 se resumen las prevalencias de anemia en ancianos según el origen de la muestra1–4.
Implicaciones pronósticas de la anemiaEn los últimos años grandes estudios epidemiológicos se han documentado que la existencia de anemia en el anciano, aunque no sea grave, es un factor predictivo de mal pronóstico funcional y vital a medio-largo plazo2–8 (tabla 2). Esta afirmación es válida tanto para ancianos aparentemente sanos, como para aquellos que cumplen criterios de fragilidad2,5,7. De hecho se ha demostrado una fuerte asociación entre anemia y las características fenotípicas del síndrome de fragilidad como sarcopenia, reducción de la fuerza muscular y problemas de movilidad5. Asimismo estudios epidemiológicos han documentado que la anemia leve (criterios OMS) es factor predictivo de fragilidad5.
Consecuencias de la anemia en el anciano
|
Se ha descrito una relación en U entre la cifra de Hb y el pronóstico (vital y/o funcional) del paciente anciano. De tal forma que los que presentan peor pronóstico son aquellos cuya cifra de Hb está situada en el primer (anémicos) o quinto quintil (poliglobúlicos) respecto a aquellos del segundo, tercer o cuarto quintil9.
Anemia, movilidad y caídasLa existencia de anemia se asocia a menor resistencia física y mayor riesgo de discapacidad, ambos, factores de riesgo independiente de caídas4,5,7. En el estudio Women's Health and Aging Studies (WHAS)9 realizado en mujeres mayores de 70 años que vivían en la comunidad se observó que en la evaluación objetiva de la movilidad mediante la escala SPS (Summary Performance Score: deambulación a trayectos cortos, paso de sedestación a bipedestación y equilibrio en bipedestación) se obtenían mejores puntuaciones en las pacientes con Hb alrededor de 14gr/dl que aquellas que estaban por encima o por debajo de esas cifras. Según este estudio, en el análisis multivariado, la anemia leve se asociaba con un incremento del riesgo de dificultad en la movilidad. Posteriormente, otro estudio prospectivo3 realizado en 1.744 ancianos (edad media 77±5 años) demostró que los ancianos anémicos al inicio del estudio presentan un mayor deterioro funcional en un seguimiento a 4 años que los no anémicos.
Asimismo, se ha demostrado que la anemia también es un factor de riesgo independiente de caídas, multiplica por 3 el riesgo de padecer una caída y esta suele ser más grave porque con mayor frecuencia se asocia a fractura. Se ha cuantificado que un incremento de 1g/dl en la concentración plasmática de Hb puede reducir hasta en un 45% el riesgo de fractura. Finalmente, la anemia al ingreso en el hospital en pacientes con fractura de fémur empeora el pronóstico a corto-medio plazo ya que aumenta la morbimortalidad y prolonga la estancia hospitalaria respecto a los sujetos no anémicos 4,5,7,8.
Anemia y alteraciones cognitivasAlgunos estudios han analizado la relación entre anemia y alteraciones cognitivas subclínicas como la función ejecutiva (planificación, monitorización y resolución de problemas) que es un marcador precoz de discapacidad en actividades instrumentales2–4. Un estudio transversal reciente10 evaluó la relación entre anemia leve (10–12g/dl) en una cohorte de 364 mujeres (70–80 años) con el Minimental Test de Folstein >24 y se observó que las pacientes anémicas tenían un riesgo 4 veces superior de obtener peores puntuaciones al realizar test cognitivos específicos. Mientras que otro estudio3 que incluyó 1.744 sujetos mayores de 71 años reveló que aquellos que estaban anémicos al inicio tenían un deterioro neurológico mayor a los 4 años de seguimiento evaluado por la escala de Pfeiffer. Sin embargo, los datos que se disponen respecto a la asociación entre anemia y demencia no son concluyentes ya que algunos estudios la confirman y otros la descartan7.
Por otro lado, también se ha constatado que la anemia es un factor de riesgo predisponente para el desarrollo de delirium entre los pacientes ingresados y que su corrección contribuye a la normalización de las alteraciones cognitivas4. Finalmente, en los pacientes con insuficiencia renal crónica terminal en fase de hemodiálisis en los que la anemia es muy frecuente y puede afectar al 80% de casos se ha observado una mayor prevalencia de alteraciones cognitivas (confusión, pérdida de memoria, pérdida de atención) entre aquellos que no tienen corregida la anemia2,8.
Anemia y calidad de vidaParece lógico suponer que si la anemia se asocia a malos resultados funcionales en los ancianos también debería inducir una peor percepción de calidad de vida2,4,8. Recientemente, se evaluaron 328 ancianos de la comunidad y se observó que los que tenían anemia (criterios OMS) tenían una peor percepción de calidad de vida medido mediante escalas validadas (SF-36 y FACIT-An). Además, existía un descenso progresivo en estas puntuaciones cuando la Hb caía por debajo de 15g/dl. Junto a peor calidad de vida percibida, los ancianos anémicos presentaban peor estado funcional y resistencia física11.
Anemia y enfermedad cardiovascularLa existencia de anemia se asocia a reducción del transporte de oxígeno a los tejidos periféricos, para corregir esta situación se activan mecanismos compensatorios no hemodinámicos (incremento en la producción de eritropoyetina y de la extracción de oxígeno en esos tejidos) y a medio plazo también mecanismos hemodinámicos (aumento de la precarga, reducción de la postcarga e incremento de la función del ventrículo izquierdo) con la finalidad de incrementar el gasto cardiaco. Los mecanismos no hemodinámicos tienen una capacidad compensatoria limitada por lo que de no corregirse la causa de la anemia y por lo tanto mantenerse activos los mecanismos hemodinámicas, puede desarrollarse hipertrofia del ventrículo izquierdo que favorecería la aparición de disfunción cardiaca y sería por ello un predictor de eventos vasculares futuros. De hecho, es conocido la asociación entre descenso del hematocrito y masa ventricular izquierda. Así, un descenso de 3 puntos del hematocrito incrementa la masa de ventrículo izquierdo entre 1,8g/m2 (mujeres) y 2,6g/m2 (hombres). Por lo tanto tratar la anemia en pacientes con cardiopatía de base es una diana terapéutica importante para mantener estable el sistema cardiovascular. En efecto, se ha comprobado que la corrección de la anemia en estos pacientes reduce las necesidades de diuréticos y los ingresos hospitalarios, mejora la función cardiaca global y la capacidad de esfuerzo y reduce la mortalidad en pacientes con insuficiencia cardiaca estable o con infarto agudo de miocardio en fase aguda4,2,8.
Anemia y mortalidadDiferentes estudios han constatado que la anemia es un factor predictivo de mortalidad a medio y largo plazo en pacientes ancianos2–5,7,8. Un estudio realizado con 5.888 pacientes mayores de 65 años de la comunidad seguidos durante 11 años observó que la mortalidad total o de origen cardiovascular era significativamente más elevada entre aquellos en los que se había diagnosticado anemia (criterios OMS) al inicio del estudio, respecto a los no anémicos (57 frente a 39%; p<0,001)6. En este mismo trabajo, cuando se evaluó la relación entre mortalidad y los quintiles de Hb se observó una relación en J invertida. Así, la mortalidad fue más elevada en el primer (49%) y quinto (41%) quintil en comparación con segundo, tercer o cuarto quintil6. Por otro lado, en sujetos de edades más extremas (>85 años) se han observado resultados similares en los que la presencia de anemia en estos pacientes se asocia a un incremento significativo de la mortalidad (RR: 1,60 y 2,3 en mujeres y hombres respectivamente) respecto a sujetos no anémicos en un seguimiento a 5 años (p<0,001)4. Datos similares se han obtenido cuando se evalúan ancianos frágiles de la comunidad o residentes en centros de larga estancia5,7.
Etiología de la anemiaEl estudio de la anemia es algo diferente del de la población más joven por los distintos condicionamientos físicos, funcionales y de comorbilidad. No obstante, cuando nos enfrentamos a un anciano con anemia nuestro propósito debería ser el de poder llegar a conocer su etiología, teniendo siempre en cuenta que dicha anomalía no es explicable simplemente por el envejecimiento.
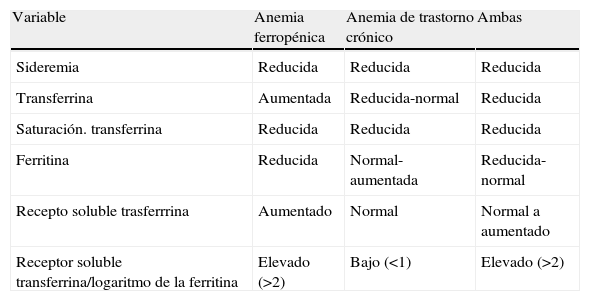
Las grandes revisiones reúnen las causas de la anemia en 3 grandes grupos: las deficitarias o carenciales, las asociadas a trastornos crónicos y las inexplicadas. Cada uno de estos grupos supone un tercio aproximadamente de los casos, por lo que resulta práctico recordar la regla de los tercios: aproximadamente un tercio para cada grupo de causas12. Entre las anemias deficitarias se engloban las ferropénicas, que suponen casi el 18% de los casos, las debidas a deficiencia de cobalamina, ácido fólico o ambas vitaminas conjuntamente y la anemia por déficit del hierro y ambas vitaminas con un 6% aproximadamente para cada uno de estos subgrupos, con lo que podemos establecer otra regla de fácil recordatorio, la del 6%. Un 6% para los déficits vitamínicos y el triple de 6, siempre con las debidas reservas, es decir un 18% para las anemias ferropénicas12. Aún cuando la causa más frecuente de la ferropenia es, con mucho, las pérdidas digestivas, potenciadas en muchos enfermos por el uso de anticoagulantes y/o antiagregantes, el estudio endoscópico completo —gastroscopia y colonoscopia—, no siempre garantiza el diagnóstico. En diversas series entre un 20 y un 40% de los pacientes quedan sin llegar a diagnosticar el origen de las pérdidas13–15 a pesar de agotar todas las maniobras diagnósticas como arteriografía o cápsula endoscópica. Por otra parte entre un 15 y un 20% de ancianos con ferropenia tienen una lesión sangrante en tracto gastrointestinal alto y bajo simultáneamente. Ello no es óbice para que siempre que la situación funcional del anciano no sea realmente mala, intentemos llevar a cabo el estudio, ya que hay numerosos trabajos que han comprobado que la tolerancia y la eficiencia tanto de la gastroscopia como de la colonoscopia en el anciano no difieren mucho de la de los pacientes adultos de edad media16–18. Además, se están llevando a cabo estudios con otras formas de acceso al aparato digestivo, como la colonoscopia virtual19 o la colonografía mediante resonancia magnética20 que pueden ayudar a ampliar el número que pueden ser sometidos a exploraciones diagnósticas. Otra mejora en la exploración diagnóstica es la endoscopia transnasal con endoscopios de menor calibre, que permiten disminuir las complicaciones y ampliar el número de pacientes a los que se les puede estudiar con más tranquilidad21. No hemos de pasar por alto que en algunas ocasiones la pérdida oculta podría tener otras localizaciones, como la vía urinaria, no siendo frecuente, aunque tampoco extraordinario, que bajo una anemia ferropénica se encuentre una neoplasia vesical. También hemos de considerar que la ferropenia puede tener su origen en una absorción deficitaria, ya sea por la existencia de una gastritis atrófica, una gastrectomía o celiaquía del adulto22. En cuanto al déficit de cobalamina, la mitad de las causas son por malabsorción intestinal de la vitamina B12, un tercio por anemia perniciosa y el resto por otras causas (déficit nutricional, malabsorción posquirúrgicas o indeterminadas)15. La deficiencia de ácido fólico se desarrolla habitualmente como resultado de una ingesta inadecuada en legumbres y vegetales de hojas verdes como lechuga o espinacas, por dietas lácteas, el uso de algunos fármacos (metrotexato, cotrimoxazol o algunos anticomiciales), además del abuso de alcohol22. Otro tercio de las anemias está causado o asociado a los procesos inflamatorios propios de diversas enfermedades crónicas, por lo que recibe el nombre de anemia por trastorno crónico o anemia de la inflamación, y corresponde por lo general, a una anemia normocítica y normocrómica (recordar que hasta un 30% de casos coexiste ferropenia y anemia de trastorno crónico). El estudio ferrocinético, con ferritina elevada y transferrina reducida o normal puede ayudar a identificar este tipo de anemia. Además, en la actualidad disponemos del receptor soluble de transferrina (Rs transferrina), que puede ayudarnos a orientar el tipo de anemia. En la anemia por trastorno crónico el Rs transferrina está normal, mientras que la ratio Rs transferrina/logaritmo de la ferritina suele ser menor de 1 (tabla 3). Entre los trastornos crónicos asociados a la anemia inflamatoria destaca por su frecuencia la insuficiencia renal, que supone más de la mitad de los casos. El trastorno fisiopatológico de esta asociación descansa en el déficit de eritropoyetina. Menos de un tercio de los casos de la anemia por trastorno crónico son debidos a enfermedades como el hipotiroidismo, las neoplasias, en caso de pacientes geriátricos sobre todo las sólidas como colon, pulmón, mama, próstata o páncreas y la enfermedades inflamatorias cono la arteritis de la temporal o la artritis reumatoide del anciano23 y el resto de los casos se deben a asociaciones de enfermedades crónicas e insuficiencia renal.
Parámetros ferrocinéticos característicos de los diferentes tipos de anemia
| Variable | Anemia ferropénica | Anemia de trastorno crónico | Ambas |
| Sideremia | Reducida | Reducida | Reducida |
| Transferrina | Aumentada | Reducida-normal | Reducida |
| Saturación. transferrina | Reducida | Reducida | Reducida |
| Ferritina | Reducida | Normal-aumentada | Reducida-normal |
| Recepto soluble trasferrrina | Aumentado | Normal | Normal a aumentado |
| Receptor soluble transferrina/logaritmo de la ferritina | Elevado (>2) | Bajo (<1) | Elevado (>2) |
Desafortunadamente, entre los pacientes geriátricos no es infrecuente que la anemia quede sin explicación, hasta casi una tercera parte, grupo denominado precisamente por muchos autores como anemia inexplicada, y su fisiopatología se explica no por una respuesta inflamatoria, ya que en este grupo los marcadores inflamatorios no están elevados, sino por una respuesta renal disminuida al descenso de la Hb con una menor fabricación de eritropoyetina24.
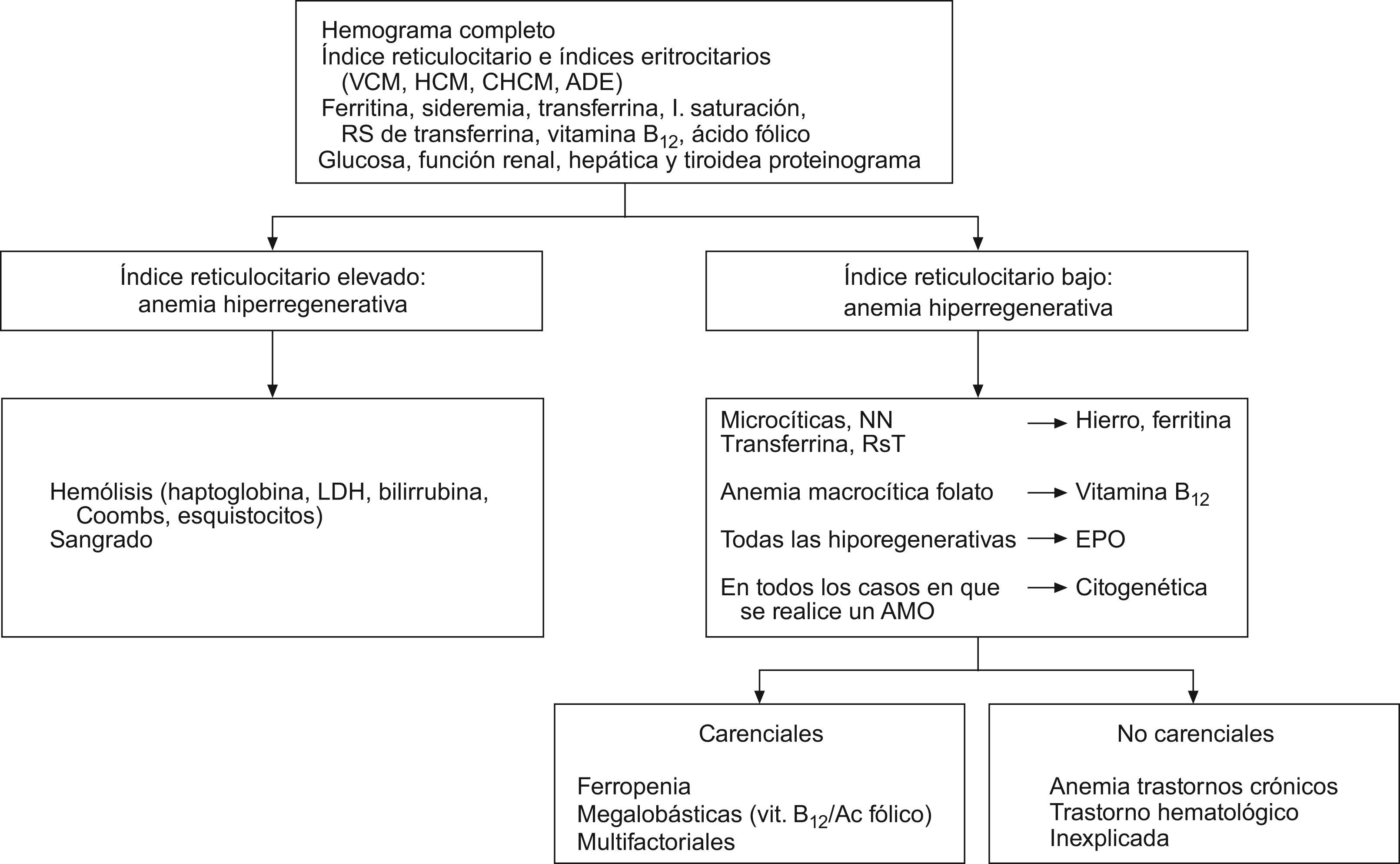
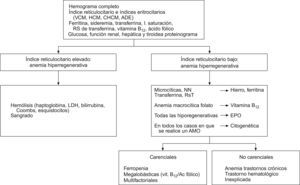
Evaluación diagnóstica de la anemia en el ancianoEn la tabla 4 se exponen las pruebas que consideramos indispensables en todo anciano con anemia. Con una sola extracción se pueden obtener todos estos parámetros y será su interpretación, junto con otras pruebas complementarias, la que nos llevará al diagnóstico. En la figura 2 se muestra un algoritmo diagnóstico de la anemia del anciano. Una vez obtenidos los parámetros comentados, si el índice reticulocitario es alto (mayor del 2%) pensaremos que estamos ante una anemia hiperregenetiva, caso de las anemias hemolíticas o de la respuesta a una hemorragia. La clínica y las exploraciones nos ayudarán a descartar la presencia de una hemorragia y, si no es el caso, solicitaremos pruebas de hemólisis que nos confirmarán la presencia de una anemia hemolítica y nos orientarán sobre la existencia de su posible origen autoinmune o vascular. Las anemias hemolíticas no suelen ser trastornos frecuentes en el anciano, pero siempre es importante tenerlas en mente. Si el índice reticulocitario es bajo, estamos ante una anemia hiporregenerativa, que es la situación más frecuente, con mucho, en el anciano. Analizaremos entonces los índices eritrocitarios (volumen corpuscular medio, concentración corpuscular media de Hb, amplitud de distribución de los hematíes) y podremos así clasificar la anemia como macrocítica e hipocroma, normocítica normocrómica o macrocítica. En este punto podremos ayudarnos de la ferrocinética (tabla 3).
Pruebas de laboratorio que se deberían determinar en todo paciente anciano
| Hemograma completo |
| Índice reticulocitario |
| Índices eritrocitarios (VCM, HCM, CHCM, ADE) |
| Ferritina, sideremia, índice de saturación transferrina, receptor soluble de transferrina |
| Vitamina B12, ácido fólico |
| Glucosa, función renal, hepática y tiroidea, proteinograma |
| Alicuota reservada para determinación de eritropoyetina, si se considera indicado |
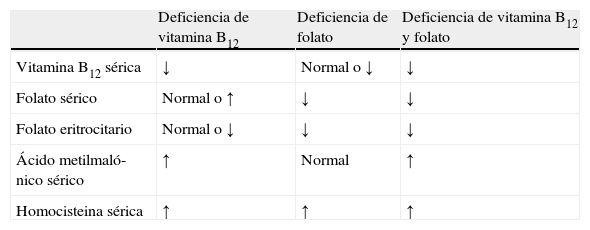
Si hemos establecido que se trata de una ferropenia nos quedará indagar, si lo creemos oportuno, su etiología teniendo en cuenta que aunque las pérdidas digestivas son, con mucho, las causas más frecuentes de la ferropenia, no son las únicas. De todas formas el estudio endoscópico no garantiza la visualización de la lesión potencialmente anemizante, ya que alrededor de un tercio de los pacientes, según diversas series, quedan sin diagnóstico después de un estudio endoscópico alto y bajo13,15. El déficit de vitamina B12 y ácido fólico, cuya determinación puede ser algo errática, puede confirmarse mediante la determinación sérica del ácido metilmalónico y de la homocisteína (tabla 5).
Comportamiento de los niveles séricos de las vitaminas y los metabolitos en las deficiencias de folato y vitamina B12
| Deficiencia de vitamina B12 | Deficiencia de folato | Deficiencia de vitamina B12 y folato | |
| Vitamina B12 sérica | ↓ | Normal o ↓ | ↓ |
| Folato sérico | Normal o ↑ | ↓ | ↓ |
| Folato eritrocitario | Normal o ↓ | ↓ | ↓ |
| Ácido metilmaló-nico sérico | ↑ | Normal | ↑ |
| Homocisteina sérica | ↑ | ↑ | ↑ |
Si estamos ante una anemia por trastorno crónico, podemos asegurar que la insuficiencia renal es responsable de la misma25 cuando el filtrado glomerular se encuentra por debajo de 30/ml/min/, aunque algunos autores validan esta asociación con aclaramientos entre 30 y 60ml/min. Descartada la insuficiencia renal como explicación de la anemia por trastorno crónico, una exploración física completa, con palpación de pulsos temporales y búsqueda de adenopatías, la determinación de reactantes de fase aguda (velocidad de sedimentación globular, proteína C reactiva y fibrinógeno), la determinación de algunos marcadores tumorales (CEA, PSA, CA-19.9), con la conocida limitación de que su utilidad fundamental no es diagnóstica y la realización de una tomografía computarizada toracoabdominal, nos puede ayudar a descartar las enfermedades crónicas más importantes de los ancianos. Finalmente si tenemos dudas de la existencia de un proceso hematológico, no hemos de dudar en realizar un aspirado de médula ósea para citología y citogénica, en las personas con una aceptable situación funcional.
Con todo ello podemos esperar, incluso empleando una sistemática sencilla y fácilmente interpretable, diagnosticar entre el 65 y el 80% de los ancianos con anemia, sabiendo que una parte importante nos quedará sin explicación y que en otros casos no podremos llegar al diagnóstico porque la situación del enfermo no hace aconsejable profundizar en estudios diagnósticos.
Tratamiento de la anemiaEn el paciente anciano, como se ha comentado previamente, la anemia frecuentemente es multifactorial e infratratada.
Tratamiento de la anemia ferropénicaSerá oral en la inmensa mayoría de casos26. Son preferibles las sales ferrosas a las férricas por su mejor absorción aunque son las peor toleradas. Lo ideal es administrarlo en ayunas, aunque en los ancianos con polifarmacia muchas veces será difícil que sigan de forma correcta el tratamiento. Además en los ancianos institucionalizados o ingresados en hospitales de agudos muchas veces las pastillas se reparten antes del desayuno, pero el paciente no las toma hasta que no llega este. Lo ideal sería poder darlos junto a un zumo de naranja, ya que la vitamina C puede aumentar un 30% su absorción; por otro lado los alimentos y muchos fármacos interfieren en su absorción. De entre los fármacos de uso común con interferencia en la absorción oral del hierro hay que considerar los inhibidores de la bomba de protones, los alcalinos o las quinolonas.
La dosis a prescribir es de 100 a 300mg al día de sal ferrosa durante un tiempo suficiente para llenar los depósitos (se estima de entre 4 y 6 meses). Los principales inconvenientes de la administración del hierro oral son: mala tolerancia digestiva, estreñimiento, la coloración negruzca de las heces, que además de asustar a muchos pacientes y cuidadores, a veces podrá interferir la valoración de unas posibles melenas. Finalmente hay un tema muy importante pero escasamente evaluado en la práctica clínica como es la nula o escasa utilización del hierro administrado por vía oral en los estados inflamatorios propios de la enfermedad aguda, proceso en que juega un importante papel la hepcidina4.
Disponemos también, en caso de necesidad, de hierro parenteral para el tratamiento de la anemia ferropénica. Hasta hace poco solo se disponía de hierro dextrano que se administraba por vía endovenosa o intramuscular, presentaba importantes efectos secundarios, y ello limitaba su uso. La aparición de presentaciones como el hierro sacarosa o del hierro carboxymaltosa, mucho mejor toleradas y seguras, ha hecho que su uso se esté incrementando sobre todo en el medio hospitalario. A pesar de ser una alternativa teóricamente interesante en los pacientes ancianos, hay muchas incógnitas y falta de consenso sobre su uso. Sus indicaciones son la intolerancia al tratamiento oral, las pérdidas sanguíneas abundantes que superen la capacidad de reposición oral, en los casos demostrados de malabsorción de hierro (celíaquía, resección gástrica o intestinal, by pass intestinal poscirugía de la obesidad, en enfermedad inflamatoria intestinal), en casos de incumplimiento del tratamiento oral y administrada junto a la eritropoyetina (EPO) en los pacientes afectos de anemia e insuficiencia renal crónica27–30. Hay indicaciones emergentes; así como parte de los programas de ahorro de sangre para evitar transfusiones en cirugía ortopédica, como complemento en el tratamiento de la anemia de la insuficiencia cardiaca, y en estados inflamatorios con ferropenia de base y en los que asumamos que no se absorberá el hierro oral.
La ventaja fundamental del hierro parenteral es su rápida biodisponibilidad, ya que evita la acción de la hepcidina a nivel de los enterocitos. A los 5 minutos de su infusión endovenosa se detecta en las células del sistema mononuclear fagocítico hepático y de la medula ósea. Hay que desarrollar guías clínicas y protocolos para el uso del hierro parenteral ya que es posible que su empleo en ancianos frágiles con anemia que residan en la comunidad o que estén institucionalizados mejore la calidad de vida y evite transfusiones urgentes, descompensaciones de enfermedades crónicas, síndromes geriátricos y por último ingresos.
Tratamiento de la anemia megaloblásticaCuando el déficit sea de ácido fólico, el tratamiento será la reposición oral con 5 o 10mg al día durante 4 meses. Es un tratamiento seguro, cuya única precaución es no administrarlo de forma aislada si no tenemos asegurados los niveles de cobalamina, ya que podemos precipitar un déficit de esta. En los casos en los que el déficit sea atribuible a fármacos antifólicos (metotrexate, cotrimoxazol, etc.) el tratamiento será con ácido folínico por vía oral.
Cuando la causa sea el déficit de cobalamina, el tratamiento será por vía parenteral, siempre que se trate de anemia perniciosa. En los casos en los que sea otra la causa del déficit de B12, teóricamente se puede dar por vía oral31 o incluso por vía nasal, con un 90% de respuestas. El problema es que en las series donde se ha ensayado la vía oral, además de excluir la anemia perniciosa, los estudios están hechos con escaso número de pacientes y poco tiempo de seguimiento para saber qué pasa a largo plazo. No hay que olvidar que en los pacientes gastrectomizados o con resección ileal hay que administrar profilaxis con cobalamina por vía parenteral.
La reposición de cobalamina se puede hacer de varias formas. Cuando haya síntomas neurológicos se administrarán 1.000μgr por vía intramuscular hasta la mejoría de los síntomas.
En ausencia de síntomas la pauta más utilizada consiste en la administración de 1 vial cada día durante 7 días por vía i.m, seguido de 1 vial cada 7 días durante 1 mes, y después 1 vial i.m. cada mes15. Recordar que aunque la vía de administración de la cobalamina es la i.m. se puede administrar por vía subcutánea en pacientes sometidos a tratamiento anticoagulante. No es aconsejable la vía i.v. por el riesgo de reacciones de hipersensibilidad.
Tratamiento de la anemia de proceso crónicoDesde la introducción del primer agente estimulante de la eritropoyesis como era la epoetina α para el tratamiento de la anemia asociada a la enfermedad renal crónica terminal, se han ido ampliando sus indicaciones.
Un interesante metaanalisis32 demostró que el uso de EPO en pacientes con insuficiencia renal crónica mejoraba las cifras de Hb y de hematocrito, disminuía el número de transfusiones, mejoraba la calidad de vida y la tolerancia al ejercicio, aunque no modificaba la progresión de la enfermedad renal. Hasta la fecha la prescripción de EPO, ha sido casi patrimonio exclusivo de los nefrólogos, pero con el envejecimiento de la población y la elevada prevalencia de anemia e insuficiencia renal crónica en los pacientes ancianos, los geriatras debemos aprender su uso, conocer sus ventajas y también sus efectos secundarios.
La EPO es una glucoproteina de 34KD cuya función es el control de la producción de los hematíes, mediante la promoción de la supervivencia, proliferación y diferenciación de los progenitores eritroides en la medula ósea. La EPO se sintetiza predominantemente en las células intersticiales del córtex renal, aunque un 20% se produce en el hígado. Favorecen la secreción de EPO, la hipoxia de los tejidos, la anemia y el hipertiroidismo. La EPO tiene otras propiedades como efecto antiapoptosis y función citoprotectora mediante la promoción de la angiogenesis33.
En los últimos años se han producido algunas advertencias sobre los peligros de incrementar en exceso de forma rápida las cifras de Hb. El estudio CREATE34 «Cardiovascular Risk Reduction by Early Anemia Tretament» comparó un grupo de pacientes en los que se corrigió la anemia con Epo β, alcanzando cifras de Hb de 13 a 15g/dl. Frente al grupo de pacientes con corrección incompleta (hemoglobinas de 10,5 a 11,5g/dl). En el grupo con corrección completa no se disminuyó el riesgo de eventos cardiovasculares, regresión de la hipertrofia ventricular izquierda, mejoría de la calidad de vida ni se frenó la progresión de la enfermedad renal. El estudio CHOIR35 «Correction of Hemoglobin and Outcomes in Renal Insufficiency» mostró en un grupo aleatorizado de pacientes con insuficiencia renal, que el grupo en el que el objetivo de Hb era de 13,5g/dl comparado con el grupo que alcanzó 11,3g/dl había un mayor riesgo de muerte, infarto de miocardio, hospitalización por insuficiencia cardiaca e ictus sin mejorar la calidad de vida.
Por lo tanto los peligros de la EPO de mayor morbimortalidad de causa cardiovascular van ligados claramente a cifras de Hb por encima de 12,5g/dl. Recientemente se ha publicado el estudio TREAT36 «Trial to Reduce Cardiovascular Events with Aranesp –darbepoteina alfa- Therapy» que incluía 4.038 pacientes diabéticos con insuficiencia renal que no estaban en diálisis, aleatorizados a tratamiento con darbepoteina alfa o placebo, con el objetivo de demostrar una menor morbimortalidad cardiovascular alcanzando cifras de Hb de 13g/dl. Los resultados mostraron una mayor mortalidad en los pacientes con cáncer que recibieron darbepoetina, así como una incidencia significativamente mayor de ictus en dicho grupo. Hay un aviso reciente de la FDA37, en el que advierte del riesgo de menor supervivencia de los pacientes con cáncer y tratamiento con EPO, así como del riesgo de progresión o recidivas de algunos tumores.
La recomendación actual para administrar EPO en pacientes con insuficiencia renal crónica y anemia, incluye la Hb menor de 10g/dl. El objetivo del tratamiento es aumentar o mantener los niveles de Hb para evitar transfusiones. Las cifras de Hb aconsejables para la FDA en el 2008 para el manejo de los agentes estimulantes de la eritropoyesis son entre 10 y 12g/dl. Si se siguen las recomendaciones de las guías y no se sobrepasa la cifra de Hb de 12g/dl, la EPO puede ser una buena arma terapéutica para nuestros pacientes con insuficiencia renal crónica a partir de estadio 3 (filtrado glomerular menor de 60).
Así, las recomendaciones prácticas para uso de EPO incluirían, en primer lugar, obtener un diagnóstico correcto, corregir el déficit de hierro y el de otros cofactores, además de garantizar un correcto y estrecho seguimiento de los pacientes. Cuando los pacientes están en predialisis la indicación es la presencia de una anemia sintomática con hemoglobinas inferiores a 10g/dl. En los pacientes diabéticos las cifras de Hb pueden ser más bajas que en los no diabéticos con filtrados glomerulares similares. Los efectos secundarios más frecuentes de todas las EPO son el empeoramiento o la aparición de novo de una hipertensión arterial, la aparición de trombosis tanto arterial como venosa, mialgias, cefalea, náuseas y fiebre. Un efecto secundario poco frecuente, pero que hay que conocer es la aplasia pura de células rojas, provocada por el desarrollo de autoanticuerpos frente a la fracción proteica de la EPO.
ConclusionesLa anemia es un diagnóstico frecuente en las personas mayores y en muchas ocasiones se asocia con una importante morbimortalidad. Es fundamental una buena aproximación diagnóstica teniendo en cuenta que frecuentemente su etiología puede ser multifactorial. Además del tratamiento habitual debemos familiarizarnos con nuevas posibilidades de tratamiento como lo son el hierro parenteral y los agentes estimulantes de la eritropoyesis.
Conflicto de interesesEl contenido de esta revisión aborda algunos de los aspectos más interesantes de la mesa redonda «anemia en el paciente anciano» realizada en Barcelona, el 3 de marzo del 2010, organizada por la Sociedad Catalana de Geriatría y Gerontología, con el patrocinio de Laboratorios Roche España.