Evaluar los resultados de la resección en bloque y la reconstrucción vascular de leiomiosarcomas con afectación de vasos principales en las extremidades inferiores.
Material y métodosDesde enero de 1983 a diciembre 2016 se diagnosticaron 42 pacientes con leiomiosarcomas, de los que 6 afectaban a vasos principales de las extremidades inferiores (denominados vasculares). Se registraron retrospectivamente datos epidemiológicos, estudios de imagen, cirugía realizada, tratamientos adyuvantes, complicaciones, así como las recidivas y mortalidad.
ResultadosTodos los pacientes fueron afectos de leiomiosarcomas de alto grado(ii-iii FNCLCC), con un diámetro mayor tumoral de 9,1cm de media (6-15) y un seguimiento medio de 23 meses (7-36). La edad media fue de 64 años (29-84). El primer síntoma fue una tumoración palpable en 4 de ellos. Los otros 2 casos comenzaron con fenómenos tromboembólicos. En 5 casos el origen fueron los vasos femorales, mientras que un caso fue a nivel poplíteo. A pesar de que todos los casos preservaban la extremidad, 3 (50%) presentaron diseminación pulmonar, 2 (33%) hepática y un caso presentó recidiva local. Dos casos fueron exitus al finalizar el estudio y hubo un caso de pérdida de seguimiento.
Discusión y conclusionesLos leiomiosarcomas vasculares son tumores altamente agresivos con baja tasa de supervivencia a los 5 años. En nuestro estudio, el 50% de los pacientes se mantienen en remisión completa con un seguimiento medio de 23 meses. Es frecuente que su inicio asocie la presencia de una masa tumoral con fenómenos trombóticos (33% de nuestros casos). La cirugía de resección tumoral habitualmente compromete las estructuras vasculares principales, hecho que implica una resección y técnicas reconstructivas vasculares para el salvamento de la extremidad.
To evaluate the results of bloc resection and vascular reconstruction of leiomyosarcomas with involvement of main vessels in the lower extremities.
Material and methodsFrom January 1983 to December 2016, 42 patients with leiomyosarcomas were diagnosed. Six of these leiomyosarcomas affected main vessels of the lower extremities (called vascular). Epidemiological data, imaging studies, surgery performed, adjuvant treatments, complications, as well as recurrences and mortality were retrospectively recorded.
ResultsAll the patients were affected by high-grade leiomyosarcomas (ii-iii FNCLCC classification), with a larger tumour average diameter of 9.1cm(6-15) and a mean follow-up of 23 months (7-36). The average age was 64 years (29-84). The first symptom was a palpable tumour in 4 of them. The other 2 cases debuted with thromboembolic phenomena. In 5 cases the origin was the femoral vessels, while one case was at the popliteal level. Although all cases preserved the limb, in 3 cases (50%) they presented pulmonary dissemination,2 cases (33%) hepatic dissemination and one case had local recurrence. Two cases died at the end of the study and there was one case of loss to follow-up.
Discussion and conclusionsVascular leiomyosarcomas are highly aggressive tumours with a low survival rate at 5 years. In our study, 50% of the patients remain in complete remission with a mean follow-up of 23 months. Their onset frequently associates the presence of tumour mass with thrombotic phenomena (33% of our cases). Tumour resection surgery usually compromises the main vascular structures, which implies resection and vascular reconstructive techniques to salvage the limb.
Los leiomiosarcomas (LMS) son tumores mesenquimales formados por células fusiformes, que presentan diferenciación a músculo liso y corresponden al 5-10% de todos los sarcomas de partes blandas1.
Sea cual fuere su localización, histológicamente son similares, pero el pronóstico y el tratamiento difieren ostensiblemente. Por dicho motivo, los LMS se han clasificado según su origen en 4 grandes grupos:
Los denominados LMS de origen vascular (en algunos artículos, intravasculares) son muy infrecuentes, corresponden al 6% de los LMS y aproximadamente al 0,7% del total de sarcomas de partes blandas6. Tienden a originarse en los sistemas vasculares de baja presión, mayoritariamente en la capa media (muscular) de las paredes de los principales vasos venosos, aunque existen casos derivados de estructuras arteriales7.
La mayoría de las publicaciones sobre los LMS vasculares se refieren a series de casos aislados o de pocos pacientes, motivo por el cual su tratamiento no está homogéneamente consensuado.
El motivo del presente trabajo es el de dar a conocer los resultados histológicos, clínicos y pronósticos obtenidos en una serie de 6 LMS de origen vascular en las extremidades inferiores, que fueron tratados mediante resección en bloque y reconstrucción vascular.
Material y métodoDesde enero de 1983 a diciembre de 2016 se diagnosticaron un total de 42 pacientes con LMS de tejidos blandos en las extremidades (excluimos los óseos), de los que 6 eran de origen vascular, afectando los vasos principales de las extremidades, todos ellos inferiores. Fueron registrados datos epidemiológicos, como la edad y el género, así como diversos parámetros clínicos, tales como el inicio de los síntomas, la localización y las dimensiones de la masa tumoral, estudios de imagen, el grado histológico, la cirugía realizada, los tratamientos adyuvantes y la evolución seguida para cada uno de ellos. Finalmente, se valoraron las complicaciones tanto precoces como tardías, las reintervenciones, así como las recidivas y la mortalidad.
El seguimiento postoperatorio por parte de la Unidad de Cirugía Ortopédica Oncológica se realizó al mes de la cirugía y cada 3 meses durante los 2 primeros años. Si el paciente se mantiene en remisión de la enfermedad, el seguimiento se realiza cada 6 meses hasta los 10 años postoperatorios. Si existe recidiva local, se adapta el seguimiento a la decisión terapéutica por parte del Comité de Sarcomas, dependiendo de si precisa nueva cirugía y/o terapias adyuvantes.
A todos los pacientes se les practicaron exploraciones complementarias como radiografías simples y RMN de la extremidad afecta (tanto pre como postadyuvancia en los casos que recibieron quimioterapia y/o radioterapia preoperatorias), TAC toracoabdominal como estudio de extensión y estudios angiográficos (ya fuera por angiografía o angio-TAC) para determinar el grado de afectación vascular.
Para el diagnóstico patológico preoperatorio, en todos los casos se realizó una biopsia percutánea con aguja gruesa. El grado histológico en todos los casos se revisó de acuerdo con la clasificación francesa de la Fédération Nationale des Centres de Lutte Contre le Cancer (FNCLCC)8, tanto las biopsias como la pieza definitiva de resección tumoral de la que obtuvimos el grado histológico definitivo. La clasificación de la FNCLCC evalúa 3 parámetros: 1) diferenciación tumoral; 2) número de mitosis, y 3) necrosis tumoral. A cada ítem se le asigna una puntuación y, de su suma, se obtienen 3 grados. El grado i tiene una puntuación total de 2 a 3, el grado ii, de 4 a 5, y el grado iii, entre 6 y 8. Histológicamente los casos más antiguos se revisaron de nuevo de acuerdo con la clasificación FNCLCC para homogeneizar el estudio.
Por lo que se refiere al tratamiento, todos los pacientes fueron valorados por el Comité Multidisciplinar de Sarcomas del hospital, con el fin de adecuar el mejor tratamiento médico-quirúrgico para cada caso en particular.
ResultadosSe trata de un estudio retrospectivo sobre 6 pacientes afectos de LMS de origen vascular en las extremidades inferiores, con un seguimiento medio de 23 meses (7-36). Al finalizar la revisión, 2 pacientes habían fallecido, hubo una pérdida de seguimiento y 3 se mantienen vivos en remisión clínica. La edad media al diagnóstico fue de 64 años (29-84), con igual número de casos para hombres que para mujeres. En cuanto al primer síntoma, 4 casos refirieron la aparición de una tumoración clínicamente palpable (dolorosa en 2 de dichos pacientes). Los otros 2 casos comenzaron con fenómenos tromboembólicos, uno de ellos con un tromboembolismo pulmonar y otro con una trombosis profunda de extremidad inferior.
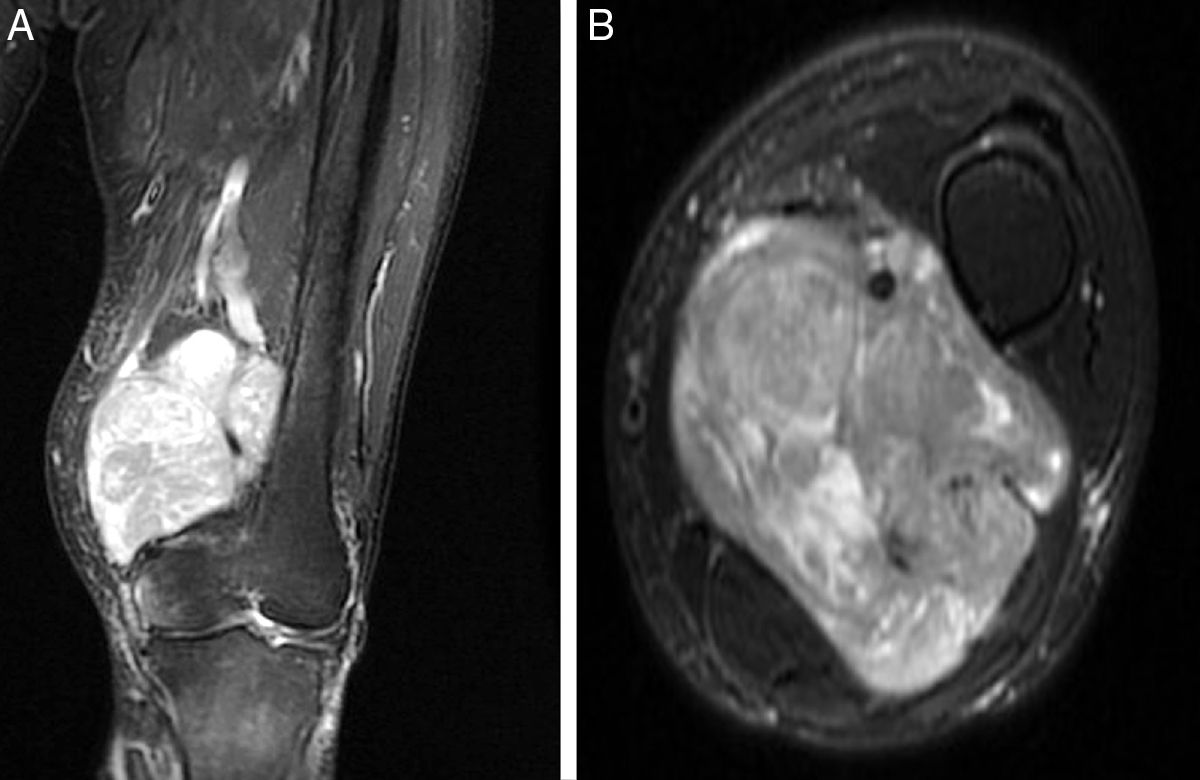
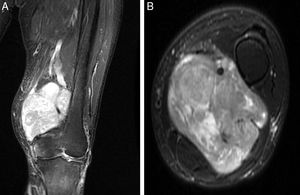
El origen fue la vena femoral en 5 casos, en la raíz de la extremidad, mientras que en el caso restante fue a nivel del hueco poplíteo, con afectación de la vena poplítea. La RMN objetivó la morfología de la lesión y el grado de compromiso del paquete vascular adyacente (fig. 1). En cuanto al diámetro mayor tumoral, la media fue de 9,1cm (6-15). El estudio histopatológico de las biopsias preoperatorias mostró que en el 100% de los casos se trataba de LMS de alto grado (ii-iii de la clasificación FNCLCC). El estudio de extensión en el momento del diagnóstico reveló la presencia de diseminación pulmonar en 2 de los casos (33%).
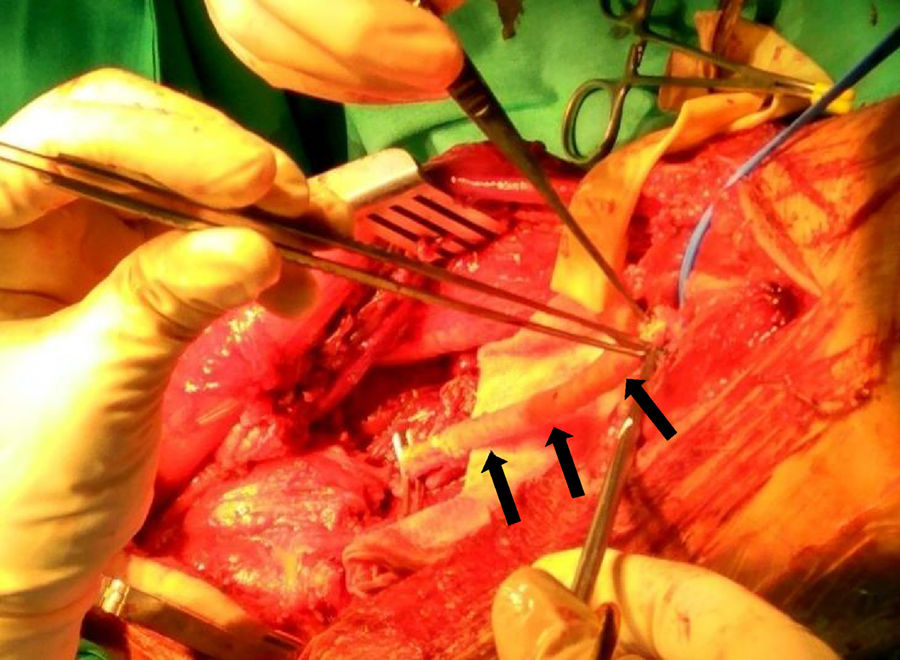
Todos los pacientes fueron intervenidos quirúrgicamente de la resección del tumor en nuestro centro. Para conseguir márgenes oncológicamente adecuados en un sarcoma de partes blandas debemos tener en cuenta la afectación tumoral tanto de tejidos adyacentes como de arterias y músculos, así como el tejido origen del tumor (en nuestros casos, la vena femoral superficial y vena poplítea).
En la planificación prequirúrgica con intención curativa, si más del 50% del perímetro de la arteria adyacente al LMS se encuentra englobado por la masa tumoral, esta es tributaria de resección y reconstrucción9.
Así pues, todos nuestros pacientes presentaban una extensión extraluminal del tumor que englobaba más del 50% de la arteria principal (detectada en los estudios por imagen preoperatorios), hecho que obligó a practicar una resección arterial en bloque con la masa tumoral10. Los márgenes obtenidos en 3 casos fueron R0, y en otros 3, R1. En cuanto a la reconstrucción arterial, preferiblemente se intenta utilizar injerto autógeno, como la vena safena contralateral, debido al menor riesgo de infección y resistencia en caso de precisar radioterapia en el lecho quirúrgico. En aquellos casos donde no se disponía de injerto autógeno competente, se opta por el uso de injerto vascular artificial. Así pues, para la reconstrucción arterial se utilizó la vena safena interna contralateral en 3 casos, e injerto vascular artificial en los otros 3 (GORE® PROPATEN®, Omniflow® y politetrafluoroetileno, respectivamente) (fig. 2).
La pieza de resección definitiva informó en todos los casos que se trataba de un LMS de alto grado histológico (2-3 FNCLCC), coincidiendo todos ellos con el grado obtenido en la biopsia.
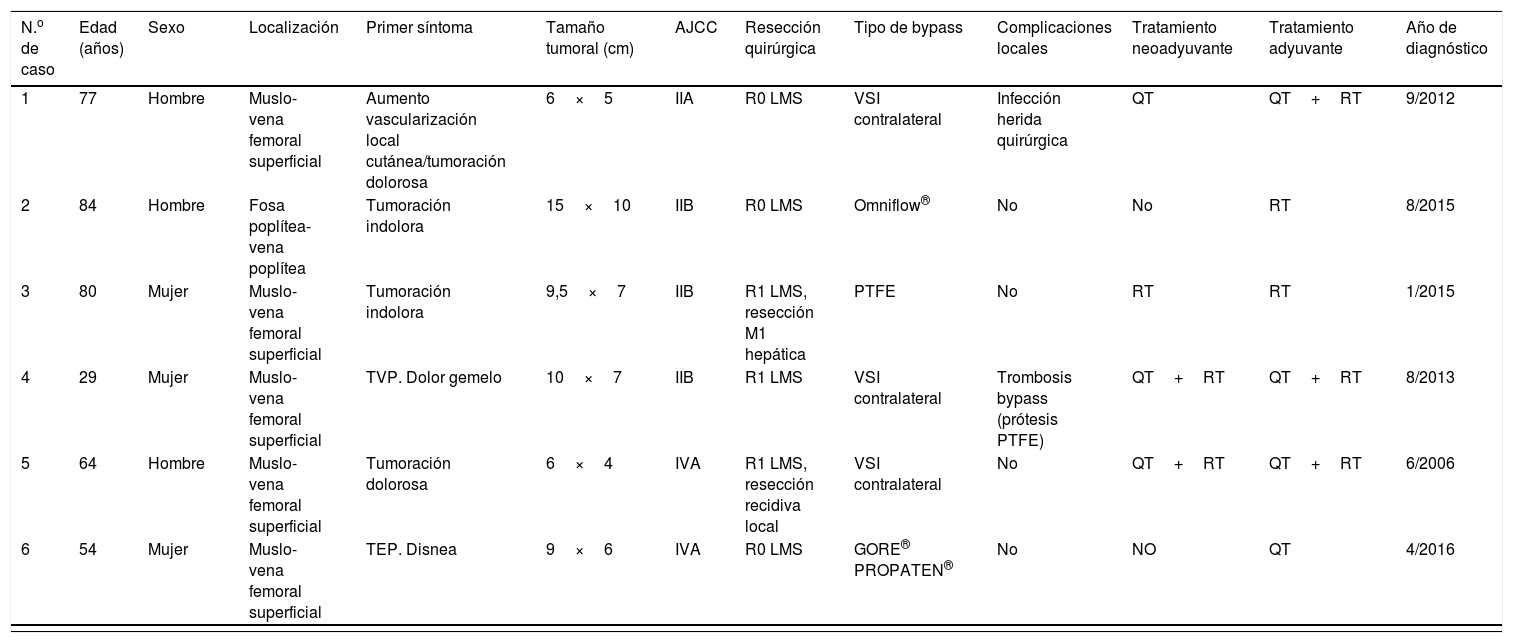
Por lo que se refiere a tratamientos oncológicos adyuvantes, preoperatoriamente un paciente recibió quimioterapia, otro paciente solo radioterapia y 2 pacientes terapia combinada con quimio y radioterapia. En cuanto a la adyuvancia postoperatoria, se administró quimioterapia a un paciente, radioterapia aislada en el lecho quirúrgico en 2 pacientes y quimio y radioterapia combinadas en los 3 pacientes restantes, siempre siguiendo las indicaciones del Comité de Sarcomas según el protocolo vigente en ese momento (tabla 1).
Datos epidemiológicos y clínicos de leiomiosarcoma en nuestro centro
| N.o de caso | Edad (años) | Sexo | Localización | Primer síntoma | Tamaño tumoral (cm) | AJCC | Resección quirúrgica | Tipo de bypass | Complicaciones locales | Tratamiento neoadyuvante | Tratamiento adyuvante | Año de diagnóstico |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 77 | Hombre | Muslo-vena femoral superficial | Aumento vascularización local cutánea/tumoración dolorosa | 6×5 | IIA | R0 LMS | VSI contralateral | Infección herida quirúrgica | QT | QT+RT | 9/2012 |
| 2 | 84 | Hombre | Fosa poplítea-vena poplítea | Tumoración indolora | 15×10 | IIB | R0 LMS | Omniflow® | No | No | RT | 8/2015 |
| 3 | 80 | Mujer | Muslo-vena femoral superficial | Tumoración indolora | 9,5×7 | IIB | R1 LMS, resección M1 hepática | PTFE | No | RT | RT | 1/2015 |
| 4 | 29 | Mujer | Muslo-vena femoral superficial | TVP. Dolor gemelo | 10×7 | IIB | R1 LMS | VSI contralateral | Trombosis bypass (prótesis PTFE) | QT+RT | QT+RT | 8/2013 |
| 5 | 64 | Hombre | Muslo-vena femoral superficial | Tumoración dolorosa | 6×4 | IVA | R1 LMS, resección recidiva local | VSI contralateral | No | QT+RT | QT+RT | 6/2006 |
| 6 | 54 | Mujer | Muslo-vena femoral superficial | TEP. Disnea | 9×6 | IVA | R0 LMS | GORE® PROPATEN® | No | NO | QT | 4/2016 |
| Tiempo de seguimiento (meses) | Supervivencia | Metástasis al diagnóstico | Diseminación periodo evolutivo | Exitus |
|---|---|---|---|---|
| 24 | Exitus a los 24m | No | Diseminación pulmonar, hepática y mesentérica | Sí |
| 20 | En remisión clínica | No | No | No |
| 24 | En remisión clínica | No | Diseminación hepática | No |
| 36 | Pérdida de seguimiento | No | No | No |
| 26 | Exitus a los 26m | Metástasis pulmonar | No | Sí |
| 7 | En remisión clínica | Metástasis pulmonar | No | No |
Como complicaciones precoces, tuvimos un caso de infección superficial de la herida quirúrgica que se solucionó con antibioticoterapia, y otro caso que desarrolló una isquemia aguda de la extremidad por taponamiento agudo del bypass y que obligó a un nuevo bypass, esta vez sin complicaciones.
Desde el punto de vista oncológico, a pesar de que todos los casos preservaban una extremidad funcional al final del estudio, 3 casos (50%) presentaron diseminación pulmonar (2 de ellos al diagnóstico del tumor primario y uno en el seguimiento evolutivo) y 2 pacientes (33%) desarrollaron metástasis hepáticas durante la evolución (uno de ellos afecto también de metástasis pulmonar). En cuanto a la evolución, se mantienen en remisión clínica el paciente con metástasis pulmonares de inicio (caso 6 de la tabla 1), tras recibir quimioterapia coadyuvante, y el paciente con metástasis hepática resecada (caso 3 de la tabla 1). Los otros 2 pacientes con diseminación sistémica han sido exitus.
En cuanto al control local de la enfermedad, un paciente presentó recidiva local, por lo que se realizó resección quirúrgica de la recidiva.
Por lo que refiere a la mortalidad, 2 pacientes fueron exitus al finalizar el estudio, con una media de 2 años desde el diagnóstico (24-26 meses). Tres pacientes se mantienen en remisión completa de la enfermedad con una media de 17 meses desde el diagnóstico (7-24). No disponemos de datos de seguimiento del caso 4 de la tabla 1 más allá de los 36 meses posdiagnóstico.
DiscusiónLos LMS de origen vascular son muy poco frecuentes, motivo por el cual existen pocos casos publicados y, en consecuencia, escasa experiencia en cuanto a su presentación clínica y el tratamiento a seguir.
En el presente estudio presentamos limitaciones importantes como son el pequeño tamaño muestral, así como el largo periodo de selección, que consideramos relevante dada la rareza de los casos analizados.
El origen de los LMS es a partir de las células musculares lisas de las paredes vasculares, fundamentalmente venosas. Si bien la vena cava es la fuente principal en la producción de estos tumores12, también se han descrito en las grandes venas de las extremidades inferiores13, menos comúnmente en las extremidades superiores14 y, excepcionalmente, en estructuras vasculares arteriales15,16. En nuestro estudio, solo tenemos 6 casos correspondientes a LMS de grandes vasos, un 14% de todos los LMS de tejidos blandos en extremidades tratados en la Unidad de Sarcomas del hospital.
El diagnóstico de sospecha es difícil si se basa únicamente en la exploración física, ya que no hay ningún parámetro que distinga un LMS de origen vascular de otros sarcomas de partes blandas en extremidades inferiores. De todas maneras, el principal hallazgo de sospecha suele ser la presencia de una tumoración palpable, habitualmente indolora y de crecimiento lento en el trayecto de un vaso principal (generalmente en la zona inguinal o poplítea). En ocasiones, debemos sospechar el diagnóstico de LMS cuando existen antecedentes de fenómenos tromboembólicos asociados a masa inguinal. En nuestro estudio, 2 pacientes comenzaron con clínica tromboembólica (33% de los casos), sin presentar relación alguna con una mayor diseminación sistémica de la enfermedad durante su evolución.
La edad de presentación suele ser entre la quinta y la sexta década de la vida, con una incidencia entre géneros similar para todo tipo de LMS17. Sin embargo, si nos centramos en el LMS vascular, el género varía de una publicación a otra, pudiendo ser más frecuentes en hombres que en mujeres o viceversa4,17,18. Tanto la edad como el género en nuestra revisión coinciden con la literatura publicada.
Una vez hecho el diagnóstico de sospecha de sarcoma de partes blandas, deben iniciarse los estudios de imagen. Estos deben incluir radiografías simples del área afectada, así como la práctica de una RMN, pues constituye la opción idónea para valorar el verdadero alcance anatómico del tumor19. Es particularmente importante el estudio angiográfico ante el diagnóstico de LMS, para poder evaluar la afectación vascular secundaria. Al respecto, los LMS vasculares pueden ser tanto intraluminales, con expansión única por dentro del vaso, como extraluminales, englobando por entero el vaso afecto. Este hecho es fundamental a la hora de la cirugía, pues si el crecimiento tumoral es intravascular, probablemente podrá disecarse la vena afecta de la arteria adyacente, sin precisar sacrificio de la misma. Por el contrario, si el crecimiento es extravascular, habitualmente se necesita la resección arterial y posterior reconstrucción, situación que puede llegar al 33% de los casos17,20. En nuestra serie de LMS vasculares fue del 100%.
Una vez obtenido el diagnóstico de presunción de LMS de origen vascular, hay que proceder a su confirmación histológica mediante biopsia. Siempre preferimos que sea llevada a cabo de forma percutánea mediante aguja gruesa para vulnerar el menor tejido posible y evitar ulceraciones e infecciones del tumor. En nuestro centro, desde el año 2012 se realizan guiadas por TAC, pues es la manera de evitar lesionar estructuras neurovasculares sanas. En ningún caso hemos precisado realizar una biopsia incisional, que reservamos para casos donde la biopsia con aguja gruesa no es diagnóstica. El aspecto histológico de la muestra puede mostrar una gran variabilidad. Sin embargo, es común observar un campo altamente celular con citoplasma eosinófilo abundante. Las células están dispuestas en haces y, en tumores bien diferenciados, estos haces a menudo forman ángulos rectos, permitiendo la identificación tanto de áreas longitudinales como transversales dentro de un campo. Los núcleos suelen estar localizados en el centro y tienen forma de cigarro. Una de las características más importantes del tumor es la presencia de miofibrillas longitudinales que abarcan toda la longitud de la célula. Sin embargo, a medida que las células van dejando de ser diferenciables, se desorganizan y empiezan a perder sus características distintivas21, con lo que aumenta el grado de malignidad del tumor.
Por lo que respecta al tratamiento, este ha de incluir la resección completa del tumor y del segmento vascular afecto con márgenes negativos, junto con los tejidos sanos adyacentes que cubran el tumor, ya sean músculo, fascia, grasa o linfa (fig. 3)17,22. Se ha considerado infiltrado el eje vascular cuando existe una estenosis y/o una trombosis del mismo, o cuando la masa tumoral rodea en más del 50% el perímetro del vaso. Dado que los LMS vasculares emergen de vasos principales, la expansión extraluminal del tumor los convierte por definición en tumores extracompartimentales. En ausencia de colaterales arteriales suficientes, es necesaria la reconstrucción vascular con injertos de interposición, sean de safena del mismo paciente o mediante prótesis vasculares. En cuanto a la reconstrucción venosa, dependerá de la presencia de un sistema superficial incompetente y poder evitar así la hipertensión venosa distal y sus secuelas22. Sin embargo, no está exenta de complicaciones, como son las oclusiones y el edema crónico.
En cuanto a los tratamientos adyuvantes, la radioterapia constituye una herramienta vital, especialmente en pacientes con LMS de alto grado, mientras que la quimioterapia puede ser de gran ayuda en los casos de LMS de alto grado, recurrentes y/o con enfermedad diseminada.
Según la bibliografía consultada, la recidiva local y las metástasis ocurren generalmente en los 3 primeros años desde el diagnóstico, siendo el pulmón el órgano más afectado por las metástasis a distancia, tal como ocurrió en nuestros pacientes. Por lo general, coincidimos con la literatura en que los LMS vasculares son tumores agresivos con un pronóstico malo, con unas tasas de supervivencia entre las más bajas de todos los sarcomas de tejidos blandos, situándose en menos del 50% a los 5 años23. El valor de la quimioterapia en mejorar la supervivencia dependerá de futuros estudios que reúnan un mayor número de casos. Aun así, debemos realizar una valoración y planificación multidisciplinar para ofrecer el tratamiento más adecuado en cada caso, tanto sistémico como local, dados los continuos avances en el campo oncológico.
Nivel de evidenciaNivel de evidencia iv.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Dr. Ignasi Proubasta Renart sus enseñanzas y dedicación, así como la constante motivación que nos transmite para avanzar científicamente en nuestra especialidad.





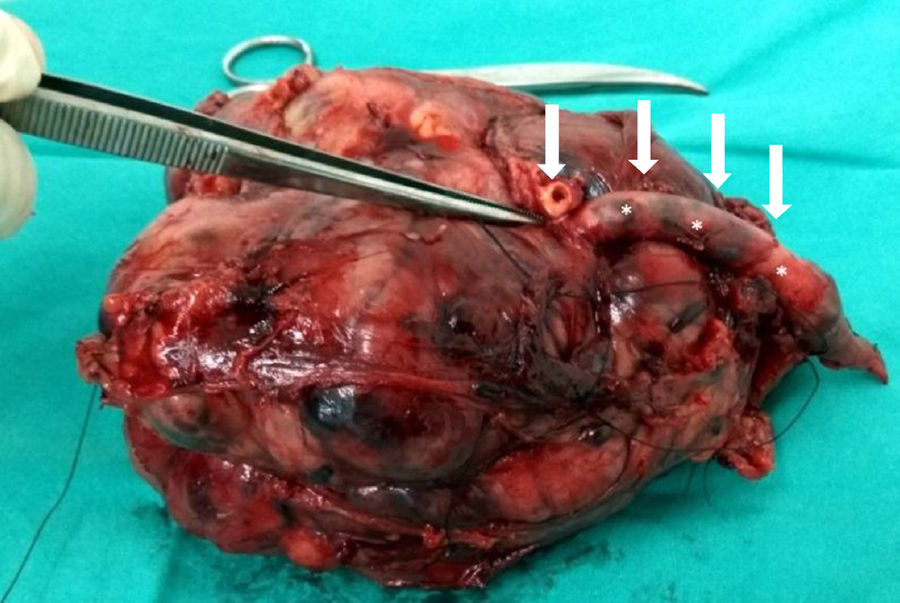
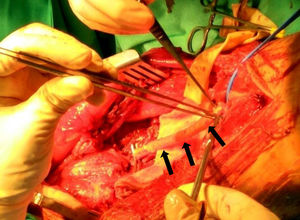
![Aspecto macroscópico de un LMS vascular después de su resección a nivel del muslo (paquete vascular femoral superficial [flechas]). Aspecto macroscópico de un LMS vascular después de su resección a nivel del muslo (paquete vascular femoral superficial [flechas]).](https://static.elsevier.es/multimedia/18884415/0000006200000006/v1_201811240656/S1888441518300900/v1_201811240656/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
