Para controlar la infección de localización quirúrgica (ILQ) se han descrito, además de otras medidas habituales (esterilización de instrumental, atuendo quirúrgico, limpieza de superficies, filtros HEPA, correcta técnica quirúrgica, etc.), unas medidas sencillas, basadas en evidencia tipo i, que además actúan sinérgicamente (bundle): corte del vello con maquinilla en lugar de rasurado, profilaxis antibiótica, control de la glucemia y la temperatura del enfermo intraquirófano. A estas medidas del bundle habría que añadir otra: antisepsia del campo quirúrgico, en el enfermo, y de las manos-antebrazos, en el equipo quirúrgico. En los últimos años se están introduciendo soluciones alcohólicas en lugar de clorhexidina o povidona iodada para la antisepsia del equipo quirúrgico, con muy buenos resultados, y recientemente (enero, 2010) se ha demostrado con un ensayo clínico multicéntrico que la clorhexidina al 2% en alcohol puede reducir a la mitad la ILQ, respecto de la utilización de povidona yodada. Por todo ello, creo que debemos implementar estos cambios de conducta para lograr reducir, sin apenas coste, la ILQ.
Besides the usual measures to control surgical site infection (SSI) (instrument sterilisation, surgical wear, clean surfaces, HEPA filters, and correct surgical technique, etc), there are some simple measures, based on type I evidence which also work synergically (bundle): hair cutting with a machine instead of a razor, antibiotic prophylaxis, blood glucose monitoring and patient temperature during surgery. To this bundle of measures should be added another: antisepsis of the surgical field, on the patient and on hands and forearms, and surgical equipment. In the last few years alcohol solutions have been introduced in place of chlorhexidine and povidone iodide for antisepsis of surgical equipment, with very good results, and in a recent multicentre clinical trial (January, 2010) it was shown that 2% chlorhexidine in alcohol could reduce SSI by half compared to the use of povidone iodide. For these reasons, I believe that we should introduce these behavioural changes to reduce SSI, with a minimum of cost.
La infección de localización quirúrgica (ILQ) es una de las complicaciones más graves de la cirugía traumatológica, por lo que se intenta controlar desde hace muchos años con la aplicación de profilaxis antibiótica periquirúrgica, unida a las medidas clásicas, como son asepsia y disciplina quirúrgicas. En los servicios de Traumatología y Ortopedia del Hospital Universitario La Paz comenzamos a principios de la década de 1980 la profilaxis antibiótica sistemática periquirúrgica (administrándola 30min antes y hasta 1–2 días después) en los enfermos sometidos a cirugía, obteniendo, en poco tiempo, una reducción a la tercera parte de la incidencia de ILQ1. Después, cuando la profilaxis antibiótica se hizo una práctica común, nuestro empeño ha sido que esta se reduzca al mínimo posible, es decir «dosis única» para no inducir resistencias al antibiótico utilizado (generalmente cefazolina o amoxicilina-clavulánico, aunque en alergias a betalactámicos se sustituye por vancomicina), y también por haber encontrado en análisis multivariante de una muestra de más de 7.000 enfermos que la profilaxis alargada (después de controlar factores de confusión dependientes de las características del enfermo, estancia, etc.) multiplica aproximadamente por 1,5 la ILQ2.
Últimamente3,4 se han descrito medidas sencillas de implantar, pero imprescindibles para reducir la incidencia de la infección hospitalaria, basadas en estudios con nivel de evidencia i (ensayos clínicos) y que, además, se «sinergizan» entre sí, de forma que la utilización de todas ellas supone una prevención mayor que la suma de cada una por separado (todo ello es lo que se denomina con la palabra inglesa bundle). El bundle de la ILQ consta de:
- 1)
corte del pelo con máquina en lugar de rasurado,
- 2)
antibioprofilaxis adecuada,
- 3)
mantener la temperatura corporal del enfermo y
- 4)
controlar la glucemia)
Todas ellas se pueden resumir con el acrónimo inglés «CATS», y que se presenta con la imagen de un gato, como regla mnemotécnica.
Pero a estas 4 medidas del bundle habría que añadir otra: la antisepsia del equipo quirúrgico y del enfermo con soluciones alcohólicas. A estas últimas me referiré a continuación, aportando las evidencias que aconsejan el cambio de proceder y las repercusiones de esos cambios para concluir con una imagen complementaria de la referida con el acrónimo inglés «gatos».
Hace más de 20 años que las soluciones alcohólicas se recomiendan para antisepsia quirúrgica en distintos países europeos, y, desde el 2002, en EE. UU.5–7.
A finales de la década de 1990 se empezó a publicar8–10 que las soluciones alcohólicas tienen más eficacia antimicrobiana que los métodos de lavado quirúrgico clásico (clorhexidina al 4–5%, PVP-I al 7,5–10%), tanto sobre la microbiota «transitoria» como sobre la microbiota «permanente» de la piel. Por otra parte, las soluciones alcohólicas protegen más la dermis del usuario (menor sequedad y menor irritación) y, al aplicarlas, no necesitan cepillado (menor agresión dérmica).
La finalidad de su utilización es como con la antisepsia clásica: minimizar el riesgo de infección quirúrgica en caso de rotura de guantes, lo que ocurre hasta en un 18% de las intervenciones.
En 2008 ha aparecido una revisión de la Cochrane11 sobre la eficacia de la antisepsia quirúrgica para reducir la infección del sitio quirúrgico, en la que se comparan las soluciones alcohólicas respecto de los otros 2 antisépticos clásicos, povidona iodada y clorhexidina. Tras su screening inicial, buscando trabajos que fuesen equiparables y con rigor metodológico para extraer conclusiones, eligieron 11, uno de los cuales era nuestro8, precisamente el único que comparaba los tres productos anteriormente señalados, en dos tipos de ensayos, con voluntarios y en cirugía real. En este trabajo, publicado en el año 2000, quedaba patente que una de las soluciones alcohólicas que en ese momento teníamos (con N-duopropenida) era más eficaz que la clorhexidina y esta que povidona iodada, al analizar la contaminación microbiana de las manos del personal sanitario (comparando en cada voluntario su microbiota antes, después de la desinfección y al quitarse los guantes). Al año siguiente, Pietsch9 demostró, también desde el punto de vista microbiológico, que la clorhexidina era peor que Sterillium® (alcohol más un amonio cuaternario, el mecetronio). Pero no fue hasta el año 2002, en el que Parienti10 et al en un estudio multicéntrico con un seguimiento de 1,5 años señaló que estos efectos antimicrobianos también repercutían en una reducción significativa de la infección de herida quirúrgica y obtuvieron que Sterillium era significativamente mejor (p<0,01) que la clorhexidina.
En 2006, Rotter12 comparó tres soluciones alcohólicas (n-propanol al 60%, 2-propanol al 70% y etanol al 80%, que son las concentraciones más adecuadas para esos alcoholes) con clorhexidina al 4% en 5 laboratorios y, aunque había cierta variación en los resultados de cada laboratorio (ya que el estudio se realiza sobre voluntarios, y la flora nunca será igual en cada grupo), la tendencia fue constante, pues n-propanol fue mejor que 2-isopropanol, este mejor que etanol y todos ellos superiores a clorhexidina al 4%.
Pero el gran problema es que en diversos trabajos se han utilizado soluciones alcohólicas con diversos adyuvantes, y la eficacia de estas soluciones puede variar mucho, según el antiséptico acompañante del alcohol e incluso de los emolientes, ya que estos protegen la piel, pero a veces también interfieren con la eficacia microbicida del producto. Por eso es difícil extraer algo más que una «tendencia» para las soluciones alcohólicas en general, y eso es lo que ha concluido la revisión efectuada por la Cochrane.
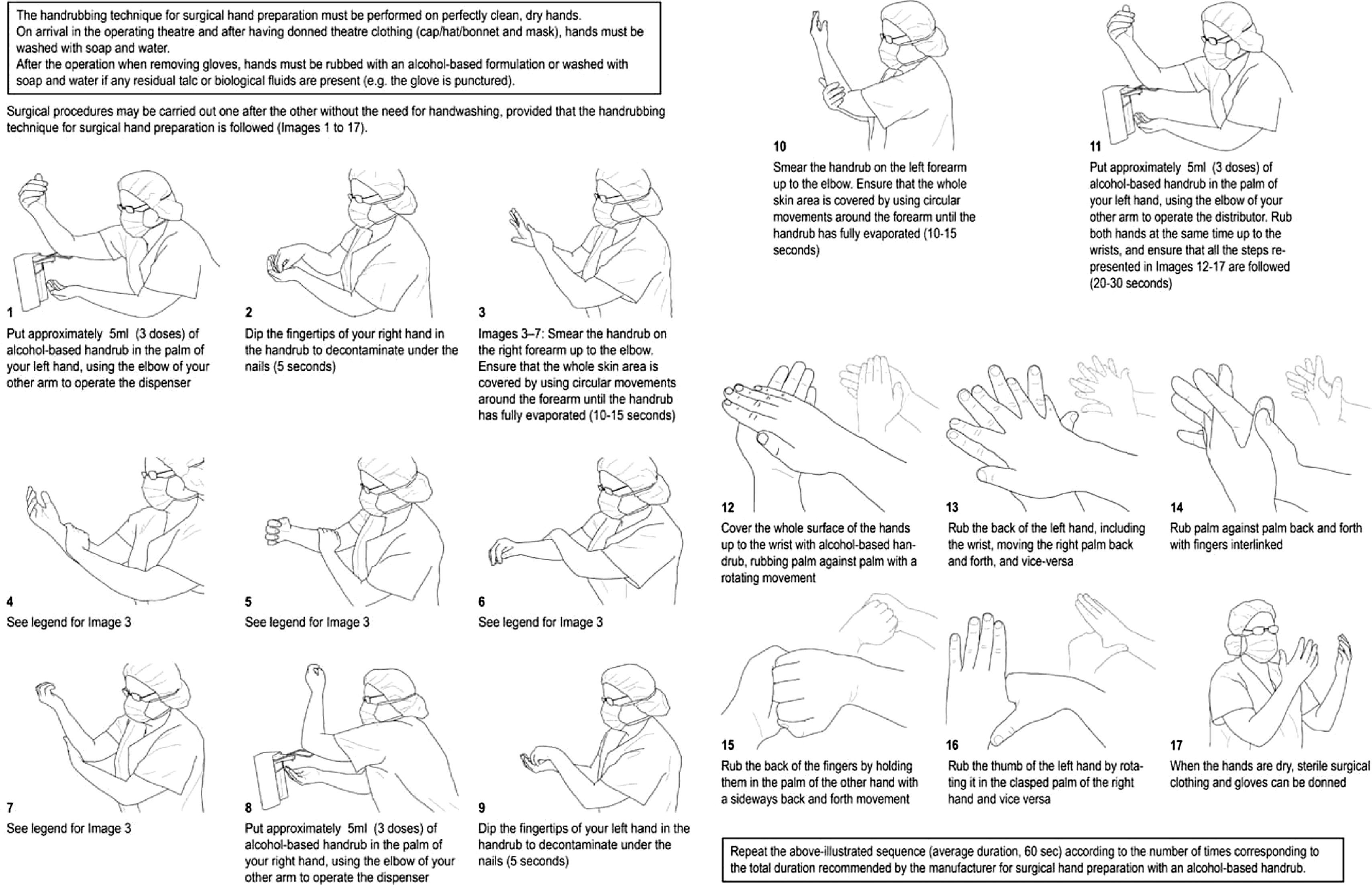
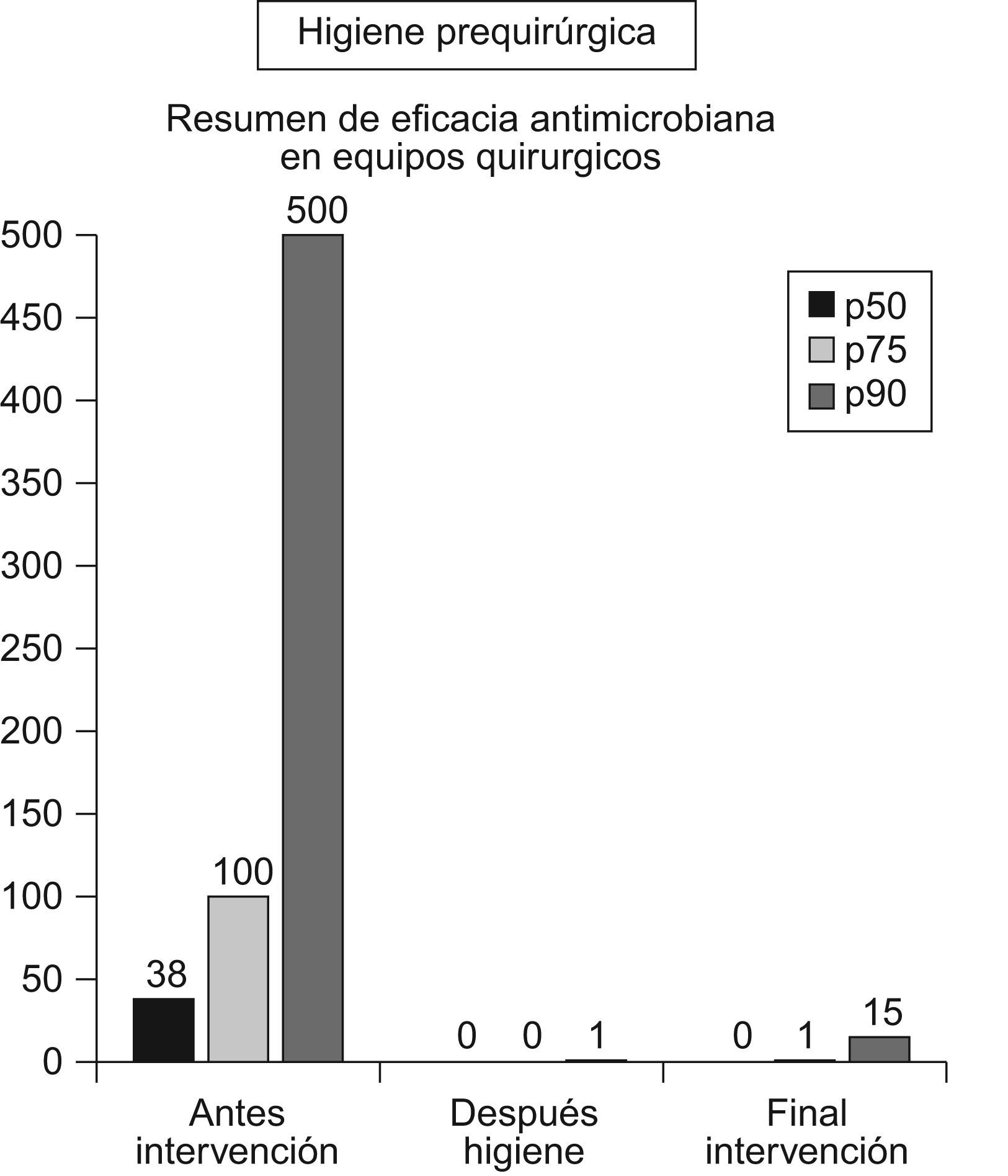
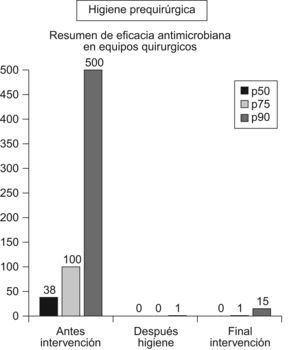
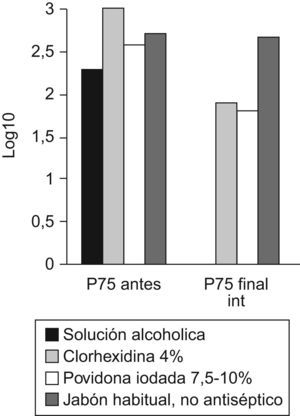
En 2009, la OMS13 ha refrendado el uso de las soluciones alcohólicas como lavado prequirúrgico con gráficas alusivas a la realización del proceso (fig. 1). Su duración es de solo 3min y no requiere lavado previo (excepto si las manos están visiblemente sucias) ni cepillado (lo que supone menor agresión dérmica). La antisepsia de las zonas subungueales se logra al depositar en el cuenco de una mano solución alcohólica y sumergir en ese líquido las uñas de la otra mano, haciendo un movimiento semejante a arañar la palma de la mano que contiene la solución alcohólica. La operación se repite en la otra mano. Los resultados microbiológicos de esta técnica son muy buenos, comparados con la técnica habitual (lavados con clorhexidina o povidona iodada) y, sobre todo, se distinguen por su mayor eficacia residual1, manteniendo la microbiota debajo del guante mejor controlada que con la técnica clásica de lavado, en la que siempre se producía una nueva contaminación de la superficie de la mano al emerger los microorganismos desde sus reservorios en glándulas sudoríparas y folículos pilosos, de forma que en intervenciones largas hemos apreciado8 que se podía tener, incluso, mayor contaminación que antes del lavado quirúrgico (sobre todo con povidona iodada), mientras que con las soluciones alcohólicas esta recontaminación se retarda, obteniendo recuentos muy bajos (cercanos a 0 por impronta de dedos). Por ello, cuando se trata de introducir esta técnica en cirugía es conveniente realizar controles de manos del equipo quirúrgico antes, después de la antisepsia y al finalizar la cirugía, para que cada participante pueda valorar, en su propia microbiota, la eficacia o no de la solución alcohólica, y matice con este resultado otros aspectos de la técnica, como olor (que a algunos desagrada), etc. En las figuras 2 y 3 exponemos algunos de los resultados obtenidos en nuestros equipos quirúrgicos en las fases iniciales de introducción de esta técnica de antisepsia quirúrgica. En ellas se puede valorar, en diferentes tipos de cirugía, que el efecto predominante es la casi eliminación completa de los microorganismos colonizantes y el mantenimiento de este nivel durante toda la intervención.
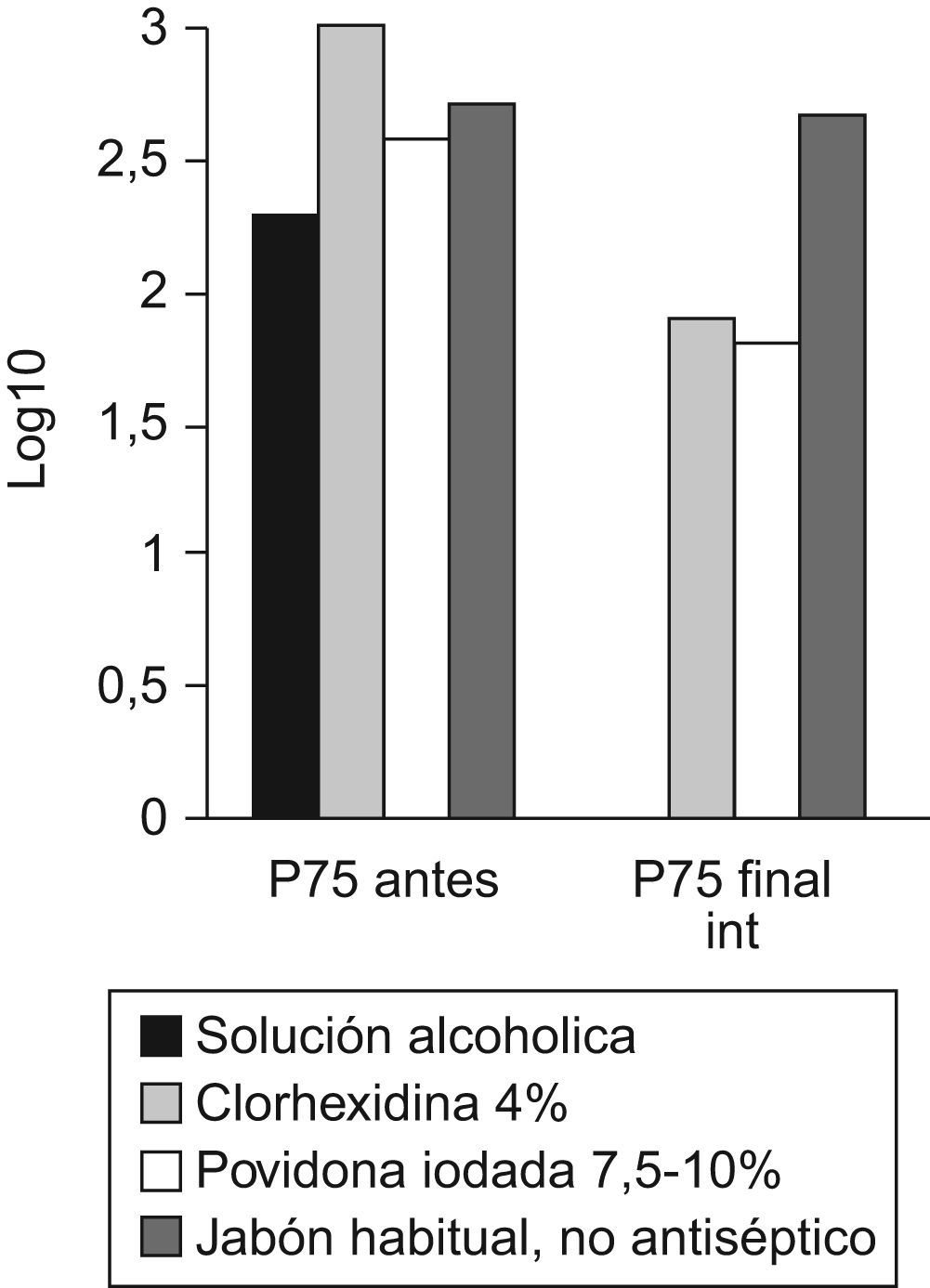
Comparación de la eficacia antimicrobiana tras utilizar diferentes soluciones para el lavado quirúrgico. Se representan, en las ordenadas, los log10 de las ufc aisladas en los dedos, antes y al final de la intervención, en el P75 de cada producto. Cirugía Traumatológica, Hospital La Paz.
Pero no solo hemos de indicar el uso de soluciones alcohólicas, sino tener criterios para aconsejar las mejores, ya que algunas, por su composición particular, no son tan eficaces, aunque los cambios de sus fórmulas no sean del todo perceptibles. ¿Cómo elegir las mejores para antisepsia quirúrgica?
Criterios de elección de la solución alcohólicaLo primero es disponer de estudios adecuados que valoren la eficacia de estas soluciones alcohólicas, por ejemplo, la norma europea EN 1279114–17, por lo que la describiremos de forma sucinta. Esta norma es muy adecuada, ya que homogeneiza la evaluación de las soluciones alcohólicas y se aproxima bastante a lo que será la práctica clínica, aunque también tiene ciertas limitaciones que intentaremos superar.
Se requiere un mínimo de 20 voluntarios que se aplican, bien una solución alcohólica de referencia (el n-propanol de 60°), o bien una solución alcohólica «problema» (la que se va a evaluar). Entre ambas aplicaciones, los voluntarios deben esperar una semana para el restablecimiento de la flora, por lo que no podrán usar soluciones alcohólicas ni continuar con la experiencia hasta pasado ese tiempo.
Resumen de los pasos de la Norma 12791:
- 1)
Lavado de manos con jabón blando al 20% (aceite de linaza+hidróxido potásico, pH 10–11) durante 1min.
- 2)
Enjuagar durante 15 s al chorro de agua y secar con toalleta de papel.
- 3)
Muestrear microbiológicamente ambas manos. Así se obtendrán los recuentos microbianos iniciales.
- 4)
Dejar secar.
- 5)
Aplicar n-propanol de 60°, extendiéndolo bien por toda la superficie de las manos hasta las muñecas, manteniéndolas húmedas durante 3min.
- 6)
Muestrear microbiológicamente la mano derecha. Este será el «tiempo 0».
- 7)
En la mano izquierda se pone un guante y el voluntario se marcha durante 3h.
- 8)
Tras ese tiempo regresa, se quita el guante de la mano izquierda y se muestrea microbiológicamente, como en el paso 6. Será el «tiempo 3h».
- 9)
Siembra, incubación y anotación del número de colonias en cada mano (antes de la aplicación del alcohol), así como las correspondientes a los tiempos 0 y 3h después de aplicar la solución alcohólica.
- 10)
Cálculo del «efecto inmediato» (restando el log10 de las encontradas en el tiempo 0 al log10 de las unidades formadoras de colonias de la mano derecha) y determinación del «efecto prolongado» (log10 de las unidades formadoras de colonias de la mano izquierda menos el log10 de las del tiempo 3h).
- 11)
A la semana se realiza de nuevo la experiencia sustituyendo el alcohol por el producto que se quiere valorar con esta norma.
El estudio concluye con un resumen en el que se describen los efectos «inmediato» y «a las 3h» del nuevo producto y del n-propanol (alcohol de referencia), así como la diferencia estadística entre ambos tipos de valores del problema y del control. Para pasar la EN 12791, el efecto inmediato del problema no debe ser estadísticamente inferior al n-propanol de 60° con una p<0,1. Y como el n-propanol no tiene apenas acción residual (sobre microbiota endógena), si se reivindica «efecto prolongado» a las 3h el nuevo producto debe ser significativamente superior al n-propanol de 60° (p<0,01).
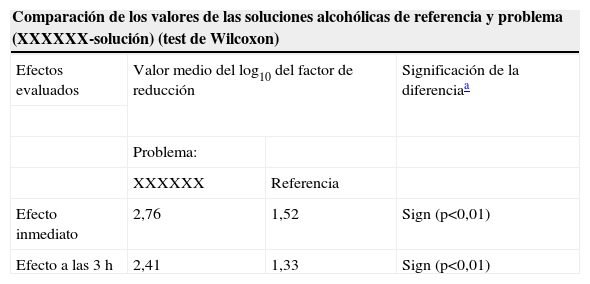
Como ejemplo véase la tabla 1, en la que se expone la última hoja de un informe de la Norma 12791 realizado en la Universidad Autónoma de Madrid.
Ejemplo de la página final de un informe de la Norma 12791
| Comparación de los valores de las soluciones alcohólicas de referencia y problema (XXXXXX-solución) (test de Wilcoxon) | |||
| Efectos evaluados | Valor medio del log10 del factor de reducción | Significación de la diferenciaa | |
| Problema: | |||
| XXXXXX | Referencia | ||
| Efecto inmediato | 2,76 | 1,52 | Sign (p<0,01) |
| Efecto a las 3h | 2,41 | 1,33 | Sign (p<0,01) |
Se ha sustituido el nombre del producto investigado por XXXXXX. Por lo tanto, XXXXXX es un producto adecuado para la desinfección quirúrgica de las manos y, además, tiene un efecto prolongado.
Log: logaritmo; Sign: significativo.
Nota: en la prenorma (pr-N 12791), a las 3h solo se exigía «no ser inferior» (como en el efecto inmediato), y en diferentes artículos basados en esta prenorma se concluye como «efecto prolongado» lo que hoy no se aceptaría como tal, y por ello hemos de tener cuidado si el informe que nos presenta una casa comercial se refiere a la Norma o a la Prenorma 12791 (no acepten este último).
Ventajas de la Norma 12791:
Es sencilla (relativamente), no requiere identificación de microorganismos y es reproducible (en el sentido en que distintos laboratorios indican el mismo «orden de prelación» de diferentes productos ensayados, pero no en que los resultados numéricos sean similares ni que dos informes sean directamente comparables entre sí).
Permite la autocorrección por persona (en cada voluntario se obtiene la reducción log10, y esa reducción corregida es la que se promedia).
Es conservadora en su «efecto inmediato», ya que permite que la reducción log10 sea menor que la del alcohol (siempre que sea no significativa). Sin embargo, esto no ocurre en el efecto prolongado, ya que debe ser superior al n-propanol de 60° con p<0,01.
Elimina la microbiota «transitoria» de cada voluntario con el lavado previo de 1 min, ya que el objetivo es la «microbiota residente».
Pero ¿no estará más directamente relacionada la ILQ con la contaminación de la piel del enfermo, sobre todo la que ocurre durante o poco después de la intervención, por emergencia de los microorganismos desde sus reservorios en las glándulas sudoríparas y los folículos pilosos de la zona periincisional? Esta contaminación endógena va en relación inversa al efecto residual del antiséptico utilizado sobre el enfermo.
El antiséptico que más se suele emplear para la antisepsia de la piel del enfermo antes de la cirugía es la povidona iodada, no solo por su eficacia antiséptica, sino también por su facilidad de ver la zona de aplicación (excepto en algunos enfermos, como neonatos, o en cesáreas18, por riesgo de absorción de yodo); sin embargo, tiene poca eficacia residual sobre microbiota endógena. Por esto, se comprenderá que el planteamiento más lógico sea comprobar si al aplicar sobre la piel del enfermo algún producto con mayor efecto antimicrobiano residual que povidona iodada, se obtiene, o no, una disminución de la incidencia de la ILQ.
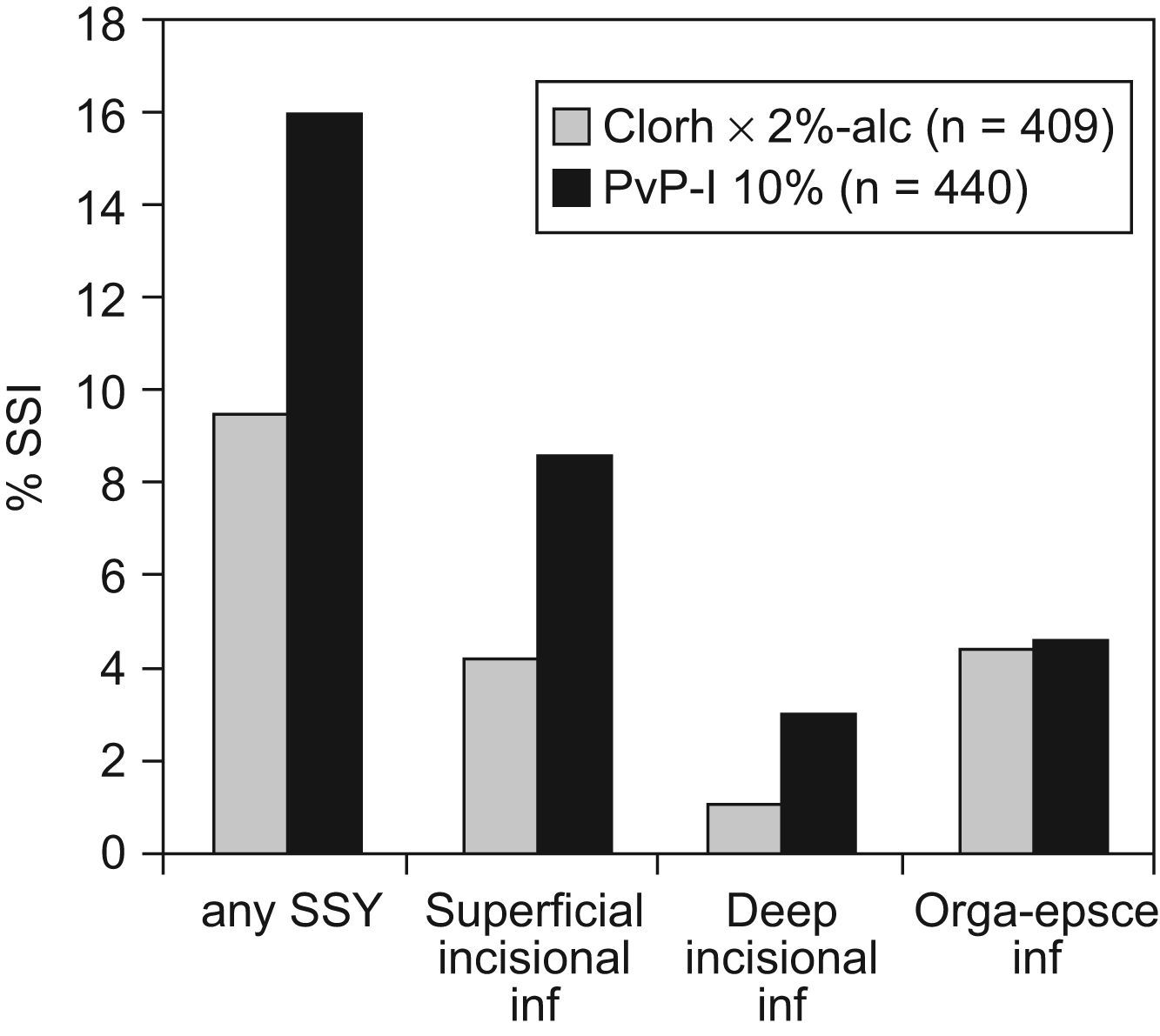
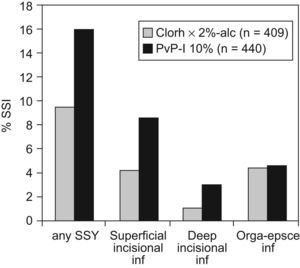
Esto es lo que se ha hecho19 en un ensayo clínico con más de 400 enfermos en cada brazo publicado a principios de este año en el N Eng J Med, en el que se ha investigado la incidencia de ILQ en enfermos sometidos a cirugía limpia-contaminada, entre aquellos a los que se aplicó como antisepsia prequirúrgica povidona iodada respecto a los que se les puso clorhexidina al 2% en isopropil-alcohol (ChloraPrep®, una solución empleada en venopunción y otros usos desde el final del pasado siglo). La eficacia de esta última solución alcohólica ha sido enorme, mucho mayor de lo esperado a priori, ya que redujo la incidencia de ILQ casi a la mitad, tanto en herida superficial como en herida profunda, e incluso redujo la infección de órgano o espacio, aunque el descenso no fue significativo con la n de 400. Además, este descenso se obtuvo en diversos tipos de cirugía limpia-contaminada. Los datos principales se detallan en la figura 4, elaborada a partir de las tablas de este ensayo clínico.
El razonamiento subyacente en el anterior experimento también se puede aplicar a cirugía limpia (quizá incluso con mayor fuerza, ya que en intervenciones como cirugía traumatológica, cardiaca, etc., el efecto residual sobre la microbiota endógena del paciente en zona periincisional puede ser de mayor valor aun), aunque al tratarse de una cirugía con menor incidencia de ILQ, se requiera un número mayor de enfermos para demostrar significación estadística, pero el RR de utilizar soluciones alcohólicas versus povidona iodada debe ser, al menos, similar al del anterior ensayo clínico.
Hemos de recordar que la aplicación de soluciones alcohólicas como antisepsia quirúrgica debe hacerse solo sobre piel íntegra, no sobre heridas o mucosas (valorar también su aplicación en axila o ingle). También se debería anotar otra restricción a esta indicación de las soluciones alcohólicas: neonatos cuando tienen menos de 37 semanas, al menos durante sus dos primeras semanas de vida, ya que este tiempo se ha asociado a mayor capacidad de absorción de las sustancias aplicadas sobre su piel, por la inmadurez del estrato córneo. Por último, estas soluciones alcohólicas con clorhexidina al 2% deben tener las mismas contraindicaciones que se especifican para el digluconato de clorhexidina en solución acuosa.
Esta solución de clorhexidina-alcohol se puede comprar (Chlora-Prep o alguna fórmula con clorhexidina al 2% en isopropanol de 70o, existente en España) o bien prepararla en farmacia hospitalaria. Algunas de las nuevas fórmulas con clorhexidina al 2% incorporan un colorante para tener la ventaja que sobresale en povidona iodada. Esto puede ayudar en su uso, aunque hay que tener cuidado, ya que el colorante puede ser difícil de retirar después, quedando la piel con una tinción que evita su correcta observación posquirúrgica. Pero ¿podríamos emplear las soluciones alcohólicas que ya se utilizan para antisepsia del equipo quirúrgico? Probablemente sí, pero hace falta demostrar que estas soluciones son tan eficaces como la clorhexidina al 2% en isopropanol de 70° y que no producen efectos nocivos en una aplicación sobre la piel íntegra del enfermo que se va a intervenir (ejemplo, ¿problemas de cicatrización por los emolientes?). In vitro hemos obtenido que la reducción log10 de 2 soluciones que cumplían la EN 12791 en sus dos tiempos, inicial y a las 3h (es decir, tenían efecto mantenido) era similar a la de clorhexidina al 2% en isopropanol, utilizando microorganismos de enfermos de UVI, pero hace falta confirmar estos experimentos con otros in vivo, con la microbiota normal de voluntarios sanos.
Sea cual sea la solución alcohólica elegida debería usarse de la siguiente forma para cirugía limpia-contaminada, y creo que también serían útiles en cirugía limpia (con las excepciones antes referidas de mucosas, neonatos, etc.): repetidas aplicaciones con una compresa o gasa sobre el enfermo, con 30s de descanso, que permitan su evaporación, hasta completar un tiempo de unos 3min, dejando secar tras la última aplicación un mínimo de 1min.
Así, pues, concluyo resumiendo las medidas con eficacia demostrada para reducir la ILQ, que se expresan en el bundle de este tipo de infección (corte del pelo con máquina en lugar de rasurado, antibioprofilaxis adecuada, mantener la temperatura corporal del enfermo y controlar la glucemia) y que deberían complementarse con algo que indique la aplicación de soluciones alcohólicas, tanto en el enfermo como en el equipo quirúrgico, es decir, añadir «As» a CATS, ¿as de gatos? (fig. 5). Como eslogan se podría decir «utiliza ese as para controlar la ILQ» o «al operar, ten en cuenta este as», etc.
Se memorice como se desee, hemos de recordar que disponemos de unas medidas sencillas y muy eficaces para reducir la ILQ, aunque lo ideal es monitorizar su mayor cumplimiento para lograr que este sea el mayor posible.
Por supuesto que a las anteriores medidas de prevención de la ILQ que se describen en el bundle hay que añadir otras que pueden variar según el tipo de intervención, como son la estancia previa a la cirugía, el atuendo quirúrgico/disciplina intraquirófano e instrumental correctos, así como un ambiente adecuado en temperatura, humedad y contaminación (controlada por filtros HEPA, al menos en intervenciones como cirugía cardiaca, ortopedia de grandes articulaciones así como limpieza de superficies, al menos 2/día, una antes del comienzo de la actividad quirúrgica y otra al final de esta), pudiéndose usar también descolonización intestinal, hiperoxigenación, etc., en ciertas cirugías, y, por último, lo más importante pero lo que es muy difícil de estandarizar: la correcta técnica quirúrgica20.
Otros factores de riesgo de ILQ, como el tipo de cirugía (riesgo codificado por el índice ASA, el NNIS, etc.), las alteraciones de la inmunidad, la malnutrición, la obesidad o incluso el tabaquismo, influyen en la cuantía de la ILQ20–23 y hay que tenerlos en cuenta al realizar comparaciones de la incidencia de esta complicación, pero son imposibles (intrínsecas a la intervención que se va a realizar) o muy difíciles de modificar, por lo que no se han tenido en cuenta en esta revisión.
En otro trabajo24 publicado también en el N Engl J Med se aborda otro tema que complementa las medidas referidas en el bundle modificado: la reducción de la ILQ actuando sobre la colonización del enfermo con S. aureus. Para ello, en cirugía limpia o limpia-contaminada, durante los días previos a la intervención, se descoloniza mediante lavados corporales con clorhexidina y aplicación nasal de mupirocina. Obtienen un buen efecto, pero restringen su indicación a los colonizados por este microorganismo, por lo que debe realizarse un screening previo, y ello puede limitar su aplicación. De todas formas, también es una estrategia que podría implementarse sin excesivo gasto; de hecho, en diversos hospitales se descoloniza la mucosa nasal con mupirocina, por ejemplo, antes de cirugía cardiaca, independientemente de si los enfermos están o no colonizados por S. aureus.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota aclaratoria: en castellano solemos hablar de eficacia «residual» al efecto de un antiséptico después de su aplicación (minutos, horas, etc.) y añadimos la frase «sobre microbiota endógena» o «exógena» (explícita o implícitamente) para describir los conceptos que en la literatura médica inglesa están diferenciados, sin necesitar esa frase añadida, ya que solo aplican el calificativo «residual» al efecto sobre microbiota exógena, mientras que sobre la endógena lo describen como «sustained effect» o efecto mantenido.