Los seres vivos crecen desde el momento de la fecundación hasta que alcanzan la madurez, existiendo en el mundo animal una gran variedad de tamaños. Cada ser tiene el tamaño que precisa para conseguir el máximo rendimiento con el mínimo gasto energético. La función impone sus condiciones al tamaño; las aves muy corpulentas pierden la facultad de vuelo, mientras que los grandes mamíferos marinos alcanzan esas dimensiones por vivir en un medio acuático que los soporta. Sin olvidarnos del dimorfismo sexual, importante en el mundo animal, en la mayoría de los vertebrados el crecimiento de los machos es mayor que el de las hembras 1 .
Durante el crecimiento, el tamaño de las diferentes porciones corporales varían en su relación; los brazos de un bebé son más cortos, en relación con el resto del cuerpo, que los brazos de un adulto, pues la velocidad de crecimiento es diferente en cada hueso en un mismo individuo. Así, las epífisis más cercanas a la articulación de la rodilla contribuyen más al crecimiento longitudinal del miembro inferior, mientras que las más alejadas del codo influyen, en mayor medida, en el crecimiento de la extremidad superior 2 . Además, cada individuo lleva su propio ritmo de crecimiento, por lo que no siempre coinciden la edad cronológica con la edad biológica.
El propósito de este artículo ha sido revisar la bibliografía referente al cartílago de crecimiento.
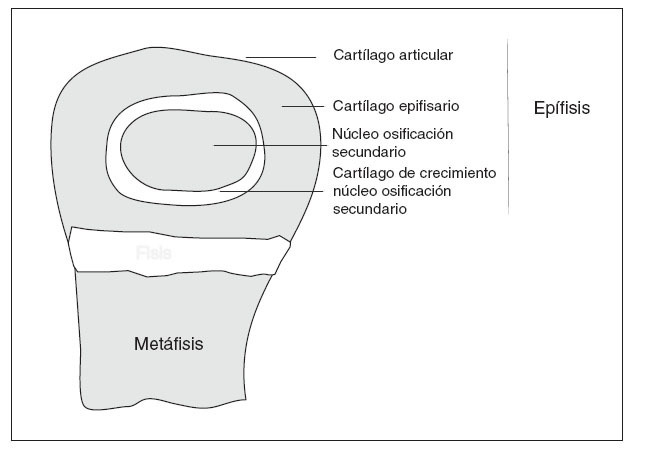
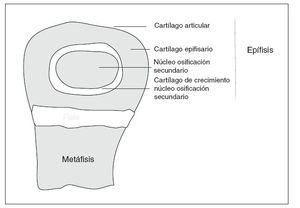
EL CRECIMIENTOLa fisis o cartílago de crecimiento es una extensión periférica del centro de osificación primario, que produce el crecimiento longitudinal de los huesos largos 3 (fig. 1). En la fisis tiene lugar un proceso secuencial de proliferación celular, síntesis de matriz extracelular, hipertrofia celular, mineralización de la matriz, invasión vascular y, eventualmente, apoptosis donde el cartílago es reemplazado continuamente por hueso, aumentando así la longitud del mismo 4 . Simultáneamente, hay un crecimiento radial por la aposición directa de hueso por los osteoblastos en la superficie perióstica y reabsorción de osteoclastos en la superficie endóstica 5 .
Cuando el esqueleto se acerca a su madurez disminuyen el crecimiento longitudinal y la proliferación de los condrocitos. Durante la adolescencia se produce una epifisiodesis fisiológica que cierra el cartílago de crecimiento. Se forman pequeños puentes óseos entre el centro de osificación epifisario y la metáfisis, y al disminuir las células y progresar la invasión vascular metafisaria la fisis desaparece. Al terminar de crecer un hueso no es necesaria la desaparición del cartílago de crecimiento, bastaría con que éste estuviese inactivo, como ocurre en los peces, pero sería un punto de menor resistencia mecánica. Para evitar las solicitaciones a cizallamiento, muchos de los cartílagos de crecimiento presentan ondulaciones que en ciertos puntos puede presentar una inclinación de unos 60° en relación con el eje diafisario 6 .
Cada epífisis tiene su propio patrón de cierre que comienza antes en las chicas que en los chicos, tal vez por efecto de los estrógenos, en ambos sexos, que aceleran la sustitución de cartílago por tejido óseo. Los estrógenos promueven el envejecimiento programado de los condrocitos del cartílago de crecimiento más que acelerar la invasión vascular o la osificación 4 . Sin embargo, hay preguntas que no se han podido contestar si el cierre del cartílago es por efecto hormonal, ¿por qué cierran los cartílagos a diferentes edades con variaciones de un individuo a otro? y ¿por qué el agente que determina la osificación del cartílago de crecimiento no lo hace sobre el cartílago articular? 7,8 .
Figura 1. Esquema de la extremidad de un hueso largo en crecimiento.
ESTRUCTURA DEL CARTÍLAGO DE CRECIMIENTO
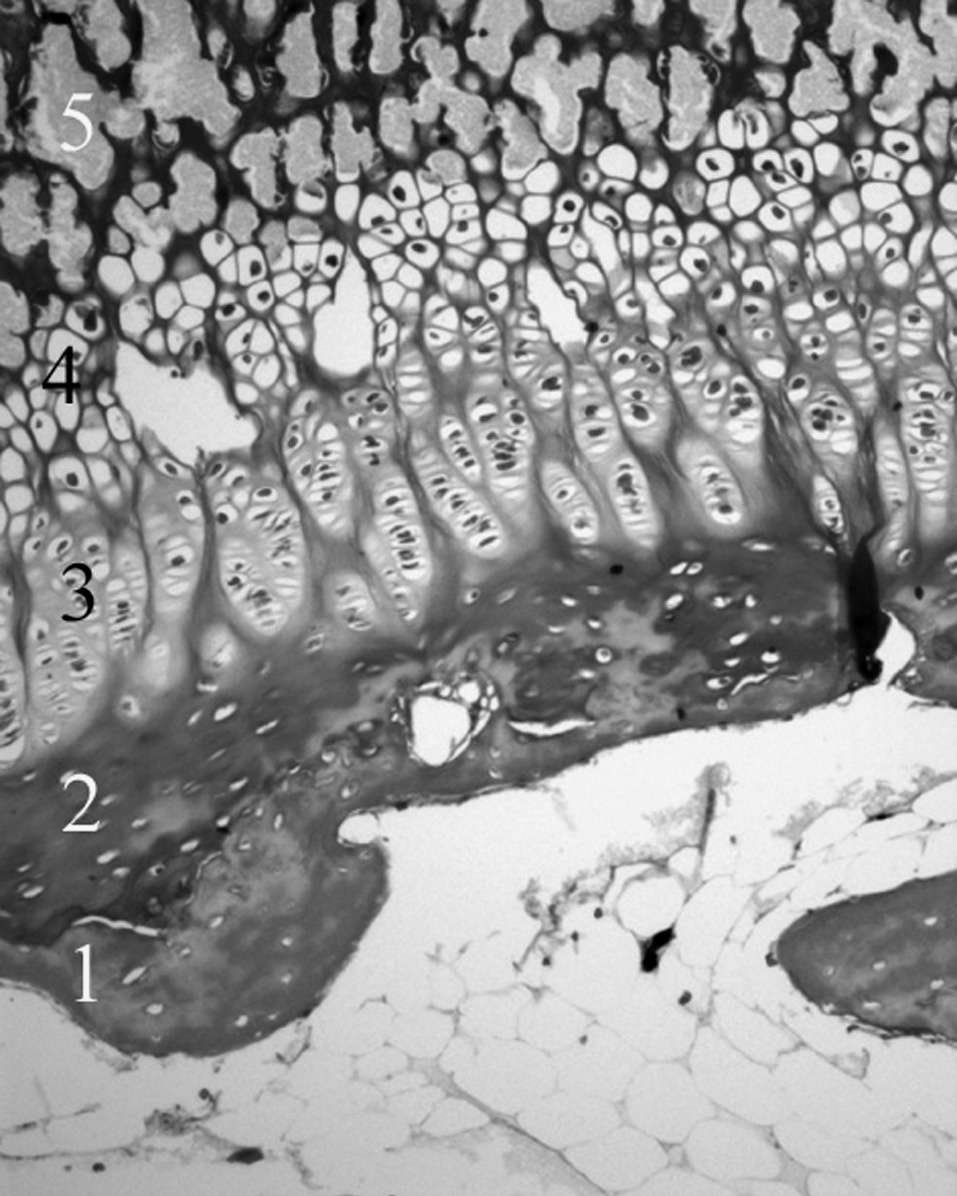
El cartílago de crecimiento de un hueso largo se ha dividido en tres porciones 3,9-11 : la fisis cartilaginosa, la metáfisis y la zona de Ranvier (figs. 2 y 3). La unidad funcional fisaria es una columna de condrocitos que atraviesa por diferentes situaciones, desde la proliferación, pasando por la hipertrofia hasta llegar a la apoptosis, la muerte programada de la célula, con los consiguientes cambios en el metabolismo celular 12-15 y regulado por diferentes hormonas y factores de crecimiento 16-18 .
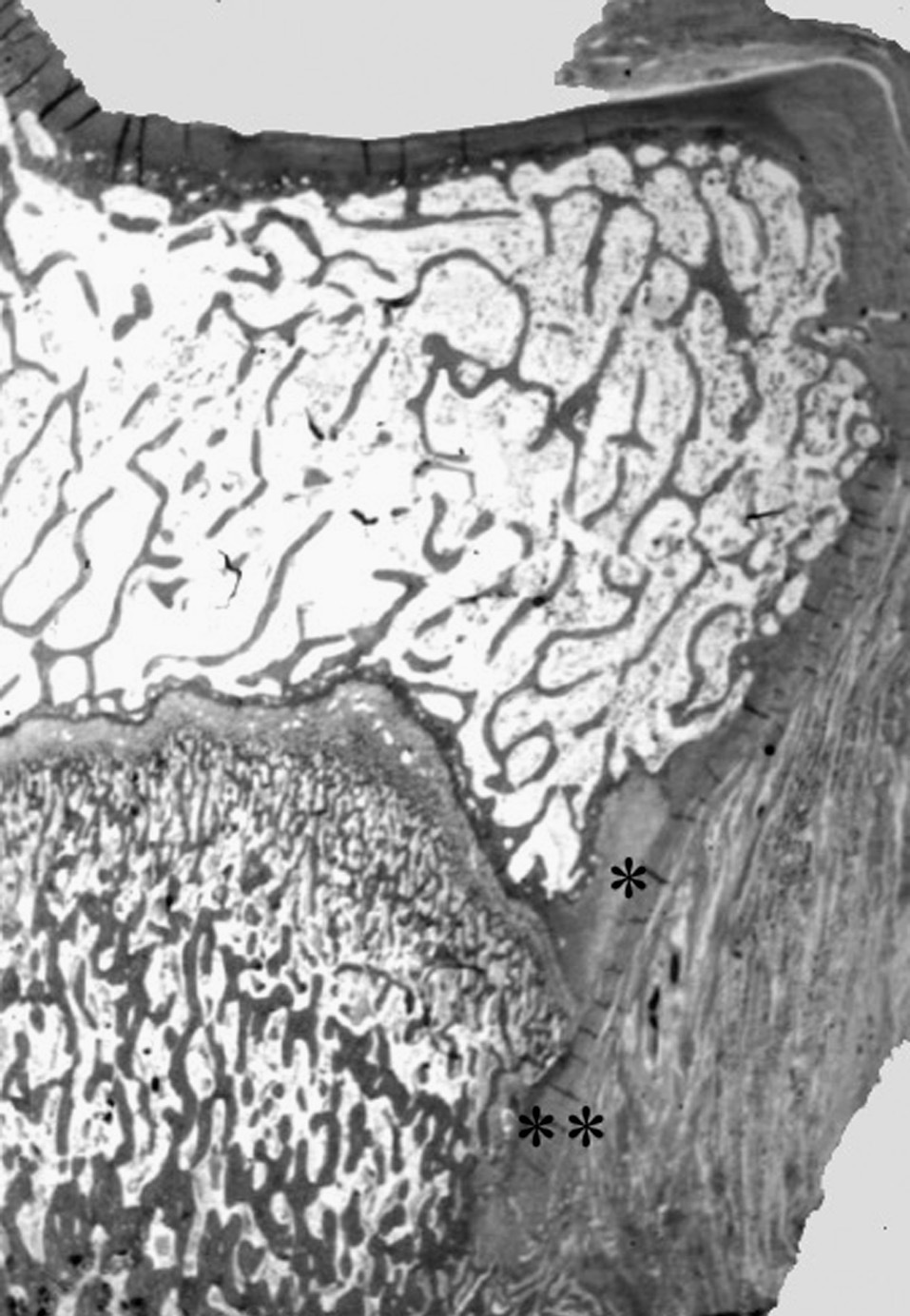
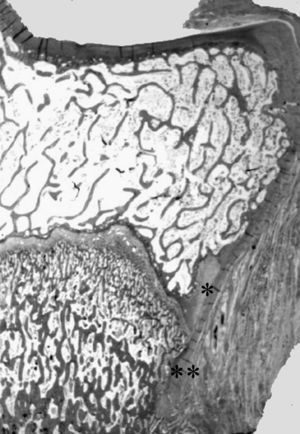
Figura 2. Nódulo de Ranvier (*) en la extremidad proximal de la tibia del cordero. Confluencia del cartílago de crecimiento y articular con la inserción perióstica (**). (Tricrómico de Masson, × 0,5.)
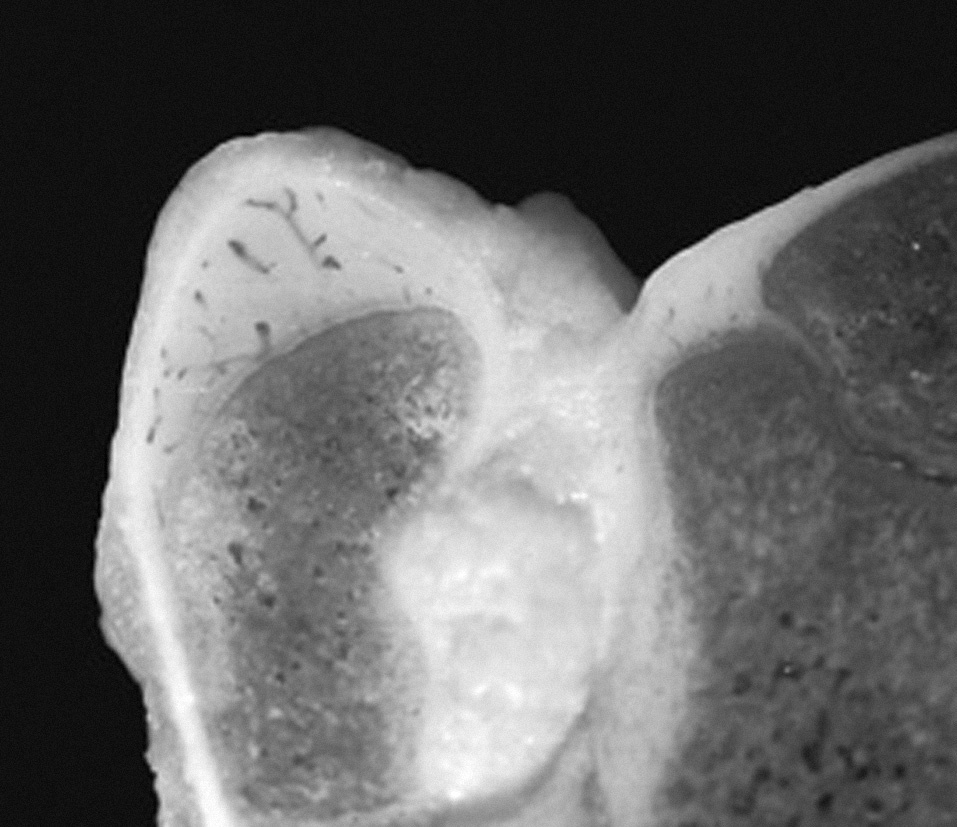
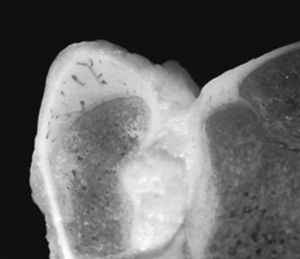
Figura 3. Imagen macroscópica de la unión del cartílago articular, cartílago de crecimiento y cartílago apofisario en la extremidad proxi mal del fémur del cordero de tres meses.
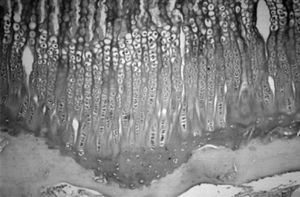
Microscópicamente, en el cartílago de crecimiento se distinguen cuatro capas, la zona de reserva, la zona proliferativa o en pila de monedas, la zona hipertrófica y la metafisaria. Funcionalmente, se consideran: 1) la zona germinativa, 2) la zona proliferativa con dos capas bien delimitadas, la superior y la baja, 3) la zona hipertrófica que en sus cuatro quintas partes superiores constituye la matriz no mineralizada y la parte inferior restante la matriz mineralizada, y 4) la metáfisis. Estas dos últimas, la zona de matriz mineralizada y la metáfisis constituyen la zona de calcificación provisional 19 . Robertson 20 distingue en la zona hipertrófica tres partes: una zona de maduración, otra de degeneración y la última de calcificacion provisional (fig. 4).
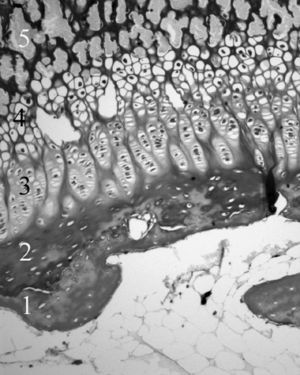
Por su parte, Jee 21 y Quacci et al 22 consideran en el cartílago de crecimiento seis capas (reserva, proliferativa, de maduración, hipertrófica, degenerativa y de calcificación) que tienen una traducción funcional. Las tres capas cercanas a la epífisis se encargarían de la proliferación de células cartilaginosas, mientras que las tres más próximas a la metáfisis están destinadas a la mineralización de la matriz pericelular 23 (fig. 5).
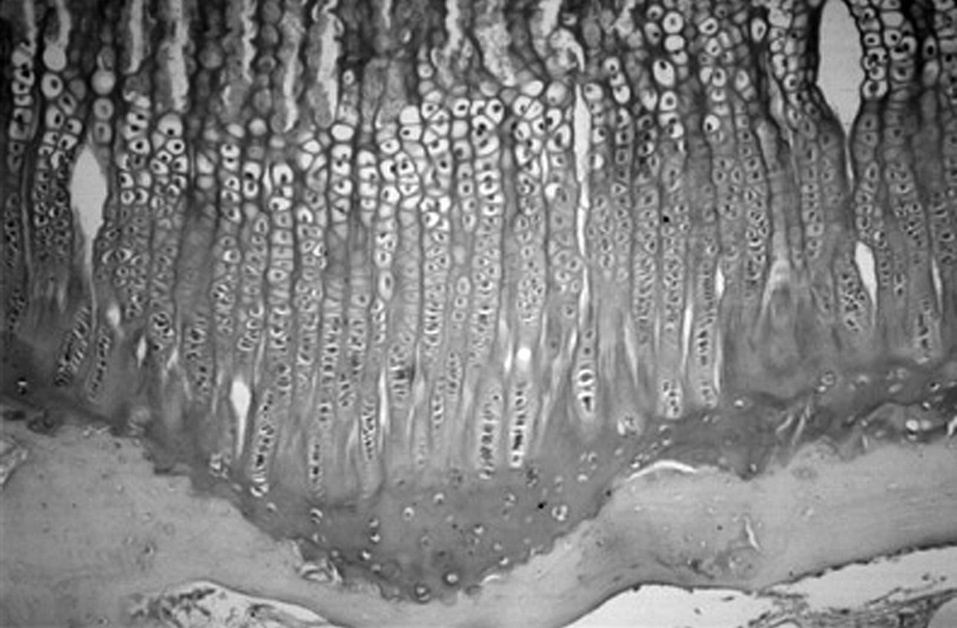
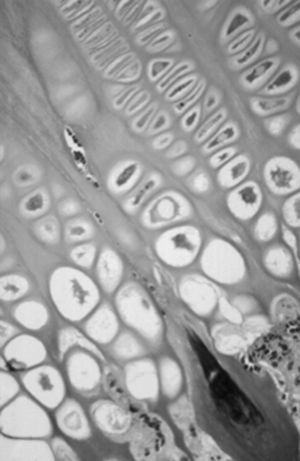
Figura 4. Cartílago de crecimiento proximal de la tibia en el cordero de tres meses. (Azul Alcián PAS, × 10.)
Figura 5. Cartílago de crecimiento proximal de la tibia. 1: Cartílago calcificado epifisario; 2: capa germinativa; 3: capa proliferativa; 4: capa hipertrófica; 5: metáfisis. (Tricrómico de Masson, × 20.)
El crecimiento en longitud de los huesos largos y la altura de las vértebras se debe a la proliferación de los condrocitos de la fisis, en la dirección del crecimiento, y a la síntesis de matriz que eventualmente se calcifica 24 , además del grosor de la zona de crecimiento y del tamaño de las células cartilaginosas hipertrofiadas 25 .
La proliferación y la hipertrofia son necesarias para conseguir el crecimiento longitudinal de un hueso. La proliferación inicia el crecimiento longitudinal y produce suficientes células que llegan a la hipertrofia, mientras que el gran aumento en el diámetro celular, por la maduración y la hipertrofia, contribuyen sustancialmente al crecimiento óseo. Durante la diferenciación, los condrocitos aumentan su volumen intracelular, entre 5 y 10 veces, como señal de una gran actividad de los orgánulos intracelulares 4 .
La capa más cercana a la epífisis es la capa germinativa
o de soporte y parece la encargada del crecimiento latitudinal. Es un almacén de nutrientes 20 con una estructura que recuerda al cartílago hialino, células pequeñas y redondas o elipsoides de distribución irregular 26,27 que no contribuye al crecimiento longitudinal 3,10,11 , pues los condrocitos no proliferan. Los vasos epifisarios llegan a esta zona atravesando múltiples orificios, sin dar ramificaciones, y las fibras de colágeno tipo II actúan como una barrera frente al núcleo secundario de osificación de la epífisis.
La capa proliferativa está formada por condrocitos dispuestos en columnas paralelas al eje longitudinal del hueso, separadas entre sí por septos de colágeno II, ocupando casi la mitad de su longitud. El número de células de cada columna oscila entre 10 y 20 según el momento mitótico 26 . Los condrocitos sólo se dividen en esta zona del cartílago de crecimiento y su alto grado de división hace que las células sean aplanadas y ligeramente irregulares en su forma. La capa proliferativa tiene un alto contenido de oxígeno, con almacenamiento de glicógeno y elevada producción de adenosina trifosfato (ATP) mitocondrial 10 .
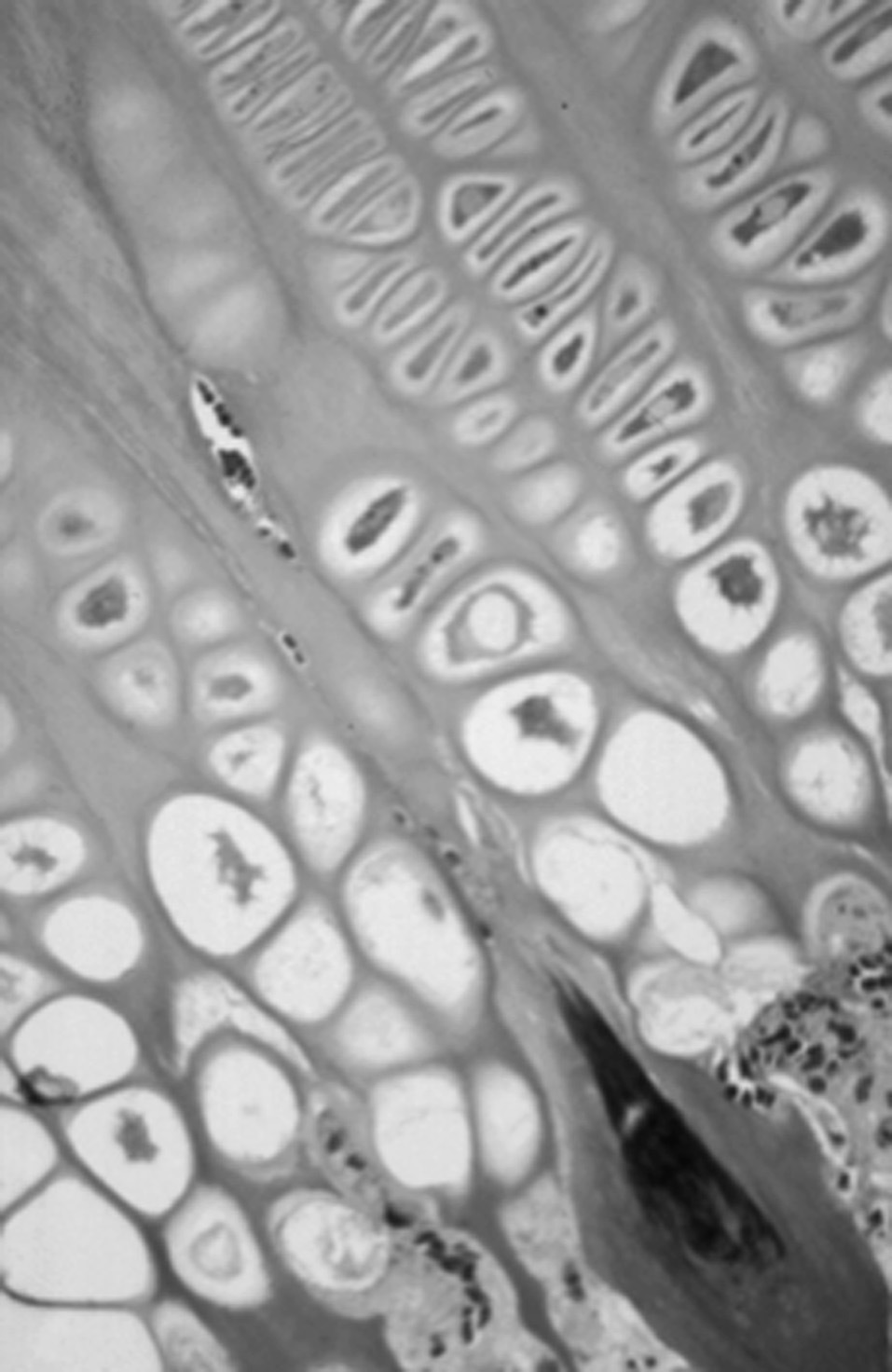
La función de la capa hipertrófica es preparar la matriz para su mineralización 10,11 . Los condrocitos hipertróficos, al aumentar su tamaño, son el motor que consigue el crecimiento óseo 28 . Además, dirigen la mineralización de la matriz adyacente, atraen vasos al producir factores de crecimiento vasculares y condroclastos, células de la línea macrofágica que digieren la matriz (figs. 6 y 7).
Las células hipertróficas cercanas a las células pericondriales atraen a los osteoblastos que secretan una matriz característica. Siguiendo la secuencia fisaria, las células de la capa hipertrófica tienen una tensión de oxígeno baja, niveles de glicógeno bajos hasta llegar a la depleción y no hay formación de ATP mitocondrial 3 . Los condrocitos hipertróficos van hacia la apoptosis, y la matriz cartilaginosa deja un entramado para la invasión vascular con la llegada de los osteoblastos, formando una matriz ósea que se conoce como esponjosa primaria.
Figura 6. Cartílago de crecimiento. Penetración vascular (*) en la ca pa hipertrófica (Tricrómico Masson, × 10.)
Figura 7. Corte semifino del cartílago de crecimiento. Penetración vascular en los septos de la capa hipertrófica.
Las enzimas que inician la apoptosis son las caspasas 29 . El PTHrP es un potente inhibidor de la apoptosis, mientras que los glucocorticoides y la radiación sobre el esqueleto en crecimiento estimulan la apoptosis 30,31 .
El número de condrocitos hipertróficos se ha considerado la causa de la velocidad de crecimiento que se explica, en parte, por los diferentes grados de hipertrofia 32 y por la síntesis de la matriz y del índice de proliferación. Los condrocitos en la fisis de los huesos de crecimiento rápido, como el fémur, aumentan más en tamaño que los de los huesos de crecimiento lento, como el radio 15,32 .
Las células hipertróficas distales, incluidas entre el colágeno tipo X y otras macromoléculas de la matriz, como la fibronectina, la fosfatasa alcalina, la colagenasa y la condrocalcina en altas concentraciones, son viables con un metabolismo muy activo 15 para intervenir en la osificación endocondral, preparando la matriz para la calcificación y la vascularización.
La mineralización del cartílago se produce, primero, en la matriz localizada entre las distintas columnas de condrocitos hipertróficos, no entre los condrocitos hipertróficos de una misma columna. Las vesículas de la matriz, en la zona hipertrófica del cartílago de crecimiento, son el punto de inicio de la mineralización, acumulando calcio, y contienen enzimas, fosfatasa alcalina y metaloproteinasas (MMP), la MMP-13 o MMP-3 4 .
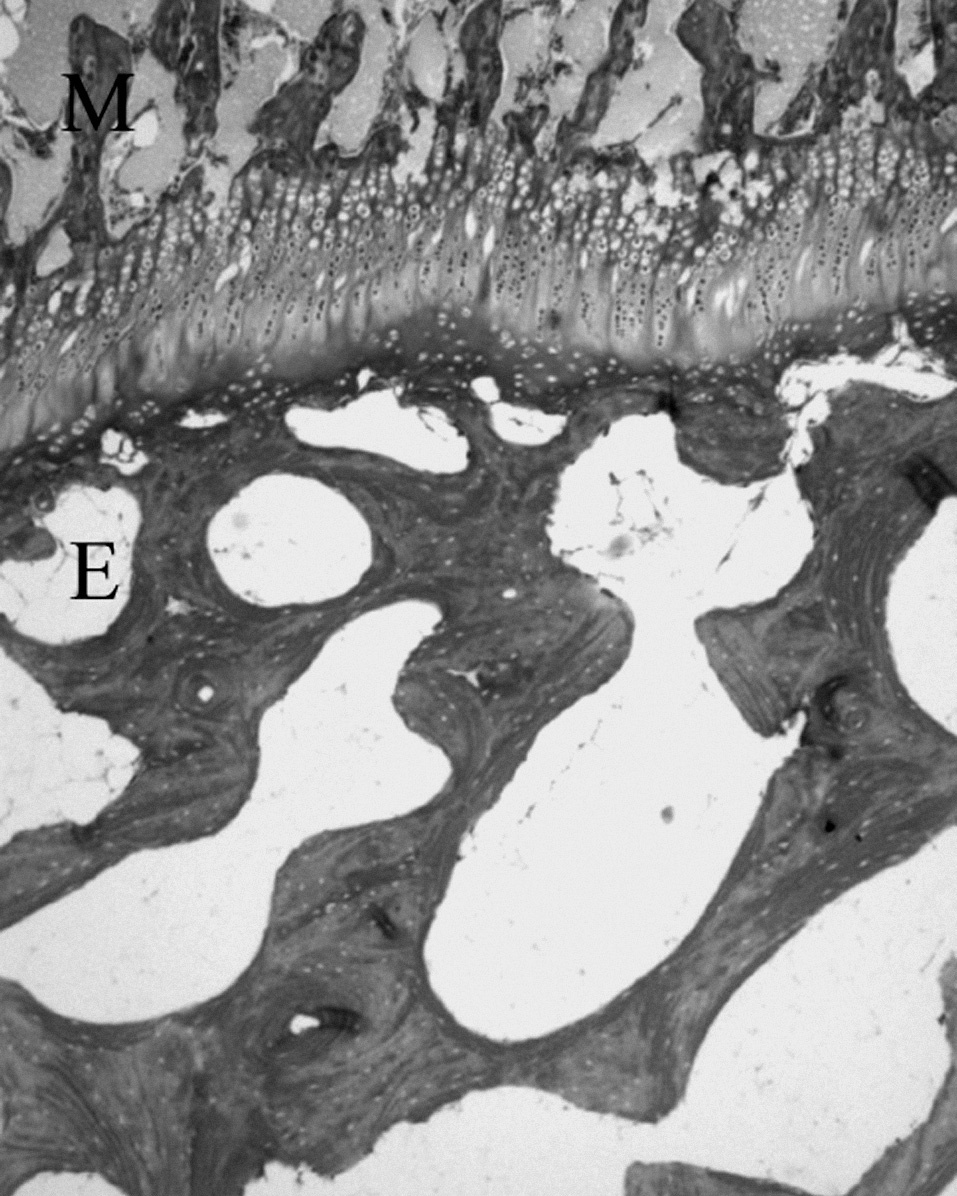
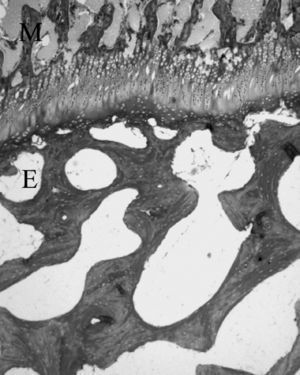
LA METÁFISISLa metáfisis es parte del cartílago de crecimiento, pues en los estadios más tempranos de su formación está íntimamente unida al proceso de osificación encondral. Por la porción metafisaria del cartílago de crecimiento penetran células y capilares aprovechando los espacios que dejan los condrocitos hipertróficos 26,33 , constituyendo «la zona dege-nerativa-osteogénica de la fisis» 34 (fig. 8).
Los capilares metafisarios están desprovistos de membrana basal y las células endoteliales están débilmente unidas entre sí, dejando grandes poros que permiten la extravasación de plasma y de otros elementos celulares sanguíneos. Los osteoblastos que acompañan a los vasos se adosan en una capa mononuclear sobre los restos de los septos longitudinales calcificados, recubriéndolos de tejido osteoide para formar la esponjosa 8 .
Figura 8. Cartílago de crecimiento del cordero entre las trabéculas óseas epifisarias (E) y metafisarias (M). (Tricrómico de Masson, × 4.)
EL ANILLO PERICONDRAL
El nódulo de Ranvier o anillo pericondral de Lacroix 35 se dispone en la periferia del cartílago de crecimiento como una estructura celular diferenciada, con fibras dispuestas en tres direcciones, verticales, circunferenciales y oblicuas. Forma un surco circunferencial en la periferia de la fisis, donde confluye el propio cartílago de crecimiento, con el periostio diafisario y el cartílago articular.
Shapiro et al 36 distinguen tres capas en el surco de osificación, una capa externa formada por fibroblastos y fibras de colágeno, continuación de las capas fibrosas del periostio y pericondrio, una capa media constituida por células conjuntivas poco diferenciadas y otra interna, constituida por un grupo de células densamente ordenadas que maduran progresivamente a osteoblastos.
Su función es organizar el crecimiento latitudinal del cartílago de crecimiento 3,10,11,35,36 , aunque también es un elemento de contención y soporte 10,11,36 , aunque el aumento del diámetro transversal fisario puede producirse por el crecimiento intersticial en la capa de reserva 37 o por el crecimiento aposicional desde el pericondrio 35,36 .
VASCULARIZACIÓN DEL CARTÍLAGO DE CRECIMIENTO
El cartílago de crecimiento es una estructura avascular, cuyas células se nutren por difusión desde las arcadas vasculares localizadas en la metáfisis 4 . Cada uno de los componentes del cartílago de crecimiento tiene su propio sistema de nutrición, aunque no se han descrito anostomosis vasculares, a través del cartílago de crecimiento, entre los vasos epifisarios y metafisarios 3,10,11,26,38 , siendo las arterias pericondrales la única conexión entre ambos sistemas 10 .
La presencia de vasos entre la metáfisis y la epífisis da lugar a la formación de puentes óseos en el cartílago de cre-cimiento 36,38-42 .
La capa proliferativa se nutre por la arteria epifisaria, dando pequeñas ramas que atraviesan la capa de reserva para terminar en la capa proliferativa 3,26,43 .
La parte central de la metáfisis se nutre con ramas de la arteria nutricia, mientras que la periferia lo hace con las arterias metafisarias y periósticas 3,26,39 . Tampoco las arterias metafisarias llegan a la capa proliferativa 3,26,39,42,43 .
Las consecuencias que tienen las lesiones vasculares sobre el crecimiento dependen de la localización y de la extensión del daño vascular 39,44-50 . Si se daña la vascularización epifisaria se produce una necrosis avascular, con el cese del crecimiento y osificación del cartílago de crecimien- 39,44,45 , mientras que los defectos periféricos producen la invasión vascular y la formación de puentes óseos fisarios 45-50 .
Es conocido que la interrupción del aporte vascular metafisario aumenta la altura del cartílago de crecimiento 39,40 , con acumulación de condrocitos en la porción inferior de la capa hipertrófica, al cesar la calcificación de la matriz y la degeneración celular 38,39,45,50,51 . Esto explica que el implante de materiales en el canal medular estimule el crecimiento óseo 42,51,52 . Sin embargo, Tomita et al 53 , tras interrumpir la circulación metafisaria, observaron una inhibición del crecimiento óseo y un cierre fisario prematuro, sugiriendo que lo vasos epifisarios nutren el cartílago de crecimiento parcialmente si no existe circulación colateral, además de una ausencia de calcio en los condrocitos hipertróficos y una inhibición de la reabsorción 54 .
En resumen, la lesión de la vascularización epifisaria provoca el cierre fisario y la detención del crecimiento, mientras que la lesión de los vasos metafisarios causa una estimulación transitoria del crecimiento que una vez restituida reanuda el crecimiento.
INERVACIÓN DEL CARTÍLAGO DE CRECIMIENTOLa influencia del sistema nervioso sobre el cartílago de crecimiento es indirecta, actuando sobre los vasos y los músculos, dando lugar a un déficit de la vascularización con la consiguiente hipoxia que afecta a la osteogénesis y a la condrogénesis.
El hueso y el periostio están inervados por fibras nerviosas simpáticas y sensitivas 55-57 que regulan el flujo vascular, perióstico y medular sobre las células óseas. El CGRP (calcitonin gene-related peptide) y la sustancia P, descritas en el periostio, alrededor de las arterias y venas medulares, y en las uniones hueso-cartílago fisarios, son va-sodilatadores 57,58 .
Varios trabajos han denervado los huesos de las patas posteriores de conejos, ratas y corderos seccionando el nervio ciático 58-60 , aunque los trabajos de Hukkanen et al 61 han demostrado que el nervio femoral y el nervio obturador también inervan la rodilla, por lo que la sección aislada del nervio ciático no resulta un modelo fiable.
La denervación de la extremidad tiene efectos sobre el cartílago de crecimiento, disminuye la proliferación condrocítica 60 , mediada por las fibras nerviosas y los neuropéptidos 62 , retrasa la maduración de los condrocitos hipertrófi- 60,63 , inhibe la actividad osteoclástica 62 y provoca un déficit vascular, desapareciendo las fibras nerviosas con inmunorreactividad al CGRP y la sustancia P 64 .
CONTROL SISTÉMICO DEL CRECIMIENTO ÓSEOEl crecimiento óseo requiere una actividad anabólica intensa basada, fundamentalmente, en la síntesis proteica. Cualquier tipo de trastorno nutritivo o metabólico que afecte a la multiplicación y diferenciación celular, la síntesis de colágeno y la formación de mucopolisacáridos puede alterar el crecimiento óseo. Una alimentación inadecuada durante la primera infancia y, en especial, durante los primeros meses de vida, produce una alteración irreversible en los patrones de crecimiento.
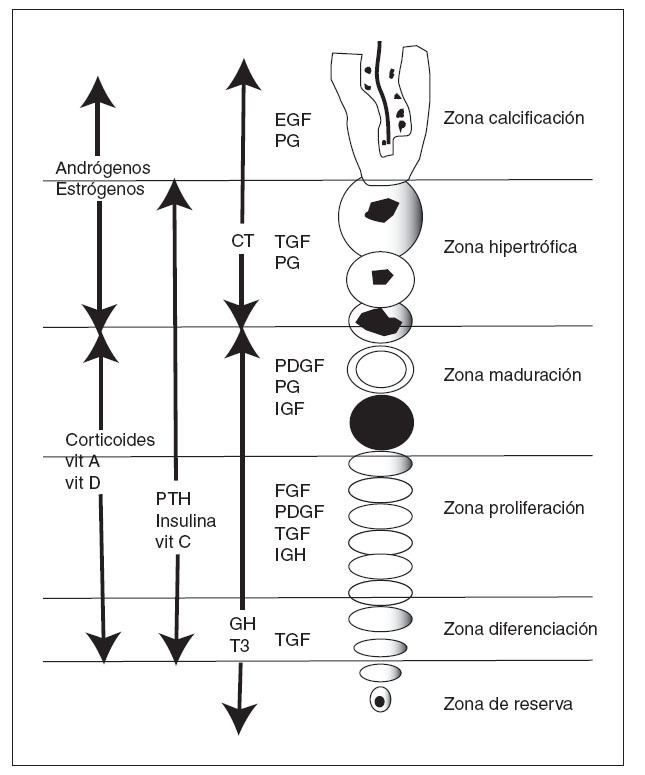
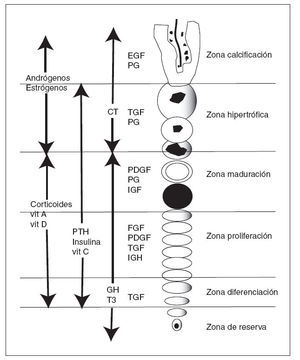
Los factores locales están unidos a factores sistémicos, como la hormona de crecimiento, la hormona tiroidea, las hormonas gonadales, estrógenos y andrógenos, la vitamina D y los glucocorticoides 28 (tabla 1 y fig. 9).
La vitamina D es esencial para la mineralización del osteoide y tiene una influencia directa sobre la fisis, aunque los condrocitos y los osteoblastos producen 1,25(OH)2D3 y 24,25(OH)2D3, que producen esteroides locales que actúan como reguladores autocrinos de los fenómenos que ocurren en la matriz 65,66 . La vitamina D aumenta la actividad de la fosfatasa alcalina y de las MMP, aunque muchos de los efectos de la vitamina D sobre el cartílago de crecimiento son secundarios a los efectos hormonales y metabólicos. Las alteraciones de la calcificación en fisis raquíticas disminuyen progresivamente con el tratamiento de vitamina D, mientras que las células de cartílago y la matriz recobran sus características normales. Se desconoce si la acción de la vitamina D es por un efecto indirecto, aumenta la calcificación, o una acción directa sobre el metabolismo de los condrocitos y de la matriz cartilaginosa 67 . Amento et al 68 vieron que la vitamina D estimula los monocitos y produce interleucina 1 (IL-1) que aumenta la actividad enzimática de los condrocitos para degradar la matriz.
Los condrocitos y los osteoblastos producen esteroides locales que funcionan como reguladores autocrinos de los eventos de la matriz, incluyendo la actividad de las enzimas de las vesículas de la matriz y las proteínas de la matriz durante el crecimiento longitudinal, la calcificación y la activación de los factores de crecimiento. Por otra parte, también los efectos de un andrógeno, como la dihidrotestosterona, y del 1,25(OH)2D3 están mediados localmente por la síntesis del factor de crecimiento similar a la insulia 1 (IGF-1) 69 .
Tabla 1. Factores que intervienen en el control sistémico y local del cartílago de crecimiento
Figura 9. Actuación de factores locales y sistémicos sobre las diferen tes zonas del cartílago de crecimiento. CT: calcitonina; EGF: factor de crecimiento epidérmico; FGF: factor de crecimiento de fibroblastos; GH: hormona de crecimiento; IGF: factor de crecimiento similar a in sulina; PDGF: factor de crecimiento derivado de las plaquetas; PG: prostaglandinas; PTH: hormona paratiroidea; T3: tiroxina; TGF: fac tor de crecimiento transformante; Vit: vitamina.
Las hormonas actúan de formas muy diversas sobre el desarrollo esquelético, alteran el grosor de la fisis, la velocidad y la magnitud del crecimiento. Tanto la hormona de crecimiento (GH) como la hormona paratiroidea (PTH) muestran su mayor actividad en la porción más alta de la zona proliferativa 20 . Al extirparse la hipófisis de un animal joven, deja de crecer si no se inyectan extractos hipofisarios, pues las células de la capa de proliferación dejan de dividirse. Sin embargo, la calcificación prosigue y la zona metafisaria continúa osificándose al mismo tiempo que disminuyen las trabéculas y la fisis se convierte en un disco cartilaginoso delgado 8 .
La GH afecta directamente a las células de las zona de reserva que inducen a la división celular y ensanchan la fisis. Es necesario el funcionamiento de la interacción de la GH con el IGF-1. Los nacidos con una deficiencia en la GH presentan crecimiento dentro de los rangos normales, lo que sugiere que otras hormonas controlan el crecimiento durante la gestación 70,71 . En ausencia de GH, las hormonas sexuales, la leptina y la insulina activan el sistema IGF fisario que estimula el crecimiento 72 .
En los niños hipotiroideos el crecimiento es defectuoso, mientras que los hipertiroideos presentan un crecimiento esquelético acelerado. La falta de tiroxina produce una pérdida de integridad del cartílago, erosión y aumento de la vascularización de la condroepífisis, con una distribución anormal de los glicosaminoglicanos de la matriz extracelular y disminución de la anchura fisaria que afecta la zona de hipertrofia. La acción de esta hormona es sinérgica con la GH. La tiroxina induce la síntesis de colágeno X in vitro, por medio de la inducción de proteínas morfogénicas (BMP-2), un efecto que se puede inhibir añadiendo noggina, un antagonista de la BMP 70,71 .
Las hormonas sexuales, andrógenos y estrógenos, aumentan la vascularización durante un corto espacio de tiempo, que puede ser el responsable de la aposición de hueso nuevo y de la invasión acelerada del cartílago de crecimiento desde la metáfisis produciendo su adelgazamiento y cierre. La testosterona inhibe la GH, reduciendo la actividad de los segmentos germinal y proliferativo 73 .
La función de los estrógenos tiene lugar gracias a los dos receptores estrogénicos, a y b, presentes en los condrocitos de la fisis. Los estrógenos inhiben el crecimiento longitudinal, disminuyendo la proliferación de los condrocitos y reduciendo la altura del cartílago de crecimiento y, secundariamente, estimulando la invasión vascular. Los estrógenos llevan la proliferación de los condrocitos al límite, disminuyendo el índice de crecimiento, la proliferación y el número de condrocitos. Los estrógenos no son estimulado-res de la osificación del cartílago de crecimiento. Por el contrario, disminuyen la función de los condrocitos cuando se produce la osificación secundaria 72,73 . El efecto de los andrógenos sobre el cartílago puede ser consecuencia de su transformación por los estrógenos. La testosterona inhibe la GH, inhibiendo a su vez la función de las células germina-les y proliferativas 73 .
Durante el estirón puberal, en la adolescencia, hay una intensa acción del cartílago de crecimiento, marcado por la acción de las hormonas sexuales y el incremento de la GH. La testosterona estimula, inicialmente, la división celular en la fisis 73 . Los estrógenos parecen estimular el crecimiento del tejido óseo diferenciado y pueden frenar el crecimiento cartilaginoso afectando la placa subcondral a cada lado de la fisis.
Aunque es evidente la relación entre crecimiento esquelético y hormonas, desconocemos su mecanismo 74 . Los estrógenos pueden suprimir la actividad del cartílago de crecimiento por un efecto indirecto, por la ausencia de receptores fisarios para derivados moleculares esteroideos o por un efecto directo que aumenta la calcificación de la matriz, un requisito para el cierre fisario. Como efecto adicional se ha considerado un aumento de la rigidez del periostio que disminuye el crecimiento longitudinal 75 . Las hormonas esteroideas regulan las células diana por los mecanismos nucleares tradicionales y por los mecanismos de membrana.
Los glucocorticoides inhiben el desarrollo de niños y jóvenes 76-78 sometidos a tratamiento prolongado 79 . Los cartílagos de crecimiento de conejos tratados con dexametasona muestran canales estrechos y tortuosos que penetran en el cartílago sin presentar capilares 80 . Después del tratamiento con glucocorticoides, las fibras de colágeno tienden a ser menos numerosas y más laxas 79,81 . Estas observaciones coinciden con los trabajos efectuados en embriones de pollo con inhibición de la síntesis de colágeno 82 y disminución de la capa de proliferación, por la inhibición de la síntesis de proteínas 79 .
Los glucocorticoides tienen un efecto catabólico sobre el cartílago de crecimiento pues interfieren con el eje GH-IGF-1, estimulan los osteoclastos y suprimen el reclutamiento osteoblástico, reducen la tensión muscular e inhiben la formación vascular 82 .
FACTORES DE CRECIMIENTO FISARIOSLa regulación del crecimiento longitudinal en la fisis se produce por la interacción de las hormonas sistémicas y los factores de crecimiento locales, llevando a cambios en la expresión génica de los condrocitos fisarios 4 . La diferenciación de las células mesenquimales en condrocitos durante la condrogénesis está regulada por la actividad del factor de transcripción Sox9, necesario para la expresión de muchas proteínas de la matriz, como el colágeno II, IX y XI y el agrecano 4 .
Un elevado número de proteínas han demostrado tener efectos sobre el cartílago de crecimiento, como son las proteínas de la matriz extracelular, las proteínas que regulan los ciclos celulares (ciclinas, Cdks), citocinas (IL-1, IL-6, IL-10), factores de crecimiento (TGF-β, FGF, BMP), vertebrate hedgehog family members (Indian hedgehog), MMP y factores angiogénicos y antiangiogénicos (VEGF, angiopoietin -2, METH-1) 28,83 .
La proliferación de los condrocitos fisarios está controlada por mecanismos primarios que comprenden tres tipos de moléculas sintetizadas por los propios condrocitos: 1) el péptido recombinante de la hormona paratiroidea (PTHrP), 2) Indian hedgehog (Ihh) y 3) los factores transformantes (TGF-b).
Los condrocitos aumentan considerablemente su volumen hasta hipertrofiarse, coincidiendo con la expresión de colágeno tipo X. La mineralización de la matriz cartilaginosa y la invasión vascular introducen precusores de la médula y osteoblastos. Los osteoblastos segregan matriz ósea y proteasas que rompen la matriz de cartílago. El inicio de la proliferación de los condrocitos del cartílago de crecimiento se estimula con el IGF1. La GH aumenta la síntesis local de IGF-1, en las células del cartílago de crecimiento, que lleva a un aumento de la división celular 4 .
Las BMP promueven y controlan la proliferación y diferenciación de las células del esqueleto y se localizan preferentemente en el citoplasma y, ocasionalmente, en la matriz extracelular del cartílago. Se presentan más frecuentemente en los osteoblastos y en los condrocitos maduros e hipertróficos que en las células perivasculares 84 . Se ha sugerido que la BMP-2 induce localmente la condrogénesis y regula la apoptosis durante el desarrollo esquelético 85 .
Las señales de BMP inducen la expresión de Ihh por los condrocitos prehipertróficos y aumentan tanto la proliferación de los condrocitos como la longitud de las columnas proliferativas. Las BMP y el factor de crecimiento fibroblástico (FGF) tienen efectos antagónicos 28 .
El Ihh es un regulador del desarrollo óseo que coordina la proliferación y diferenciación de condrocitos y osteoblastos. En el desarrollo endocondral, el Ihh es sintetizado por los condrocitos de la capa proliferativa e hipertróficos iniciales, y las interacciones con la PTHrP son fundamentales para determinar la longitud de la columnas proliferativas en cada hueso y en cada individuo 28 .
El VEGF es el factor responsable y necesario para el crecimiento vascular en el cartílago de crecimiento. La ausencia de esta proteína produce importantes alteraciones en la arquitectura de la fisis, afectando al crecimiento longitudinal del hueso. Por el contrario, la invasión de los capilares metafisarios regula la morfogénesis del cartílago de crecimiento y remodela el cartílago 28 . La invasión vascular del cartílago de crecimiento se correlaciona con la expresión, en los condrocitos hipertróficos, de VEGF 86,87 .
La fibronectina (FN) es un factor de unión célula (célula a célula) matriz extracelular que participa en la organización de la matriz 88 . Por su parte, la laminina es abundante en la zona de reposo y disminuye en la zona proliferativa, esto es interesante para identificar los condrocitos de la zona de reserva y para definir áreas durante la condrogénesis inicial. En la fisis, la distribución homogénea de FN y colágeno II señala una regulación de la diferenciación de los condrocitos desde la zona de reserva a la hipertrófica, aunque la presencia de laminina e integrinas en los condrocitos de la zona de reserva indica que son factores de diferenciación celular.
EFECTO DE LA ACTIVIDAD FÍSICA SOBRE EL CARTÍLAGO DE CRECIMIENTOSi bien los índices de formación y remodelación de hueso están determinados genéticamente, el cartílago de crecimiento es sensible a los cambios de las solicitaciones mecánicas 89 . Las solicitaciones fisiológicas sobre el cartílago de crecimiento son necesarias para alcanzar un correcto desarrollo esquelético.
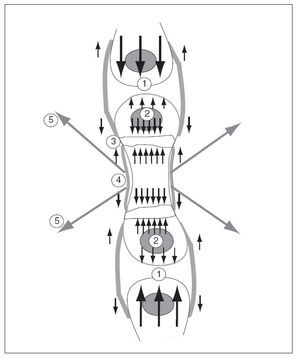
El cartílago de crecimiento está sometido a solicitaciones provocadas por las fuerzas internas y externas. Entre las fuerzas internas hay que considerar el propio crecimiento fisario y el del núcleo de osificación secundario. Al crecer precisan de espacio y chocan con los huesos vecinos. Entre las fuerzas externas hay que considerar el periostio, el nódulo de Ranvier y los músculos, que crecen y se contraen, con sus tendones que se insertan en el hueso 46 (fig. 10).
Dentro de los baremos biológicos, el aumento de la tensión o de la compresión acelera el crecimiento, mientras que por debajo de los límites fisiológicos el crecimiento puede verse disminuido o incluso detenido. Estos principios son conocidos como ley de Hueter-Volkmann, propuesta inicialmente por Delpech 90 , que señala la relación inversa entre las solicitaciones a compresión paralelas al eje longitudinal del cartílago epifisario y el índice de crecimiento epifisario 46 . Simon y Papiersky 91 vieron en la fisis de ratas bípedas, normales e hipofisectomizadas, que el aumento de fuerzas a compresión intermitentes prolonga el crecimiento del cartílago fisario y que el estímulo mecánico puede ser un mecanismo que ayude el crecimiento óseo. Stokes et al 92 , estudiando las influencias mecánicas en la cola de la rata, vieron que las variaciones mecánicas actúan sobre la velocidad de crecimiento de la fisis de los vertebrados, modificando la altura de los condrocitos hipertróficos, siendo los efectos de la compresión mayores que los conseguidos con la distracción.
Según Henderson y Carter 83 el propio crecimiento genera deformaciones y presiones en el esqueleto en desarrollo, que influyen sobre la morfogénesis por uno o varios de los cuatro patrones siguientes: modulando la velocidad de crecimiento, modulando la diferenciación de los tejidos, influyendo en la dirección del crecimiento o deformando los tejidos.
EFECTOS DE LA COMPRESIÓN SOBRE EL CARTÍLAGO DE CRECIMIENTOLa compresión produce una reducción de la zona proliferativa y un aumento de la zona hipertrófica con una desorganización progresiva de las capas y de las columnas de condrocitos 9,41,93-95 .
Es conocido en clínica el estrechamiento radiológico de la fisis al comprimir con un mecanismo, grapas o fijadores externos, sobre el cartílago de crecimiento 94 . El crecimiento longitudinal se reanuda si desaparece el agente compresor, siempre y cuando el hueso no haya alcanzado la madurez esquelética, aunque el ritmo y la cantidad del crecimiento posterior son impredecibles 9,93,94 .
Christensen 94 señaló que, tras el grapado, la fisis persiste en su estructura cartilaginosa durante un período de tiempo después de cesar en su crecimiento, sin aparecer puentes óseos hasta 45 días después, aunque la fisis desaparece si la duración de la compresión es larga 9,41,94-97 .
El efecto de las solicitaciones a compresión de baja magnitud sobre la fisis es controvertido y algunos autores no creen que fuerzas pequeñas inhiben el crecimiento, si bien Peruchon et al 98 demostraron que el aumento de la presión disminuía el crecimiento. Con el método de elementos finitos, Lerner et al 99 vieron que las solicitaciones a compresión elevadas están correlacionadas con menores índices de crecimiento.
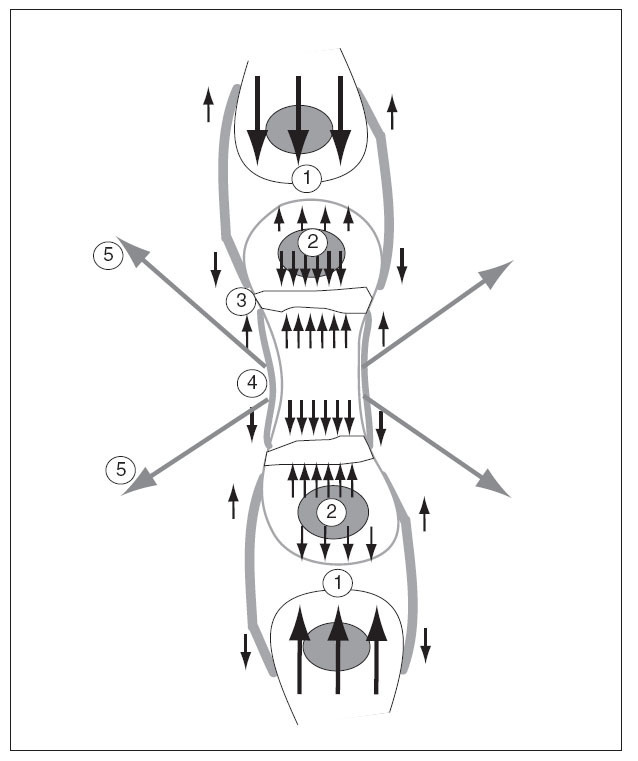
Figura 10. Solicitaciones que actúan sobre el cartílago de crecimiento por las fuerzas intrínsecas y extrínsecas producidas por el crecimiento. 1: Del propio hueso contra los huesos vecinos; 2: del núcleo epifisario; 3: del cartílago de crecimiento; 4: del periostio; 5: por las contracciones de los músculos que se insertan en el hueso.
Hay un efecto compensatorio del crecimiento de un mismo hueso. El cartílago de crecimiento intacto compensa, en parte, el crecimiento óseo 100,101 . Además, cuando hay un defecto mecánico parcial sobre el cartílago de crecimiento, la parte no afectada sigue creciendo, por lo que se produce una desalineación axial. También es conocido 102 que las fracturas de un hueso largo en desarrollo pueden producir un hipercrecimiento del mismo. Al efectuar una elongación en conejos, Lee et al 103 demostraron que una osteotomía sin elongación estimulaba el cartílago de crecimiento. Una elongación del 20% de la longitud del hueso no produjo cambios, mientras que el crecimiento fisario se redujo considerablemente cuando la elongación era superior al 30% y, en la mitad de los casos, se observó un cierre fisario.
EFECTOS DE LA DISTRACCIÓN SOBRE EL CARTÍLAGO DE CRECIMIENTOLa distracción fisaria es una técnica que se ha utilizado en la corrección de las dismetrías y desviaciones angulares de los huesos largos. En modelos animales, la distracción pequeña y a ritmo lento aumenta la longitud del hueso mediante hiperplasia del cartílago de crecimiento, sin producir una epifisiólisis, con un aumento de la actividad celular fi- 101,104,105 . Sin embargo, al efectuar una tensión sobre el cartílago de crecimiento, aunque sea muy pequeña, durante un tiempo lo suficientemente largo, se produce una separación entre la capa hipertrófica y la metáfisis.
El aumento en la altura fisaria originada por la tensión, antes de producirse la epifisiólisis, puede deberse a una afectación de la irrigación metafisaria 60,95,106-109 al acumularse condrocitos en la capa hipertrófica sin aporte vascular y sin la llegada de células óseas por la isquemia metafisaria. Los vasos son elongados y tienen que realizar un mayor recorrido hasta alcanzar la capa hipertrófica del cartílago de crecimiento, disminuyendo su diámetro y el flujo sanguíneo 95 .
Arriola et al 95 encontraron un aumento de la capa hipertrófica, aunque otros autores han descrito también un aumento de la capa proliferativa 104,105 .
La respuesta de la fisis a la distracción se relacionó con un aumento de su anchura por hiperplasia celular 104-113 o, probablemente, por el retraso en la mineralización de los condrocitos hipertróficos que produce una mayor acumulación de los mismos 95 y a una alteración de la calcificación de la matriz.
EFECTOS DE LA DESPERIOSTIZACIÓN SOBRE EL CARTÍLAGO DE CRECIMIENTOEl periostio tiene una función importante en la formación del hueso cortical y en la reparación de las fracturas y está, como hemos visto, fuertemente adherido a los extremos epifisarios del hueso en crecimiento, sobre el nódulo de Ranvier.
Dimitriou et al 114 compararon la sección longitudinal y transversal del periostio viendo que sólo esta última aumenta el crecimiento longitudinal de los huesos largos, apoyando la teoría mecánica de que la disminución de la tensión sobre la fisis tiene un efecto beneficioso en el crecimiento 101 . La sección circunferencial del periostio reduce la fuerza necesaria para producir la epifisiólisis mientras que su sección parcial en la tibia proximal lleva a una deformación en valgo 46 . La excisión de tiras de periostio de 4 mm de grosor, en la región diafisaria media, en ratas de 4 semanas, aumenta el crecimiento en un 1,5% con respecto al lado control. Haasbeck et al 115 señalaron, en dos casos clínicos, deformaciones angulares al tensar el periostio cerca de la fisis.
Tras desperiostizar la diáfisis en ratas, no se vieron diferencias significativas en la estructura fisaria respecto a los grupos control 116 , hecho que no apoya la teoría vascular pues, según Trueta y Morgan 26 , las cuatro quintas partes centrales de la vascularización metafisaria del cartílago de crecimiento provienen de la arteria nutricia, y sólo el margen exterior del cartílago de crecimiento está vascularizado por los vasos provenientes de las arterias periósticas.
En conclusión, el crecimiento óseo precisa de una intensa actividad anabólica que se centra, sobre todo, en la síntesis proteica. Cualquier alteración que afecte la biología celular del cartílago de crecimiento producirá una alteración patológica. Las hormonas actúan según diferentes patrones sobre el desarrollo esquelético, cambiando el grosor de las fisis y el índice y magnitud de su creecimiento, pero también hay factores locales, en y alrededor de las epífisis, que unidos a los factores sistémicos (hormona de crecimiento, hormona tiroidea, estrógenos y andrógenos, glucocorticoides y vitamina D) influyen sobre la función fisaria, sin olvidar que la modificación de la mecánica también modifica la magnitud del crecimiento y su orientación.
Los conocimientos sobre el cartílago de crecimiento han mejorado en los últimos años, especialmente su biología molecular, aunque los conocimientos se basan en trabajos clásicos iniciados en la década de los 50 y 60, del siglo XX. Son pocas las soluciones aportadas a los problemas clínicos del crecimiento y desarrollo óseo, pues en el cartílago de crecimiento son muy difíciles de introducir las nuevas estrategias de la llamada ingeniería de tejidos.
Es necesario establecer la relación entre los factores sistémicos, locales y la influencia de la biomecánica para proponer nuevos tratamientos, si bien las mejores técnicas de imagen ayudan a diagnosticar, prevenir y controlar la patología fisaria de origen congénito, infeccioso, tumoral o traumático.
Correspondencia
F. Forriol.Departamento de Cirugía Ortopédica y Traumatología. Clinica Universitaria. Avda. Pío XII, 32. 31008 Pamplona. Navarra. Correo electrónico: fforriol@unav.es
Recibido: septiembre de 2004. Aceptado: septiembre de 2004.