Los defectos craneales tienen una repercusión importante en el paciente desde un punto de vista estético, psicológico y funcional. Actualmente no existe acuerdo sobre el material ideal para la reconstrucción de estos defectos.
Material y métodosRealizamos un estudio retrospectivo incluyendo a los pacientes con reconstrucción craneal con prótesis de polieteretercetona (PEEK) a medida entre los años 2008 y 2014 en el Servicio de Cirugía Oral y Maxilofacial del Hospital Universitario La Paz, Madrid. Las prótesis son diseñadas de manera específica para cada paciente con el sistema CAD-CAM.
ResultadosSe reconstruyó a un total de 7 pacientes con defectos craneales con prótesis de PEEK. Solo en un caso, la resección y reconstrucción fueron realizadas en el mismo acto quirúrgico. En el resto de los casos se realizó una reconstrucción diferida. Las complicaciones que se presentaron fueron: un seroma y una fístula de LCR, que se resolvieron con tratamiento conservador; y una dehiscencia de la herida y un caso con episodios de infecciones repetidas, cuyo defecto estaba próximo al seno frontal, que terminaron con la retirada definitiva de la prótesis.
ConclusiónEl material ideal para la reconstrucción de defectos craneales no existe. Las prótesis de PEEK están obteniendo buenos resultados estética y funcionalmente. Cuando el hueso autógeno no esté disponible o en determinados casos con defectos grandes, las prótesis de PEEK pueden ser una buena opción. Sin embargo, si el defecto está en comunicación directa con los senos paranasales, debemos valorar bien la indicación.
Cranial defects tend to carry functional and aesthetic consequences for the patient. The most suitable material to be used remains controversial.
MethodsWe report a retrospective review of patients whose cranial defects were reconstructed using a computer designed polyetheretherketone (PEEK)-patient specific implant) between 2008 and 2014 at the Oral and Maxillofacial Surgery Department, in Hospital Universitario La Paz, Madrid. Implants are designed individually to each patient with CAD-CAM system.
ResultsSeven patients underwent cranial reconstruction using a PEEK-patient specific implant. One case involved a one-step primary reconstruction and the rest of cases underwent a delayed reconstruction. Complications were: one seroma and one CSF leak, resolved with conservative treatment, and a wound dehiscence and an infection case whose defect was near the frontal sinus, resolved with removal of the implant.
ConclusionThe ideal material for reconstructing cranial defects does not exist, but PEEK has demonstrated good outcomes. When autologous bone is not available or in selected cases with large defects, PEEK is a good option to reconstruct these defects. However, if the defect is related with paranasal sinuses, indication must be evaluated.
La craneotomía es un procedimiento frecuente en múltiples afecciones, como hemorragias intracraneales, traumatismos craneoencefálicos, tumores o infecciones. La creación de un bolsillo subcutáneo o la crioperservación1 son los métodos más utilizados como almacenamiento del injerto óseo retirado en la craneotomía. La reposición posterior del hueso original es lo ideal, pero esta opción no está siempre disponible, sobre todo si la reconstrucción es diferida. En estos casos, el injerto óseo suele tener una viabilidad comprometida, lo que conlleva un grado de reabsorción impredecible, con irregularidades de contorno y mayor posibilidad de infección y fracaso del injerto2.
El injerto de hueso autógeno se considera el gold standard para reconstruir los defectos craneales, ya que permite una integración biológica completa sin respuesta inmunogénica y sin costes elevados asociados. Sin embargo, no está exento de riesgos, como la infección, la reabsorción ósea o la fragmentación, y además, tiene ciertas limitaciones para cubrir defectos grandes.
Múltiples materiales sintéticos se han propuesto como alternativa, pero ninguno cumple con todos los requisitos para ser el material ideal. Presentamos nuestra experiencia en reconstrucción craneal con prótesis de polieteretercetona (PEEK) diseñadas por ordenador.
Material y métodosRealizamos un estudio retrospectivo incluyendo los pacientes con reconstrucción craneal con prótesis de PEEK a medida entre los años 2008 y 2014 en el Servicio de Cirugía Oral y Maxilofacial del Hospital Universitario La Paz, Madrid. Las prótesis son diseñadas de manera específica para cada paciente con el sistema Computer-Aided Design and Manufacturing. Para ello, es necesaria una TC preoperatoria de alta resolución con cortes de 1,0mm. Las imágenes se envían al proveedor (Synthes Maxillofacial, Oberstdorf, Suiza) y se diseña la prótesis a través de una imagen especular del lado sano. En algunos casos, la resección y la reconstrucción se realizaron al mismo tiempo. En estos casos, el cirujano define los límites de la resección y es posible fabricar una guía de corte intraoperatoria. Un archivo con todos los datos se envía para la aprobación final y, con una máquina de prototipado rápido, se crea el implante específico para el paciente. La prótesis es enviada al hospital y esterilizada antes de la cirugía.
Todos los procedimientos se llevaron a cabo bajo anestesia general. A través de un abordaje coronal se realizó la resección de la lesión en caso de estar planificado previamente, y se colocó la prótesis de PEEK en el defecto craneal. La fijación de las prótesis se realizó con tornillos y miniplacas 2.0 (Synthes Maxillofacial, Oberstdorf, Suiza). Se solicita una TC postoperatoria como prueba de control cuando la enfermedad de base del paciente lo requiere o ante la aparición de complicaciones. Se administran 2g de amoxicilina-ácido clavulánico como profilaxis preoperatoria y 1g intravenoso cada 8h durante una semana tras la cirugía. Además, se administran AINEs durante la primera semana postoperatoria.
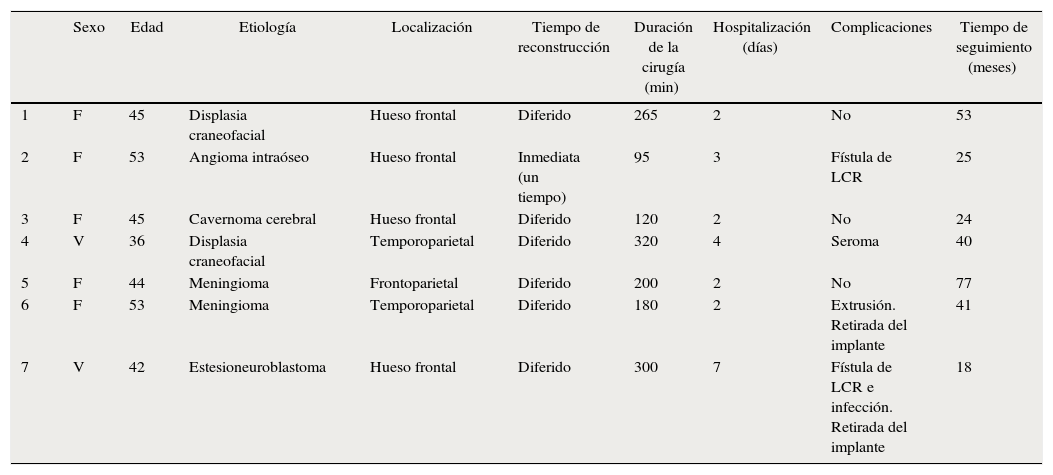
ResultadosSe reconstruyeron un total de 7 pacientes con defectos craneales con prótesis de PEEK (tabla 1). Los defectos fueron secundarios a diferentes tipos de tumores benignos y malignos (5 casos) y por deformidades congénitas (2 casos). Solo en un caso, la resección y la reconstrucción fueron realizadas en el mismo acto quirúrgico. En el resto de los casos se realizó una reconstrucción diferida. La mayoría de estos pacientes tuvieron procesos de reabsorción e infección del hueso autógeno repuesto tras craneotomía, lo que indicó una reconstrucción secundaria.
Datos de los pacientes con las principales variables analizadas
| Sexo | Edad | Etiología | Localización | Tiempo de reconstrucción | Duración de la cirugía (min) | Hospitalización (días) | Complicaciones | Tiempo de seguimiento (meses) | |
|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 45 | Displasia craneofacial | Hueso frontal | Diferido | 265 | 2 | No | 53 |
| 2 | F | 53 | Angioma intraóseo | Hueso frontal | Inmediata (un tiempo) | 95 | 3 | Fístula de LCR | 25 |
| 3 | F | 45 | Cavernoma cerebral | Hueso frontal | Diferido | 120 | 2 | No | 24 |
| 4 | V | 36 | Displasia craneofacial | Temporoparietal | Diferido | 320 | 4 | Seroma | 40 |
| 5 | F | 44 | Meningioma | Frontoparietal | Diferido | 200 | 2 | No | 77 |
| 6 | F | 53 | Meningioma | Temporoparietal | Diferido | 180 | 2 | Extrusión. Retirada del implante | 41 |
| 7 | V | 42 | Estesioneuroblastoma | Hueso frontal | Diferido | 300 | 7 | Fístula de LCR e infección. Retirada del implante | 18 |
El tiempo medio de cirugía fue de 211min (95-320min) y la media de tiempo de hospitalización de 3 días (2-7 días). No fueron necesarios ajustes intraoperatorios de las prótesis.
El tiempo medio de seguimiento es de 39 meses (18-77 meses).
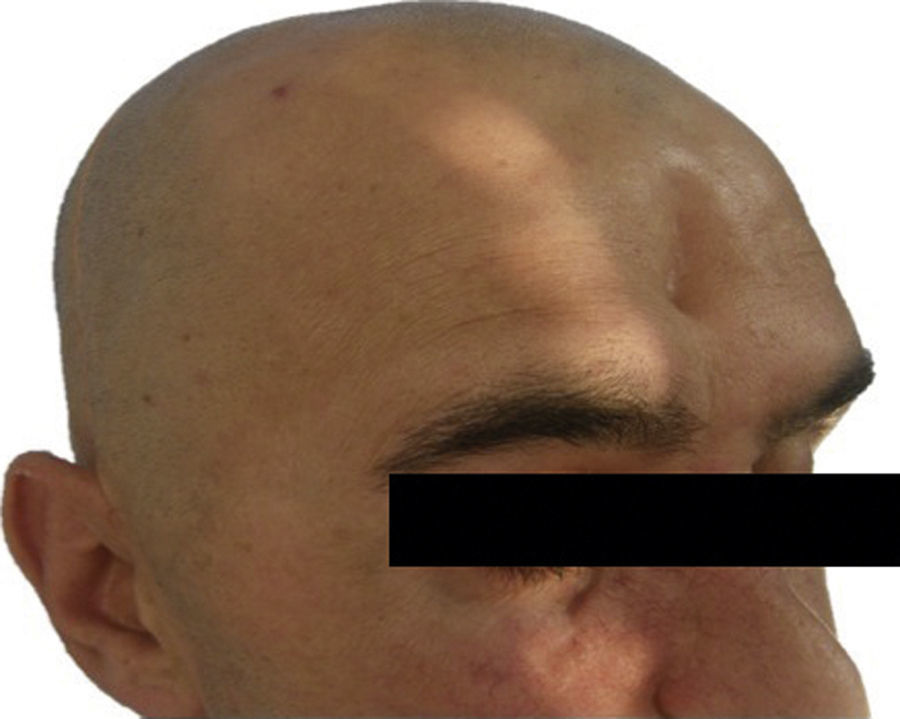
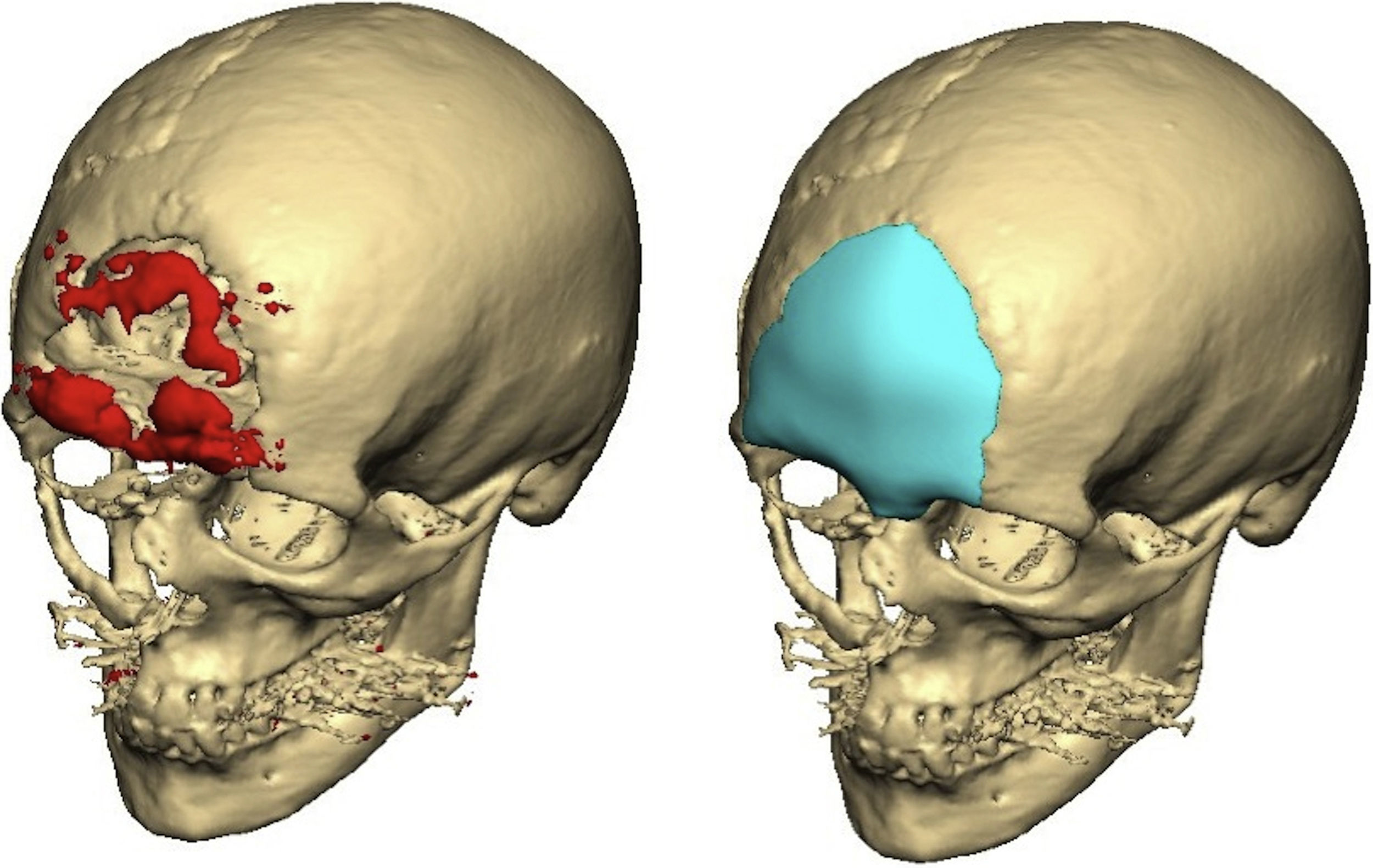
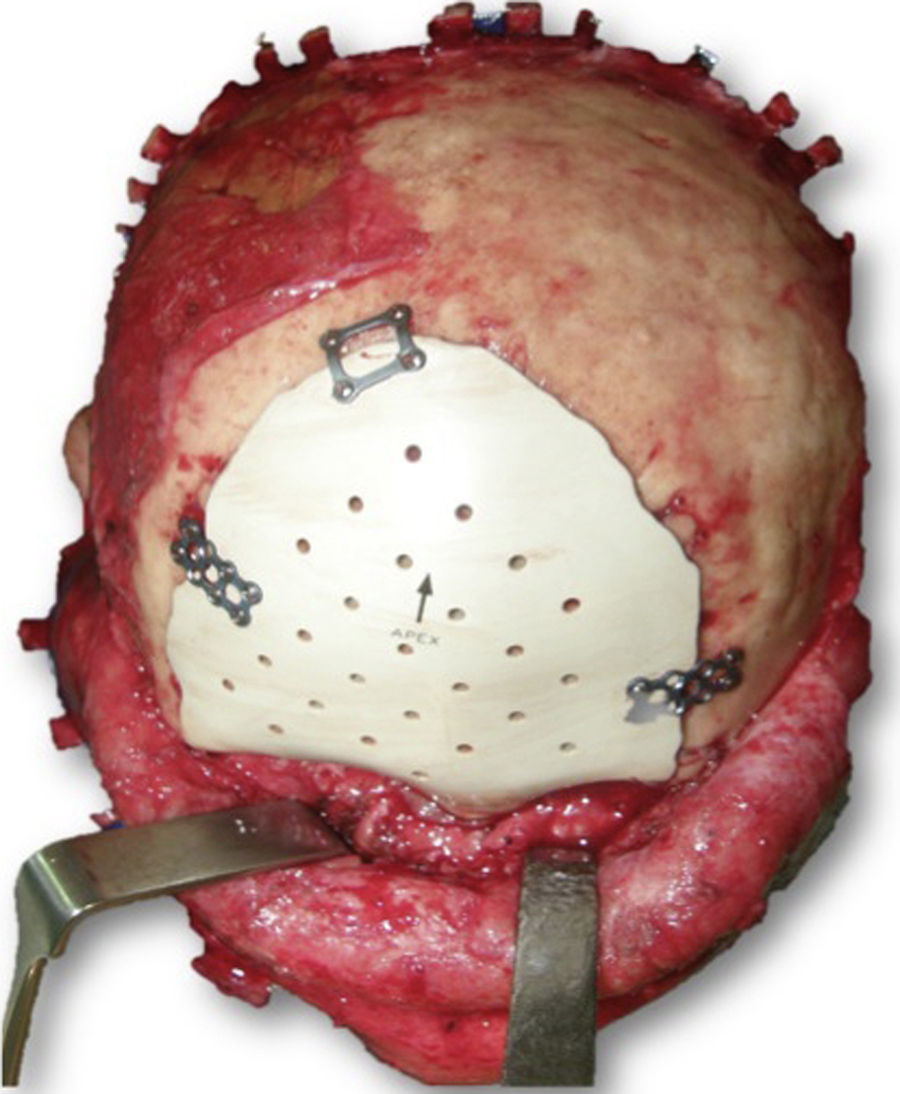
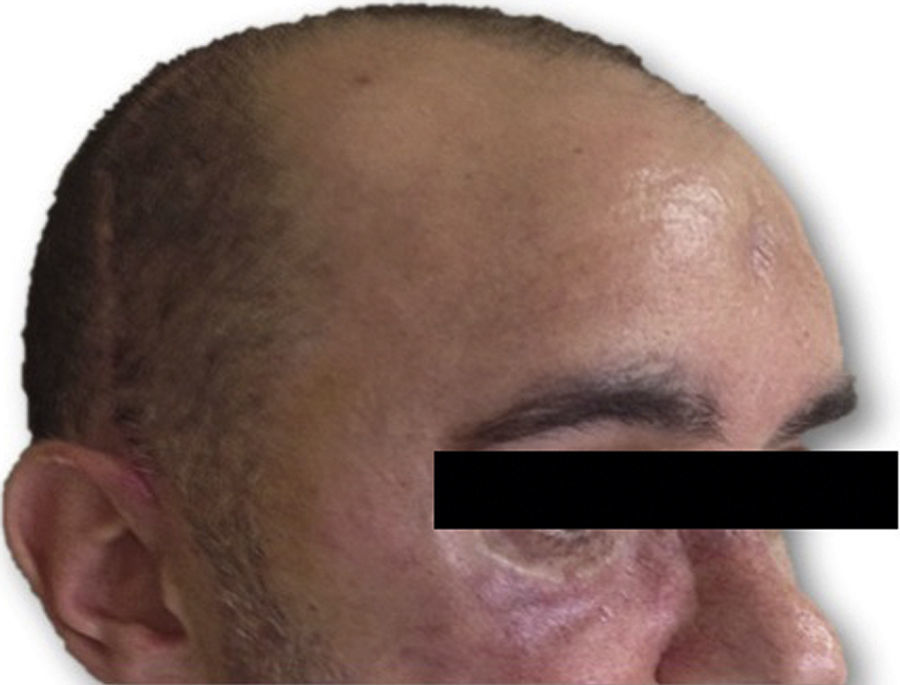
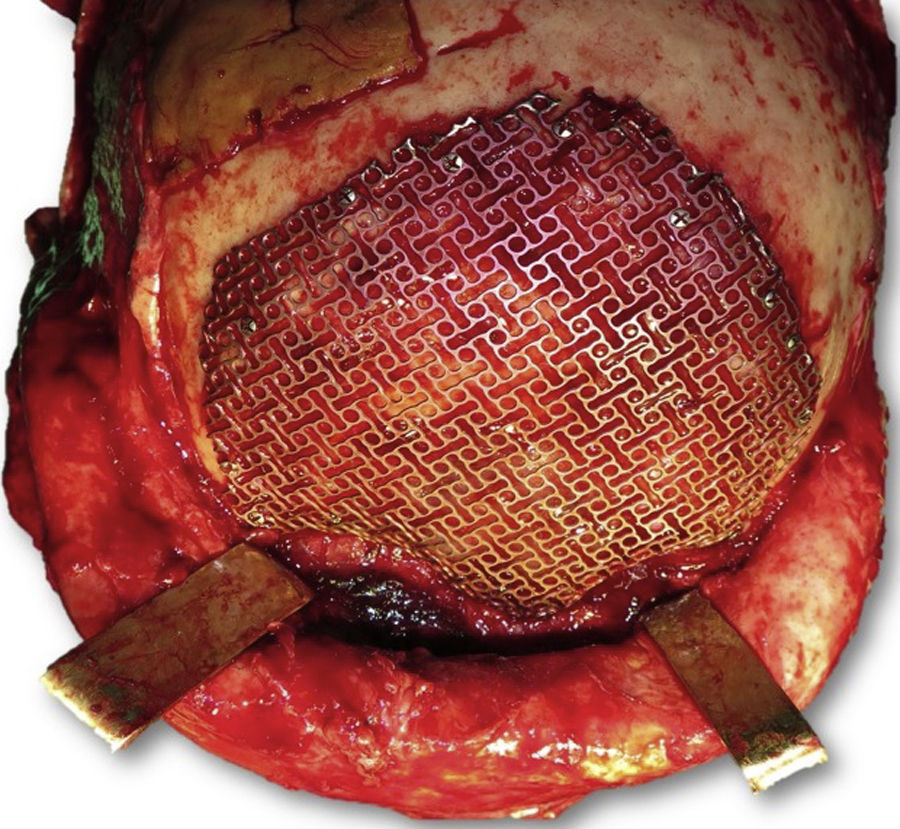
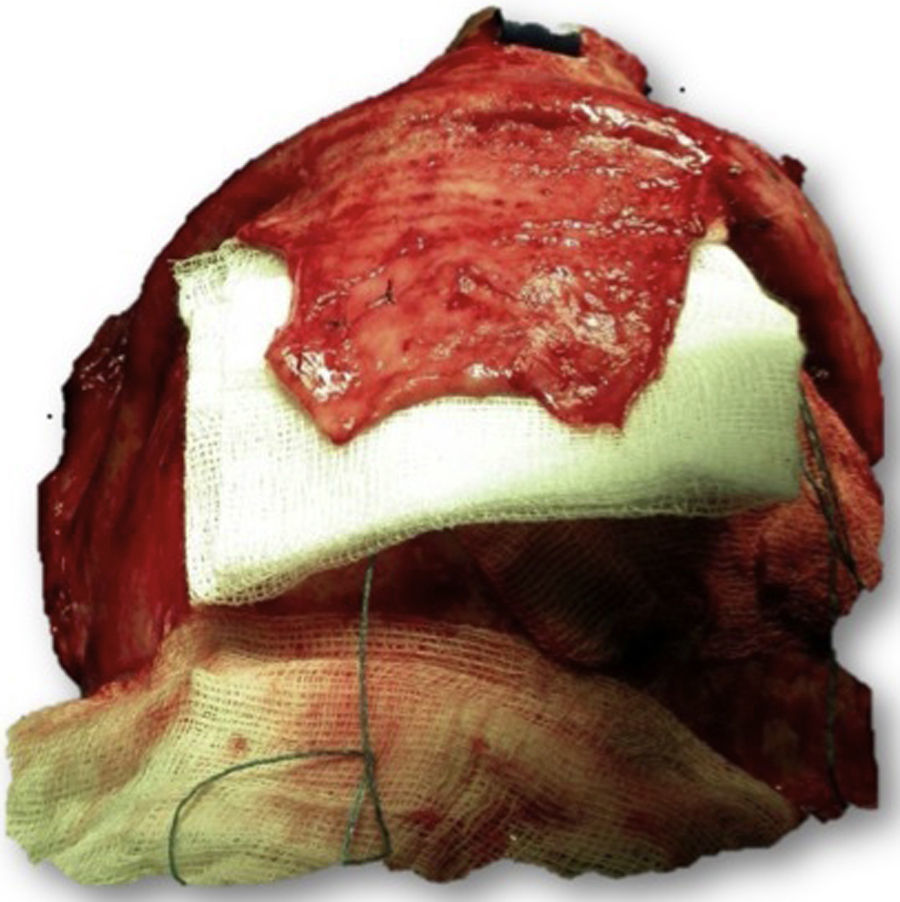
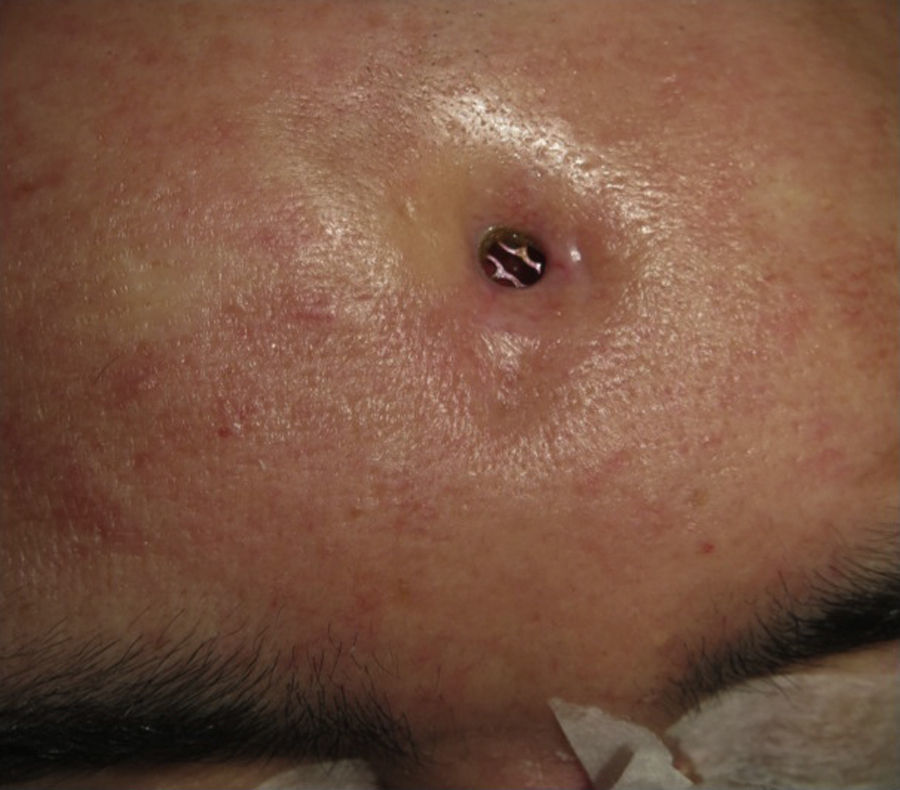
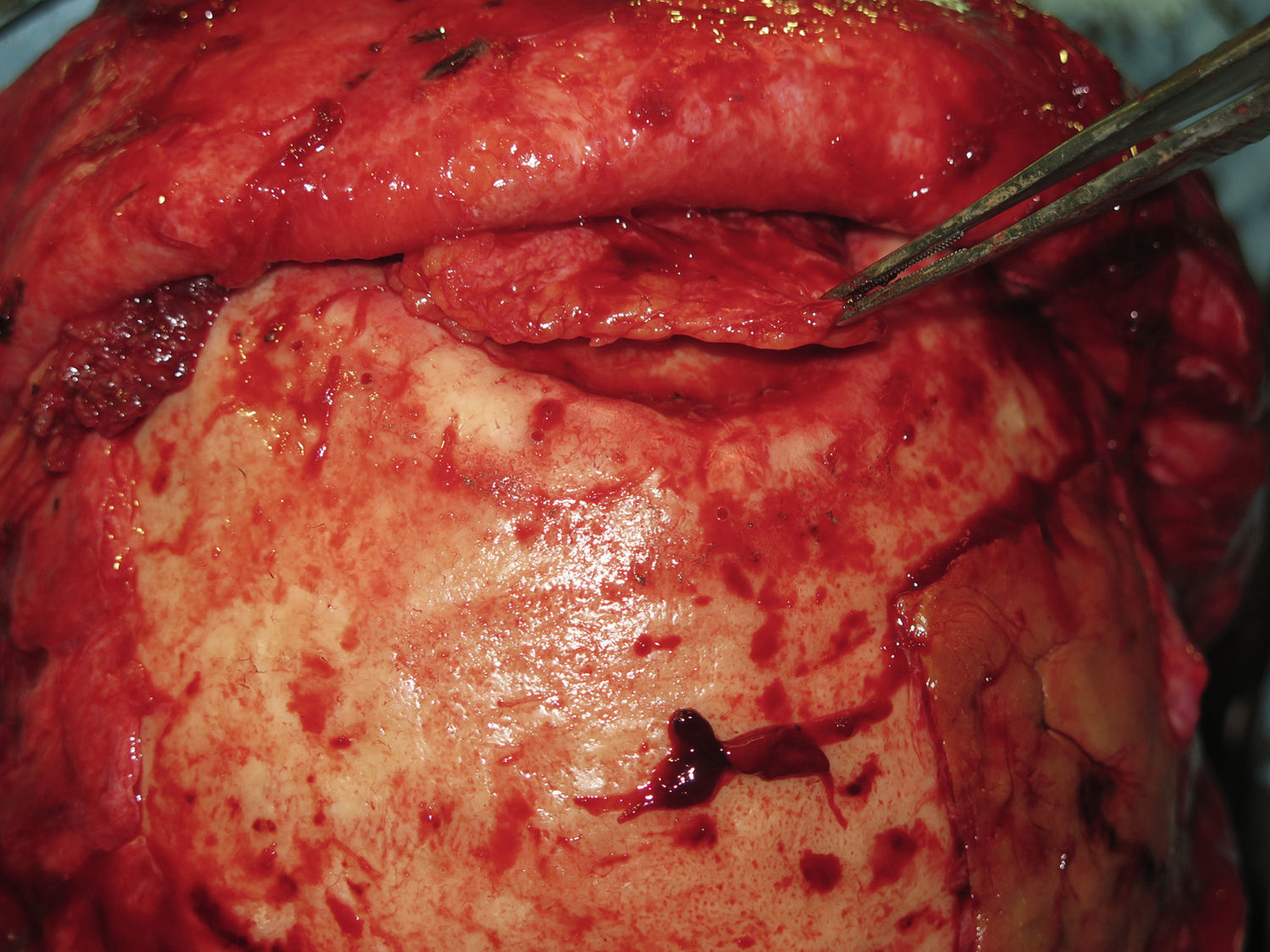
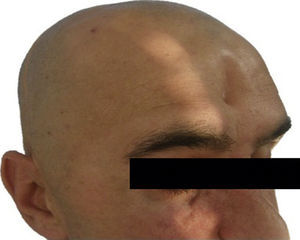
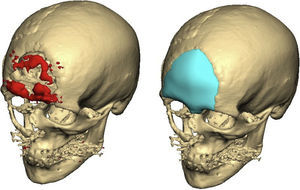
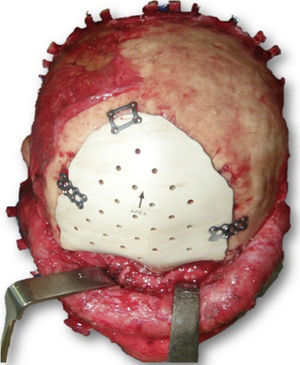
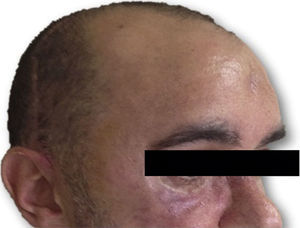
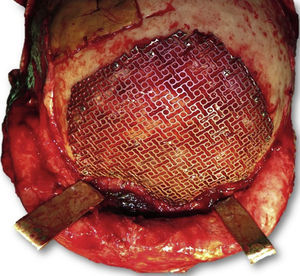
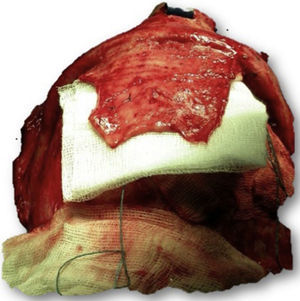
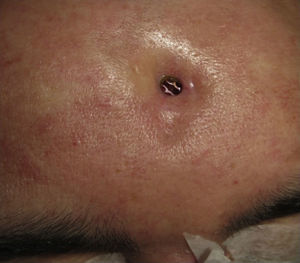
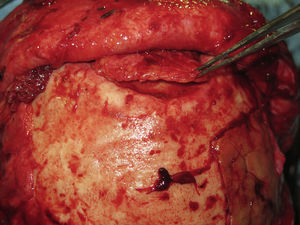
Las complicaciones que se presentaron fueron: un seroma que se resolvió tras drenaje y tratamiento antibiótico; una fístula de LCR que se manejó con tratamiento conservador; y una dehiscencia de herida con exposición de la prótesis, que obligó a la retirada definitiva de la misma. Un caso de reconstrucción diferida de defecto craneal frontal por un estesioneuroblastoma (figs. 1–4) presentó episodios de infecciones repetidas y una fístula de LCR que no mejoraron con drenaje lumbar y tratamiento antibiótico. La prótesis fue retirada y sustituida por una malla de titanio (fig. 5). En la primera cirugía se había utilizado un colgajo de pericráneo para aislar el seno frontal de la prótesis (fig. 6). Y en la segunda cirugía, antes de colocar la malla de titanio, se utilizó un colgajo galeal con el mismo fin. A los 2 meses de la segunda cirugía, el paciente comenzó con la misma clínica, que terminó en una dehiscencia de la herida con exposición de la malla de titanio (fig. 7). En una tercera cirugía se retiró el material sintético y se aisló el seno frontal con un colgajo microvascularizado anterolateral de muslo (fig. 8). Con un mes de seguimiento, el paciente se encuentra asintomático.
No se objetivaron otras complicaciones como fracturas o desplazamientos de los implantes. Los resultados estéticos fueron satisfactorios, con una buena aceptación por parte de los pacientes.
DiscusiónLos defectos craneales tienen una repercusión importante en el paciente, no solo desde un punto de vista estético y psicológico, sino también funcional. Síntomas como cefaleas, mareos, irritabilidad, depresión o intolerancia al ruido y la vibración son comunes en estos pacientes no reconstruidos, debido al efecto de la presión atmosférica sobre el cuero cabelludo y la duramadre, que es lo que se conoce como el «síndrome del trepanado»3,4.
La utilización del hueso autógeno se considera el gold standard, pero también presenta algunas desventajas, como la limitación en cantidad de hueso disponible, la dificultad de remodelación, la morbilidad de la zona donante, la tasa de reabsorción impredecible, o el tiempo quirúrgico que consume. Para defectos pequeños es muy útil, pero en defectos de mayor tamaño o forma compleja, el uso de material aloplástico puede aportar ciertas ventajas. Algunos autores han referido resultados prometedores mediante la utilización de distracción ósea bifocal de la calota5.
Se han utilizado materiales sintéticos como titanio6, hidroxiapatita7, cerámicas8, metil metacrilato9 o polietileno poroso10 para reconstrucciones craneofaciales. El metil metacrilato es un material fuerte y económico, pero produce una reacción exotérmica que puede causar quemaduras en los tejidos11. Las mallas de titanio producen artefactos en las pruebas de imagen, pero son fáciles de adaptar y generan una tasa de infección baja12. Por este motivo fue la opción elegida en nuestro caso de retirada de la prótesis por infección. Las mallas de titanio, además, pueden utilizarse solas o junto con otros materiales sintéticos, como cemento de hidroxiapatita, para reforzarlas13.
El material ideal aún no ha sido descubierto. Debe ser biocompatible, fuerte, ligero, maleable, resistente a la temperatura, inerte, radiolúcido, con baja tasa de fractura y de infección. Las prótesis de PEEK están teniendo buenos resultados. Se trata de un polímero semicristalino termoplástico inerte, radiolúcido, no magnético, fuerte, con un espesor y elasticidad comparables al de la cortical ósea14. Pero una de las principales desventajas de las prótesis PEEK, al igual que sucede en otros materiales aloplásticos, es la infección.
En esta serie de pacientes, un 14,3% (uno de los 7 pacientes) presentó episodios de infección repetidos y una fístula de LCR que terminó con la retirada de la prótesis. Sin embargo, tras la sustitución por una malla de titanio, material al que se asocia una menor tasa de infecciones, la clínica no desapareció, posiblemente en relación con una cobertura insuficiente para aislar el seno frontal. El defecto craneal de este paciente se originó hace 16 años por un estesioneuroblastoma que fue extirpado y posteriormente radiado, otro de los factores que puede estar relacionado. Recientemente, hemos realizado una revisión de pacientes con defectos reconstruidos con prótesis PEEK tanto craneales como craneofaciales15. En el momento de su elaboración, este paciente estaba asintomático. Hemos querido poner en conocimiento la evolución de este caso, pues creemos importante la relación que parece existir entre los materiales sintéticos y los senos paranasales. En la serie completa que incluye a los pacientes con defectos faciales existieron 2 casos de infección. Uno de ellos tenía un defecto de arco cigomático y hueso temporal y presentó un episodio de infección y celulitis tras un traumatismo, que cedió con tratamiento médico conservador. El otro caso que presentó infección fue un paciente con defecto de suelo de órbita en el que, tras varios episodios no resueltos con tratamiento médico, se revisó el lecho quirúrgico sin hallar infección activa; por ello, se decidió reesterilizar la prótesis, limpiar el lecho con rifampicina y clorhexidina, y recolocarla. Tras 32 meses de seguimiento, este paciente continúa asintomático. Parece que los mecanismos que predisponen a la infección en estos 3 casos han sido el traumatismo en uno de ellos y la comunicación con los senos paranasales (maxilar en el caso del defecto de suelo de órbita y frontal en el caso del defecto craneal). No hay que olvidar tampoco la posible influencia del tratamiento radioterápico del caso presentado en este artículo. Ninguno de los otros pacientes con defectos craneales o craneofaciales recibió radioterapia previa a la colocación de la prótesis de PEEK.
Cuando existe un episodio de infección, nuestro protocolo de actuación es instaurar, en primer lugar, medidas conservadoras con terapia antibiótica empírica y, posteriormente, ajustarla según antibiograma. En caso de infecciones repetidas, debe considerarse la retirada de la prótesis. En casos determinados, si en el momento de la revisión quirúrgica no hay infección activa, puede replantearse la esterilización y recolocación de la misma. Si hay infección activa, la mejor opción es retirarla. Es importante aislar bien los senos con cranealización o colgajos. Aunque no hay datos sobre la relación entre las prótesis de PEEK y los senos paranasales, parece que, si existe una comunicación directa, el riesgo de infección podría aumentar.
Hanasono et al.16 publicaron la primera serie de prótesis PEEK para reconstrucción craneal diferida. Uno de los 6 pacientes presentó una fístula de LCR que requirió retirar la prótesis; sin embargo, fue recolocada. No tuvieron ninguna infección. Lethaus et al.1 publicaron una serie de 12 pacientes con reconstrucciones craneales con PEEK y solo tuvieron como complicación un hematoma epidural en un paciente anticoagulado. Ng y Nawaz2 reconstruyeron 12 defectos craneales con buenos resultados, y recomiendan los implantes de PEEK para craneoplastias como una opción viable cuando el hueso autógeno no está disponible o no es adecuado. Rosenthal et al.17 describen su experiencia en 66 craneoplastias de 3 instituciones diferentes, y tienen una tasa de infección del 7,6%, comparable con otros materiales autógenos o con el hueso autógeno.
Con las técnicas Computer-Aided Design and Manufacturing es posible conocer bien la lesión y/o defecto a reconstruir, reducir el tiempo quirúrgico y anticipar posibles complicaciones, sobre todo técnicas, durante la cirugía. Con esta técnica es posible fabricar prótesis a medida de cada paciente. En nuestra serie, no fue necesario el ajuste de la prótesis en ninguno de los casos, con una buena adaptación al defecto.
ConclusiónEl material ideal para la reconstrucción de defectos craneales no existe. Las prótesis de PEEK están obteniendo buenos resultados estética y funcionalmente. Cuando el hueso autógeno no esté disponible o en determinados casos con defectos grandes, las prótesis de PEEK pueden ser una buena opción. Sin embargo, si el defecto está en comunicación directa con los senos paranasales, debemos valorar bien la indicación, pues la tasa de infecciones puede aumentar.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.