La infección por el virus chikungunya se ha convertido en un problema de salud pública, tanto por su afección inmediata sobre la salud y calidad de vida de los pacientes y sus familias, como por las complicaciones a medio y largo plazos. Es necesario llevar a cabo la caracterización inmunológica de esta afección, como paso importante para el futuro desarrollo de estrategias tendentes a disminuir su incidencia y agresividad.
ObjetivoCaracterizar inmunológicamente una población del Caribe colombiano con diagnóstico clínico y serológico de infección por el virus chikungunya.
Material y métodosEstudio descriptivo, longitudinal, prospectivo, en 109 pacientes con diagnóstico clínico y confirmación serológica de infección por el virus chikungunya, atendidos en el Servicio de Emergencias de la Fundación Hospital Universitario Metropolitano y en la consulta externa del Centro de Reumatología y Ortopedia. A partir de la toma de muestra de sangre periférica, se determinaron anticuerpos tipo inmunoglobulina G o M contra el virus chikungunya, por ensayo inmunoenzimático y pruebas de serología inmunológicas, orientadas al diagnóstico de enfermedades reumatológicas.
ResultadosSe obtuvieron resultados positivos para anticuerpos tipo inmunoglobulina G contra el virus chikungunya en 109 pacientes. Los resultados para anticuerpos antipéptido cíclico citrulinado, factor reumatoide, anticuerpos antinucleares, anticuerpo anti-ADN, fueron negativos en la mayoría de los sujetos.
ConclusiónLos pacientes no se encontraban en un proceso de replicación viral, característico de la fase aguda de la enfermedad. No hubo resultados positivos en las pruebas de laboratorio relacionadas con enfermedades reumatológicas. Las concentraciones altas halladas son sugerentes de un proceso inflamatorio articular con artralgias severas, que puede mimetizar las condiciones de una enfermedad reumatológica.
Chikungunya virus infection has become a public health problem, due to its immediate effect on the health and quality of life of patients and their families, as well as complications in the medium and long term. Its necessary to determine immunological characteristics of this afection as an important step for the future development of strategies to reduce its incidence and aggressiveness.
ObjectiveTo characterize immunologically a population from colombian caribbean with serologic and clinic diagnosis of chikungunya virus infection.
Material and methodsA descriptive, longitudinal, and prospective study was conducted on in 109 patients with a clinical diagnosis and serological confirmation of chikungunya virus infection and attended in the emergency department of the Fundación Hospital Universitario Metropolitano and the Orthopaedic and Rheumatology Centre. Immunoglobulin G or M type antibodies against Chikungunya virus were determined in a peripheral blood sample using immuno-enzymatic serological and immunological test in order to diagnose rheumatic diseases.
ResultsTests were positive for immunoglobulin G type antibodies against chikungunya virus in all of the 109 patients. The results for anti-cyclic citrullinated peptide antibodies, rheumatoid factor, antinuclear, and anti-DNA antibodies were negative in almost all of the 109 patients.
ConclusionPatients were not in a viral replication process that characterises the acute phase of the disease. There were no positive results in laboratory test related to rheumatic diseases. High concentrations of certain pro-inflammatory interleukins were found in patients, and the clinical manifestations in these, suggest an inflammatory joint process with severe arthralgia that can mimic the symptoms of a rheumatic disease.
La infección por virus chikungunya (CHIKV) se adquiere por la picadura del mosquito hembra Aedes aegypti o Aedes albopictus1–3. El virus penetra en los capilares subcutáneos, iniciando su replicación en los macrófagos de la dermis, fibroblastos y células endoteliales, desde donde es transportado a los ganglios linfáticos adyacentes al inóculo, difundiendo por la circulación a tejidos y órganos como hígado, músculos y articulaciones4,5.
La mayoría de los pacientes infectados presentan manifestaciones agudas, subagudas y crónicas, aunque del 3 al 12% cursan asintomáticos6,7. Durante el período de incubación silencioso (2 a 4 días), interviene el sistema inmunitario innato8–11, y tiempo después la respuesta inmunitaria específica12 que, en la mayoría de los casos, logra un barrido inicial del virus13,14.
Durante la respuesta inflamatoria inicial, el interferón 1α, al unirse a su receptor de superficie celular, produce la activación de tirosinquinasas, que conducen a la producción de varias enzimas inhibidoras de la replicación del virus en las células infectadas, que han escapado a la acción de las células asesinas naturales (NK)15–17.
El ácido nucleico viral induce la secreción de interferón 1β que, al unirse a su receptor de superficie celular, libera enzimas que frenan la síntesis proteica, inhibiendo la transducción del ARN viral y degradando de esta manera el ARN mensajero viral. La producción del interferón γ es mediada por linfocitos T activados por antígenos que le son presentados; este interferón actúa sobre células NK, macrófagos, linfocitos T y B, modificando la producción de anticuerpos. Posteriormente, se desarrolla la respuesta inmunitaria específica, con liberación de citoquinas, que atraen leucocitos al sitio de la replicación viral18–20.
Por su parte, la inmunidad celular está mediada por linfocitos T citotóxicos (CTL CD8+), encargados de neutralizar y destruir las células infectadas, mediante la liberación de enzimas, previa unión del receptor de membrana T CD8+, con el complejo mayor de histocompatibilidad I (HLA I) en la superficie de células infectadas21.
La respuesta linfocitaria T CD4+(LTh), se basa en la liberación de interleucinas (IL) específicas. Las células Th1 producen: IL2, interferón gamma (INFγ), factor de necrosis tumoral (TNFα), con características proinflamatorias. Las células Th2, secretan IL4, IL5, IL6 e IL10 y promueven la producción de anticuerpos mediada por los linfocitos B22,23.
Durante la fase aguda de la infección por el CHIKV, hay elevación del interferón alfa (INFα), mediada por la IL-1, IL-2 y TNFα. El IFNα es producido por linfocitos T, linfocitos B, macrófagos, fibroblastos, células endoteliales, células NK y osteoblastos, entre otros, sus efectos antivirales incluyen la inhibición de la replicación viral, la activación de macrófagos y células NK.
Los efectos del INFα son potenciados por el INFγ, una vez es secretado por las células Th1 activadas. Los síntomas como el dolor muscular y la fiebre están relacionados con la producción de interferones24–26.
Considerando que la respuesta inmunitaria regula el control de la enfermedad, esta dependerá de la situación inmunitaria subyacente en cada paciente, tal como la presencia de un estado reumatológico premórbido (artritis reumatoide)27–29.
En el medio regional, hasta el momento, no se han encontrado trabajos que muestren la caracterización inmunológica de los pacientes infectados con CHIKV, por lo que surgió la necesidad de llevar a cabo el presente trabajo, con el objetivo de analizar su respuesta inmunitaria, relacionando los casos de artralgias más graves, como el resultado de un defecto en los mecanismos de defensa30–33.
Materiales y métodosEstudio descriptivo, longitudinal y prospectivo, realizado en 109 pacientes, con diagnóstico clínico y serológico de infección por CHIKV, de octubre de 2014 a agosto de 2015, con edades comprendidas entre 22 y 82 años, atendidos en la Fundación Hospital Universitario Metropolitano (FHUM) y el Centro Reumatológico y Ortopédico, de la ciudad de Barranquilla. Las muestras de sangre periférica se obtuvieron de los sujetos después del inicio de los síntomas, en un tiempo promedio de 49 días, para la determinación de pruebas de laboratorio inmunológicas y medición de las concentraciones de INF e IL, según protocolo Affymetrix Biocience.
A todas las muestras se les realizó ELISA (quantitative enzyme-linked immunosorbent assay, second generation) para determinación de anticuerpos tipo IgG e IgM contra CHIKV, inmunofenotipificación de poblaciones linfocitarias por citometría de flujo, con anticuerpos monoclonales (anti-CD3, anti-CD4, anti-CD8), concentración de IL-1β, IL-2, IL-6, IL8, IL-10, IL-12, IL-17, IFNγ, IFNα, TNFα, factor reumatoide, péptido citrulinado, proteína C reactiva, anticuerpos antinucleares y anti-DNA.
La prueba ELISA utilizada, pertenecía a la casa comercial eBioscience, Inc- An affymetrix Company, y fue realizada en la ciudad de Barranquilla.
Los pacientes incluidos en el estudio fueron seleccionados en forma consecutiva durante su atención en el servicio de urgencias de la FHUM y en la consulta externa del Centro Reumatológico y Ortopédico de Barranquilla, los cuales reunieron los criterios de inclusión para participar en el estudio.
Los criterios de inclusión establecidos fueron: caso sospechoso (fiebre mayor a 38,5°C, artralgia severa o artritis de comienzo agudo, sin otra condición médica que lo explique y brote). Pacientes con anti-CHIKV positivo tipo IgM o IgG, por ELISA. Consentimiento informado diligenciado y firmado.
Se excluyeron aquellos con diagnóstico previo o presuntivo de enfermedad reumatológica, o con resultados positivos para: péptido citrulinado, factor reumatoide, ASTO, ácido úrico, anticuerpos antinucleares con título mayor 1/160 o pacientes que no firmaran el consentimiento.
Durante la recolección de la información, se aplicó un formulario que permitió analizar: el tiempo de inicio y duración de los síntomas, dolor o inflamación, afecciones articulares, artralgias, mialgias, cefalea, dolor de espalda, fiebre, brote, náuseas e incapacidad laboral y, en algunos casos, el diagnóstico de artritis reumatoide (AR), según los criterios establecidos por ACR/EULAR38. De forma periódica los pacientes fueron evaluados clínicamente a los 9 meses.
El análisis estadístico, descriptivo e inferencial, de las manifestaciones clínicas, permitió observar el comportamiento y la afectación inmuno-reumatológica.
ÉticaEl estudio fue aprobado por el Comité de Ética de la Universidad Metropolitana y de la FHUM. Los pacientes participantes fueron debidamente informados, diligenciaron y firmaron el consentimiento. Durante el estudio se aplicaron las Normas de Buenas Prácticas Clínicas en Investigación.
Análisis estadísticoTodos los datos fueron ingresados en el programa Microsoft Excel versión 2010, para el análisis estadístico se utilizó el programa Statgraphics XVI, donde se obtuvo el promedio y desviación estándar para las variables cuantitativas, frecuencia y porcentajes para las variables cualitativas.
Para las variables cuantitativas se utilizó la prueba t de Student para establecer la existencia o no de diferencias significativas entre los valores promedios. Se calculó la medida de asociación odss ratio, para medir el nivel de relación entre los síntomas y los marcadores de laboratorio determinados, considerando los valores del grupo control sano para cada prueba.
ResultadosUn total de 109 pacientes fueron estudiados, a los cuales se les tomó muestra de sangre periférica. El rango de edad de la población osciló entre 22 y 82 años, con un mayor porcentaje (56%) entre las edades de 41 a 60 años. Con respecto a la actividad y persistencia de la sintomatología, la edad no fue determinante. En cuanto al género, se encontró un predominio femenino, que corresponde al 89% de la población analizada, desempeñándose el 40% de ellas, como amas de casa.
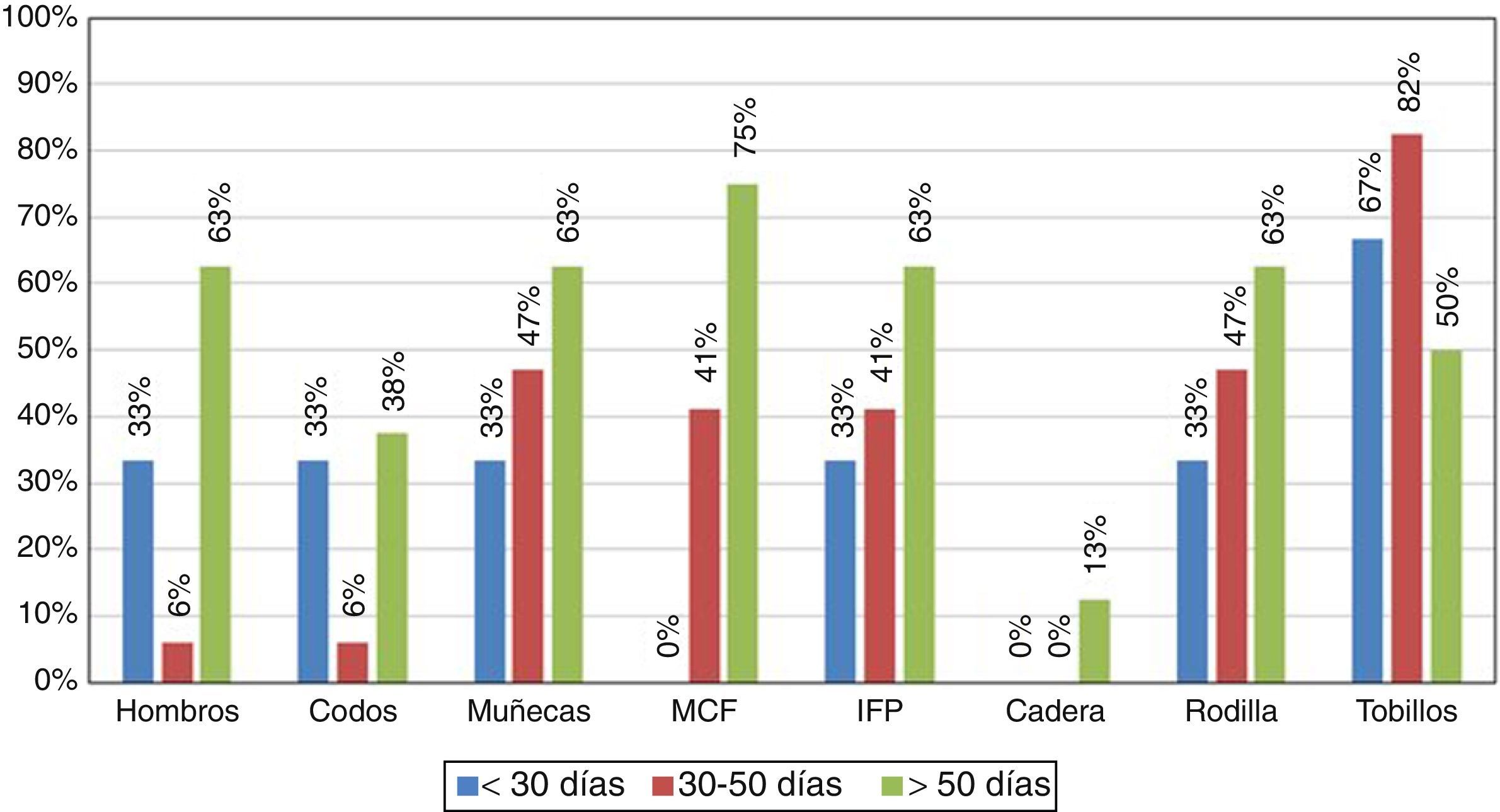
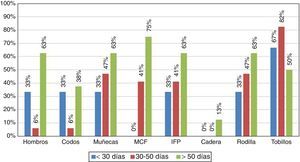
Aunque el objetivo principal del estudio fue caracterizar la respuesta inmunitaria de los pacientes infectados con el CHIKV, es importante resaltar las manifestaciones clínicas halladas durante la atención médica (tabla 1). En este contexto, los síntomas más característicos fueron: poliartritis simétrica en pequeñas articulaciones y tobillos, con una persistencia de más de 6 semanas de los síntomas, con lo cual los pacientes cumplían los criterios para AR (fig. 1).
Signos y síntomas presentes en los participantes
| Signo/síntoma | Porcentaje |
|---|---|
| Dolor articular | |
| Manos | 82% |
| Tobillos | 80% |
| Pies | 72% |
| Codos | 57% |
| S. musculares y periarticulares | |
| Artralgia | 76% |
| Mialgia | 72% |
| Dolor de espalda | 61% |
| Edema periarticular | 55% |
| S. Generales o no articulares | |
| Fiebre | 89% |
| Brote | 73% |
| Cefalea | 69% |
| Náuseas | 31% |
| Vómitos | 19% |
| Sangrado de mucosas | 5% |
| Astenia | 82% |
| Manifestaciones cutáneas | 80% |
| Meningo encefalitis | 57% |
Fuente: plantilla de seguimiento de resultados de laboratorio de FHUM.
En el momento de la recolección inicial de la información, todos los pacientes presentaban por lo menos una artralgia persistente (tabla 1), y un 10% de ellos síntomas de poliartritis, que por el tiempo de evolución se clasificó la enfermedad en etapa subaguda (persistencia de los síntomas por un tiempo mayor a 8 días e inferior a 3 meses). No hubo pacientes en el estudio que se encontraran en la fase aguda.
A los 9 meses se realizó nueva evaluación clínica de los pacientes, un 72% de los mismos mostró persistencia de artralgias y edema periarticular predominantemente en tobillos, lo que indicaba cronicidad de la enfermedad.
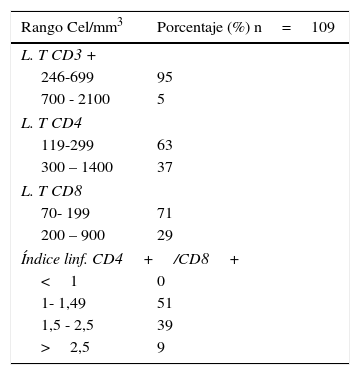
Por otro lado, todos los pacientes incluidos en el estudio tuvieron resultados positivos para anticuerpos anti-CHIKV tipo IgG. Las poblaciones y subpoblaciones de linfocitos T se encontraron disminuidas: el 95% de la población expresó menos de 700 linfocitos T CD3+/mm3, las de linfocitos T CD4+también estuvieron disminuidas en un 63% de los participantes, así como 71% de los mismos con respecto a los linfocitos T CD8. En cuanto a la relación CD4/CD8, el 51% de los participantes presentó valores entre 1-2,5, denotando un equilibrio de la subpoblación de linfocitos CD4 respecto a linfocitos CD8 (tabla 1).
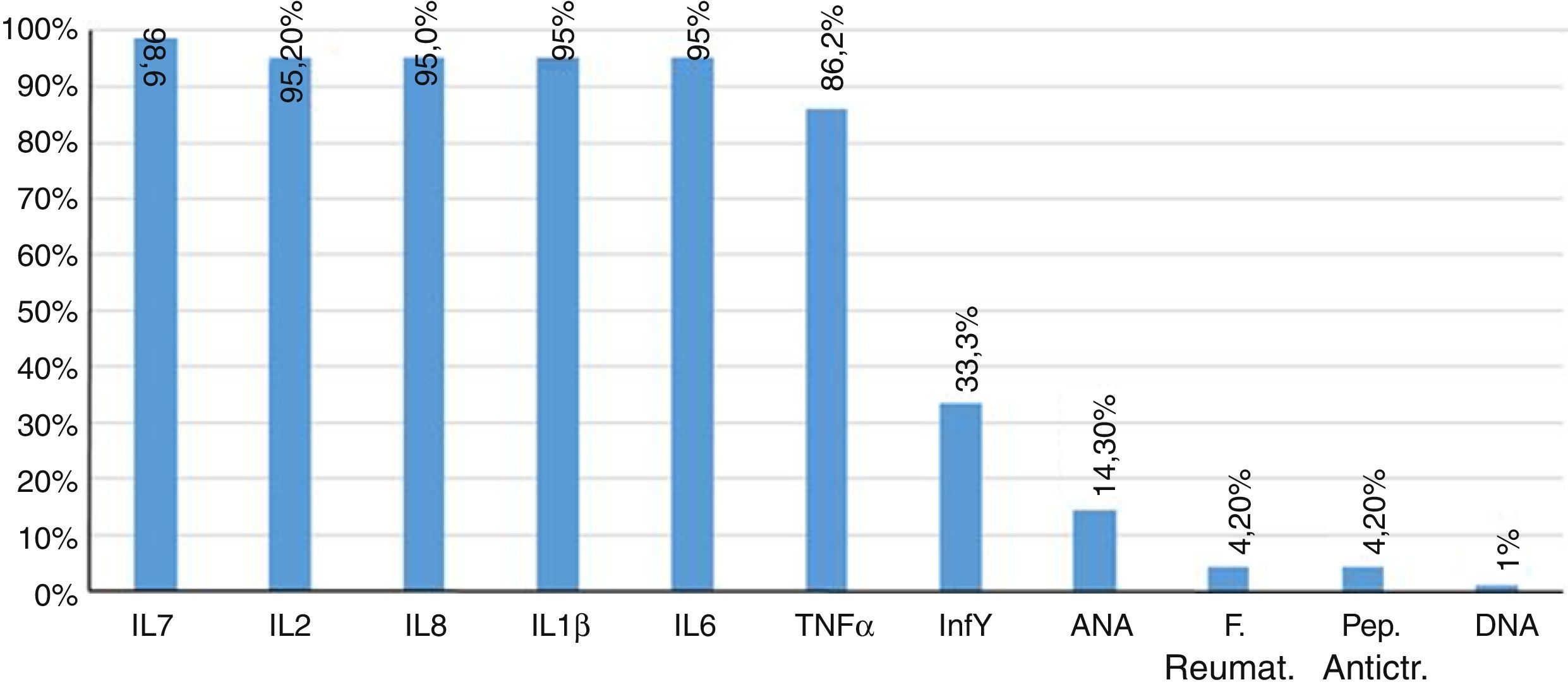
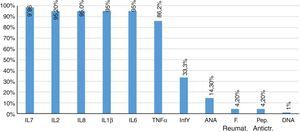
Por otro lado, el 85,7% de los pacientes tuvo resultados de anticuerpos antinucleares negativos. Dos pacientes mostraron títulos mayores a dilución 1/80, y un solo paciente presentó DNA positivo. El factor reumatoide y el péptido anticitrulina estuvieron negativos en el 95,8% de los pacientes. Finalmente, las concentraciones de interleucinas proinflamatorias, IL1β, IL2, IL6, IL8, IL17, IFNγ, TNF α, se encontraron aumentadas en el 95% de los pacientes (fig. 2).
DiscusiónAunque el 75% de los pacientes incluidos en el estudio presentaron más de 10 articulaciones afectadas, cumpliendo con los criterios de afectación articular establecidos por la ACR/EULAR, la presentación clínica de manifestaciones como el brote, la fiebre y la coexistencia del brote epidemiológico en la ciudad, marcaban una diferencia con el diagnóstico de AR e inclinaban el diagnóstico clínico hacia una infección viral.
Se encontró una disminución de la respuesta inmunitaria, mediada por las poblaciones y subpoblaciones de linfocitos T, lo que indicaría un diagnóstico de linfocitopenia secundaria a la infección viral. Pero a diferencia de la disminución linfocitaria encontrada en la infección por el virus HIV, el balance entre CD4/CD8, en los pacientes infectados con CHIKV, se mantiene en favor de las células TH (CD4+).
El índice CD4/CD8 fue mayor a 1, destacando la capacidad funcional de producción en estos pacientes de una respuesta inmunitaria específica, así como el parcial equilibrio de las subpoblaciones linfocitarias. A diferencia de lo encontrado en la AR, en donde existe también un balance positivo entre CD4/CD8, en esta entidad encontramos aumentadas las subpoblaciones de LTH39.
La linfocitopenia a expensas de los linfocitos CD4+, que se observa en los pacientes con VIH, difiere de la disminución de la respuesta inmunitaria celular hallada en los pacientes con CHIKV, por cuanto en estos últimos el índice de la relación CD4/CD8 es positivo, de tal forma que el 63% de la población que presentó menos de 300 linfocitos CD4/mm3, presentó de igual forma menos de 200 linfocitos CD8/mm3, lo cual mostraría una inmunodepleción transitoria, posiblemente resultado de un efecto inmunomodulador. En contraposición, la linfocitopenia en VIH se acompaña de un disbalance linfocitario con predominio de células CD8, con efecto inmunosupresor y asociado a infecciones oportunistas40.
El FNTα, al igual que las interleucinas IL17 (fig. 1), IL1β (fig. 2) e IL8 se encuentran aumentadas apreciablemente, lo cual coincide con los valores encontrados regularmente en procesos inflamatorios activos de carácter viral, ampliamente referenciados41,42.
Las concentraciones de INFα, cercanas a los valores del grupo control sano, se explicarían por el hecho de que esta proteína se eleva durante la fase aguda de la enfermedad y no hubo pacientes en esa fase.
Debido al mimetismo clínico que exhibe la fiebre CHIK con enfermedades reumatológicas como la AR, es importante comparar ambas entidades dentro del marco de la respuesta inmunitaria. En el suero de los pacientes infectados, se encontró un incremento de las interleucinas proinflamatorias analizadas, principalmente IL2 e IL8, que superaron unas 2 veces el valor del grupo control sano.
Esta respuesta obedecería al estímulo que ejerce la disminución de linfocitos CD4, hallada en los pacientes infectados con CHIKV, en la producción de IL2. Estos datos son consistentes con lo publicado por otros autores, después de analizar el perfil de citoquinas en adultos y jóvenes con AR, pero que a diferencia de nuestra población fueron positivos para anticuerpos antipéptidos citrulinados16,17,33.
Los diferentes niveles de expresión de las citoquinas dan cuenta del pleiotropismo, en el curso de una misma enfermedad o entre diversas enfermedades reumatológicas, en nuestro estudio los niveles de IL6 y TNFα, estuvieron por encima del grupo control sano, con un comportamiento similar al hallado en el grupo de AR, dentro de un estudio comparativo realizado entre AR y artritis idiopática juvenil, en el cual aunque en ambas entidades estas citoquinas estaban aumentadas, fue superior en el grupo de AR que en la artritis idiopática juvenil18,34,35.
En cuanto a la expresión de la IL10 antiinflamatoria, no hubo una elevación y por lo tanto sus efectos inmunorreguladores y supresores sobre el IL1β e IFNγ no se evidenciaron19,36,37.
Los resultados de factor reumatoide, anticuerpos antinucleares, anti-ADN y anticitrulina negativos, indican que en la infección por CHIKV no existe una respuesta de tipo autoinmunitario, por esta razón, se considera que se trata de una inflamación articular con mediadores de inflamación muy similar a lo que podríamos encontrar en enfermedades reumatológicas, especialmente en la AR, aunque no se pudo determinar que hubiese una respuesta autoinmune desarrollada por la infección del virus, hallada en procesos reumatológicos. No obstante, habría que esperar en una próxima evaluación en los pacientes con persistencia de los síntomas articulares, las pruebas de laboratorio inmunológico (ANA, DNA, FR, anticitrulina) y observar reacciones autoinmunes.
Se plantea realizar estudios en líquido sinovial, para determinar si la disminución de las células T CD4 y TCD8 en sangre periférica obedece, como en modelos animales, a la fijación y activación de estos linfocitos en tejidos.
ConclusiónSe encontró una respuesta inmunitaria viral de los participantes en el estudio, aunque no se produjeron anticuerpos específicos.
La mayor parte de los participantes mostraron un gran componente de tipo dolor poliarticular de forma persistente, por lo que se considera importante realizar un seguimiento de la evolución clínica y del perfil inmunitario, y continuar las investigaciones durante las fases aguda, hiperaguda y crónica, de la fiebre CHIKV.
Debido a la gran similitud en la sintomatología clínica, entre la fiebre CHIKV y la AR, los reumatólogos deben estar alerta con los pacientes que presenten afectación de pequeñas articulaciones y que de cierta forma cumplan con los criterios para el diagnóstico de AR de la ACR/EULAR, deben además tener en cuenta la importancia de realizar un diagnóstico diferencial en los lugares endémicos para CHIKV (tabla 2).
Valores de linfocitos T: CD3, CD4, CD8 e índice linfocitario CD4+/CD8+
| Rango Cel/mm3 | Porcentaje (%) n=109 |
|---|---|
| L. T CD3 + | |
| 246-699 | 95 |
| 700 - 2100 | 5 |
| L. T CD4 | |
| 119-299 | 63 |
| 300 – 1400 | 37 |
| L. T CD8 | |
| 70- 199 | 71 |
| 200 – 900 | 29 |
| Índice linf. CD4+/CD8+ | |
| <1 | 0 |
| 1- 1,49 | 51 |
| 1,5 - 2,5 | 39 |
| >2,5 | 9 |
Fuente: plantilla de seguimiento de resultados de laboratorio de FHUM.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónUniversidad Metropolitana, Fundación Hospital Universitario Metropolitano y Centro de Reumatología y Ortopedia.
Conflicto de interesesDeclaramos que no tenemos interés comercial o asociativo alguno, que represente un conflicto de intereses con el trabajo presentado.