La enfermedad periodontal (EP) y la artritis reumatoide (AR) son enfermedades inflamatorias crónicas multifactoriales que tienen en común algunos factores etiopatogénicos y la destrucción de los tejidos dentoalveolares y de las articulaciones sinoviales, de tal forma que se han identificado anticuerpos contra microorganismos periodontales en el fluido crevicular, líquido sinovial y en la membrana sinovial.
ObjetivoIdentificar, recuperar, analizar críticamente y sintetizar la literatura disponible acerca de la prevalencia de microorganismos periodontales en el líquido sinovial de pacientes con AR.
Materiales y métodosSe realizó búsqueda sistemática en Medline, ScienceDirect, SciELO y Google Scholar a través de los descriptores en salud Rheumatoid arthritis, periodontal microorganisms y synovial fluid. Se incluyeron artículos que describieron la presencia de microorganismos periodontales aislados en líquido sinovial de pacientes diagnosticados con AR. La búsqueda se cerró en febrero de 2017 y fue realizada con metodología PRISMA. Se emplearon las fichas de lectura crítica OSTEBA para valorar la validez externa y el nivel de evidencia de cada artículo en función del rigor metodológico.
ResultadosCatorce publicaciones describieron la presencia de microorganismos periodontales en líquido sinovial de pacientes con EP y AR. Seis publicaciones realizaron detección de microorganismos periodontales en muestras de líquido sinovial, identificando en todas a P. gingivalis.
ConclusionesLos estudios incluidos evidenciaron la presencia de microrganismos periodontales en el líquido sinovial en sujetos con EP y AR, asociando la prevalencia de P. gingivalis con el aumento de los niveles de anticuerpos anti-CCP, lo que podría exacerbar los procesos inflamatorios y producir reacciones autoinmunes en AR.
Periodontal disease (PD) and rheumatoid arthritis (RA) are multifactorial chronic inflammatory diseases that share similar aetiopathogenic mechanisms that lead to the destruction of both dental-alveolar tissues and synovial joints, in such way that antibodies against periodontal pathogens have been identified in the crevicular fluid and in the synovial fluid and membranes.
ObjectiveTo identify, recover, critically analyse and synthesise the available literature on the prevalence of periodontal microorganisms in synovial fluid of patients with RA.
Materials and methodsA systematic search was performed in MEDLINE, ScienceDirect, SciELO and Google Scholar using the medical subject headings “Rheumatoid arthritis”, “periodontal microorganisms” and “synovial fluid”. Articles were included that described the presence of isolated periodontal pathogens in synovial fluid of patients diagnosed with RA. The search was closed in February 2017 and was performed using PRISMA methodology. The OSTEBA critical reading sheets were used to assess the external validity and level of evidence of each article in terms of methodological rigour.
ResultsA total of 14 publications were included that described the presence of periodntal pathogens in synovial fluid of patients with PD and RA. Seven publications detected periodontal pathogens in synovial fluid, with P. gingivalis being positive in all of them.
ConclusionsThe included studies provided evidence of the presence of periodontal microorganisms in the synovial fluid in subjects with PD and RA, associating the prevalence of P. gingivalis with increased levels of anti-cyclic citrullinated peptide (anti-CCP) antibodies, which could exacerbate inflammatory processes and produce autoimmune reactions in RA.
La enfermedad periodontal (EP) es una infección crónica multifactorial que conlleva la destrucción de los tejidos de soporte del diente1. Esta enfermedad se inicia con la conformación de una biopelícula dental, biofilm o placa bacteriana, la cual estimula el sistema inmune y activa diversos mecanismos inflamatorios en un intento por detener la infección, de tal forma que la mayoría de los procesos destructivos asociados se debe a una respuesta excesiva del huésped ante el reto bacteriano2,3.
La etiopatogénesis de la EP implica un incremento de bacterias facultativas y anaerobias en el surco gingival alrededor de los dientes, en lo que denominamos el microbioma subgingival, constituido por especies patogénicas como Porphyromonas gingivalis, Prevotella intermedia, Bacteroides forsythus, Treponema denticola, Aggregatibacter actinomycetemcomitans y Fusobacterium nucleatum, entre otras, y algunos patógenos oportunistas como enterobacterias y bacilos gram negativos no fermentadores, que actúan en conjunto para iniciar un proceso inmunoinflamatorio2,3. Esta placa dental subgingival o microbioma subgingival ocasiona destrucción de los tejidos de soporte y de protección periodontal a partir de las fases descritas por Page y Schroeder en 1971, y revisadas por Page y Kornman en 1994: 1) una lesión inicial que marca el curso etiopatogénico; 2) la progresión hacia una lesión establecida con signos clínicos de gingivitis; y 3) el avance de una lesión que evidencia la formación de la bolsa periodontal o de la recesión gingival por pérdida de inserción, además de la pérdida ósea4–8. En Colombia, la prevalencia de la EP es del 73%, pero si incluimos las gingivitis la prevalencia es del 100% en la población dentada y adulta9.
Desde finales del siglo pasado el estudio de la etiopatogénesis de la EP y sus interacciones con el huésped ha permitido conocer que existe una asociación entre la EP y las enfermedades sistémicas, centrándose principalmente en la relación de la respuesta inflamatoria local y sistémica a partir de marcadores como las citoquinas proinflamatorias —factor de necrosis tumoral alfa (TNF-α) y las interleucinas 1 (IL-1) y 6 (IL-6)— y la proteína C reactiva (PCR), en procesos patológicos como las enfermedades cardiovasculares, la diabetes y sus complicaciones, los resultados adversos del embarazo, las infecciones respiratorias y algunas enfermedades reumatológicas10–14. Dentro de estas últimas se encuentra la artritis reumatoide (AR)14,15.
La AR es una poliartritis sistémica autoinmune, crónica e inflamatoria, de etiología multifactorial, caracterizada por inflamación de la membrana sinovial de las vainas tendinosas y de las bursas sinoviales de deslizamiento15, causando la destrucción generalizada de las articulaciones diartrodiales sinoviales, acompañada habitualmente por edema y dolor articular, lo cual conlleva que el individuo tenga discapacidad física, disminución de la calidad de vida, depresión y muerte prematura14. Su prevalencia varía entre el 1% y el 5%, siendo en Colombia del 0,9% con tendencia al crecimiento, de acuerdo con un estudio realizado en 2005 a partir del Sistema de Información de Prestaciones de Salud16. Aunque la causa de la AR aún es discutida, se han identificado factores de riesgo ambientales, genéticos y endocrinos involucrados en la patogénesis de la enfermedad17,18. Sin embargo, la evidencia disponible sugiere que existe una relación causa-efecto entre la magnitud y tipo de respuesta inmune y la AR, donde son importantes, también, la predisposición genética y posiblemente influyen las infecciones agudas y crónicas15,19.
Dado que la EP y la AR son desórdenes inflamatorios crónicos que se caracterizan por la destrucción ósea y la producción de citoquinas proinflamatorias, resulta plausible un vínculo fisiopatológico20–23, más aún cuando en el líquido sinovial y en la membrana sinovial en pacientes con AR se han detectado niveles de anticuerpos contra las bacterias anaerobias orales, específicamente contra P. gingivalis24–26, y que dicho microorganismo tiene la capacidad de citrulinar las proteínas y en dicho caso agravar la AR. P. gingivalis produce antígenos citrulinados en los tejidos que infecta y la citrulinación de las proteínas es una característica de la AR, agravándola en aquellos pacientes con EP no controlada27–29. La citrulinación es un proceso fisiológico intracelular postraduccional en el que una arginina se cambia por una citrulina, en proteínas con función estructural como la filagrina, diferentes queratinas (vimentina), algunos colágenos, la proteína básica de la mielina, la fibrina (fibrinógeno), la α-enolasa y las histonas, durante procesos como la queratinización, la inflamación y la apoptosis30–32. Este proceso de citrulinación es realizado por la familia de enzimas peptidil arginina deiminasa (PAD), de las cuales hasta ahora se han identificado 5 isoformas33,34. Sin embargo, debido a que la PAD no es expresada en el timo, los linfocitos T reactivos a los antígenos citrulinados pueden sobrevivir y generar una posible reacción autoinmune contra antígenos citrulinados en el resto del organismo. Sin embargo, en condiciones normales el sistema inmunológico no reacciona contra antígenos propios debido a los procesos de tolerancia inmunológica central y periférica. En el caso de individuos con AR se producen anticuerpos antipéptidos cíclicos citrulinados (anti-CCP), los cuales median los procesos inflamatorios al favorecer la activación de linfocitos T30,31.
Esta respuesta inflamatoria, acentuada por la migración de leucocitos desde los capilares sinoviales hacia el compartimento de las articulaciones sinoviales, ocasiona la sinovitis y activa la respuesta inmune adaptativa, en la que los linfocitos T infiltran la lesión34. Si bien se ha considerado la AR como una enfermedad con un perfil de citoquinas Th1, en la actualidad la atención se ha centrado en un perfil Th17 y su capacidad de producir IL-17A, IL-17F, IL-21, IL-22 y TNF-α ante un ambiente proinflamatorio generado por la produción de IL-1β, IL-6, IL-21, IL-23 y TGF-β por macrófagos y células dendríticas de la membrana sinovial, en el que la diferenciación y actividad de los linfocitos T reguladores es reducida, y en donde por sinergia de IL-17 y TNF-α activa los fibroblastos sinoviales35. De esta forma, un perfil Th1 y Th17 desencadena el incremento de la IL-22 o Th22, el cual se observa aumentado en la membrana sinovial de los pacientes con AR como consecuencia de la proliferación de fibroblastos sinoviales y de la hiperactividad osteoclástica por sobreexpresión del receptor activador del factor nuclear Kappa-B ligando, lo que finalmente aumenta la severidad de la enfermedad36,37. Las células efectoras que se encuentran en la membrana sinovial (macrófagos, mastocitos y linfocitos NK) y en el líquido sinovial (neutrófilos) activan la respuesta inmune innata. En el caso particular de los macrófagos estos se constituyen en las células efectoras centrales de la sinovitis a través de la secreción de citoquinas, intermediarios reactivos del oxígeno, prostanoides y metaloproteinasas de matriz extracelular (MMP), además de las funciones clásicas de fagocitosis y presentación de antígenos. Este patrón de expresión activa principalmente los macrófagos M1 a través de los receptores tipo Toll (Toll-like receptors TLR2/6, TLR3, TLR4 y TLR8) por citoquinas, interacciones con linfocitos T y complejos inmunes38,39.
De esta forma, las células de la membrana sinovial reaccionan alterando la estructura a través de una respuesta hiperplásica, en donde los sinoviocitos tipo A (macrófagos residentes) y los sinoviocitos tipo B (fibroblastos) desarrollan un fenotipo semiautónomo caracterizado por desmontar uniones intercelulares y aumentar la capacidad de proliferación; además de expresar proteínas de choque térmico y altos niveles de citoquinas, quimioquinas, MMP e inhibidores titulares de metaloproteinasas (TIMP), con lo que contribuyen a la promoción de un microambiente favorable para los linfocitos T efectores, la supervivencia de los linfocitos B y la organización de la respuesta inmune adaptativa35. Con la hiperplasia, la membrana sinovial pierde sus efectos protectores y la degradación del cartílago articular se inicia, debido a que el nuevo fenotipo del fibroblasto sinovial sintetiza una gran cantidad de MMP que degradan los componentes fibrilar y no fibrilar de la matriz extracelular cartilaginosa, de tal forma que sobreviene el daño estructural y la disfunción biomecánica ante la incapacidad fisiológica regenerativa del cartílago y la ineficiencia de los TIMP40.
Ante ello, el modelo más plausible de la etiopatogénesis de la AR plantea que durante la apoptosis —promovida por el daño de los tejidos articulares— se altera la integridad de la membrana celular, lo que permite un aumento de la concentración de calcio intracelular y activación subsecuente de las enzimas PAD, las cuales dan inicio a la citrulinación de diferentes proteínas en el núcleo, el citoplasma y la matriz extracelular30,31. De las proteínas citrulinadas se generan los neoantígenos blanco de los anti-CCP que forman complejos inmunes y activan el sistema del complemento para reclutar polimorfonucleares, monocitos, macrófagos y mastocitos en los tejidos sinoviales, los cuales promueven la inflamación de las articulaciones y conducen a un «círculo vicioso» donde la respuesta inmunológica ocasiona que el proceso inflamatorio se vuelva crónico y que se haga evidente el daño de los tejidos articulares41–44. Sumado a esto, se ha podido identificar que P. gingivalis expresa una serie de factores de virulencia involucrados en la colonización, invasión, establecimiento y persistencia tisular, los cuales le permiten evadir los mecanismos del sistema inmune, generando daño periodontal45,46. Uno de dichos factores son las gingipaínas, proteasas citrulinadas implicadas en la patogénesis de la EP dada su capacidad de degradar proteínas del huésped (fibrinógeno y α-enolasa en los tejidos periodontales) para ser usadas por la bacteria para su crecimiento y metabolismo, alterando la morfología y función celular47. De esta forma, P. gingivalis es la única procariota —hasta el momento— a la que se le ha identificado actividad enzimática PAD bacteriana similar en función de la PAD humana (pero no dependiente de calcio y a un pH inflamatorio elevado), por lo que este microorganismo periodontal se constituye en uno de los candidatos directos para asociar la EP y la AR47–52. Aunque estudios recientes han encontrado que A. actinomycetemcomitans induce la citrulinación de enzimas en los neutrófilos a través de la secreción de leucotoxina A —citotoxina que causa degeneración y necrosis de los leucocitos—, la cual genera poros en la membrana celular para movilizar calcio, hiperactivar la acción PAD y producir neoantígenos que exacerban la respuesta inmunológica53,54.
Si bien la actividad enzimática PAD y la citrulinación ocurren de forma fisiológica en los seres humanos, en individuos con AR susceptibles a HLA-DRB (complejo mayor de histocompatibilidad [MHC] clase ii) o PTPN22 (receptor no específico de tirosín fosfatasa), factores medioambientales como el hábito de fumar cigarrillos y la EP inducen la producción patológica de neoantígenos que conllevan a la formación de anti-CCP y, por consiguiente, pérdida de la tolerancia inmunológica41. Sin embargo, la asociación entre EP y AR es interesante por las vías inmunopatológicas comunes entre ellas. La EP tiene un origen infeccioso y la AR es autoinmune; sin embargo, en ambas hay un incremento de citoquinas proinflamatorias (TNF-α, IL-1 e IL-6) y de MMP. Las proteínas citrulinadas, entonces, bien sea por actividad enzimática PAD humana o PAD bacteriana son consideradas como neoantígenos debido a que no hacen su selección en el timo. Los linfocitos T poseen una restricción del MHC clase ii para diferenciar entre péptidos no citrulinados y péptidos citrulinados presentados por células profesionales presentadoras de antígenos55–59.
Ahora bien, uno de los aspectos menos estudiados de la relación entre EP y AR es el lugar en donde P. gingivalis actúa, ya que los anti-CCP que contribuyen a la pérdida de la tolerancia inmunológica pueden diseminarse en la sangre perpetuando, de esta forma, el proceso autoinmune de la AR, sin importar que su nicho ecológico patogénico (tejidos periodontales) se encuentre distante de las articulaciones sinoviales58,59. No obstante, diferentes estudios han podido detectar P. gingivalis en los tejidos sinoviales y en el líquido sinovial, debido su potencial de generar sangrado gingival y bacteriemia59, o de inducir fagocitosis por macrófagos y células dendríticas, y así diseminarse por vía sanguínea60–64. En este sentido, si la AR es la enfermedad articular inflamatoria más común en el mundo y su curso etiopatogénico conduce a deformidades de las articulaciones, discapacidad funcional y disminución de la expectativa de vida, los planes de tratamiento deberían incluir, desde un enfoque biopsicosocial, no solo la identificación de la predisposición genética y el control de los factores ambientales típicos (por ejemplo fumar cigarrillos), sino también el control de los estados inflamatorios en otros sitios del cuerpo65. De esta forma, los protocolos de la guía de práctica clínica para los pacientes con AR deberían incluir el control de las periodontitis, ya que al tratar estas últimas se reducen los anticuerpos anti-CCP específicos para P. gingivalis66–69 y se mejora la calidad de vida de los pacientes con AR70.
Por tanto, el objetivo de la presente revisión sistemática es identificar, recuperar, analizar críticamente y sintetizar la literatura disponible sobre la prevalencia de microorganismos periodontales en líquido sinovial de pacientes con AR.
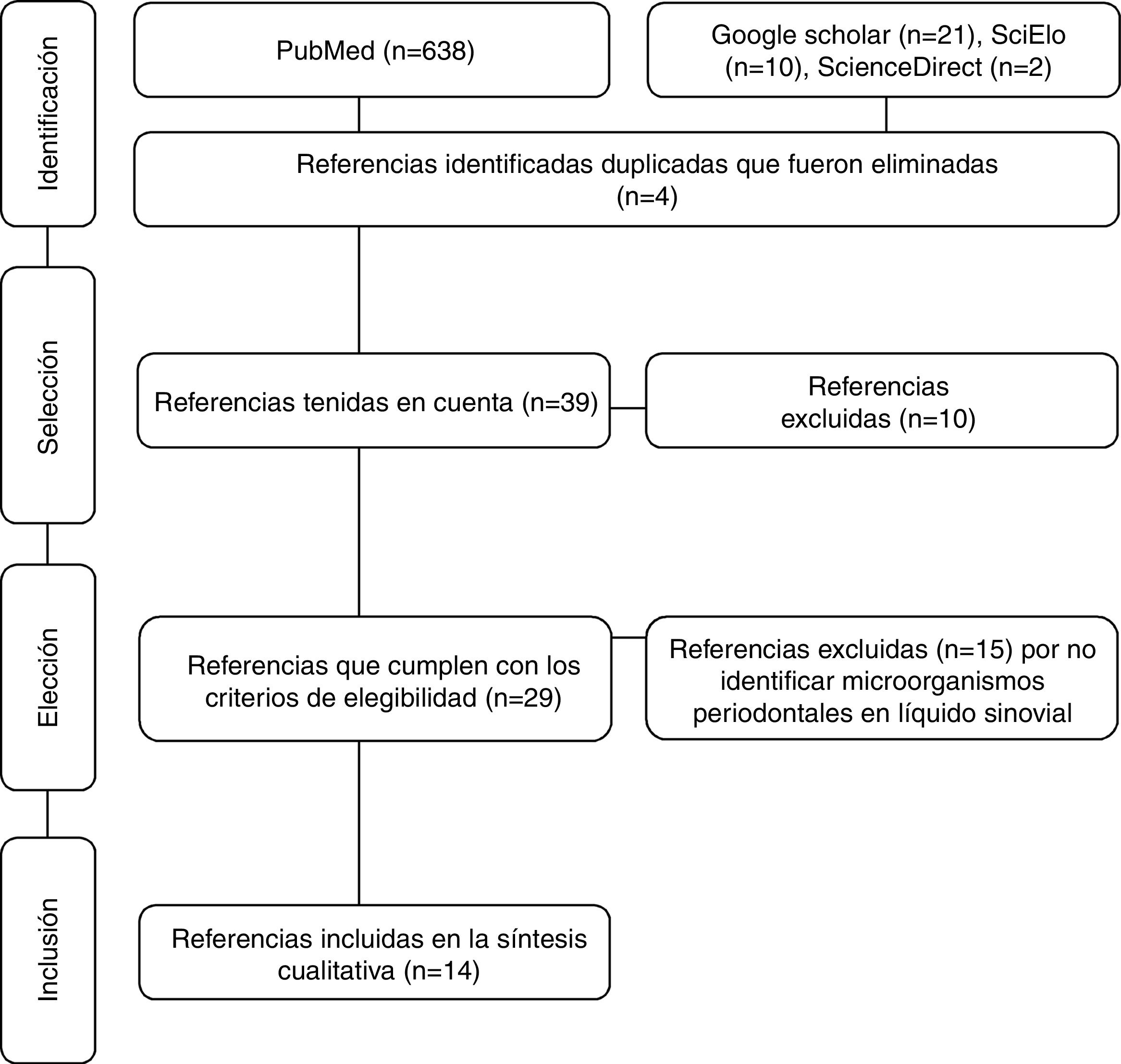
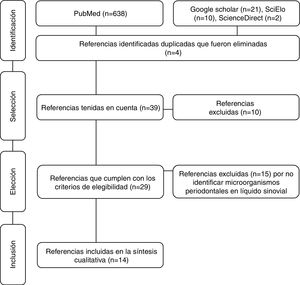
Materiales y métodosSe realizó una revisión sistemática de la literatura en Medline, Science Direct, SciELO y Google Scholar a través de los descriptores en salud MeSH Rheumatoid arthritis, periodontal microorganisms y synovial fluid combinados con el conector boleano and y con filtro humans. Los descriptores en salud utilizados fueron verificados en el MeSH on Demand a través de la pregunta Are periodontal microorganisms present in synovial fluid of patients with rheumatoid arthritis?. La búsqueda se basó en ensayos clínicos, estudios descriptivos, revisiones sistemáticas y revisiones de la literatura. Se incluyeron artículos que identificaron la presencia de microorganismos periodontales clasificados en complejos de acuerdo con el orden de aparición (colonización) en la biopelícula71, aislados de líquido sinovial de pacientes diagnosticados con AR —sin tener en cuenta su evolución—, adultos, de ambos sexos y que no tuvieran en cuenta comorbilidades. La sistemática de búsqueda cerró en febrero de 2017 y fue realizada con metodología PRISMA72 (fig. 1). De cada uno de los artículos se tuvieron en cuenta variables demográficas (autores, año de publicación y país de origen de la muestra), metodológicas (tipo de estudio, muestra, diagnósticos de EP y AR, métodos de detección de periodontopatógenos y conclusiones) y microorganismos periodontales (especies identificadas y su prevalencia) (tabla 1).
Artículos obtenidos a través de la búsqueda sistemática mediante metodología PRISMA
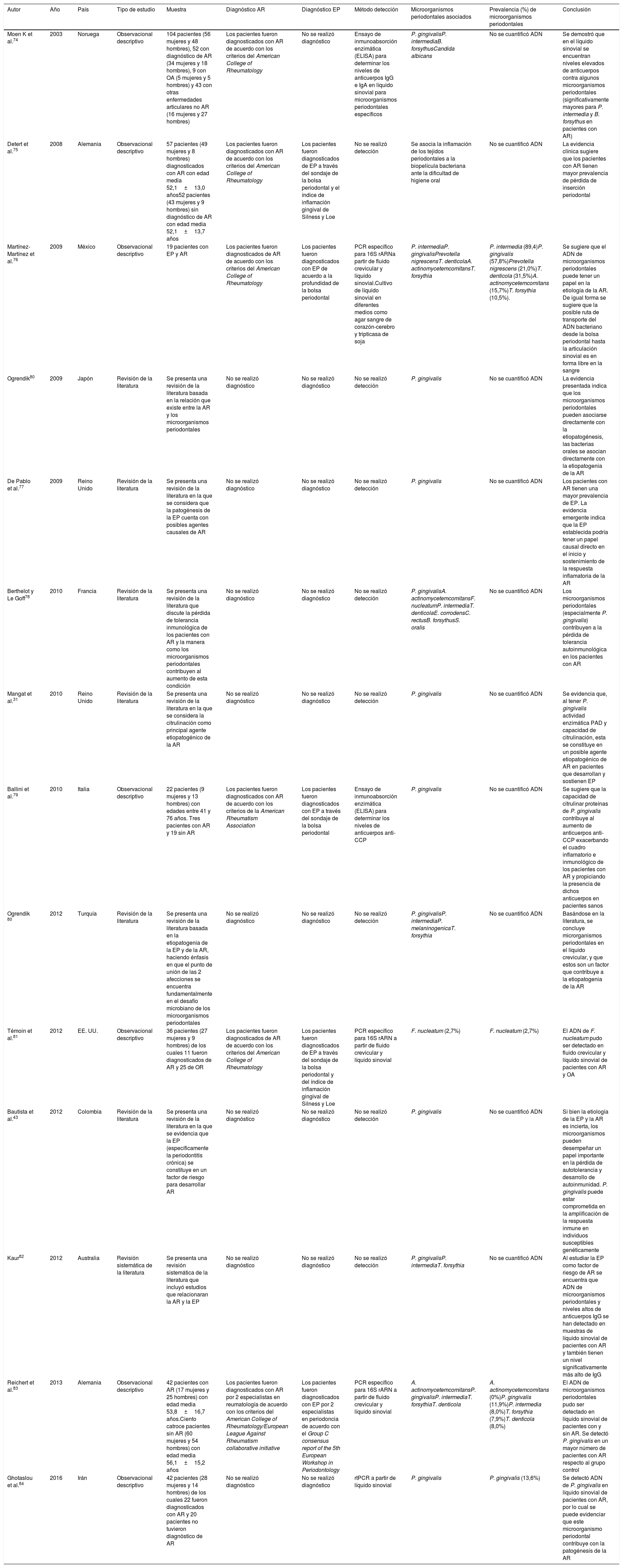
| Autor | Año | País | Tipo de estudio | Muestra | Diagnóstico AR | Diagnóstico EP | Método detección | Microorganismos periodontales asociados | Prevalencia (%) de microorganismos periodontales | Conclusión |
|---|---|---|---|---|---|---|---|---|---|---|
| Moen K et al.74 | 2003 | Noruega | Observacional descriptivo | 104 pacientes (56 mujeres y 48 hombres), 52 con diagnóstico de AR (34 mujeres y 18 hombres), 9 con OA (5 mujeres y 5 hombres) y 43 con otras enfermedades articulares no AR (16 mujeres y 27 hombres) | Los pacientes fueron diagnosticados con AR de acuerdo con los criterios del American College of Rheumatology | No se realizó diagnóstico | Ensayo de inmunoabsorción enzimática (ELISA) para determinar los niveles de anticuerpos IgG e IgA en líquido sinovial para microorganismos periodontales específicos | P. gingivalisP. intermediaB. forsythusCandida albicans | No se cuantificó ADN | Se demostró que en el líquido sinovial se encuentran niveles elevados de anticuerpos contra algunos microorganismos periodontales (significativamente mayores para P. intermedia y B. forsythus en pacientes con AR) |
| Detert et al.75 | 2008 | Alemania | Observacional descriptivo | 57 pacientes (49 mujeres y 8 hombres) diagnosticados con AR con edad media 52,1±13,0 años52 pacientes (43 mujeres y 9 hombres) sin diagnóstico de AR con edad media 52,1±13,7 años | Los pacientes fueron diagnosticados con AR de acuerdo con los criterios del American College of Rheumatology | Los pacientes fueron diagnosticados de EP a través del sondaje de la bolsa periodontal y el índice de inflamación gingival de Silness y Loe | No se realizó detección | Se asocia la inflamación de los tejidos periodontales a la biopelícula bacteriana ante la dificultad de higiene oral | No se cuantificó ADN | La evidencia clínica sugiere que los pacientes con AR tienen mayor prevalencia de pérdida de inserción periodontal |
| Martínez-Martínez et al.76 | 2009 | México | Observacional descriptivo | 19 pacientes con EP y AR | Los pacientes fueron diagnosticados de AR de acuerdo con los criterios del American College of Rheumatology | Los pacientes fueron diagnosticados con EP de acuerdo a la profundidad de la bolsa periodontal | PCR específico para 16S rARNa partir de fluido crevicular y líquido sinovial.Cultivo de líquido sinovial en diferentes medios como agar sangre de corazón-cerebro y tripticasa de soja | P. intermediaP. gingivalisPrevotella nigrescensT. denticolaA. actinomycetemcomitansT. forsythia | P. intermedia (89,4)P. gingivalis (57,8%)Prevotella nigrescens (21,0%)T. denticola (31,5%)A. actinomycetemcomitans (15,7%)T. forsythia (10,5%). | Se sugiere que el ADN de microorganismos periodontales puede tener un papel en la etiología de la AR. De igual forma se sugiere que la posible ruta de transporte del ADN bacteriano desde la bolsa periodontal hasta la articulación sinovial es en forma libre en la sangre |
| Ogrendik80 | 2009 | Japón | Revisión de la literatura | Se presenta una revisión de la literatura basada en la relación que existe entre la AR y los microorganismos periodontales | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalis | No se cuantificó ADN | La evidencia presentada indica que los microorganismos periodontales pueden asociarse directamente con la etiopatogénesis, las bacterias orales se asocian directamente con la etiopatogenia de la AR |
| De Pablo et al.77 | 2009 | Reino Unido | Revisión de la literatura | Se presenta una revisión de la literatura en la que se considera que la patogénesis de la EP cuenta con posibles agentes causales de AR | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalis | No se cuantificó ADN | Los pacientes con AR tienen una mayor prevalencia de EP. La evidencia emergente indica que la EP establecida podría tener un papel causal directo en el inicio y sostenimiento de la respuesta inflamatoria de la AR |
| Berthelot y Le Goff78 | 2010 | Francia | Revisión de la literatura | Se presenta una revisión de la literatura que discute la pérdida de tolerancia inmunológica de los pacientes con AR y la manera como los microorganismos periodontales contribuyen al aumento de esta condición | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalisA. actinomycetemcomitansF. nucleatumP. intermediaT. denticolaE. corrodensC. rectusB. forsythusS. oralis | No se cuantificó ADN | Los microorganismos periodontales (especialmente P. gingivalis) contribuyen a la pérdida de tolerancia autoinmunológica en los pacientes con AR |
| Mangat et al.31 | 2010 | Reino Unido | Revisión de la literatura | Se presenta una revisión de la literatura en la que se considera la citrulinación como principal agente etiopatogénico de la AR | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalis | No se cuantificó ADN | Se evidencia que, al tener P. gingivalis actividad enzimática PAD y capacidad de citrulinación, esta se constituye en un posible agente etiopatogénico de AR en pacientes que desarrollan y sostienen EP |
| Ballini et al.79 | 2010 | Italia | Observacional descriptivo | 22 pacientes (9 mujeres y 13 hombres) con edades entre 41 y 76 años. Tres pacientes con AR y 19 sin AR | Los pacientes fueron diagnosticados con AR de acuerdo con los criterios de la American Rheumatism Association | Los pacientes fueron diagnosticados con EP a través del sondaje de la bolsa periodontal | Ensayo de inmunoabsorción enzimática (ELISA) para determinar los niveles de anticuerpos anti-CCP | P. gingivalis | No se cuantificó ADN | Se sugiere que la capacidad de citrulinar proteínas de P. gingivalis contribuye al aumento de anticuerpos anti-CCP exacerbando el cuadro inflamatorio e inmunológico de los pacientes con AR y propiciando la presencia de dichos anticuerpos en pacientes sanos |
| Ogrendik 80 | 2012 | Turquía | Revisión de la literatura | Se presenta una revisión de la literatura basada en la etiopatogenia de la EP y de la AR, haciendo énfasis en que el punto de unión de las 2 afecciones se encuentra fundamentalmente en el desafío microbiano de los microorganismos periodontales | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalisP. intermediaP. melaninogenicaT. forsythia | No se cuantificó ADN | Basándose en la literatura, se concluye microrganismos periodontales en el líquido crevicular, y que estos son un factor que contribuye a la etiopatogenia de la AR |
| Témoin et al.81 | 2012 | EE. UU. | Observacional descriptivo | 36 pacientes (27 mujeres y 9 hombres) de los cuales 11 fueron diagnosticados de AR y 25 de OR | Los pacientes fueron diagnosticados de AR de acuerdo con los criterios del American College of Rheumatology | Los pacientes fueron diagnosticados de EP a través del sondaje de la bolsa periodontal y del índice de inflamación gingival de Silness y Loe | PCR específico para 16S rARN a partir de fluido crevicular y líquido sinovial | F. nucleatum (2,7%) | F. nucleatum (2,7%) | El ADN de F. nucleatum pudo ser detectado en fluido crevicular y líquido sinovial de pacientes con AR y OA |
| Bautista et al.43 | 2012 | Colombia | Revisión de la literatura | Se presenta una revisión de la literatura en la que se evidencia que la EP (específicamente la periodontitis crónica) se constituye en un factor de riesgo para desarrollar AR | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalis | No se cuantificó ADN | Si bien la etiología de la EP y la AR es incierta, los microorganismos pueden desempeñar un papel importante en la pérdida de autotolerancia y desarrollo de autoinmunidad. P. gingivalis puede estar comprometida en la amplificación de la respuesta inmune en individuos susceptibles genéticamente |
| Kaur82 | 2012 | Australia | Revisión sistemática de la literatura | Se presenta una revisión sistemática de la literatura que incluyó estudios que relacionaran la AR y la EP | No se realizó diagnóstico | No se realizó diagnóstico | No se realizó detección | P. gingivalisP. intermediaT. forsythia | No se cuantificó ADN | Al estudiar la EP como factor de riesgo de AR se encuentra que ADN de microorganismos periodontales y niveles altos de anticuerpos IgG se han detectado en muestras de líquido sinovial de pacientes con AR y también tienen un nivel significativamente más alto de IgG |
| Reichert et al.83 | 2013 | Alemania | Observacional descriptivo | 42 pacientes con AR (17 mujeres y 25 hombres) con edad media 53,8±16,7 años.Ciento catroce pacientes sin AR (60 mujeres y 54 hombres) con edad media 56,1±15,2 años | Los pacientes fueron diagnosticados con AR por 2 especialistas en reumatología de acuerdo con los criterios del American College of Rheumatology/European League Against Rheumatism collaborative initiative | Los pacientes fueron diagnosticados con EP por 2 especialistas en periodoncia de acuerdo con el Group C consensus report of the 5th European Workshop in Periodontology | PCR específico para 16S rARN a partir de fluido crevicular y líquido sinovial | A. actinomycetemcomitansP. gingivalisP. intermediaT. forsythiaT. denticola | A. actinomycetemcomitans (0%)P. gingivalis (11,9%)P. intermedia (8,0%)T. forsythia (7,9%)T. denticola (8,0%) | El ADN de microorganismos periodontales pudo ser detectado en líquido sinovial de pacientes con y sin AR. Se detectó P. gingivalis en un mayor número de pacientes con AR respecto al grupo control |
| Ghotaslou et al.84 | 2016 | Irán | Observacional descriptivo | 42 pacientes (28 mujeres y 14 hombres) de los cuales 22 fueron diagnosticados con AR y 20 pacientes no tuvieron diagnóstico de AR | No se realizó diagnóstico | No se realizó diagnóstico | rtPCR a partir de líquido sinovial | P. gingivalis | P. gingivalis (13,6%) | Se detectó ADN de P. gingivalis en líquido sinovial de pacientes con AR, por lo cual se puede evidenciar que este microorganismo periodontal contribuye con la patogénesis de la AR |
Para valorar la calidad o validez de las pruebas científicas de cada artículo —en función de su rigor metodológico— se usaron las fichas de lectura crítica OSTEBA de la plataforma Web FLC 2.0 desarrollada por el Servicio de Evaluación de Tecnologías Sanitarias del Departamento de Salud del Gobierno Vasco73. La ficha de pruebas diagnósticas para estudios comparativos no experimentales incluye cualquier procedimiento empleado para conocer el estado de salud de un individuo (pruebas de laboratorio, quirúrgicas, exámenes clínicos, pruebas de imagen, cuestionarios, etc.) con el propósito de valorar el impacto de la identificación de microorganismos periodontales en el fluido crevicular y en el líquido sinovial de pacientes diagnosticados con EP y AR.
ResultadosEn total fueron incluidas 14 publicaciones que cumplieron con los criterios de inclusión, las cuales fueron organizadas por autor, año, país, tipo de estudio, muestra, diagnóstico de AR, diagnóstico de EP, método de detección, microorganismos periodontales y conclusión (tabla 1). Los 14 artículos fueron publicados entre 2003 y 2016, 8 en países europeos, 2 en países latinoamericanos (uno en Colombia), uno en Norteamérica, uno en Medio Oriente, uno en Lejano Oriente y uno en Oceanía. En total hubo 8 estudios observacionales descriptivos, una revisión sistemática de la literatura y 4 revisiones de la literatura. De los 7 estudios descriptivos 4 realizaron detección de periodontopatógenos en fluido crevicular y en líquido sinovial, 3 con PCR específico para 16S rARN y uno con real time PCR. Dos estudios emplearon ensayo de inmunoabsorción enzimática (ELISA) para determinar los niveles de anticuerpos anti-CCP y de anticuerpos IgG e IgA. Solo un estudio hizo cultivo en diferentes medios como agar sangre de corazón-cerebro y tripticasa de soja. En todos los estudios las diferentes pruebas de detección dieron positivo para P. gingivalis en líquido sinovial. Cuatro estudios diagnosticaron la EP a través de métodos estandarizados (de acuerdo con el Group C consensus report of the 5th European Workshop in Periodontology, sondaje de la profundidad de la bolsa periodontal y el índice de inflamación gingival de Silness y Loe) y 6 diagnosticaron AR de acuerdo con los criterios de la American Rheumatism Association. Los estudios concluyen que existe evidencia que permite asociar la EP y la AR, además de apuntar que P. gingivalis puede desempeñar un papel importante en la etiopatogénesis de la AR.
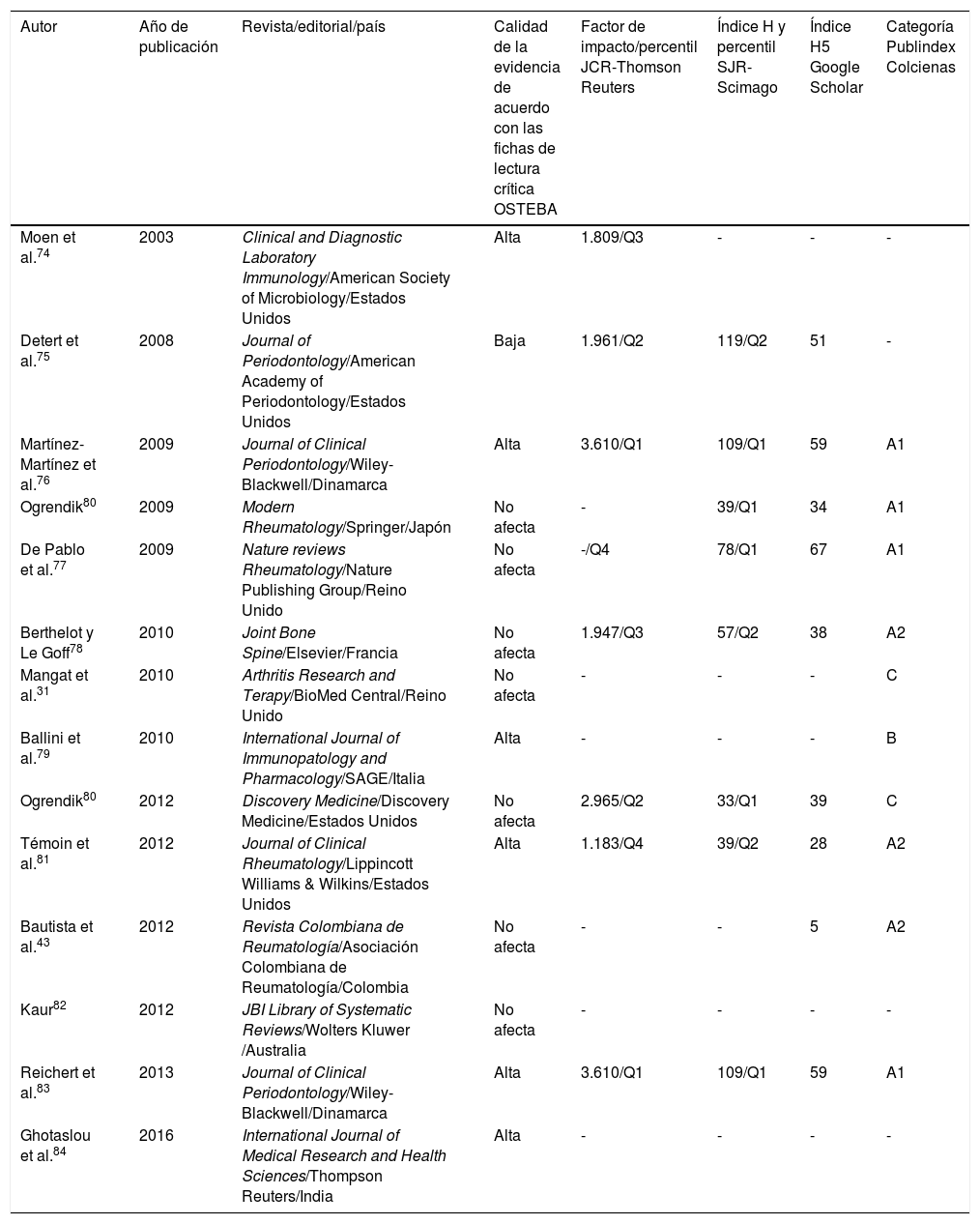
De acuerdo con la ficha de lectura crítica OSTEBA para estudios comparativos no experimentales, 6 publicaciones presentaron un nivel de evidencia alto. Dentro de estas se encuentran los estudios que emplearon alguna técnica molecular para detectar ADN de microorganismos periodontales o anticuerpos específicos para algunas especies en líquido sinovial. Un estudio observacional presentó nivel de evidencia bajo debido a que solo diagnosticó EP en pacientes con AR, y a que la asociación entre estas 2 enfermedades se basó en la literatura citada. Para 7 publicaciones el formato no fue relevante. Asimismo, se identificó que los estudios que tienen nivel de evidencia alto fueron publicados en revistas científicas con indicadores de calidad igualmente altos (tabla 2).
Indicadores de calidad de las revistas en donde fueron publicados los artículos incluidos en este estudioa
| Autor | Año de publicación | Revista/editorial/país | Calidad de la evidencia de acuerdo con las fichas de lectura crítica OSTEBA | Factor de impacto/percentil JCR-Thomson Reuters | Índice H y percentil SJR-Scimago | Índice H5 Google Scholar | Categoría Publindex Colcienas |
|---|---|---|---|---|---|---|---|
| Moen et al.74 | 2003 | Clinical and Diagnostic Laboratory Immunology/American Society of Microbiology/Estados Unidos | Alta | 1.809/Q3 | - | - | - |
| Detert et al.75 | 2008 | Journal of Periodontology/American Academy of Periodontology/Estados Unidos | Baja | 1.961/Q2 | 119/Q2 | 51 | - |
| Martínez-Martínez et al.76 | 2009 | Journal of Clinical Periodontology/Wiley-Blackwell/Dinamarca | Alta | 3.610/Q1 | 109/Q1 | 59 | A1 |
| Ogrendik80 | 2009 | Modern Rheumatology/Springer/Japón | No afecta | - | 39/Q1 | 34 | A1 |
| De Pablo et al.77 | 2009 | Nature reviews Rheumatology/Nature Publishing Group/Reino Unido | No afecta | -/Q4 | 78/Q1 | 67 | A1 |
| Berthelot y Le Goff78 | 2010 | Joint Bone Spine/Elsevier/Francia | No afecta | 1.947/Q3 | 57/Q2 | 38 | A2 |
| Mangat et al.31 | 2010 | Arthritis Research and Terapy/BioMed Central/Reino Unido | No afecta | - | - | - | C |
| Ballini et al.79 | 2010 | International Journal of Immunopatology and Pharmacology/SAGE/Italia | Alta | - | - | - | B |
| Ogrendik80 | 2012 | Discovery Medicine/Discovery Medicine/Estados Unidos | No afecta | 2.965/Q2 | 33/Q1 | 39 | C |
| Témoin et al.81 | 2012 | Journal of Clinical Rheumatology/Lippincott Williams & Wilkins/Estados Unidos | Alta | 1.183/Q4 | 39/Q2 | 28 | A2 |
| Bautista et al.43 | 2012 | Revista Colombiana de Reumatología/Asociación Colombiana de Reumatología/Colombia | No afecta | - | - | 5 | A2 |
| Kaur82 | 2012 | JBI Library of Systematic Reviews/Wolters Kluwer /Australia | No afecta | - | - | - | - |
| Reichert et al.83 | 2013 | Journal of Clinical Periodontology/Wiley-Blackwell/Dinamarca | Alta | 3.610/Q1 | 109/Q1 | 59 | A1 |
| Ghotaslou et al.84 | 2016 | International Journal of Medical Research and Health Sciences/Thompson Reuters/India | Alta | - | - | - | - |
La EP y la AR, 2 enfermedades de origen infeccioso y autoinmune, respectivamente, que incluyen procesos inflamatorios crónicos, son un modelo propicio para determinar si existe una relación de doble vía14,15. Ambas enfermedades se caracterizan por una reacción inflamatoria que causa la destrucción de los tejidos blandos y mineralizados (hueso y cartílago) alterando la morfofunción de las articulaciones (tipo gónfosis para los dientes y sinovial para las articulaciones óseas)20,21. Asimismo, se han observado patrones similares de curso natural y patogénesis, respuesta inmune, susceptibilidad genética, infiltración celular y expresión aumentada de enzimas y citoquinas, hasta tal punto que las implicaciones del tratamiento tanto de la EP como de la AR incluyen manejo de los síntomas clínicos y modulación de la respuesta inmune22.
Se cree que los microorganismos periodontales producen una inflamación crónica periodontal y que pueden exacerbar la AR en individuos genéticamente susceptibles, asociado a la detección de ADN y de anticuerpos IgG e IgA en el líquido sinovial contra bacterias periodontales del complejo rojo —colonizadores tardíos— como P. gingivalis, T. forsythia y T. denticola; bacterias del complejo naranja —colonizadores intermedios— como P. intermedia y P. nigrescens, y bacterias del complejo verde —colonizadores tempranos— como A. actinomycetemcomitans24,28,71. Además, debido a la capacidad de citrulinar proteínas por P. gingivalis, se ha propuesto que este patógeno periodontal activa la respuesta de tipo humoral tras la producción de anticuerpos anti-CCP, con lo que la EP puede ser un factor de riesgo en AR14,50,55,57,74,85,86. Se conoce que la mayoría de los anticuerpos anti-CCP en pacientes con suceptibilidad genética (epítope compartido) son contra P. gingivalis24,87, lo cual resulta de relevancia clínica para el diagnóstico temprano de la AR87.
De acuerdo con los resultados presentados por 6 de los 14 estudios incluidos en esta revisión sistemática de la literatura, la discusión se va a centrar en la detección de anticuerpos específicos para microorganismos periodontales y en la prevalencia de microorganismos periodontales en el líquido sinovial de pacientes con AR.
Detección de anticuerpos inmunoglobulina G e inmunoglobulina A para periodontopatógenos en líquido sinovial de pacientes con artritis reumatoideEn la lesión inicial de la EP se produce IL-1 y TNF-α por los neutrófilos y macrófagos infiltrantes y por la activación de las células endoteliales, y se produce IL-8, una citoquina con actividad quimiotáctica para la llegada de más polimorfonucleares neutrófilos en el ambiente subgingival —mediante netosis— en el sitio en donde se encuentran las bacterias8. Una vez establecida la lesión (gingivitis) se desencadena la respuesta inmune adaptativa con la acumulación de linfocitos T CD4 + del perfil Th1, quienes producen IFNγ e IL-2 para promover la actividad de macrófagos y coestimular los linfocitos B que producen anticuerpos tipo IgG e IgA88. Con ello, la lesión avanza hasta la formación de la bolsa periodontal o de la recesión gingival por pérdida de inserción (periodontitis), lo cual conduce a la aparición de una microbiota más patogénica representada por bacterias gram negativas anaerobias71. Esta lesión presenta como características inmunológicas una respuesta inmune innata disminuida, abundantes plasmocitos (50%) y linfocitos T CD4 + del perfil Th2 que producen IL-4, IL-5, IL-6 e IL-10 para favorecer la producción de IgG4 e IgE por parte de linfocitos B, de tal forma que con este perfil se suprime la actividad de los macrófagos5,6. Sin embargo, hay estudios que muestran la sobreestimulación de monocitos, macrófagos y fibroblastos gingivales que producen más IL-1β, TNFα y MMP, generando un ambiente inflamatorio dirigido por el perfil Th1 o Th17, efecto que caracteriza la naturaleza cíclica de la EP8.
Moen et al.74 realizaron un ELISA para determinar los niveles de anticuerpos IgG e IgA específicos para 3 periodontopatógenos en muestras de líquido sinovial de individuos sanos e individuos diagnosticados de enfermedad articular que tuvieran EP. Encontraron niveles de anticuerpos IgG específicos para P. gingivalis —con valores de p sin significación estadística— y de IgA específicos para P. intermedia y B. forsythus aumentados —con valores p con significación estadística— en individuos con AR respecto a individuos con osteoartritis o individuos sanos. Lo que sugiere que en individuos con AR y EP los linfocitos B presentan una mayor activación y una mayor producción de anticuerpos dirigidos de forma específica contra antígenos de P. intermedia y B. forsythus, de tal forma que existen mecanismos de captura de ADN bacteriano por parte de la membrana sinovial, además del depósito de complejos inmunes antígeno-anticuerpo en el compartimento sinovial y de células plasmáticas en los tejidos sinoviales74. En el caso específico de P. gingivalis, aunque no hubo diferencia entre los niveles de IgG e IgA entre los diferentes individuos que conformaron la muestra del estudio, este periodontopatógeno parece ser un eslabón que conecta la EP y la AR, debido a que anticuerpos IgG específicos contra P. gingivalis hacen una reacción cruzada contra neoantígenos del huésped (vimentina, colágeno tipo ii, α-enolasa y fibrinógeno)45,46.
Teniendo en cuenta que P. gingivalis tiene actividad PAD para citrulinar las gingipaínas como mecanismo de virulencia, los anticuerpos específicos para estos antígenos citrulinados al circular por sangre pueden reconocer péptidos citrulinados en otros tejidos del cuerpo, incluyendo las articulaciones sinoviales, en donde la actividad PAD humana es mucho más frecuente en los estados proinflamatorios56. De esta forma, cuando los anticuerpos IgG específicos para P. gingivalis reconocen los péptidos citrulinados propios, se forman complejos inmunes que desencadenan las funciones efectoras de la inmunidad humoral, las cuales incluyen la activación de neutrófilos, monocitos y macrófagos, la activación de la vía clásica del complemento y la activación de macrófagos que favorecen el estado proinflamatorio crónico50. Estos complejos inmunes activan una respuesta de hipersensibilidad tipo iii, en la cual el proceso inflamatorio que contribuye a la pérdida de la tolerancia inmunológica exacerba el cuadro clínico de la EP y de la AR26,46,47,51.
En este sentido, Ballini et al. determinaron los niveles aumentados de anticuerpos anti-CCP a través de ELISA, en pacientes con EP y AR, sugiriendo que la capacidad de citrulinar de P. gingivalis contribuye a la exacerbación del cuadro inflamatorio e inmunológico de los pacientes con AR79. Por otro lado, resulta fundamental tener en cuenta que la AR es una enfermedad autoinmune, en la cual la susceptibilidad genética se ha comprobado43. En AR los principales alelos de susceptibilidad están presentes principalmente en HLA-DRB1 y sus variantes, todas ellas asociadas al motivo EQKRAA, el cual se localiza en la tercera región hipervariable de la cadena DRB que constituye parte de la hendidura de unión peptídica —reconocida como el epítope compartido de la molécula de MHC clase ii— para vimentina, colágeno tipo II, α-enolasa y fibrinógeno citrulinado32,34. De esta forma, la cadena β del alelo HLA-DRB1 se constituye en el mayor riesgo genético (susceptibilidad y progresión) de la AR, porque al unirse a la citrulina da inicio a respuestas inmunológicas a través de la producción de IgA e IgG por parte de linfocitos B activados y la estimulación de macrófagos mediante la síntesis de IL-17, FN-γ, TNF-α e IL-6 por parte de linfocitos T CD4+. Por lo tanto, HLA-DRB1 se comporta como un factor de riesgo para la producción de anti-CCP y desencadenar AR43,87,89–91.
Detección de ADN de periodontopatógenos en líquido sinovial de pacientes con artritis reumatoideUna de las hipótesis planteadas dentro de la relación entre EP y AR es que los periodontopatógenos hacen bacteriemia desde el surco gingival y colonizan los tejidos sinoviales, lugar en el que alteran la tolerancia inmunológica e inducen daño tisular por activación de las 2 vías del complemento, el montaje de trampas para los neutrófilos, la degradación de la matriz extracelular del cartílago articular y la resorción ósea del hueso subcondral48.
De esta forma, Martínez-Martínez et al. identificaron ADN bacteriano por PCR en el 100% de muestras del líquido sinovial (84,2%) de 19 pacientes con EP y AR. Las especies de periodontopatógenos identificadas fueron P. intermedia (89,4%), P. gingivalis (57,8%), Prevotella nigrescens (21,0%), T. denticola (31,5%), A. actinomycetemcomitans (15,7%) y Tanerella forsythensis (10,5%). Sin embargo, no se pudo comprobar que hubiese células bacterianas viables al resultar negativo el crecimiento bacteriano por cultivo. Los autores sugirieron que el ADN bacteriano pudo ser transportado desde los tejidos periodontales hacia los tejidos sinoviales de forma intracelular en leucocitos y células dendríticas o por bacteriemia76. A partir de esta ruta de diseminación se ha evidenciado que el ADN bacteriano contiene motivos CpG capaces de estimular la respuesta inmune innata tras la activación de receptores tipo Toll y la posterior liberación de citoquinas proinflamatorias, lo que se podría constituir en un punto clave para la relación entre la EP y la AR92.
Reichert et al.83 utilizaron una prueba de PCR para detectar ADN bacteriano en muestras de fluido crevicular y líquido sinovial de 42 pacientes con AR y 114 con enfermedad no reumatoide. Los autores identificaron, en 28 pacientes con AR, ADN de P. intermedia (19,0%), T. forsythia (16,7%), P. gingivalis (16,7%), T. denticola (8,0%) y A. actinomycetemcomitans (2,4%). Estos hallazgos les permitieron afirmar que la prevalencia de microorganismos periodontales en líquido sinovial —específicamente P. gingivalis (16,7% en individuos con AR versus 3,5% en individuos sanos, p=0,045)— puede tener un papel fundamental en la etiología de la AR83. Témoin et al. también detectaron ADN bacteriano en líquido sinovial (2 de 11 pacientes diagnosticados con AR y 3 de 25 pacientes con osteoartritis), siendo la prueba de PCR positiva para F. nucleatum (2,7%) en fluido crevicular y líquido sinovial de pacientes con AR79. Finalmente, Ghotaslou et al. detectaron P. gingivalis en 3 pacientes con AR (13,6%) a través de real time PCR (rtPCR) en líquido sinovial —con valores p sin significación estadística respecto al grupo control—, concluyendo que al ser mayor la cantidad de ADN en pacientes con AR este microorganismo periodontal podría contribuir con la patogénesis de la AR84.
Nivel de evidenciaSi bien el nuevo conocimiento científico no siempre modifica la conducta de la atención clínica, resulta importante evaluar la calidad de la evidencia, la validez de los resultados y la calidad metodológica de las investigaciones92–94. De esta forma, 6 estudios descriptivos que fueron incluidos en esta revisión, que emplearon algún método estandarizado para diagnosticar EP y AR, y que detectaron la presencia de ADN de bacterias periodontales (o sus anticuerpos IgG e IgA) en líquido sinovial, tuvieron nivel de evidencia alto y fueron publicados en revistas arbitradas de alto impacto, específicamente los estudios de Martínez-Martínez et al.76, Témoin et al.81 y Reichert et al.83. Sin embargo, se debe tener en cuenta el sesgo de publicación que ha sido asociado, en lo fundamental, a las conductas editoriales de las revistas científicas y a las diferentes estrategias con las que se mide el impacto de las mismas (por ejemplo índices de citación), las cuales —no necesariamente— garatizan que los resultados puedan respaldar la toma de decisiones clínicas basadas en la «mejor evidencia» disponible95,96.
ConclusionesDe acuerdo con los resultados y con el nivel de evidencia de los artículos incluidos, y con los indicadores de calidad de las revistas en las que fueron publicados, resulta posible concluir —de forma general— que la presencia de microorganismos periodontales en el líquido sinovial de pacientes con EP y AR podría explicar:
- 1.
Los niveles aumentados (p<0,05) de anticuerpos IgG e IgA específicos para P. gingivalis en líquido sinovial, además del aumento de los niveles de anticuerpos anti-CCP, fueron asociados a la presencia de P. gingivalis, debido a su función enzimática PAD y a su capacidad de citrulinar proteínas, lo que se ha considerado como el enlace biológico plausible entre ambas enfermedades.
- 2.
La prevalencia de ADN de P. gingivalis —principalmente— y de otros microorganismos periodontales (F. nucleatum, T. forsythia, P. intermedia, A. actinomycetemcomitans, P. nigrescens y T. denticola) en líquido sinovial, reportada en los estudios, refuerza el paradigma de que ambas enfermedades pueden estar ligadas, debido a que la biopelícula oral ejerce un estímulo constante en el sistema inmune, lo que puede estar asociado al proceso inflamatorio crónico local con inflamación sistémica de bajo grado.
Sin embargo, la evidencia que ofrecen los estudios incluidos en esta revisión sistemática no pone de manifiesto que P. gingivalis sea un factor etiológico de la AR en humanos. A pesar de que su ADN ha sido identificado en muestras de líquido sinovial humano, que P. gingivalis estimule la producción de anticuerpos anti-CCP en los tejidos que infecta, incluso en las articulaciones sinoviales, tal y como ha sido comprobado en modelos animales, aún es una posibilidad.
FinanciaciónEste artículo original deriva del proyecto de investigación Asociación entre estrés académico y niveles de proteína C reactiva en estudiantes de la carrera de medicina de la Pontificia Universidad Javeriana Cali, el cual fue financiado por la Convocatoria Interna 2015-2016 de la Pontificia Universidad Javeriana Cali (Colombia).
Conflicto de interesesLos autores del artículo hacen constar que no existe, de manera directa o indirecta, ningún tipo de conflicto de intereses que pueda poner en peligro la validez de lo comunicado.