La terapia antifactor de necrosis tumoral se ha convertido en los últimos años en uno de los pilares fundamentales para el tratamiento de la artritis reumatoide. El adalimumab es un anticuerpo monoclonal humanizado empleado en el tratamiento de la artritis reumatoide. Se describe un caso de lupus cutáneo inducido por adalimumab.
Tumor necrosis factor inhibitors have become one of the most important treatments of rheumatoid arthritis. Adalimumab is a monoclonal antibody used for the treatment of this condition. A case is described of adalimumab induced cutaneous lupus.
La terapia antifactor de necrosis tumoral (TNF) es ampliamente utilizada en el tratamiento de la artritis reumatoide (AR), en aquellos pacientes que no responden a la terapia convencional con fármacos modificadores de la enfermedad (DMARD). El adalimumab es un anticuerpo monoclonal humano, en la mayoría de los casos con buena tolerancia y escasos efectos adversos. En el presente caso se reporta una paciente de 55 años a quien después de haber recibido terapia de manera intermitente con adalimumab durante 7 años, se le diagnostica lupus cutáneo inducido por este medicamento.
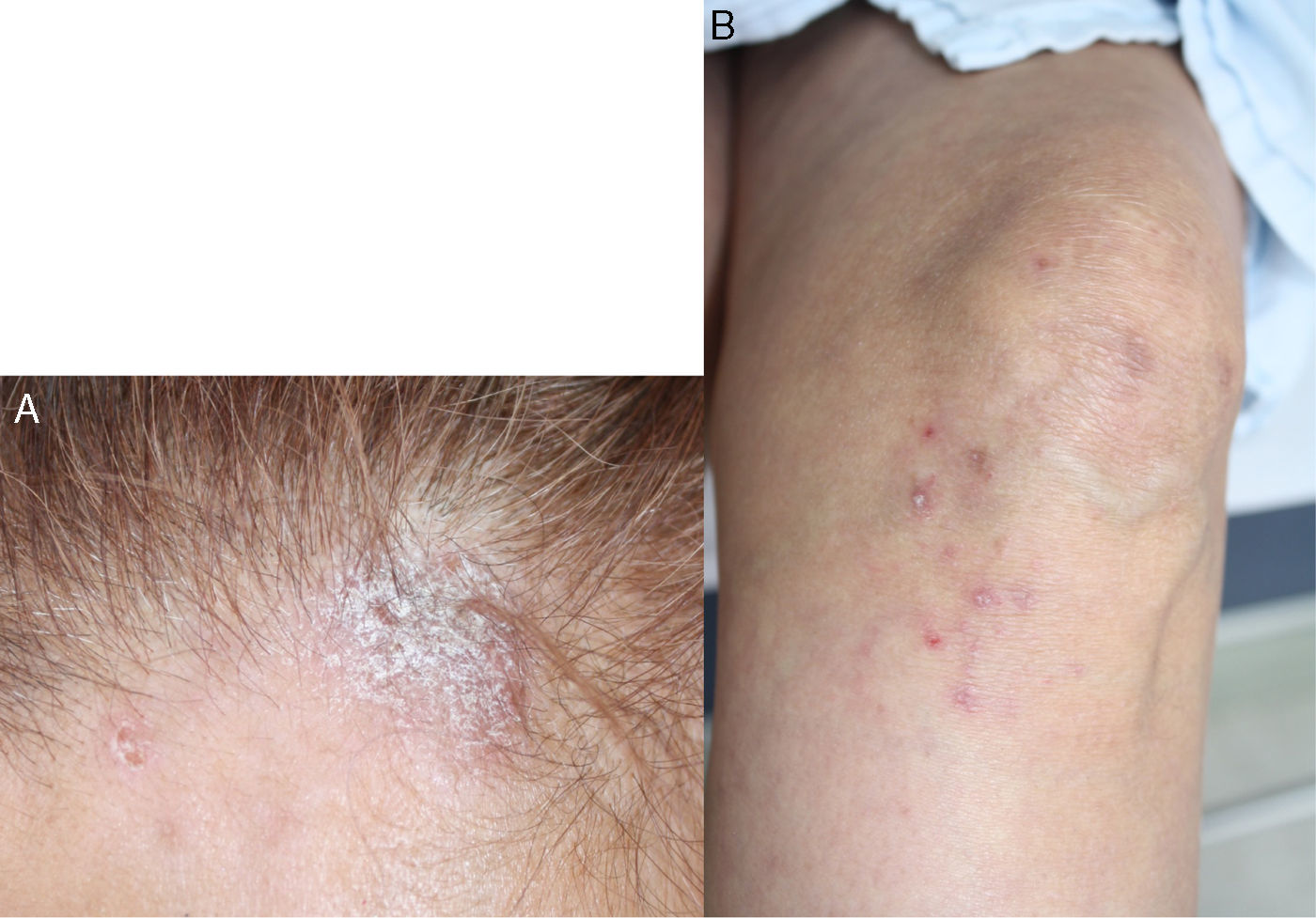
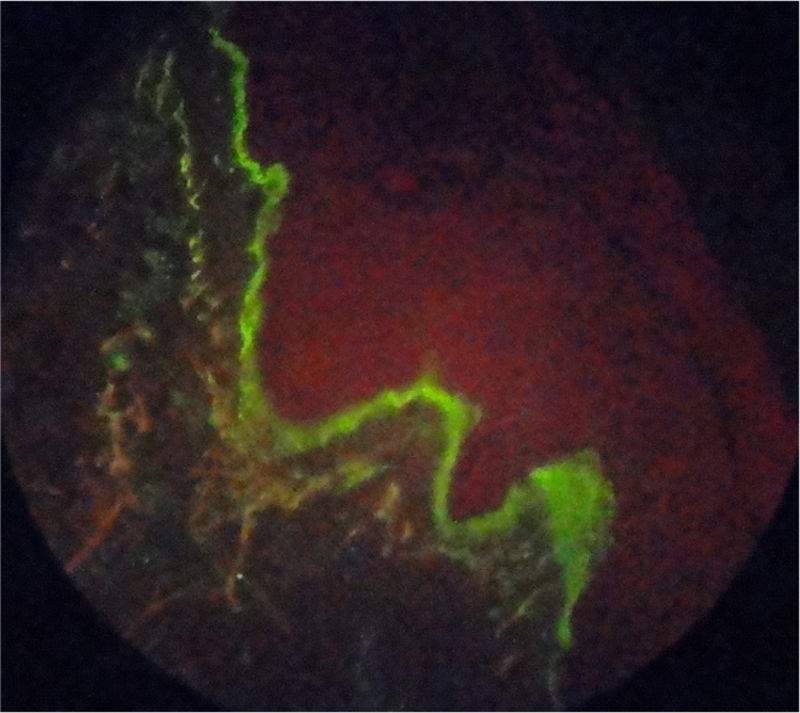
Reporte de casoPaciente de 55 años con antecedente de AR diagnosticada a los 39 años de edad, quien recibió terapia biológica con adalimumab durante 4 años consecutivos (2005 a 2009), sin embargo, en el momento de la consulta esta terapia había sido suspendida desde hacía 4 meses por dificultades administrativas con su administradora de salud, y desde entonces continuaba en manejo con metotrexato 12,5mg cada semana y sulfazalazina 500mg cada 12 h, los cuales había recibido desde el año 1994. Relataba excelente respuesta y adecuada tolerancia a la terapia biológica instaurada, sin embargo, desde el momento de su suspensión inicia con actividad de su patología de base, consistente en artritis de muñecas y articulaciones interfalángicas proximales, con franco deterioro de su clase funcional y limitación para la realización de actividades de la vida diaria. En los paraclínicos se evidencia elevación de reactantes de fase aguda, PCR 4,5mg/dl (valor de referencia: 0 a 1mg/dl) y VSG 65mm/hora (valor de referencia menor a 20mm/hora) por lo cual se decide reinicio de terapia biológica con adalimumab 40mg subcutáneo cada 15 días, superando en este momento los inconvenientes administrativos que impidieron durante 4 meses la aplicación de este biológico. En el mes de junio de 2011 consulta por aparición de lesiones en piel consistentes en xerodermia en manos y piernas con aparición de lesiones psoriasiformes tipo placas eritematosas en áreas fotoexpuestas, descamativas, en primer y segundo dedo de mano izquierda y región anterior de cuello, las cuales se extendieron en el transcurso de un mes hacia manos, piernas, dorso, pabellón auricular y cuero cabelludo, con prurito asociado (fig. 1). Se realiza toma de biopsia de piel la cual reporta dermatitis de interfase con adelgazamiento de la epidermis y degeneración vacuolar de la capa basal, con inmunofluorescencia positiva para IgM en patrón de membrana fuerte (fig. 2). Se solicitaron laboratorios encontrando hemograma normal, anti-DNA negativo, complemento normal, anti-Ro 24 unidades (débilmente positivos, valor referencia: menor 20 U), anti-La, anti-RNP y anti-Sm negativos, autoanticuerpos antinucleares (ANAS) positivos 1/640 patrón moteado y anticuerpos antihistonas 7,4 U/l (valor referencia: menor a 1 U/l), confirmando el diagnóstico de lupus cutáneo subagudo. La paciente no tiene estudios previos de autoinmunidad para contrastar estos resultados con exámenes previos.
La paciente presenta progresión e intensificación de sus síntomas cutáneos asociándose, además, a livedo reticularis. Se realiza diagnóstico de lupus cutáneo inducido por adalimumab y se suspende su aplicación (octubre de 2011). En el seguimiento posterior se observa desaparición completa de lesiones cutáneas 4 semanas después de haber suspendido el medicamento biológico.
DiscusiónLa terapia antifactor de necrosis tumoral es utilizada para el manejo de artritis reumatoide. Dentro de sus efectos adversos principales se encuentran el incremento en el riesgo de infecciones oportunistas, principalmente tuberculosis1 y la aparición de fenómenos autoinmunes, entre ellos formación de ANAS y anticuerpos anti-DNA de doble cadena (anti-DNAds) asociado a síndrome de lupus inducido por medicamentos2–6.
Los reportes de casos de lupus inducido por adalimumab son escasos6–9, y dentro de los encontrados son pocos los que describen manifestaciones cutáneas únicas como la paciente descrita, prevaleciendo los secundarios a otras terapias biológicas, principalmente infliximab y etanercept, y el compromiso por lupus sistémico7,8.
Dentro de los casos encontrados en la literatura se describen dos pacientes con diagnóstico de AR en manejo con etanercept y uno con infliximab, sin embargo, estos se manifestaron con compromiso sistémico asociado a manifestaciones cutáneas7. Posteriormente se publica un nuevo caso de una paciente de 53 años con diagnóstico de lupus eritematoso discoide-like inducido por infliximab con diagnóstico de base de AR comprobado mediante estudio anatomopatológico y de inmunifluorescencia9.
En el registro francés publicado en el año 2005 se presentan 10 casos de pacientes con manifestaciones cutáneas aisladas o toxicodermias asociadas a uso de terapia biológica en contexto de autoinmunidad, 4 de ellos con etanercept y 6 con infliximab, sin embargo, fue mayor el número de pacientes que presentaron manifestaciones sistémicas (12 en total), 9 asociadas a infliximab y 3 a etanercept4.
Encontramos una serie de casos adicional de 14 pacientes con seguimiento durante 8 años, 10 de ellos con diagnóstico de enfermedad de Crohn y 4 con AR, de los cuales 13 fueron tratados con infliximab y uno con adalimumab, los cuales presentaron síndrome lupus-like con manifestaciones sistémicas, con resolución posterior a la suspensión de la terapia biológica5.
Con respecto a casos reportados por adalimumab, los reportes son escasos, confinados a pacientes con diagnóstico de AR y enfermedad de Crohn (la mayoría de los casos), sin embargo, son pocos aquellos que presentan como única manifestación el compromiso cutáneo como nuestra paciente. Las manifestaciones sistémicas de lupus inducido por adalimumab son variables, con respecto a grados de severidad y compromiso de órgano blanco. Dentro de los hallazgos dermatológicos descritos en la literatura, han sido reportadas reacciones locales asociadas al sitio anatómico de administración, como la presencia de exantema pápulo-pustular en el sitio de aplicación y en palmas y plantas, con resolución completa posterior a la suspensión del medicamento10.
En el año 2011 se describió un caso de una paciente de 53 años, con diagnóstico de enfermedad de Crohn en tratamiento con adalimumab, complicado con lupus eritematoso con compromiso en sistema nervioso central, asociado a derrame pleural, derrame pericárdico y ascitis, requiriendo manejo con altas dosis de glucocorticoides, sin embargo, a diferencia de nuestra paciente, el perfil inmunológico fue normal antes, durante y después de la terapia con este medicamento2.
Se han reportado casos similares al nuestro, en cuanto a seroconversión inmunológica evidenciada mediante pruebas de laboratorios entre ellos ANAS, anti-DNA y anticoagulante lúpico, en un paciente con enfermedad de Crohn, cuyas manifestaciones sistémicas consistieron en úlceras orales, artritis, fiebre, rash en dorso de manos y fatiga, sin embargo, como fue descrito previamente, nuestra paciente no cursó con manifestaciones sistémicas5.
Dentro de la literatura revisada, encontramos un caso de lupus eritematoso cutáneo inducido por adalimumab de características clínicas similares, en una paciente de 61 años con diagnóstico de AR, quien tras meses de haber recibido terapia biológica con adalimumab a dosis de 40mg subcutánea, cada 2 semanas, presenta positividad de ANAS de patrón homogéneo con títulos que fueron incrementándose en los siguientes dos años (1/160 hasta 1/640) con posterior aparición de placas descamativas eritematosas en cara y tronco, no asociado a ningún otro síntoma, con reporte de biopsia compatible con lupus cutáneo (no se realizó inmunofluorescencia, a diferencia de nuestra paciente), por lo que se suspendió adalimumab y después de dos meses de su suspensión desaparecieron las lesiones dermatológicas11. No se reportó realización de anticuerpos antihistonas. Un segundo caso se reportó en Brasil12 en una mujer de 42 años con artritis psoriásica, quien presenta lupus inducido por adalimumab con vasculitis leucocitoclástica, después de 22 meses de tratamiento con esta terapia biológica. El cuadro se caracterizó por mialgias, artralgias en codos y muñecas, febrícula (38 grados centígrados) y lesiones dermatológicas (pápulas purpúricas en la punta de los dedos de las manos con telangiectasias periungueales. Desde el punto de vista de paraclínicos presentó positividad para ANAS (1/640 patrón homogéneo) y anticuerpos antihistona (no anotan el valor exacto).
El mecanismo inmunopatológico del lupus inducido por adalimumab aún es desconocido, se cree que se trata de un proceso mediado por inmunidad celular que involucra dos fases, la primera en donde la activación de linfocitos TH1 incrementa la producción de citoquinas proinflamatorias, especialmente interferón gamma e IL2, que estimulan la producción de autoanticuerpos y la segunda fase que corresponde a la producción de otras citoquinas por los linfocitos TH2 encargadas de perpetuar los niveles de dichos anticuerpos en sangre. Se propone que esta terapia bloquea de manera preferente la producción de interferón gamma (INF gamma) y con esta inhibición se bloquea la regulación a la alta del Fas dependiente de INF gamma, con la consecuente falta de inhibición de citoquinas como IL4, IL6, IL10, sugiriendo que la terapia con adalimumab promueve la aparición de autoinmunidad humoral mediante la inhibición selectiva de la respuesta de linfocitos T citotóxicos, que en condiciones normales debería inhibir las células B autorreactivas13,14. Otros autores sugieren que este medicamento ejerce un efecto similar a los rayos ultravioleta, induciendo apoptosis celular y con esta, acumulación de material nucleosomal formador de autoanticuerpos o que el incremento en la frecuencia de complicaciones infecciosas de estos pacientes predispone a la activación policlonal de linfocitos B y a sobreexpresión de receptores tipo-Toll 9, con la consecuente formación de anticuerpos15,16, sin embargo, se cree que la participación de la predisposición genética juega un papel primordial en el desarrollo de estas manifestaciones, entre las descritas el polimorfismo TNF alfa 308 A16.
La suspensión de la terapia es la principal medida terapéutica, y la mayoría de los pacientes presentan resolución de sus manifestaciones clínicas después de esta, en un período aproximado de 6 a 12 semanas.
ConclusiónPresentamos un caso de lupus cutáneo inducido por adalimumab, con cambios histopatológicos compatibles y presencia de ANAS, anti-Ro y anticuerpos antihistona positivo, sin manifestaciones sistémicas, con resolución completa del cuadro después de la suspensión del medicamento biológico. El médico reumatólogo o el médico especialista prescriptor de terapias biológicas como los anti-TNF y dentro de ellos, adalimumab, debe estar atento a situaciones paradójicas como la descrita en el presente caso clínico, consistente en la aparición de fenómenos autoinmunes, secundarios al tratamiento de enfermedades autoinmunes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.