Comparar y caracterizar modelos de osteoartritis inducida en ratas en una fase temprana (7 días luego de la inducción).
Materiales y métodosEste es un estudio retrospectivo que compara resultados de experiencias previas. Se compararon los modelos de: a) corte del ligamento cruzado anterior (CLX), y artritis inducida por adyuvante en sus 2 variedades, b) subplantar (ASP) y c) intraarticular (AIA). Las variables analizadas fueron: estado clínico, histología, radiología y marcadores séricos de inflamación (IL-1β, IL-4, IL-6, TNF-α, MMP-2 y MMP-9).
ResultadosEl modelo AIA presenta diferencias significativas en diversos parámetros cuando se compara con el grupo control. Además, los niveles de IL-1 fueron elevados en todos los modelos de osteoartritis respecto al basal, siendo más pronunciados en los grupos CLX y AIA (p<0,001). Por otra parte, el valor más bajo de IL-4 fue observado en el grupo AIA (p<0,001 frente al grupo basal). Además, los valores más elevados de MMP-2 fueron observados en el modelo ASP.
ConclusionesSi bien se usan y se comparan de manera indistinta los modelos de artritis en ratas como si fueran similares, en este trabajo demostramos que en un estadio temprano los modelos se comportan bastante diferentes en la mayoría de las variables estudiadas.
To assess osteoarthritis in rat models at an early stage (7 days after induction).
Materials and methodsThis is a retrospective study comparing results from previous experiments. The models compared were: a) anterior cruciate ligament transection model (CLX), and an adjuvant-induced arthritis model in two varieties b) sub-plantar (ASP), and c) intra-articular (AIA). Seven days after osteoarthritis (OA) induction, an analysis was made of the clinical, histological, radiological, and serological inflammatory markers (IL-1β, IL-4, IL-6, TNF-α, MMP-2, and MMP-9).
ResultsThe AIA model produced significant differences in several parameters, when compared to the control group. However, the levels of IL-1 were higher in all OA models than in the baseline group, being more pronounced in the CXL and AIA groups (P<.001). Surprisingly, the lowest value for IL-4 was observed in the AIA group (P<.001 versus baseline group). Furthermore, the most elevated values of MMP-2 were observed in the ASP model.
ConclusionsAlthough arthritis rat models are used and compared interchangeably as if they were the same, it is shown in this work that at an early stage the models behave quite different in most of the studied variables.
Las artritis en sus diversas presentaciones nosológicas son enfermedades que presentan un curso progresivo, con algunos periodos de remisión, causan dolor y suelen dejar secuelas. En medicina humana la artritis reumatoide es de particular importancia por su incidencia, mientras que en medicina veterinaria los equinos deportivos presentan artritis de curso crónico y progresivo con reagudizaciones esporádicas, en general por sobrecarga mecánica relacionada con la actividad deportiva. El manejo adecuado de la osteoartritis (OA) permitiría reducir las altas pérdidas económicas ocasionadas por el retiro temprano de animales de la competencia deportiva.
Tanto para el estudio de la artritis en humanos como en equinos se ha trabajado desde hace tiempo con modelos murinos de artritis, con el propósito de comprender la fisiopatología de la enfermedad y de evaluar la utilidad de drogas antiartríticas. Sin embargo, existen varios modelos de artritis en ratas que guardan relación con las enfermedades estudiadas en humanos y otras especies, pero los mismos no han sido bien caracterizados desde el punto de vista de la respuesta temprana en sus aspectos clínicos, histológicos, radiológicos, así como tampoco en cuanto a su perfil sérico inflamatorio. Considerando las normas correspondientes al uso racional de animales de laboratorio1, surgió la posibilidad de comparar retrospectivamente los resultados de distintas experiencias realizadas en nuestro laboratorio basadas en el uso de algunos de los modelos propuestos para el estudio de la artritis.
En este trabajo comparamos 3 modelos murinos, que si bien están ampliamente difundidos en artritis experimental no se ha aclarado previamente cuál es el tipo de artritis que cada uno de ellos mejor representa, así como tampoco ha sido notificado cuáles son los métodos complementarios más pertinentes para el estudio de cada una de estas artritis.
Es decir, por un lado estos modelos han sido usados, indistintamente, tanto para evaluar fenómenos agudos como crónicos, y en cuanto a la determinación de marcadores moleculares de la inflamación hay contrariedades en la información para cada modelo. Actualmente, el rol que cumplirían los biomarcadores en la OA resulta incierto, y esto es en gran parte debido a la diversidad de modelos de artritis que se han estado utilizando. La validación y utilización biológica de los biomarcadores moleculares podría resultar de suma utilidad para la práctica clínica en el diagnóstico y monitorización de la OA, siempre y cuando se conozca cómo varían los niveles de estos biomarcadores según las distintas presentaciones de la OA y cómo se asocian los niveles de ellos entre sí.
En este trabajo comparamos 3 modelos que hemos utilizado, estos son: el de sección de ligamentos cruzados (CLX) y el de artritis inducida por adyuvante en 2 modalidades, intraarticular (AIA) y subplantar (ASP).
El modelo de CLX supondría un tipo de artritis crónica producido por el desgaste de las carillas articulares como consecuencia de la inestabilidad producida en la articulación injuriada; este modelo podría corresponderse con un buen modelo del desgaste deportivo por sobreentrenamiento.
Por otra parte, la artritis inducida por adyuvante ha sido un modelo ampliamente utilizado para inducir la patogenia de la artritis reumatoide2, así mismo, este modelo puede ser utilizado para asemejar otros tipos de artritis reactivas que suelen ser muy frecuentes en medicina veterinaria. La artritis puede ser fácilmente inducida por inoculación subcutánea de Mycobacterium tuberculosis H37Ra (Mtb) inactivada por calor y suspendida en excipiente oleoso. Por otra parte, el modelo de artritis inducida por adyuvante se ha estado utilizando como modelo general de inflamación para permitir evaluar el uso de antiinflamatorios. Cabe mencionar que por factores genéticos3 no todas las cepas de ratas son factibles de ser inducidas, sin embargo, funciona bien en Sprague-Dawley4 y Lewis5. Algunos de los factores estudiados a los que se les atribuye la susceptibilidad de estas cepas para generar la artritis inducida por adyuvante serían el incremento en la expresión de la hsp47 articular con el incremento de colágeno tipo I y el desarrollo de anticuerpos anti-hsp476, así como también la migración de leucocitos hacia la articulación y el rol del factor quimiotáctico MCP-17. Este modelo general de inflamación ha sido utilizado para evaluar el efecto antiartrítico de diferentes drogas8.
Ciertos autores en sus trabajos han administrado el adyuvante para inducir la artritis por vía intraarticular en la rodilla y evalúan la respuesta a los 3 y 5 días posadministración9.
En nuestro trabajo decidimos comparar la experiencia del uso de estas 2 vías de adyuvante, ya que la diferente forma de aplicación parecería generar efectos diversos. Si bien la administración de adyuvante produce un modelo de artritis que se asemeja a la artritis reumatoide, este modelo también resulta válido para otros tipos de artritis que se dan en medicina veterinaria, siendo que este modelo se caracteriza por presentar un buen componente inflamatorio y un importante daño del cartílago articular10. Por el contrario, el modelo de CLX ha sido usado para simular una evolución más crónica de la OA11. Si bien existen trabajos publicados con diferentes modelos12, la caracterización y comparación propiamente dicha del modelo utilizado respecto a otros resulta dificultosa porque los diferentes tiempos, drogas y variables aplicadas no se mantienen constantes en todos los trabajos.
En virtud de nuestro interés de medir mediadores moleculares de inflamación como citoquinas y MMP, en la bibliografía existen resultados contrapuestos probablemente por los diferentes modelos y tiempos de muestreos. El objetivo de este trabajo es caracterizar y comparar patrones relacionados con la sintomatología clínica, radiológica e histopatológica, así como también el estudio de biomarcadores moleculares inflamatorios en ratas que presentaban diferentes modelos de artritis en una etapa temprana de los mismos (7 días).
Materiales y métodosDiseño experimental y animales. En este trabajo se comparan resultados de experiencias previas de nuestro grupo; se tomó como día de referencia el día 7, ya que fue el día más representativo para todos los modelos. Se utilizaron 40 ratas Sprague Dolley de 2 meses (200-250g) criadas en el Bioterio Central de la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires (10 animales por grupo). Todos los animales fueron mantenidos a 22°C con ciclos de luz de 12h, con acceso a comida y agua ad libitum. Los grupos fueron: i) basal o baseline, animales a los cuales no se les realizó ningún procedimiento; ii) sección de ligamento cruzado anterior (CLX), este grupo se realizó mediante un procedimiento quirúrgico con anestesia ketamina/xilacina11; iii) artritis inducida por adyuvante subplantar (ASP), a este grupo se le inoculó 0,1ml de adyuvante completo de Freund (Sigma, St Louis, EE.UU.) por vía subplantar13, y iv) artritis inducida por adyuvante intraarticular (AIA), a este grupo se le inoculó 0,1ml de adyuvante completo de Freund por vía intraarticular en la articulación femorotibiorrotuliana14.
De cada grupo de 10 animales, al sacrificio, 5 animales se utilizaron para estudios radiológicos e histopatológicos y los otros 5 para medir biomarcadores inflamatorios a partir de homogenatos articulares. Los animales fueron sacrificados por sangrado a blanco, bajo anestesia general de ketamina-xilacina. Los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL) de la Facultad de Ciencias Veterinarias, Universidad de Buenos Aires.
Puntaje clínico. Se definió un puntaje de 0 a 415 según el grado de gravedad de la claudicación: 0 representa ausencia de claudicación; 1: claudicación apenas perceptible; 2: claudicación moderada; 3: claudicación muy marcada en la que en ocasiones el animal sustrae al apoyo el miembro, y 4: se presenta con sustracción al apoyo la mayor parte del tiempo. La observación de los síntomas se realizó diariamente.
Puntaje histopatológico. Una vez finalizada la experiencia se procedió a la eutanasia de las ratas y se extrajeron las articulaciones: tibiotarsiana y femorotibiorrotuliana, para evaluación histopatológica. Las muestras se fijaron en formol al 10% y se realizó un proceso estándar de descalcificación para muestras óseas. Los cortes se tiñeron con hematoxilina/eosina. Las muestras observadas se clasificaron de 0 a 6 según el grado de infiltración celular y resorción ósea del hueso subyacente según el puntaje de Pritzker12,16.
Estudios radiográficos. Se realizaron estudios radiográficos con equipo de rayosX con radiovisiógrafo digital (Kodak), especial para muestras de animales de laboratorio. Se radiografiaron las articulaciones femorotibiorrotuliana y tibiotarsiana. Las placas se analizaron mediante puntaje radiográfico, de acuerdo con lo descrito previamente por otros autores17, con ligeras modificaciones. Brevemente, estrechamiento del espacio articular (0-3) y daño del contorno articular (0-3), siendo el rango total de 0 a 6.
Zimografías. La actividad de MMP-2 y MMP-9 se analizó mediante zimografía en geles de poliacrilamida con el agregado de gelatina. La muestra consistió en lisados articulares que se realizaron disecando la articulación femorotibiorrotuliana para trituración en homogeneizador; las muestras se recuperaron en buffer de extracción de proteínas (50mM Tris-HCl, 150mM NaCl, 1% Triton X-100), 1ml/g de tejido. Al producto obtenido se le determinó la concentración de proteínas utilizando un kit comercial (Wiener Lab.; Argentina). Alícuotas de 100μg se mezclaron con el buffer muestra y se calentaron por 3 minutos a 100°C, posteriormente se sembraron en el SDS-PAGE 10% con 0,2% de gelatina. Luego los geles fueron lavados con 50mM Tris-HCl pH 7,5 con el agregado de 2,5% de Triton X-100 durante 45min, seguido de lavado con 50mM Tris HCl 5mM CaCl 1 μM ZnCl2 pH 7,5 con el agregado de 2,5% de Triton X-100 pH 7,5 durante 45min. A continuación, se incubaron con 50mM Tris-HCl, 10mM CaCl2, 200mM NaCl pH 7,5 a 37°C por 24h. Finalmente, se tiñeron con 0,5% Coomassie Brilliant Blue R-250 por 2h y posteriormente fueron desteñidos con solución decolorante (25%v/v isopropanol 10%v/v ácido acético). La actividad gelatinolítica generó bandas claras, los geles fueron digitalizados y se realizó un estudio densitométrico de las bandas por medio del software J Image. La actividad zimográfica fue expresada como porcentaje respecto al grupo basal para la MMP-2 y como porcentaje respecto a la muestra control en el caso de la MMP-9. La explicación de esta decisión es que debido a que la MMP-9 se encuentra prácticamente ausente en muestras del grupo basal hubo que referirla como porcentaje de la muestra control. La cantidad que se cargó de la muestra control fue previamente titulada de acuerdo con su actividad para producir un porcentaje de saturación en la zimografía del 50%. Los datos correspondientes a diferentes geles fueron normalizados mediante la utilización de esta muestra control, que además sirvió de referente para el análisis densitométrico.
ELISA de IL-1β, IL-4, IL-6 y TNF-α. La concentración de citoquinas (IL-1β, IL-4, IL-6, TNF-α) en los sobrenadantes de los lisados articulares, preparados al igual que lo descrito en el ítem anterior, fue determinada mediante ELISA de captura comercial BD OptEIA (BD, Biosciences, San Diego, CA, EE.UU.), siguiendo las recomendaciones del fabricante. Las concentraciones se determinaron mediante curva patrón realizada con la respectiva citoquina recombinante suministrada por el kit. Se leyeron las muestras en lector de microplacas Rayto 2100 (China) a 450nm.
Análisis estadísticos. Los análisis estadísticos y los gráficos se realizaron utilizando el software Instat3. Se aplicó ANOVA para establecer si existían diferencias estadísticamente significativas entre los distintos grupos experimentales (p≤0,05) y luego el test de Tukey de comparaciones múltiples.
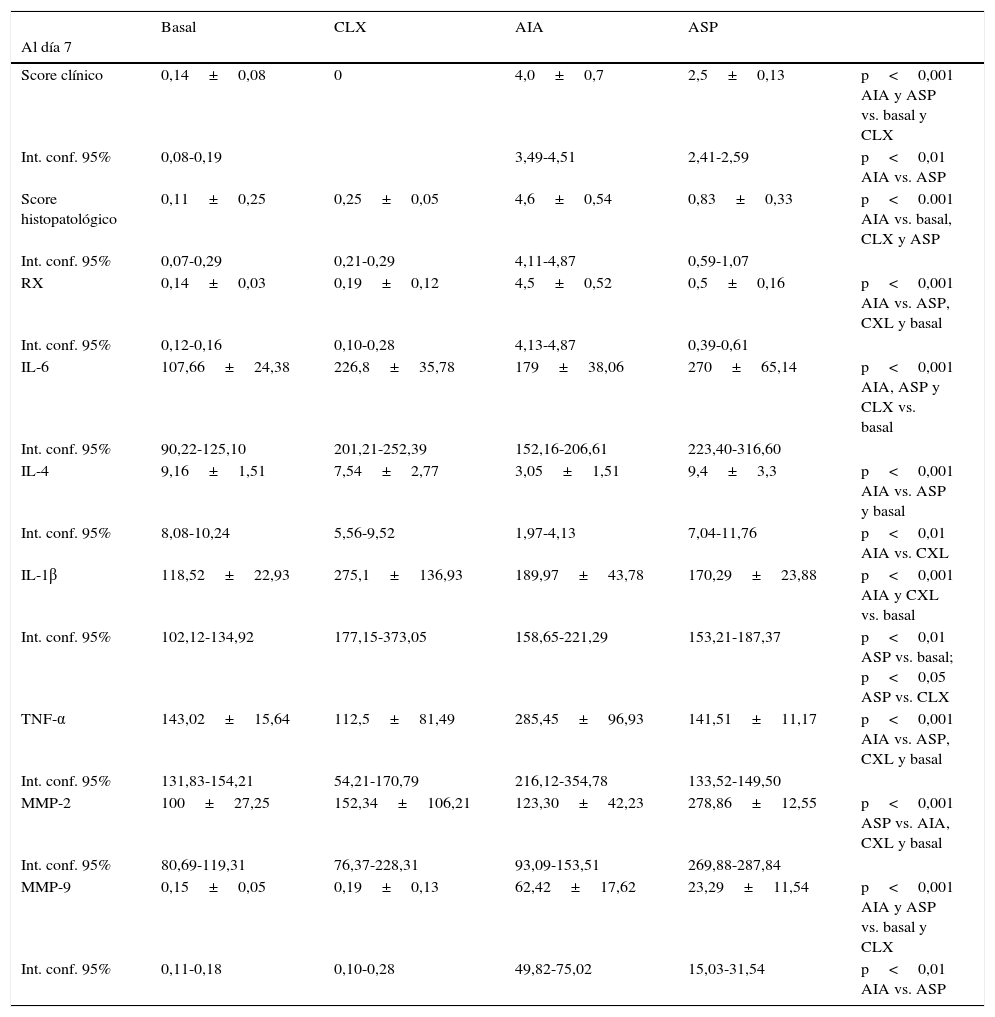
ResultadosLa tabla 1 resume los valores de los resultados obtenidos, que serán analizados a continuación en detalle.
Valores de los resultados de las diferentes variables estudiadas para cada modelo. Se aplicó ANOVA seguido del test de Tukey
Al día 7 | Basal | CLX | AIA | ASP | |
|---|---|---|---|---|---|
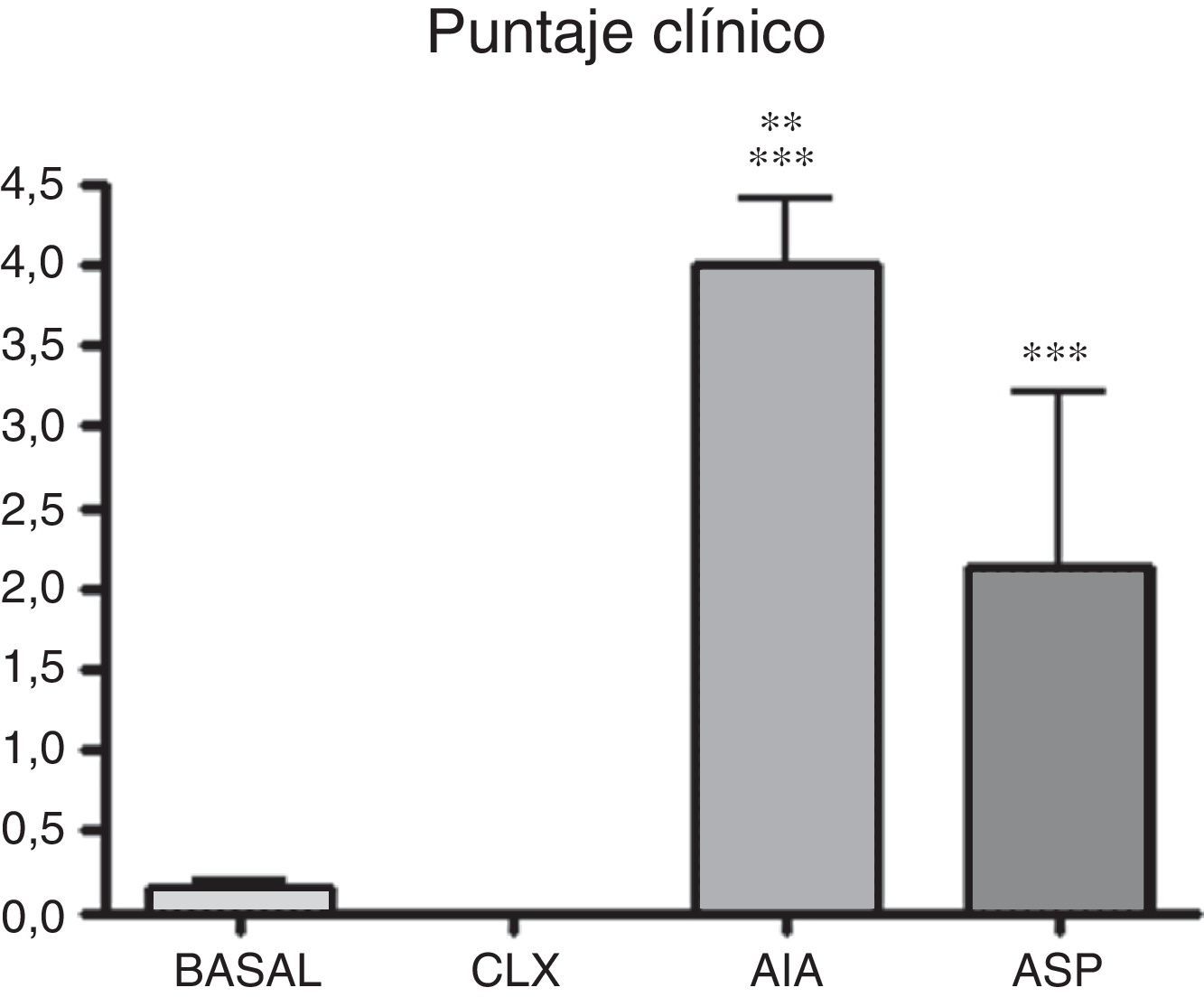
| Score clínico | 0,14±0,08 | 0 | 4,0±0,7 | 2,5±0,13 | p<0,001 AIA y ASP vs. basal y CLX |
| Int. conf. 95% | 0,08-0,19 | 3,49-4,51 | 2,41-2,59 | p<0,01 AIA vs. ASP | |
| Score histopatológico | 0,11±0,25 | 0,25±0,05 | 4,6±0,54 | 0,83±0,33 | p<0.001 AIA vs. basal, CLX y ASP |
| Int. conf. 95% | 0,07-0,29 | 0,21-0,29 | 4,11-4,87 | 0,59-1,07 | |
| RX | 0,14±0,03 | 0,19±0,12 | 4,5±0,52 | 0,5±0,16 | p<0,001 AIA vs. ASP, CXL y basal |
| Int. conf. 95% | 0,12-0,16 | 0,10-0,28 | 4,13-4,87 | 0,39-0,61 | |
| IL-6 | 107,66±24,38 | 226,8±35,78 | 179±38,06 | 270±65,14 | p<0,001 AIA, ASP y CLX vs. basal |
| Int. conf. 95% | 90,22-125,10 | 201,21-252,39 | 152,16-206,61 | 223,40-316,60 | |
| IL-4 | 9,16±1,51 | 7,54±2,77 | 3,05±1,51 | 9,4±3,3 | p<0,001 AIA vs. ASP y basal |
| Int. conf. 95% | 8,08-10,24 | 5,56-9,52 | 1,97-4,13 | 7,04-11,76 | p<0,01 AIA vs. CXL |
| IL-1β | 118,52±22,93 | 275,1±136,93 | 189,97±43,78 | 170,29±23,88 | p<0,001 AIA y CXL vs. basal |
| Int. conf. 95% | 102,12-134,92 | 177,15-373,05 | 158,65-221,29 | 153,21-187,37 | p<0,01 ASP vs. basal; p<0,05 ASP vs. CLX |
| TNF-α | 143,02±15,64 | 112,5±81,49 | 285,45±96,93 | 141,51±11,17 | p<0,001 AIA vs. ASP, CXL y basal |
| Int. conf. 95% | 131,83-154,21 | 54,21-170,79 | 216,12-354,78 | 133,52-149,50 | |
| MMP-2 | 100±27,25 | 152,34±106,21 | 123,30±42,23 | 278,86±12,55 | p<0,001 ASP vs. AIA, CXL y basal |
| Int. conf. 95% | 80,69-119,31 | 76,37-228,31 | 93,09-153,51 | 269,88-287,84 | |
| MMP-9 | 0,15±0,05 | 0,19±0,13 | 62,42±17,62 | 23,29±11,54 | p<0,001 AIA y ASP vs. basal y CLX |
| Int. conf. 95% | 0,11-0,18 | 0,10-0,28 | 49,82-75,02 | 15,03-31,54 | p<0,01 AIA vs. ASP |
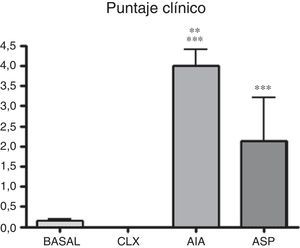
Puntaje clínico. Se puede observar que los modelos de artritis que producen diferencias significativas en el puntaje clínico respecto al grupo basal son el de AIA y ASP (p<0,001). Además, el modelo de AIA demostró ser clínicamente más agresivo que el de ASP (p<0,01). Estos resultados estarían indicando que, para realizar estudios de evaluación de sintomatología clínica y respuestas a una droga, los modelos de ASP y AIA requieren menos tiempo que el modelo de CLX. Estos 2 modelos además de la claudicación observada demostraban presentar en muchos casos deformación y edema del miembro (fig. 1).
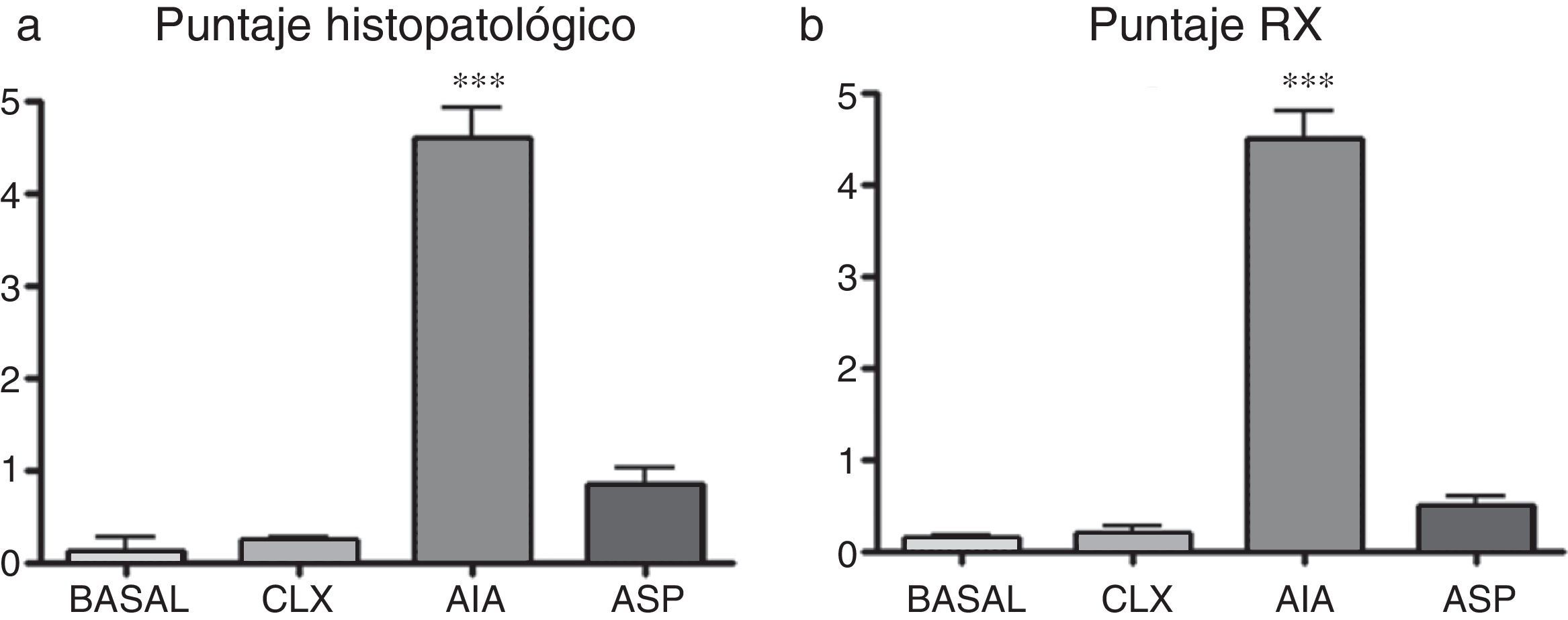
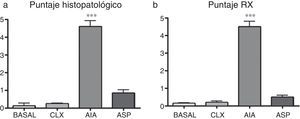
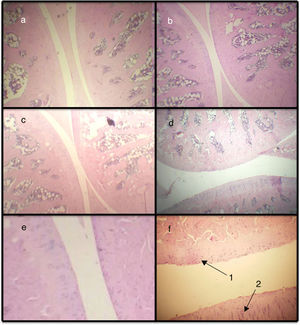
Puntaje histopatológico. Mediante el puntaje histopatológico se puede observar que los 3 modelos presentan diferencias significativas respecto al basal, siendo el modelo de AIA el que más diferencia presenta (fig. 2a y fig. 3). De esta manera, la AIA genera una reacción inflamatoria de manera intensa al día 7, en tanto que los otros 2 modelos, ASP y CLX, desarrollan lesiones de manera menos intensa. Los modelos de CLX y ASP presentaban principalmente escasas zonas de fibrilación superficial de la estructura del cartílago. Por otra parte, el modelo de AIA presentaba fisuras en el cartílago articular con pérdida de la matriz del cartílago e hipercelularidad (fig. 3).
a) Diferencias en los análisis histopatológicos entre los diferentes grupos cuantificados mediante un puntaje histológico. Se aplicó ANOVA seguido del test de Tukey. El grupo AIA presenta diferencias significativas (***p<0,001) vs. los 3 grupos restantes. b) Resultados del puntaje radiográfico en el cual se observa que el modelo que presenta mayores lesiones es el de AIA (***p<0,01 vs. el resto de los modelos).
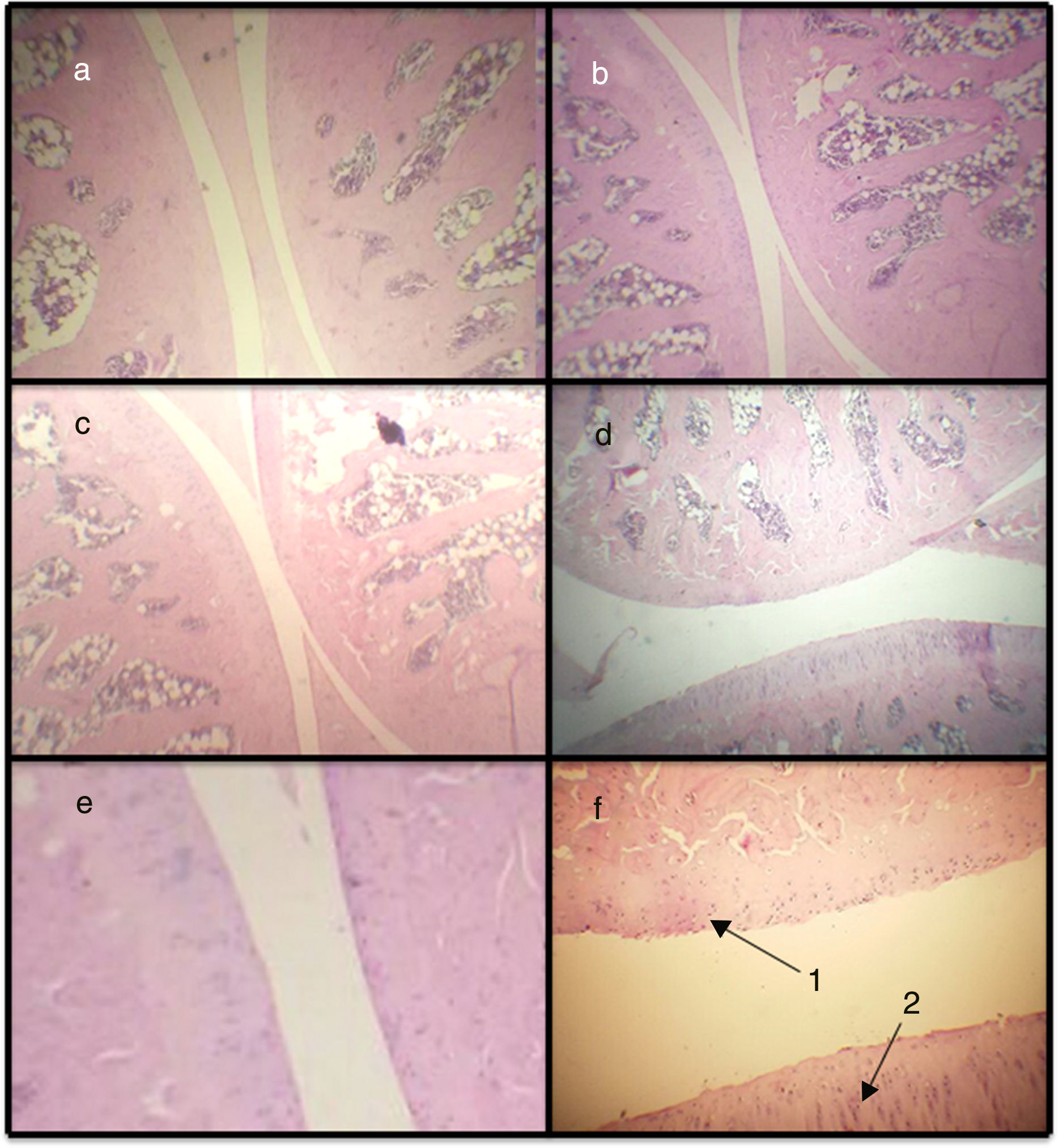
Microfotografías de cortes histológicos correspondientes a la articulación femorotibiorrotuliana. Basal (a), CLX (b), ASP (c) y AIA (d) (100×). Los cortes (e) y (f) corresponden a ampliación de sección sana y con daño respectivamente (400×). La figura (d) es la que presenta daños en la superficie articular y se encuentra ampliada. En (f) se observa fibrilación articular (1) e hipercelularidad (2) a nivel del cartílago articular.
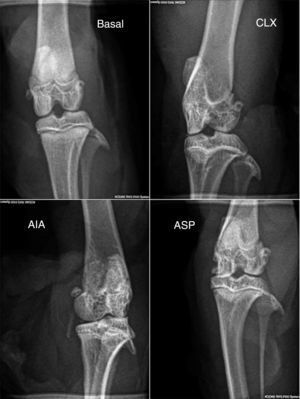
Puntaje radiológico. En el puntaje radiológico se obtuvieron resultados similares a los observados con los modelos en la histopatología. El modelo de AIA mostró diferencias significativas (p<0,01) respecto al resto de los modelos (fig. 2b y fig. 4), siendo el modelo de AIA el que mayor daño radiológico presentó, mostrando severa pérdida de contorno articular y estrechez del espacio articular. Por otra parte, los modelos de ASP y CLX evidenciaron grados leves de deformación y de estrechez del espacio articular (fig. 4).
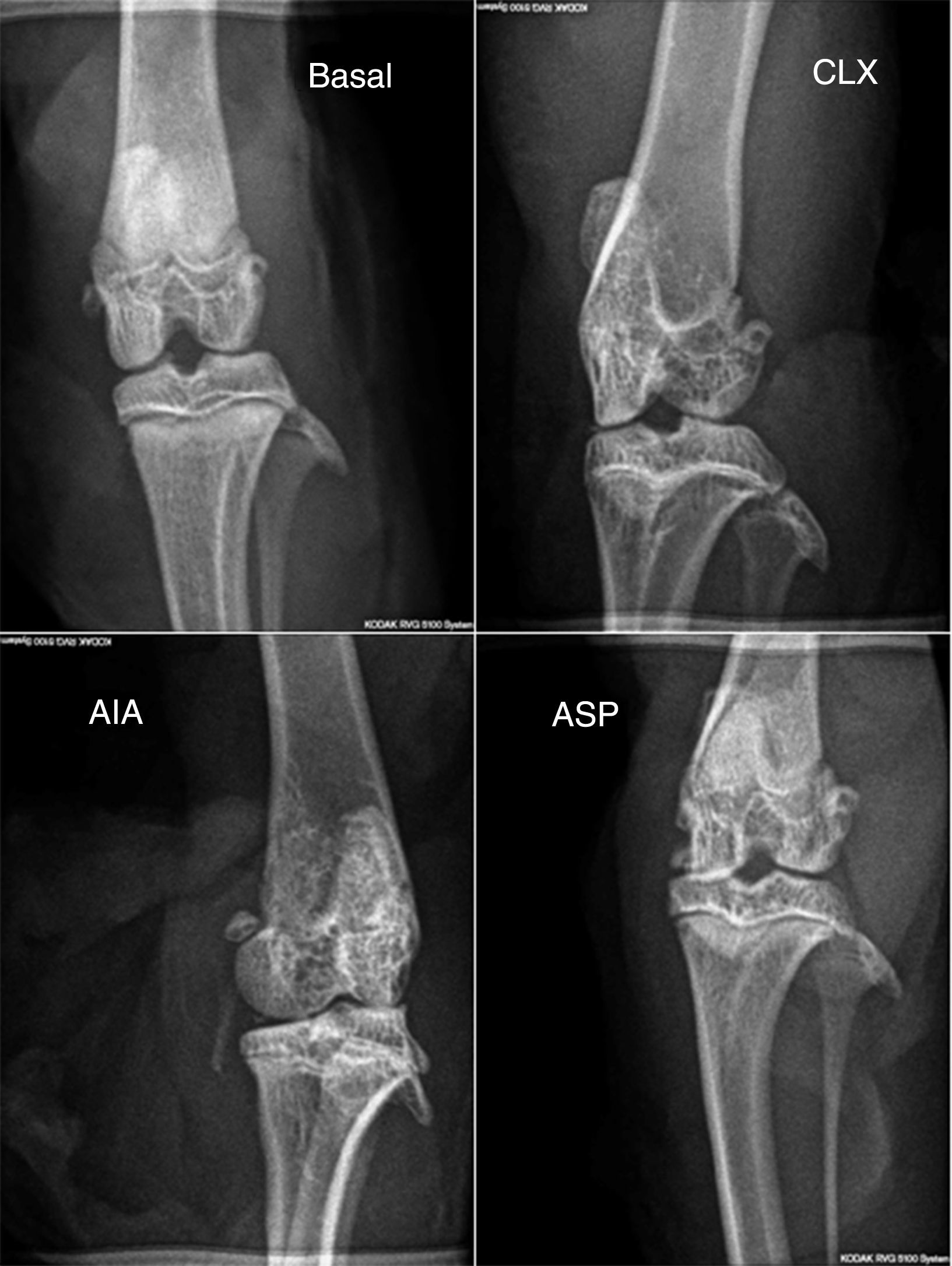
Radiografías en posición anteroposterior de los miembros de cada grupo (basal, CLX, AIA, ASP). Las mayores lesiones las presentó el grupo ASP, donde se observa cierto grado de deformación, erosión ósea, periostitis, estrechamiento del espacio articular, osteopenia y pérdida del contorno óseo.
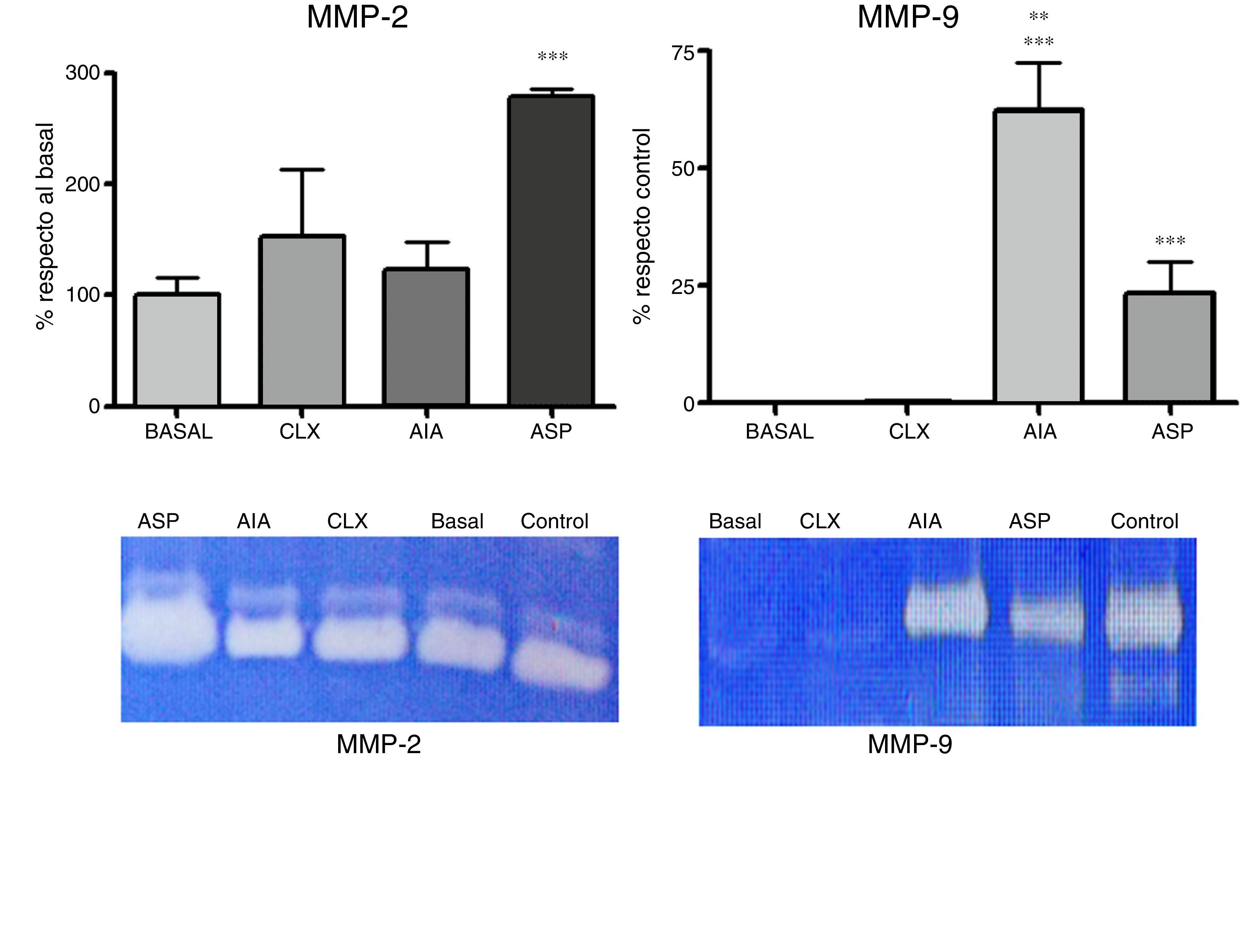
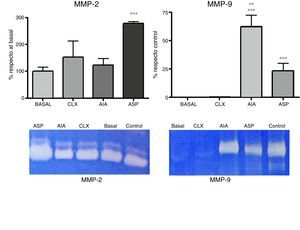
Zimografías. Los resultados zimográficos en SDS-PAGE con el agregado de gelatina mostraron 2 bandas correspondientes a la MMP-2 y MMP-9. De acuerdo con los estudios densitométricos referidos con las muestras patrones, pudimos observar que los niveles de MMP-2 estaban muy elevados en el modelo de ASP, siendo el único que presentaba diferencias significativas respecto al basal (p<0,01) (fig. 5). Asimismo, al analizar la MMP-9 observamos que estaba incrementada en los 2 modelos de artritis inducida por adyuvante (ASP y AIA), siendo que la MMP-9 se incrementa a nivel articular exclusivamente en procesos patológicos. Se destaca que el modelo de CLX al día 7 no presenta niveles elevados de MMP-9 (fig. 5).
Expresión de MMP-2 y MMP-9 a partir de homogenatos articulares para cada uno de los modelos, el control corresponde a una muestra de MMP-2 y MMP-9, respectivamente, que se utiliza para ubicar las bandas y referir la densitometría de diferentes geles. La MMP-2 se expresó como porcentaje de actividad respecto al grupo basal. La MMP-9 fue expresada como porcentaje de actividad respecto a la muestra control. Se aplicó ANOVA seguido del test de Tukey. Para la MMP-2: ***p<0,001 ASP vs. AIA, CXL y basal. Para MMP-9: ***p<0,001 AIA y ASP vs. basal y CLX, **p<0,01 AIA vs. ASP.
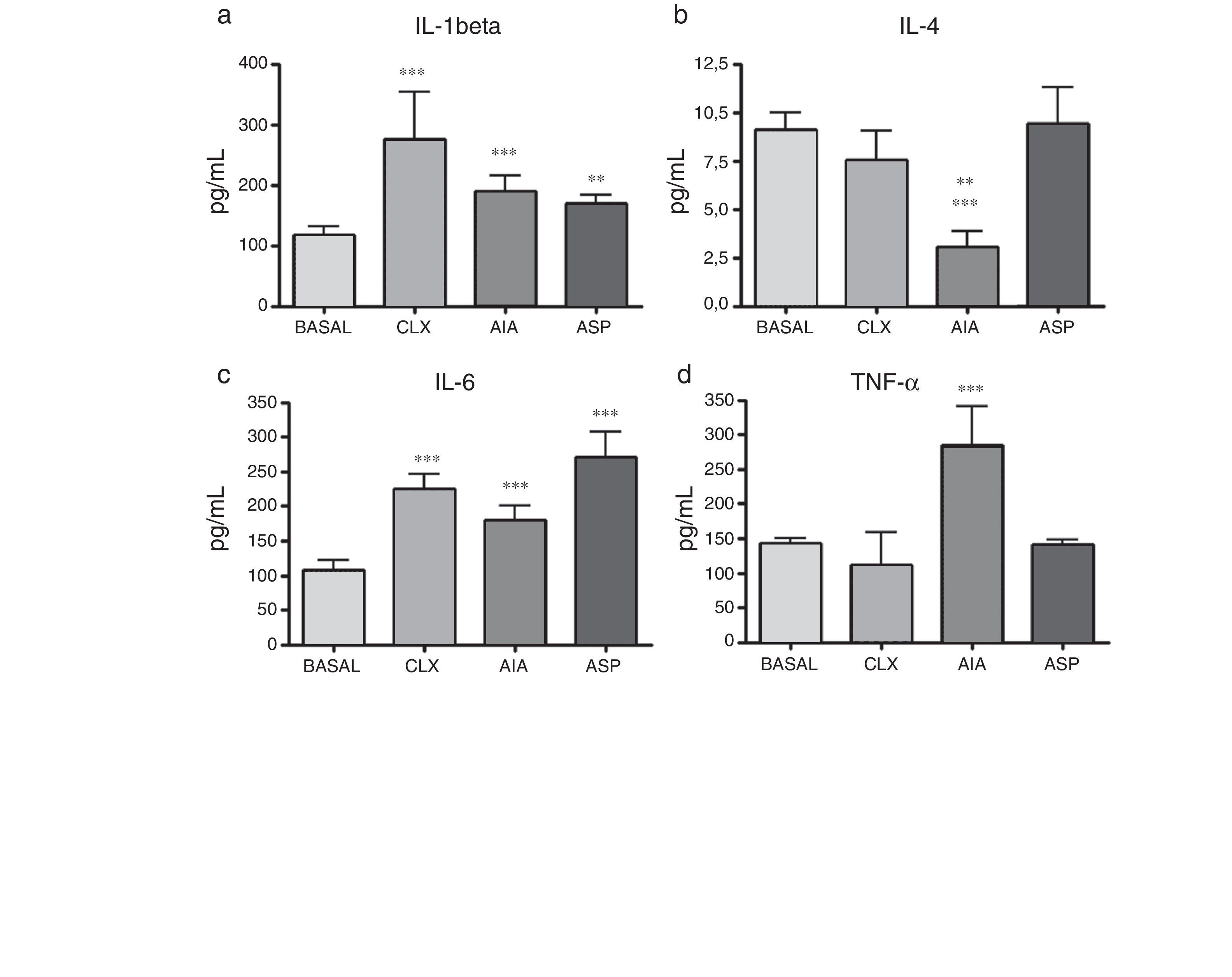
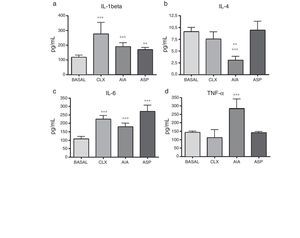
ELISA de citoquinas. Las citoquinas presentaron resultados variables entre ellas y según el modelo en cuestión. Respecto a la IL-1β, si bien todos los modelos tuvieron incrementos respecto al basal, los modelos de CLX y AIA fueron los que mostraron las diferencias con mayor nivel de significación (p<0,001), aunque el modelo ASP también presentó diferencia significativa respecto al basal (p<0,01). Por otra parte, la IL-4, que es una citoquina relacionada con perfil de respuesta TH2 y antiinflamatoria, mostró en el modelo de AIA una caída importante respecto al grupo basal y al grupo ASP (p<0,001); también el modelo AIA presentó diferencia significativa respecto al modelo CLX, aunque con una significación menor (p<0,01). Además la IL-6 tuvo incrementos en los 3 modelos, siendo más notables en los modelos de ASP y CLX (p<0,001) vs. basal. Por último, el TNF-α mostró un incremento significativo solo en el modelo de AIA vs. los otros 3 modelos (p<0,001) (fig. 6).
Concentración de citoquinas en las ratas basales y pertenecientes a los diferentes modelos de artritis estudiados. Se aplicó ANOVA seguido del test de Tukey. a) IL-1β: los modelos CLX y AIA (***p<0,001) vs. basal, ASP vs. basal (**p<0,01). b) IL-4: AIA vs. basal y ASP (***p<0,001), AIA vs. CLX (**p<0,01). c) IL-6: ASP, AIA y CLX, (***p<0,001) vs. basal. d) TNF-α: AIA (***p<0,001) vs. el grupo basal y los otros 2 modelos (CLX y ASP).
En este trabajo, al comparar los resultados en diferentes modelos de artritis inducida, podemos observar que si bien en la bibliografía los modelos se usan de manera indistinta para probar diferentes fármacos o evaluar la respuesta a los mismos, debería ser contemplada la diferencia en la manifestación clínica que ellos inducen. En nuestro trabajo hicimos foco en la fase temprana de la OA que correspondería a un modelo de fase aguda. Como podemos observar en la tabla 1, solo los modelos de artritis inducida por adyuvante presentan una sintomatología clínica al día 7. Muchos autores utilizan la vía intradérmica en la base de la cola en ratas endocriadas, Lewis et al., describen el desarrollo de edema y artritis a partir de las 2 semanas18. Ciertas diferencias podrían deberse a la susceptibilidad de las cepas de ratas a generar artritis sistémicas; en nuestro trabajo usamos ratas de la cepa Sprague Dolley que según la bibliografía se encuentran entre las cepas capaces de producir artritis sistémicas4,19. Otros autores que también usaron las vías subplantar observaron edema e inflamación en la pata, que alcanzó el punto máximo al día 5-7, para luego entrar en una etapa más crónica hacia el día 2020.
El modelo de CLX se ha realizado en diversas especies animales anteriormente como son caninos, conejos, cobayos y ratas12. El modelo de CLX está indicado para generar inestabilidad a la articulación y desencadenar artritis a mediano o largo plazo, sin embargo, algunos trabajos han observado lesiones histopatológicas y radiológicas en el transcurso de 2 semanas21. Al igual que otros modelos no estudiados en este trabajo, como la artritis inducida por colágeno y la artritis inducida por antígeno, se observan en los modelos de AIA y ASP lesiones histopatológicas al día 7. Estas lesiones se caracterizan por inflamación sinovial y erosión temprana del cartílago articular.
La IL-1β se encuentra elevada respecto al control en los 3 modelos de artritis probados, lo cual podría indicar que sería esta citoquina un posible blanco general para el control de las artritis de diferente tipo. El uso del receptor antagonista de la IL-1β mostró resultados variables en diferentes modelos inflamatorios22 y en pacientes con OA23. Por otra parte, algunos trabajos mostraron efectos protectores en lo relacionado con la degradación del cartílago articular y la progresión de la erosión ósea24. Por el lado de las citoquinas, el modelo de AIA es el que mayor incremento del TNF-α ha producido. El incremento del TNF-α ha sido asociado con un incremento de infiltrados leucocitarios que llevan a la inflamación, dolor y daño articular. El incremento de TNF-α ha sido asociado en medicina humana a ciertos tipos de artritis tales como artritis reumatoide, artritis psoriásica y espondilitis anquilosante. Los incrementos de IL-1β y TNFα han sido relacionados con la inducción de MMP, que son las que estarían vinculadas a la destrucción de la matriz extracelular y al daño articular propiamente dicho25. Asimismo, en modelos de inyección de IL-1β al espacio articular se observó que en la artritis que se desencadenaba se perdían proteoglicanos del cartílago articular26. También se presentó incremento de IL-1β en otros modelos, como es el caso de la artritis inducida por colágeno27. Otros trabajos demostraron que el TNF-α se encontraría elevado en estadios tempranos de la enfermedad articular, mientras que la IL-1β se encontraría elevada por más tiempo28. La supresión de TNF-α ha demostrado tener efectos beneficiosos en diferentes modelos de artritis autoinmunes29. Además de la importancia que presentan estas citoquinas por el rol que cumplen en el proceso inflamatorio, se ha descrito que la IL-1β, IL-6 y el TNF-α participan directamente mediando el dolor en terminaciones nociceptivas articulares30. También se ha demostrado que la IL-6 cumple un rol importante en la destrucción del cartílago articular en las artritis inducidas. Asimismo, en nuestro trabajo la IL-4 encontró los niveles más bajos en el modelo de AIA. La IL-4 está relacionada con un efecto, en los modelos de artritis, que sería el de reducir la inflamación, las citoquinas proinflamatorias, la vascularización y la destrucción ósea. La MMP-9 en el modelo CLX presenta valores mínimos, similares a los de los animales basales, mientras que esta proteasa se encuentra sumamente elevada en el modelo de AIA, en coincidencia con el mayor daño articular.
El modelo que presentó variación significativa respecto del grupo control, en la mayor cantidad de variables, es el modelo de AIA. Pero IL-1, al día 7, presentó diferencia significativa en todos los modelos respecto del basal, siendo esta más marcada en el CXL, y para la IL-4 se observó el valor más bajo en el grupo AIA. Este trabajo permitió evaluar y comparar el comportamiento de las diferentes variables en cada modelo, en una fase temprana pero aguda de la enfermedad articular, lo cual puede ser útil al momento de elegir trabajar en un modelo agudo de OA. Por otra parte, el modelo de ASP resultó ser muy útil como modelo de inflamación clínica a los 7 días y fue el que más elevación presentó en la MMP-2. Si bien se usan y se comparan de manera indistinta los modelos de artritis en ratas como si fueran similares, en este trabajo demostramos que en un estadio temprano los modelos se comportan de manera diferente en la mayoría de las variables estudiadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónProyecto UBACYT 20020120100092BA.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.