Una alta proporción de los trastornos depresivos se acompañan de manifestaciones ansiosas, así como la depresión y la ansiedad cursan frecuentemente con dolor. En otro sentido, las manifestaciones dolorosas causan o empeoran los síntomas depresivos y ansiosos. Cada vez hay más evidencia sobre la similitud fisiopatológica, imagenológica y neurofisiológica del dolor y la depresión.
MétodosRevisión narrativa de los aspectos fisiopatológicos y clínicos de la comorbilidad depresión y dolor crónico. Se incluyen los artículos de investigación que enfatizan los elementos relevantes relacionados con la comprensión de la fisiopatología de ambas manifestaciones.
ResultadosCon los más recientes avances en técnicas bioquímicas y celulares y el advenimiento de tecnologías imagenológicas de avanzada, se ha podido considerar cada vez más claramente la aproximación etiopatogénica, fisiopatológica y clínica de estos trastornos. Se sistematiza esta información en imágenes y cuadros comprensivos.
ConclusionesEl reconocimiento de que el polimorfismo de los genes relacionados con la inflamación genera susceptibilidad a las manifestaciones depresivas y puede modificar la respuesta a los tratamientos antidepresivos establece que la respuesta inflamatoria no solo es un componente etiopatogénico del dolor, sino del estrés y la depresión. De igual manera, la similitud en la aproximación con imágenes corrobora la analogía no solo estructural, sino también funcional y fisiopatológica, entre la depresión y el dolor crónico. El conocimiento de la comorbilidad depresión-ansiedad-dolor crónico es importante en la búsqueda de intervenciones terapéuticas eficaces.
A high proportion of depressive disorders are accompanied by anxious manifestations, just as depression and anxiety often present with many painful manifestations, or conversely, painful manifestations cause or worsen depressive and anxious expressions. There is increasingly more evidence of the pathophysiological, and neurophysiological and technical imaging similarity of pain and depression.
MethodsNarrative review of the pathophysiological and clinical aspects of depression and chronic pain comorbidity. Research articles are included that emphasise the most relevant elements related to understanding the pathophysiology of both manifestations.
ResultsThe pathological origin, physiology and clinical approach to these disorders have been more clearly established with the latest advances in biochemical and cellular techniques, as well as the advent of imaging technologies. This information is systematised with comprehensive images and clinical pictures.
ConclusionsThe recognition that the polymorphism of inflammation-related genes generates susceptibility to depressive manifestations and may modify the response to antidepressant treatments establishes that the inflammatory response is not only an aetiopathogenic component of pain, but also of stress and depression. Likewise, the similarity in approach with images corroborates not only the structural, but the functional and pathophysiological analogy between depression and chronic pain. Knowledge of depression-anxiety-chronic pain comorbidity is essential in the search for effective therapeutic interventions.
En 1989 Hudson y Pope plantearon que un grupo de enfermedades crónicas médicas y psiquiátricas se podrían incluir en una agrupación con una fisiopatología común, que denominaron trastornos del espectro afectivo1. Estos trastornos tienen en común manifestaciones depresivas y ansiosas, pueden responder al uso de antidepresivos y se asocian con frecuencia a entidades clínicas con manifestaciones dolorosas como la fibromialgia, el síndrome de fatiga crónica, la migraña, el síndrome de colon irritable y el trastorno disfórico premenstrual2.
En atención primaria los síntomas físicos son una frecuente causa de consulta, sin embargo, el trasfondo de la consulta es la depresión. Más del 50% de los pacientes con depresión reportan quejas somáticas y por lo menos el 60% de estos síntomas están relacionados con el dolor3. La consulta por quejas físicas reduce el reconocimiento de la depresión y la ansiedad, porque los médicos de atención primaria pueden suponer que todos los síntomas físicos están producidos por una enfermedad médica subyacente4. La presencia de numerosas quejas de dolor se asocia con aumento de la gravedad de la depresión; además, el aumento de la intensidad del dolor es predictivo de mal pronóstico para el tratamiento de la depresión1. Cada vez es más clara la relación etiopatogénica entre el estado de ánimo depresivo o ansioso, el dolor y los trastornos somáticos, lo cual refuerza el concepto de trastornos del espectro afectivo. Los pacientes con fibromialgia, por ejemplo, tienen 2 veces más posibilidad de sufrir otros trastornos psiquiátricos, especialmente depresión o ansiedad, que los pacientes sin fibromialgia5.
Los diferentes sistemas nosológicos en psiquiatría no incluyen el dolor crónico entre las manifestaciones de la depresión o lo incluyen de manera muy poco relevante, de modo que se ha generalizado la idea que la depresión tiene muy poco en común con el dolor crónico3. El dolor no aparece como un síntoma de algún trastorno del estado de ánimo o de ansiedad, y las quejas de depresión son marginales en la lista de síntomas requeridos entre los criterios de trastorno de dolor crónico. La investigación médica reciente indica que esta separación nosológica y sintomatológica no es congruente con la realidad clínica y neurobiológica5,6.
MétodosEl presente artículo es el resultado de una revisión narrativa de los aspectos fisiopatológicos y clínicos de la relación entre la depresión, la ansiedad y el dolor crónico. Se incluyen los artículos de investigación que enfatizan datos de la comorbilidad depresión mayor y dolor crónico, tomando los elementos más relevantes relacionados con la comprensión de la fisiopatología de ambas manifestaciones. La abundante información se organiza en un texto comprehensivo y se plantea un desenlace psicopatológico común, depresión-ansiedad-dolor, que se sistematiza en figuras y tablas.
ResultadosTrastorno depresivo, trastorno ansioso y dolorLa relación entre los trastornos de ansiedad y los trastornos depresivos no solo tiene un correlato fisiopatológico, sino también clínico. En uno de los primeros metanálisis que se realizaron buscando la comorbilidad entre estas dos enfermedades5, se encontró que el 58% de los pacientes depresivos presentaban algún tipo de ansiedad, concomitancia que se había dado en el 52,2% de los casos en el último año. A la inversa, la presencia de depresión en pacientes con ansiedad fue del 56%. Hay evidencia de que la depresión y la ansiedad se asocian al dolor crónico y no solo tienen simultaneidad clínica, sino que se considera que el dolor crónico es un predictor de depresión mayor o empeoramiento de los síntomas ansiosos6–10; se ha encontrado relación entre la magnitud de la queja por dolor y la intensidad de las manifestaciones depresivas y ansiosas9.
Un análisis de un modelo bidimensional de ansiedad y depresión encontró que las puntuaciones de cada uno de estos síndromes se correlacionaban significativamente con la intensidad y la gravedad del dolor11,12. Por otro lado, un estudio epidemiológico mostró que los síntomas físicos dolorosos son una característica común en los pacientes que sufren trastorno de ansiedad generalizada y en mayor magnitud en los pacientes con trastorno depresivo comórbido. Se ha demostrado asociación entre síntomas físicos dolorosos en pacientes con trastorno de ansiedad con o sin comorbilidad depresiva y deterioro funcional en el trabajo, los aspectos sociales y el funcionamiento familiar11.
Entre los pacientes de atención primaria con dolor osteomuscular crónico, la depresión y la ansiedad tienen efectos independientes y acumulativos en la intensidad del dolor, la interferencia del dolor, las limitaciones funcionales, los días de incapacidad y la calidad de vida13. Otros estudios han mostrado que el 65,8% de los pacientes de atención primaria que requieren un tratamiento antidepresivo informaron de dolores de cabeza y musculares como quejas concomitantes14,15.
Una revisión de la literatura en busca de la relación entre depresión y dolor concurrente reveló que la prevalencia de síntomas de dolor en pacientes con depresión es del 15 al 100% (media aproximada, 65%)3. En general, se considera que del 30 al 60% de los pacientes con depresión presentan algún tipo de síntoma doloroso significativo13. Así como las condiciones dolorosas crónicas son comunes en pacientes con trastorno depresivo mayor, esta manifestación clínica aumenta la frecuencia y la gravedad de 7 de los síntomas depresivos: el estado de ánimo deprimido, la pérdida de interés, la agitación o inhibición psicomotora, el aumento de peso, el insomnio, la fatiga y los problemas de concentración8. El autor de ese estudio propone que se debe considerar el dolor como una de las manifestaciones clínicas del trastorno depresivo mayor. Se plantea entonces que el número de quejas relacionadas con dolor, que generalmente aumenta en función de la gravedad de la depresión, se debe considerar tanto en el diagnóstico de la depresión como en la planificación de estrategias de tratamiento y la medición del resultado de este16.
En un estudio longitudinal a 3 años17, la presencia de síntomas dolorosos redujo sustancialmente la probabilidad de recuperación de la depresión en un grupo de pacientes de edad avanzada, pues se encontró una tasa de remisión del 9%, en comparación con el 47% de los pacientes que no tenían síntomas dolorosos concomitantes. Un estudio latinoamericano18 en pacientes deprimidos reportó que el 72,6% de las personas clasificadas con síntomas físicos dolorosos tenían mayores gravedad y duración de las manifestaciones depresivas, lo que indica la necesidad de una atención integral de los síntomas emocionales y físicos de la depresión. Posteriormente se identificó en una población de atención primaria en Colombia una asociación entre depresión, ansiedad y somatización, en especial dolorosa, con efectos independientes de cada síndrome que incrementan la discapacidad y la ideación suicida19. Este tipo de pacientes con frecuencia consultan crónicamente más por los síntomas somáticos de dolor que por la ansiedad, la depresión o el insomnio, lo cual destaca la necesidad de cribar a los frecuentadores de servicios de atención tanto primaria como especializada20,21.
Se describe también una relación importante entre los trastornos depresivos y ansiosos y los dolores crónicos específicos como la fibromialgia, el dolor neuropático, el dolor lumbar crónico, la migraña, los síntomas físicos dolorosos y los síntomas dolorosos persistentes (tabla 1). Los pacientes que presentan ansiedad y dolor son más propensos a prestar más atención a las sensaciones corporales y detectar síntomas físicos, refieren dolor más intenso, tienen menos tolerancia al dolor e informan de más ansiedad y pensamientos catastróficos que los pacientes con manifestaciones dolorosas sin síntomas ansiosos31,32.
Proporción entre la comorbilidad de depresión y ansiedad con síndromes dolorosos crónicos
| Trastorno | Comorbilidad | Proporción |
|---|---|---|
| Fibromialgia22,23 | Trastorno depresivo mayor | 20-80% |
| Trastorno de ansiedad | 13-63,8% | |
| Trastorno de ansiedad moderado-grave | 38% | |
| Trastorno depresivo moderado-grave | 27% | |
| Dolor neuropático24–26 | Trastorno depresivo mayor | 34% |
| Trastorno de ansiedad | 25-59,4% | |
| Dolor lumbar crónico27 | Trastorno depresivo | 26% |
| Migraña28,29 | Trastorno depresivo | 48% |
| Síntomas dolorosos persistentes30 | Trastorno de ansiedad generalizada | 60-93% |
| Síntomas físicos dolorosos26 | Trastorno depresivo | 93,5% |
| Trastorno depresivo con síntomas dolorosos como causa de consulta | 72,4% |
El insomnio es una queja muy prevalente en la población general, puede alcanzar al 9% con insomnio crónico y el 30% con insomnio ocasional. Las tasas de incidencia reportadas en estudios longitudinales se encuentran entre el 3 y el 20%33, variación que depende de la población estudiada, el lapso analizado y la definición de insomnio. Entre el 65 y el 89% de los pacientes con dolor crónico evaluados en centros de tratamiento especializados tienen por lo menos una queja de sueño o se describen con sueño no reparador34,35. Los pacientes que se quejan de dolor y tienen insomnio reportan mayor intensidad del dolor, dificultad para conciliar el sueño, despertares frecuentes, menos horas de sueño y sueño menos reparador que los pacientes con dolor sin insomnio o alteraciones del sueño incluso con dolor34,36.
La calificación emocional del dolor y la ansiedad fueron los mejores predictores de la gravedad del insomnio, lo que representó el 30% de la varianza total, incluso cuando la intensidad del dolor estaba controlada. Se concluye que las manifestaciones afectivas asociadas al dolor son un predictor significativo de la gravedad del insomnio37. Un grupo de investigación analizó una muestra transversal de 118.336 participantes mayores de 18 años con dolor por artritis38, y reportó el 45,8% de dolor artrítico, el 24,8% de insomnio y el 11,9% de sueño no reparador, en comparación con los resultados de personas sin artritis: el 11,7, el 10,6 y el 6,1% respectivamente.
El dolor puede interferir significativamente con la conciliación o el mantenimiento del sueño, pero hay evidencia de que el insomnio incrementa de manera importante la intensidad del dolor. Una investigación clínica39 proporciona la primera evidencia de un aumento exagerado de los síntomas de dolor en los pacientes con artritis reumatoide respecto a los sujetos de control después de la disminución del sueño. Con la privación parcial de sueño, en la mañana los síntomas de dolor declarados por los pacientes con artritis reumatoide fueron mayores que los de los controles. Además, la disminución de sueño incrementa el número de articulaciones dolorosas y la intensidad de dolor. Se encontró que la pérdida de sueño, en oposición a la fragmentación del sueño, tiene un papel único en la inducción diferencial de los síntomas de dolor en los pacientes con artritis reumatoide. Por otro lado, se ha encontrado que la calidad del sueño es un factor importante que contribuye a la deficiencia de la modulación inhibitoria del dolor condicionado en la fibromialgia, por lo tanto, es posible que un mejor tratamiento de las dificultades del sueño dé lugar a una mejora de los síntomas dolorosos en fibromialgia40.
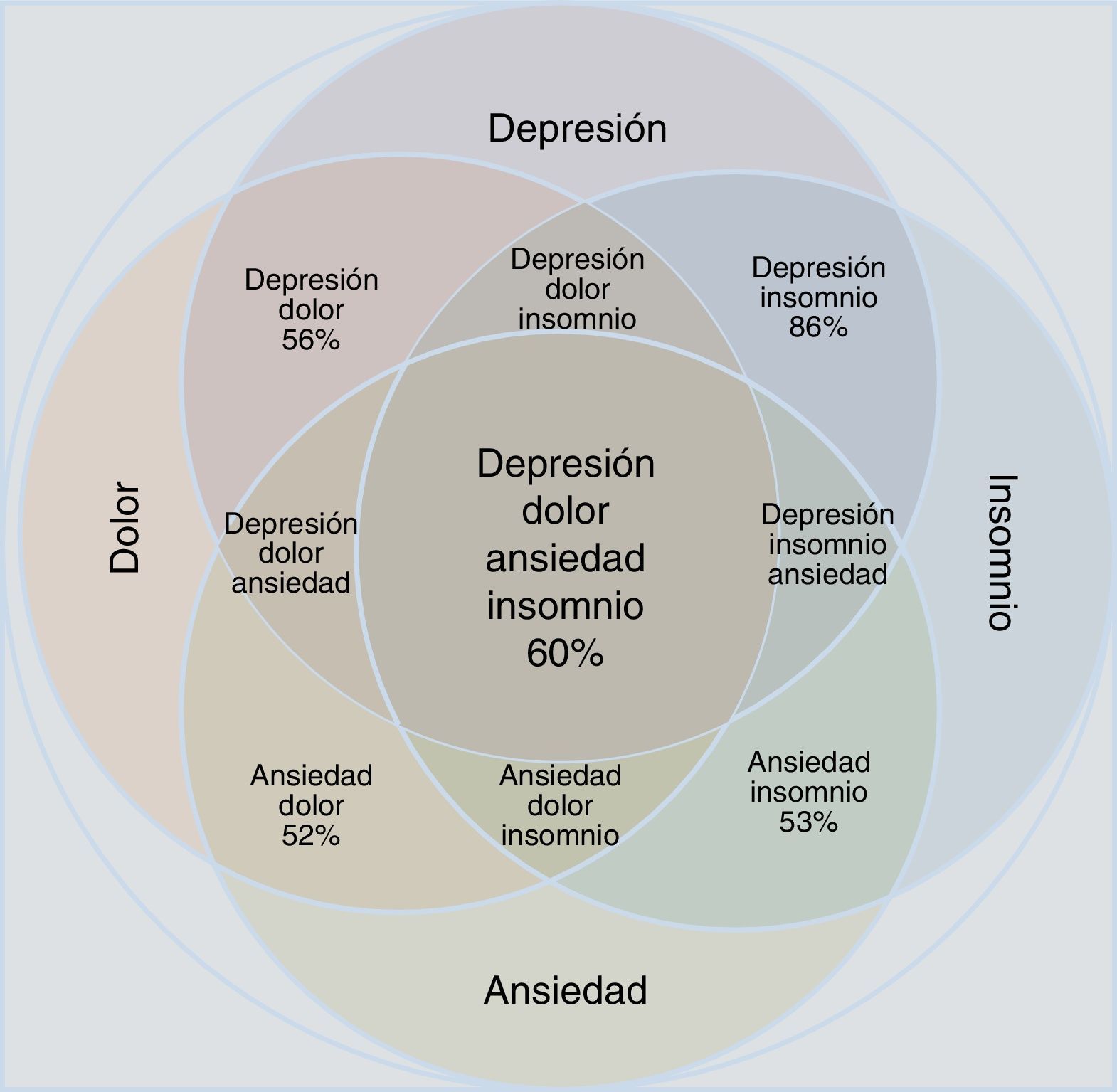
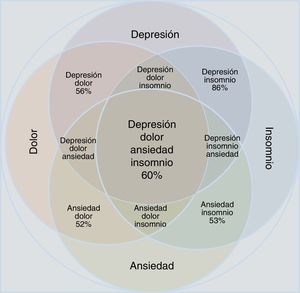
Los reportes estadísticos muestran que la ansiedad y la depresión exacerban las manifestaciones dolorosas, y esta tríada empeora el insomnio34–37. El insomnio y el dolor, a su vez, incrementan las manifestaciones depresivas y ansiosas. La comorbilidad depresión-ansiedad-dolor y la manifestación clínica del insomnio conforman un complejo clínico en el cual se encuentran todas las combinaciones posibles (tabla 1 y fig. 1). Es necesario que el clínico tenga en cuenta todos los aspectos de la relaciones depresión-ansiedad e insomnio-dolor para valorar adecuadamente las posibilidades terapéuticas y la mejoría de los pacientes.
Aproximación acorde con los datos epidemiológicos de la concomitancia, el solapamiento y la comorbilidad del trastorno depresivo y el trastorno de ansiedad en relación con las manifestaciones de dolor e insomnio. Obsérvese que las entidades individuales ocupan menos área que el conjunto fusionado. Se muestran todas las posibilidades de combinación; los porcentajes se refieren a estimaciones epidemiológicas de comorbilidad.
Los avances en la investigación biomédica de años recientes indican que los trastornos depresivos y ansiosos comparten aspectos biológicos y ambientales con los trastornos dolorosos crónicos y el insomnio. Entre los factores biológicos, se han encontrado determinantes genéticos que incluyen genes que regulan la señalización de neurotransmisores y citocinas neurotróficas e inflamatorias. Entre los factores ambientales de riesgo, se encuentran el estrés psicosocial, especialmente cuando es continuo, y la enfermedad en general, los cuales promueven, en individuos vulnerables, cambios en la sensibilidad de los receptores de glucocorticoides en el sistema nervioso y otros órganos, disfunción del eje hipotálamo-hipófiso-adrenal, alteraciones en las funciones autonómicas y aumento en la producción y la liberación de citocinas proinflamatorias; todo lo cual confluye en variaciones estructurales y funcionales del sistema nervioso (tabla 2). La vía fisiopatológica común tiene que ver con alteraciones en el soporte neurotrófico y de la interacción glia-neurona, que ocasionan un fenómeno de sensibilización central al dolor, asociada por la misma vía a las manifestaciones depresivas y ansiosas y las alteraciones del sueño. La concomitancia de los 4 componentes clínicos adquiere un carácter biológico sinérgico que se asocia a la naturaleza progresiva y la tendencia a la perpetuación de estos trastornos, especialmente cuando no se tratan adecuadamente.
Similitudes etiológicas, funcionales y estructurales entre el dolor crónico, la depresión y la ansiedad
| • Los síntomas depresivo-ansiosos y los síntomas dolorosos pueden desencadenarse o agravarse por el estrés29,41–43 |
| • El sistema de circuitos involucrados en la modulación del dolor tiene elementos comunes con los circuitos de regulación de la respuesta al estrés y el estado de ánimo44,45 |
| • Los estudios de resonancia magnética nuclear funcional muestran que la corteza anterior del cíngulo es fundamental en el reconocimiento de la experiencia del afecto negativo en respuesta al dolor físico, área que también media en procesos de malestar asociados a exclusión social46,47 |
| • Las transmisión del dolor emocional y el dolor corporal comparte los mismos tractos en el sistema nervioso central48 |
| • Se han descrito cambios funcionales y estructurales de la amígdala y el hipocampo en trastornos del afecto y enfermedades dolorosas49,50 |
| • La disfunción de las estructuras límbicas contribuye a las perturbaciones en el funcionamiento neuroendocrino, autónomo e inmunitario que pueden influir en la generación o el agravamiento de los síntomas del estado de ánimo y el dolor51–53 |
| • La activación excesiva del sistema simpático, combinada con la elevada producción de citocinas proinflamatorias, desempeña un papel en la etiología depresiva y dolorosa54 |
| • En las células, se han señalado alteraciones en la relación neurona-glia en los síntomas tanto dolorosos como afectivos55,56 |
| • En la depresión-ansiedad y el dolor crónico se ha comprobado a escala molecular disfunción glutamatérgica y alteraciones de las cascadas de señalización intracelular y el soporte neurotrófico57–59 |
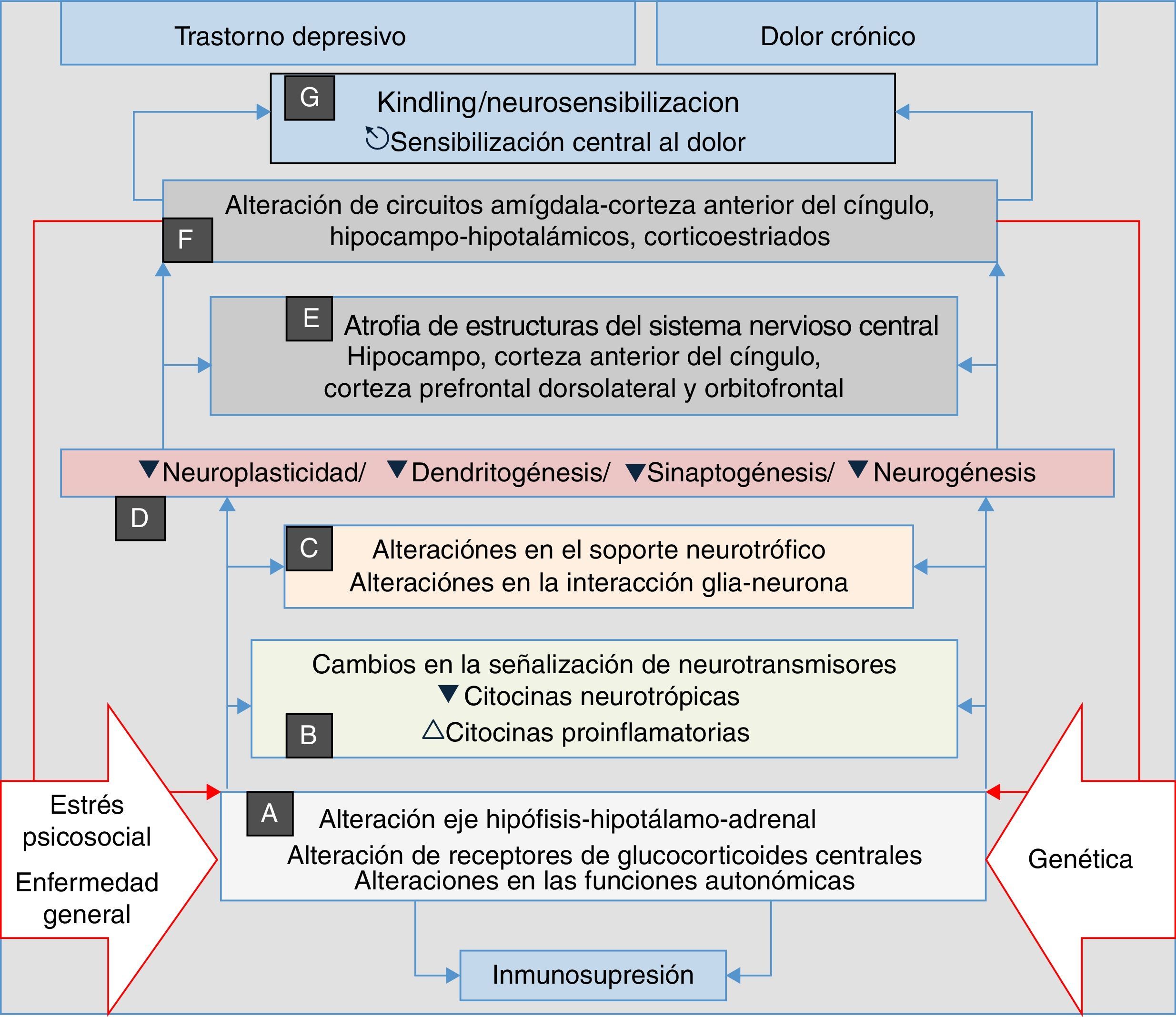
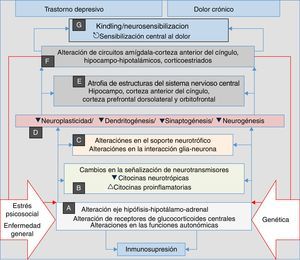
Se ha apuntado en investigaciones recientes que, en la depresión, la ansiedad y el dolor crónico, se desarrollan procesos de neurosensibilización, un fenómeno análogo al kindling descrito en la epilepsia y que consiste en un incremento persistente de la reactividad neuronal, que tanto en la depresión como en el dolor crónico tienen los mismos orígenes neurobiológicos, como cambios neuroplásicos y cambios en la expresión génica. Algunos autores han considerado la neurosensibilización como el fundamento de una etiología común del dolor crónico, la depresión y los trastornos de ansiedad60–63; en todos los casos, se genera un proceso fisiopatológico en el que las manifestaciones se asocian principalmente a circunstancias endógenas, y tienen menos relevancia aspectos estresantes externos como traumatismos, enfermedades dolorosas y/o estrés psicosocial, factores que inicialmente desencadenan el proceso en un sujeto genéticamente vulnerable (fig. 2). Tanto en la depresión como en el dolor, la neurosensibilización hace que las manifestaciones clínicas sean cada vez más espontáneas, persistentes y graves60,63.
El estrés, la enfermedad general y los factores genéticos son el terreno en el cual se desencadenan los procesos que confluyen en manifestaciones clínicas de depresión, ansiedad, dolor e insomnio. Se inician con alteraciones autonómicas y en el eje neuroendocrino (A) que desencadenan cambios neuroquímicos (B) y en el soporte trófico (C), lo cual genera alteraciones microestructurales (D) y posteriormente macroestructurales (E) y funcionales (F), con lo que se establece un complejo patológico (G) que puede ser común a las 4 manifestaciones clínicas. Obsérvese la perpetuación del fenómeno psicopatológico por la influencia de (F) en (A) (líneas dobles rojas).
En el año 2000 se planteó la primera hipótesis relacionada con la patogenia de la depresión, fundamentada en una alteración de la neurogénesis en el hipocampo64. Posteriormente se comprobaron cambios similares en circunstancias de ansiedad y dolor crónico65–67, y se propuso un sustrato clínico y fisiopatológico común (tabla 2). En todos los casos, los cambios se han relacionado con alteraciones en sustancias como el factor neurotrófico derivado del cerebro (Brain Derived Neurotrophic Factor [BDNF]) y otras sustancias como la serotonina que sustentan la vitalidad neuronal y glial. Teniendo en cuenta estos aspectos, es llamativo que en la depresión mayor, como en las manifestaciones dolorosas crónicas, haya un curso progresivo hacia alteraciones cognitivas relacionadas posiblemente con los cambios estructurales en el cerebro, especialmente en la corteza prefrontal medial, la corteza anterior del cíngulo y el hipocampo68.
En términos generales, se ha establecido que los genes implicados en la enfermedad mental no determinan el desarrollo de una enfermedad específica, sino que los rasgos endofenotípicos incrementan el riesgo de morbilidad psiquiátrica69–71. Se ha señalado en diferentes trabajos que el alelo corto del gen promotor del 5HTTPR aumenta la probabilidad de depresión e ideación suicida solo si las personas se encuentran expuestas a factores estresantes ambientales; si este factor ambiental es mínimo, es posible que no se desarrolle el cuadro clínico71,72. En el trastorno depresivo mayor y el suicidio, el alelo Val66Met se manifiesta con una actividad disminuida del BDNF y se ha asociado a cambios cerebrales estructurales como la reducción de la materia gris en las corteza prefrontal dorsolateral, la corteza prefrontal orbital lateral y el hipocampo. Se ha observado la relación del gen del BDNF en la modulación de la capacidad de recuperación celular, la neuroplasticidad y la neurogénesis73–75. Por otro lado, se ha descrito una relación entre las manifestaciones de dolor crónico y la disminución bilateral del tamaño del hipocampo en el dolor crónico de espalda y el síndrome de dolor regional complejo76. Tanto en los trastornos depresivos como en el dolor crónico, los cambios potencian el riesgo de alteraciones en el circuito límbico amígdala-corteza anterior del cíngulo y en el eje hipófiso-hipotálamo-adrenal77,78. El mecanismo genético que podría vincular las alteraciones en estos circuitos es la epistasis, fenómeno que consiste en la interacción entre alelos presentes en diferentes locus y ocurre cuando 2 pares de genes afectan a la misma característica.
El polimorfismo genético de la depresión se ha relacionado con receptores de serotonina y con las enzimas catecol-o-metiltransferasa, citocinas proinflamatorias, receptores de opioides, receptores de glutamato, factor liberador de corticotropina y genes de receptores de dopamina; se ha implicado a los mismos genes en la génesis de las manifestaciones dolorosas79–81. La tabla 3 resume la correspondencia de los aspectos genéticos entre el trastorno depresivo mayor y el dolor agudo y crónico.
Genes implicados en la vulnerabilidad al trastorno depresivo mayor y el dolor agudo y crónico
| Genes que regulan el locus promotor del transportador de serotonina (5HTTPR)82,83 |
| Genes del receptor de serotonina 5HT2A84–86 |
| Genes de la enzima catecol-o-metil transferasa (COMT)87–89 |
| Genes de la citocina proinflamatoria interleucina 690 |
| Genes del factor neurotrófico derivado del cerebro (BDNF)91 |
| Genes de los receptores de opioides92,93 |
| Genes de la citocina proinflamatoria interleucina 194–96 |
| Genes del receptor de glutamato97 |
| Genes que regulan la síntesis y la actividad del factor liberador de corticotropina (CRF)98 |
| Genes del receptor de dopamina D493,99,100 |
Se ha planteado que la fibromialgia está relacionada con un déficit en la modulación interna del dolor, especialmente de los mecanismos inhibitorios101,102. La neurobiología del dolor implica la regulación de procesos endógenos de inhibición y excitación que incluyen la modulación inhibitoria del dolor condicionado; se postula en este fenómeno que la estimulación nociceptiva cancela otro estímulo nociceptivo si se produce en un sitio del cuerpo distante de la superficie dolorosa. Este sistema implica vías inhibidoras serotoninérgicas, noradrenérgicas y opioidérgicas y causa una reducción de dolor difuso en todo el cuerpo con el efecto emocional asociado. Algunos estudios experimentales han demostrado que la modulación inhibitoria del dolor condicionado es deficiente en la fibromialgia102–104. Se considera que esta enfermedad se relaciona con una hiperexcitabilidad central y periférica del sistema nociceptor que se manifiesta como múltiples puntos dolorosos osteotendinosos, hiperalgesia y alodinia.
En los pacientes deprimidos, se describen alteraciones imagenológicas en el sector de la ínsula dorsal anterior donde normalmente ocurren los cambios en pacientes con dolor crónico; esto puede tener un papel en la llamada «alodinia emocional», un concepto en relación con la experiencia dolorosa de personas con depresión mayor en respuesta a estímulos que normalmente no serían dolorosos105. Es de anotar que en personas con trastorno bipolar también se ha observado una comorbilidad con fibromialgia106–110 y migraña111–113. Estudios de imagenología funcional revelan cambios estructurales en la amígdala y la corteza prefrontal y dan soporte al hecho que la depresión bipolar, el sufrimiento por dolor y el sufrimiento por rechazo comparten los mismos circuitos biológicos114,115. La bipolaridad y el dolor crónico podría estar relacionados con que algunos medicamentos moduladores del estado de ánimo tienen claros efectos en el control del dolor como la neuralgia del trigémino, el dolor neuropático y la migraña116.
ConclusionesEl conjunto de síntomas de la depresión agrava y acentúa los síntomas dolorosos y, viceversa, una potenciación similar se da con el insomnio y las manifestaciones de ansiedad. La relación entre dolor, alteraciones del sueño y quejas cognitivas establecen un síndrome similar a la depresión que hace difícil discernir los diferentes componentes psicopatológicos117,118. Todas estas circunstancias hacen compleja la intervención terapéutica y con frecuencia la eficacia de los medicamentos no es la adecuada para una sola manifestación, dado el solapamiento que presentan. El conocimiento de la comorbilidad depresión-ansiedad-dolor crónico-insomnio es fundamental en la búsqueda de intervenciones terapéuticas eficaces y asertivas.
Así como el insomnio, por la alta manifestación en el trastorno depresivo, los síntomas dolorosos deberían considerarse expresiones cardinales de los trastornos depresivos. El reconocimiento de que el polimorfismo de los genes relacionados con la inflamación genera susceptibilidad a las manifestaciones depresivas y puede modificar la respuesta a los tratamientos antidepresivos establece que la respuesta inflamatoria no solo es un componente etiopatogénico de la depresión, sino también del estrés y el dolor; de igual manera, la similitud en la aproximación con imágenes indica no solo analogía estructural, sino funcional y fisiopatológica119,120.
FinanciaciónRecursos de investigación procedentes de la Fundación Valle del Lili y la Universidad Icesi de Cali, Colombia.
Conflicto de interesesNinguno.