La hipertensión arterial pulmonar es una enfermedad grave que requiere procesos estructurados de diagnóstico con el objetivo de realizar una categorización clínica adecuada con la intención de seleccionar la mejor estrategia terapéutica inicial fundamentada en el riesgo individualizado. Esta estrategia individualizada no tiene sentido si no se tienen metas terapéuticas claras, que no son más que objetivos de tratamiento que permiten guiar las intervenciones buscando que éstas se lleven a cabo de manera temprana y se definan con claridad los momentos de ejecutar escaladas terapéuticas antes de que el paciente se deteriore, con la finalidad de reducir el detrimento funcional y prolongar la vida. Es importante afianzar el mensaje a los clínicos, que una vez iniciado el tratamiento es una obligación vital continuar un seguimiento estratégico y ambicioso para alcanzar la mayor mejoría posible.
Pulmonary arterial hypertension is a serious illness that requires structured diagnostic procedures with the aim of making an appropriate clinical classification in order to choose the best initial strategy based on individualised risk. This individualised strategy does not make sense if there are no clear therapeutic challenges that are no more than treatment goals that help to guide interventions, searching for these that are carried out early and with clearly defined times of executing therapeutic schemes before the patient gets worse, with the aim of reducing the functional impairment and prolonging life. It is important to reinforce the message to clinicians, that once treatment is started it is a vital obligation to continue a strategic and ambitious follow-up to achieve the best possible outcome.
La hipertensión arterial pulmonar es una enfermedad compleja que involucra gran cantidad de vías fisiopatológicas que incluyen mecanismos hereditarios, medicamentos y factores epigéneticos, que puede llevar a aumento de la resistencia vascular pulmonar y disminución del gasto cardiaco, falla cardiaca y muerte.
Previo a la era moderna de tratamiento, la supervivencia era de 2,8 años después del diagnóstico1. Datos de los registros actuales demuestran una mejoría clara en la supervivencia desde la introducción de la terapia2,3, que incluye alrededor de doce opciones diferentes entre orales, inhaladas y parenterales. Infortunadamente, aunque los tratamientos actuales parecen aliviar los síntomas, mejorar la capacidad de ejercicio y evitar hospitalizaciones, sólo se ha observado evidencia limitada para la reversión de la enfermedad y por ende son pocas las opciones terapéuticas que impactan en mortalidad, de modo tal que ésta continúa siendo alta1–3. En los estudios más recientes, los desenlaces clínicos cambian4 al igual que la forma de uso de la terapéutica es cada vez más agresiva; así mismo, variaron las tendencias de inicio de los medicamentos desde el estudio AMBITION5 en la búsqueda de metas que mejoren la condición de los pacientes.
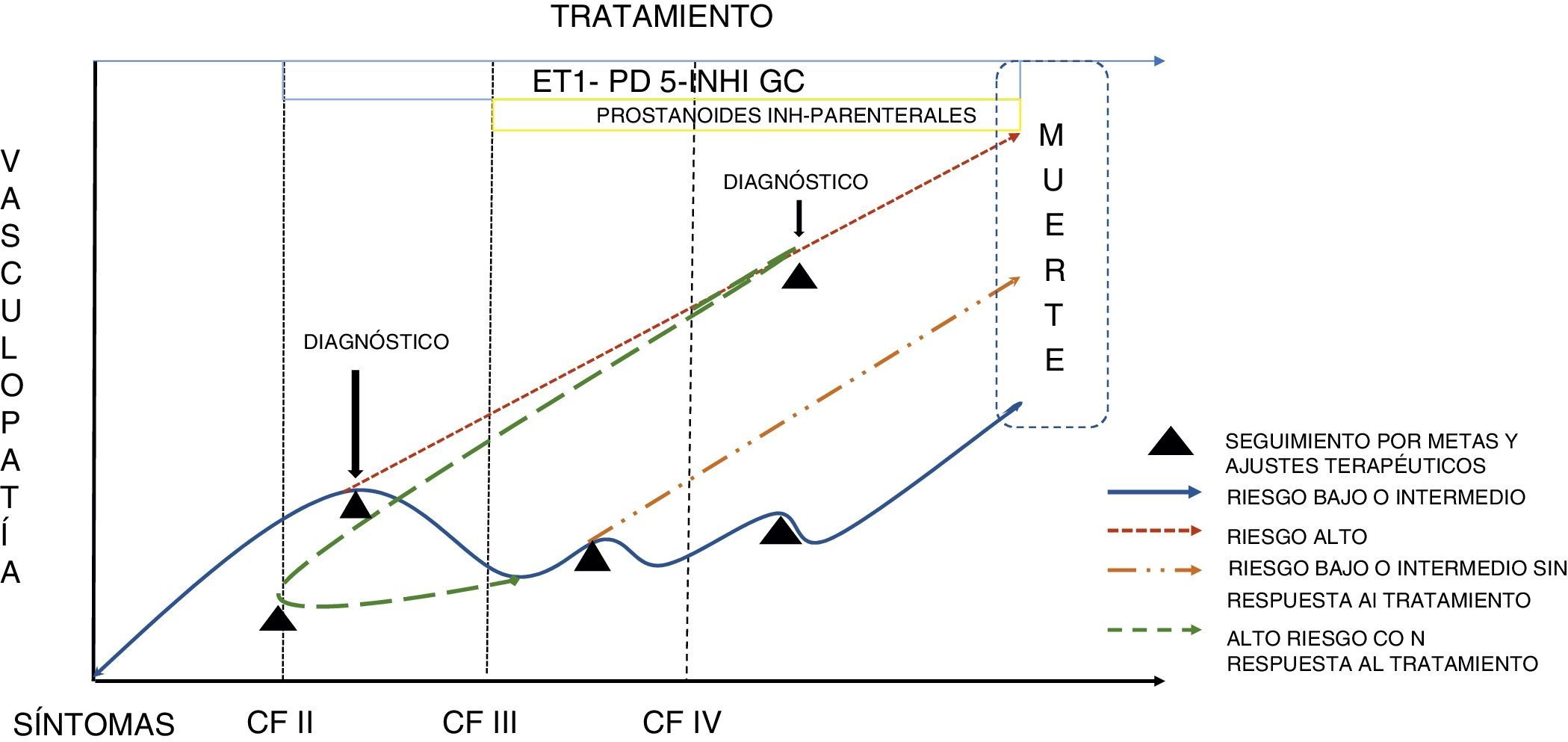
El desarrollo de variables integradas en la toma de decisiones ha sido el resultado de diferentes estudios que permitieron la aprobación de diversas alternativas de tratamiento. El trabajo de Hooper en 2005 en el que mediante una estrategia de tratamiento en la que se iniciaba con monoterapia y en búsqueda de objetivos se adicionaba otra molécula terapéutica bajo seguimiento no invasivo, incluyó el seguimiento de metas terapéuticas como caminata de 6 minutos > 380 metros, consumo pico de oxígeno de > 10,4ml/min/kg y presión sistólica pico durante el ejercicio > 120mm Hg. Se consideró que alcanzar las tres metas era el objetivo. Por su parte, la probabilidad de supervivencia de los pacientes con hipertensión arterial idiopática de 2002-2004 (n=589) en 1, 2 y 3 años fue 93,3, 88,3 y 83,9%, respectivamente en el grupo de tratamiento por objetivos, eliminar fue significativamente mejor que la supervivencia de los pacientes con hipertensión arterial idiopática en el grupo de control histórico (90,9, 74,9 y 60,2%, respectivamente, así como mejor que la supervivencia predicha basada en la ecuación de los NIH que fue del 71,5%, 59,9% y 50,0% a uno, dos y tres 3 años, respectivamente6. Esta propuesta terapéutica, denominada estrategia orientada por metas, utiliza indicadores de pronóstico estudiados previamente como los objetivos de tratamiento, guiando la intervención temprana y la escalada terapéutica antes de que comience el deterioro de los pacientes. El objetivo final de tratamiento óptimo en la hipertensión arterial pulmonar es reducir el deterioro funcional y prolongar la vida7. La figura 1 ejemplifica en forma hipotética como los pacientes con hipertensión pulmonar tienen diferentes comportamientos clínicos que obligan a efectuar ajustes terapéuticos periódicos con base en su evolución, no solo del momento de partida sino en el proceso de seguimiento. De este modo, existen pacientes de curso evolutivo lento hacia al deterioro, que permiten ajustes secuenciales en el tratamiento, mientras que existe otro grupo de pacientes de curso evolutivo más agresivo que requieren así mismo intervenciones con dos o tres medicamentos para retardar la evolución de la enfermedad. La estrategia es el fundamento del enfoque terapéutico actual ya que permite un orden claro en la búsqueda de objetivos con variables conocidas como biomarcadores, los cuales se discutirán en este artículo. La importancia de variables hemodinámicas como meta terapéutica en hipertensión pulmonar, hace parte de otro apartado de esta publicación.
Es un indicador global de los síntomas del paciente y determina en gran medida las actividades diarias que puede realizar, de manera tal que es apenas lógico que se incluya como una meta. Sin embargo, conviene tener en cuenta que la clase funcional es además un marcador de desenlaces, como se verá a continuación, lo que le permite ser una guía y un marcador de pronóstico para el clínico.
Una de las ventajas de esta meta es que es fácil de valorar en el consultorio, incluso a través de llamadas telefónicas de seguimiento. La escala a utilizar es la modificada de la NYHA-WHO8.
En el estudio publicado por McLaughin et al.9 la clase funcional basal y la alcanzada luego del primer período de uso de epoprostenol endovenoso fue un determinante de mortalidad a los 84 meses de seguimiento, con razón de disparidad de 2,9 (basal) y 3,28.
Existe diferencia importante de sobrevida al comparar el grupo de pacientes que lograron clase funcional I y II contra los que se mantuvieron en clase III y IV. Sitbon et al.10 encontraron hallazgos similares con una muestra de 178 pacientes también en terapia con epoprostenol.
De forma más reciente, el registro REVEAL11 encontró porcentajes de mortalidad determinados según la clase funcional basal; los pacientes con clase funcional I y II muestran un comportamiento muy distinto a los de clase funcional III y IV.
Un estudio distinto12 pero derivado también del registro REVEAL, mostró de forma similar a como lo hicieron McLaughin et al. que cuando se logra mejorar la clase funcional del paciente con hipertensión pulmonar arterial también se mejora su mortalidad. Este trabajo muestra una sobrevida a tres años del 85% para los pacientes que mejoraron de clase funcional III a I y II y de 65% para los que se mantuvieron en clase funcional III a pesar de las intervenciones. Esta diferencia pronóstica se presenta tanto en casos previamente conocidos de hipertensión pulmonar arterial como en casos de diagnóstico nuevo12,13.
Se considera, por tanto que, a pesar de su carácter subjetivo y la variabilidad interobservador, la clase funcional es una herramienta fácil, rápida y siempre disponible de evaluación del tratamiento y pronóstico de la enfermedad. Se recomienda su valoración en cada visita y se plantea, como meta, llevar el paciente a clase funcional I y II. El equipo multidisciplinario involucrado en el manejo integral de estos pacientes debe estar familiarizado con la escala, al igual que el paciente deberá hacerlo con el tiempo.
Caminata de 6 minutosEs una prueba fácil de realizar, con protocolos internacionales establecidos y poco costosa. Con el tiempo el personal del centro de hipertensión pulmonar y el paciente logran familiarizarse con la misma. Tiene en contra que está influenciada por la edad, el sexo, la talla, el peso, las comorbilidades, el grado de suplencia de oxígeno y la motivación del paciente.
De nuevo el registro REVEAL muestra datos importantes a través del estudio de Farber et al.14 en el que los pacientes que recorrieron más de 440 metros en la caminata de 6 minutos (C6M) tuvieron una sobrevida al año del 96,9% mientras que fue de 68,4% para los de menos de 165 metros. Adicionalmente, se encontró que un deterioro en la distancia recorrida mayor al 15% al año de seguimiento se asocia con mayor mortalidad (HR 1,21; p <0,001). En el caso contrario, una mejoría en la distancia recorrida no se asoció con incremento de la sobrevida. En concordancia con este último hallazgo, el metaanálisis de Savarese et al.15, que incluyó 3.112 pacientes a partir de 22 estudios, no encontró que la distancia recorrida en la C6M fuera una variable predictora de desenlaces clínicos favorables.
A la fecha, la distancia caminada en valores absolutos sigue siendo la variable más estudiada y utilizada en ensayos clínicos y desde el consenso de Niza del 2013 se propone tratar de mantener los pacientes en tratamiento por encima de los 380-440 metros.
ErgoespirometríaPuede tener un rol especial en los pacientes con clase funcional más preservada (I y II) puesto que implica un esfuerzo máximo, o en aquellos con condiciones que impiden realizar la caminata de 6 minutos (artritis, gota, inestabilidad). Consumos pico de oxígeno (PVO2) inferiores a 14ml/min/kg se han asociado con mayor mortalidad16,17, por lo que como meta se ha establecido un PVO2 mayor a 15ml/min/kg. Otros marcadores de pobre pronóstico son una relación elevada de equivalentes respiratorios sobre dióxido de carbono (VE/VCO2 >45) y el desarrollo de shunt de derecha a izquierda18.
Calidad de vidaAunque las terapias para la hipertensión arterial pulmonar han demostrado mejorar la calidad de vida, la asociación entre esta mejoría y desenlaces como deterioro clínico y/o sobrevida no ha sido suficientemente estudiada. La mayoría de estudios utilizan escalas de calidad de vida que no son específicas para hipertensión arterial pulmonar19. A la fecha el único cuestionario validado, si bien no en español, para hipertensión arterial pulmonar es el CAMPHOR; sin embargo, su uso en la práctica diaria puede verse limitado pues implica evaluar 65 ítems20. La capacidad del CAMPHOR para pronosticar deterioro clínico fue evaluada en un grupo de 87 pacientes con hipertensión arterial pulmonar, pero sólo los valores absolutos muy elevados se comportaron como predictores independientes e incluso este efecto se diluyó al ajustar por caminata de 6 minutos y clase funcional20; adicionalmente, al realizar el análisis longitudinal no se encontró que valoraciones seriadas del CAMPHOR aportaran al pronóstico. El SF-36, aunque inespecífico, ha sido el más utilizado en los ensayos clínicos a la fecha y se encuentra validado para múltiples lenguas, incluido el español. Fernandes et al.21 encontraron una mejoría en 7/8 dominios del SF-36 tras 16 semanas de tratamiento en un grupo de 54 pacientes con hipertensión arterial pulmonar. Como marcador pronóstico encontraron que del SF-36 el puntaje del PCS (Physical Component Summary) pronosticó mejor sobrevida si era > 32 (p=0,04) antes de la terapia y > 38 (p=0,016) a las 16 semanas de la terapia.
BiomarcadoresLa Administración de medicamentos y alimentos de los Estados Unidos (FDA), define un biomarcador como una característica que se mide y se evalúa objetivamente como un indicador de procesos normales biológicos, procesos patogénicos o respuestas biológicas a una intervención terapéutica22.
Dada la complejidad de la hipertensión arterial pulmonar y nuestra comprensión incompleta de su patogénesis, se han investigado numerosos marcadores para su potencial como biomarcadores. No obstante, pocos se han identificado y validado clínicamente23.
Los biomarcadores plasmáticos utilizados o propuestos en la actualidad en la hipertensión arterial pulmonar se podrían resumir de la siguiente manera24:
- •
Biomarcadores de disfunción/activación neurohormonal (natriurético 8ericárd endotelina [ET] -1, adrenomedulina, copeptina).
- •
De lesión miocárdica (troponinas).
- •
De inflamación/estrés oxidativo-interleucinas [IL], proteína C reactiva [PCR], isoprostanos).
- •
De daño vascular/remodelación: factor de von Willebrand, angiopoyetina, macropartículas.
- •
De diferenciación. Factor de crecimiento-15 [GDF-15].
- •
De insuficiencia de órganos diana: creatinina, sodio, ácido úrico.
- •
De los reguladores de la transcripción y la expresión génica: microARN [miARN], sitio de integración proviral de murina de Moloney y leucemia virus-1 [PIM-1] .BMP7.
El único biomarcador recomendado por las directrices actuales para la estratificación del riesgo es el péptido natriurético cerebral (BNP) o el fragmento N-terminal (NT) de pro-BNP (NT-proBNP).
Los péptidos natriuréticos fueron de los primeros biomarcadores identificados en pacientes con hipertensión arterial pulmonar. El BNP es una hormona natriurética liberada principalmente desde el corazón (en particular los ventrículos) debido a la tensión del miocardio. Los péptidos natriuréticos relajan el músculo liso vascular, causando dilatación arterial y venosa que lleva a reducir la presión arterial y la precarga ventricular; también tienen importantes efectos centrales y periféricos simpático-inhibitorios. Ambas hormonas bloquean la actividad del sistema nervioso simpático cardíaco, incluso cuando las presiones de llenado cardíaco disminuyen. Estas hormonas también inhiben el eje renina-angiotensina. Específicamente la liberación de BNP tiene acción lusitrópica directa sobre el miocardio; además podría tener efectos antiproliferativos y antifibróticos tisulares. vascular25.
En comparación con ANP, BNP es mucho más estable y menos sensible a los cambios de temperatura, y por ende es una prueba más práctica26. NT-proBNP tiene una ventaja sobre BNP en que su aclaramiento metabólico es más lenta.
Similar a ANP, BNP y NT-proBNP se correlacionan con parámetros hemodinámicos (incluyendo PAP media y la PVR) y la gravedad de pH27. Los niveles basales de ambos BNP y NT-proBNP también predicen la mortalidad en pacientes con hipertensión arterial pulmonar28. Dada la posibilidad de valores persistentemente elevados de BNP o NT- ProBNP en el seguimiento, un pequeño estudio en el contexto de hipertensión arterial pulmonar estableció que una reducción en los niveles de BNP de ≥ 50% del valor inicial después de la introducción de epoprostenol, fue un fuerte indicador de la supervivencia libre de eventos para el año siguiente29.
La comparación de los dos valores consecutivos de NT-proBNP se puede realizar mediante la adopción de sus equivalentes Loge, es decir, valores de NT-proBNP que se transformaron en equivalentes logarítmicos; la diferencia se determina mediante la fórmula: loge (corriente NT-proBNP) – loge (NT anterior –proBNP) = x. Se utilizó un valor de corte de 0,26, es decir, un valor de y ≥ + 0,26 para predecir eventos adversos y un valor de 0,26 y ≤ para predecir la estabilidad. Los niveles de corte de 0,26 y -0,26 fueron elegidos como equivalentes a un cambio del 30% del valor inicial, y por tanto comparable a los puntos de corte elegidos para los niveles absolutos de NT-proBNP. Este método comparativo fue superior que la caminata de 6 minutos y el cambio en el valor del NT proBNP para predecir eventos adversos. De manera que un cambio en los valores de NT-proBNP loge de ≥ + 0,26. Tuvo una especificidad del 98%, sensibilidad del 60%, valor predictivo positivo de 90% y valor predictivo negativo del 89%30.
EcocardiogramaEs una herramienta vital en el estudio inicial del paciente como sospecha diagnóstica que también ha sido evaluado con fines pronósticos como elemento importante en el seguimiento, dado que la realización del cateterismo derecho es una herramienta poco atractiva para el seguimiento y la evaluación del ventrículo derecho, pese a que existen diferencias importantes con la medición de variables hemodinámicas31.
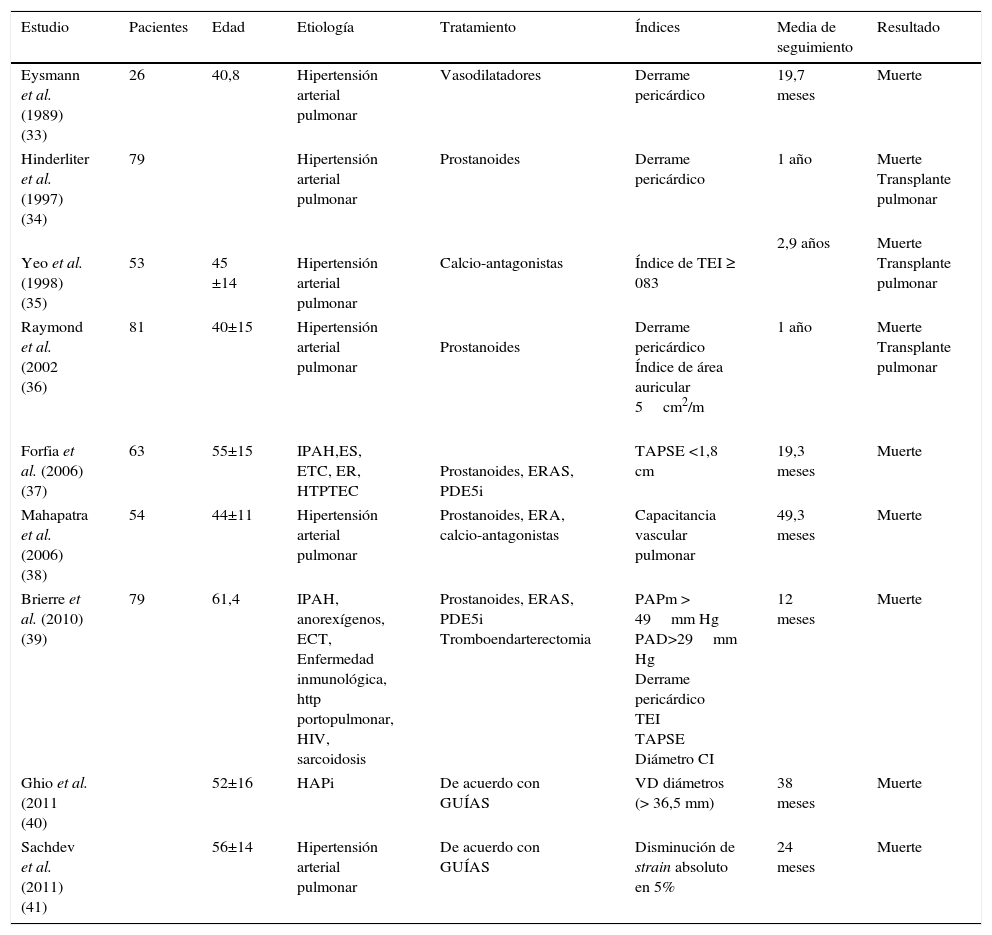
Predictores ecocardiográficos de pronóstico incluyen derrame pericárdico, área de la aurícula derecha, grado de desplazamiento del tabique hacia el ventrículo izquierdo en diástole, excursión sistólica del anillo tricúspide, capacitancia vascular pulmonar e índice de Doppler del VD (TEI índice o índice de rendimiento miocárdico del VD)32. La idea fundamental es alcanzar valores lo más cercanos a lo normal y alejar al paciente de criterios de mal pronóstico. Sin embargo, el análisis de este tipo de variables está limitado por la variabilidad que puede existir a razón de dificultades técnicas e interpretaciones del observador. La tabla 1 muestra los estudios que han determinado los diferentes índices pronósticos medidos por ecocardiograma32–41.
Se solicitó cambiar mayúsculas sostenidas por itálicas en altas y bajas
| I | NO HAY LIMITACIÓN PARA LA ACTIVIDAD FÍSICA Ausencia de síntomas con actividad ordinaria. |
| II | LEVE LIMITACIÓN PARA LA ACTIVIDAD FÍSICA Confortable en reposo. Las actividades ordinarias causan disnea o fatiga, dolor torácico o presíncope. |
| III | MARCADA LIMITACIÓN PARA LA ACTIVIDAD FÍSICA Confortable en reposo. Actividades de menor esfuerzo que las ordinarias generan disnea, fatiga, dolor torácico o presíncope. |
| IV | INHABILIDAD PARA LLEVAR A CABO CUALQUIER ACTIVIDAD SIN SÍNTOMAS Manifiestan signos de falla cardíaca derecha. Disnea y fatiga en reposo. Disconfort con cualquier actividad. |
| Estudio | Pacientes | Edad | Etiología | Tratamiento | Índices | Media de seguimiento | Resultado |
|---|---|---|---|---|---|---|---|
| Eysmann et al. (1989) (33) | 26 | 40,8 | Hipertensión arterial pulmonar | Vasodilatadores | Derrame pericárdico | 19,7 meses | Muerte |
| Hinderliter et al. (1997) (34) | 79 | Hipertensión arterial pulmonar | Prostanoides | Derrame pericárdico | 1 año | Muerte Transplante pulmonar | |
Yeo et al. (1998) (35) | 53 | 45 ±14 | Hipertensión arterial pulmonar | Calcio-antagonistas | Índice de TEI ≥ 083 | 2,9 años | Muerte Transplante pulmonar |
| Raymond et al. (2002 (36) | 81 | 40±15 | Hipertensión arterial pulmonar | Prostanoides | Derrame pericárdico Índice de área auricular 5cm2/m | 1 año | Muerte Transplante pulmonar |
| Forfia et al. (2006) (37) | 63 | 55±15 | IPAH,ES, ETC, ER, HTPTEC | Prostanoides, ERAS, PDE5i | TAPSE <1,8 cm | 19,3 meses | Muerte |
| Mahapatra et al. (2006) (38) | 54 | 44±11 | Hipertensión arterial pulmonar | Prostanoides, ERA, calcio-antagonistas | Capacitancia vascular pulmonar | 49,3 meses | Muerte |
| Brierre et al. (2010) (39) | 79 | 61,4 | IPAH, anorexígenos, ECT, Enfermedad inmunológica, http portopulmonar, HIV, sarcoidosis | Prostanoides, ERAS, PDE5i Tromboendarterectomia | PAPm > 49mm Hg PAD>29mm Hg Derrame pericárdico TEI TAPSE Diámetro CI | 12 meses | Muerte |
| Ghio et al. (2011 (40) | 52±16 | HAPi | De acuerdo con GUÍAS | VD diámetros (> 36,5 mm) | 38 meses | Muerte | |
| Sachdev et al. (2011) (41) | 56±14 | Hipertensión arterial pulmonar | De acuerdo con GUÍAS | Disminución de strain absoluto en 5% | 24 meses | Muerte | |
Modificada de: J Am Echocardiogr. 2013;26(1):1-14.
Sobre la realidad en el contexto de la hipertensión arterial pulmonar, el ventrículo derecho es el que realmente define el pronóstico42. Por lo tanto, la arteria pulmonar (AP) y el cumplimiento de la función del VD deben ser estudiados como una unidad para una evaluación exhaustiva de la hipertensión arterial pulmonar, especialmente en las etapas avanzadas de la enfermedad. En este objetivo la RMN es una herramienta no invasiva y muy útil en la caracterización adecuada de la función del VD. Un reciente metaanálisis43 que intenta fundamentar el rendimiento clínico de los resultados de RMN en el pronóstico de los pacientes con hipertensión arterial pulmonar, evaluó ocho estudios (539 pacientes) que investigaron 21 hallazgos RMN diferentes. Se encontró que la fracción de eyección del VD parece ser el predictor más fuerte y bien establecida de la mortalidad en la hipertensión arterial pulmonar. Además, se encontró que el aumento de los volúmenes del VD y el VI disminuido el volumen diastólico final al inicio del estudio se asocia con un mayor riesgo de mortalidad en pacientes con hipertensión arterial pulmonar. Dos estudios hacen énfasis directamente con mediciones seriadas en el seguimiento de pacientes mediante RMN43,44. Ambos estudios informan la importancia pronóstica de una disminución de la fracción de eyección del VD con el tiempo42,44.
Conflicto de interesesNinguno.