La válvula tricúspide tradicionalmente se conoce como la válvula olvidada debido a la menor importancia en cuanto a literatura publicada y ensayos clínicos disponibles hasta hace unos años. La ecocardiografía con sus diferentes modalidades de imagen se mantiene como el patrón de oro para determinar el mecanismo y la severidad de la insuficiencia tricúspide. En los últimos años, la investigación ha permitido implementar la técnica 3D, tanto en el examen transtorácico como en el transesofágico, para evaluar la anatomía valvular tricúspide desde su aspecto auricular o ventricular y analizar la estructura de sus valvas, sus variaciones anatómicas y los diferentes mecanismos o lesiones que pueden afectar su funcionamiento adecuado y generar regurgitación tricúspide y la consecuente morbimortalidad que conlleva.
The tricuspid valve is traditionally known as the forgotten valve, due to its importance given in the published literature and in the clinical trials available over the years. Echocardiography, with its different imaging modes, remains the reference standard for determining the mechanism and severity of the tricuspid insufficiency. In the past few years, research has enabled the 3-dimensional technique to be introduced, both in the transthoracic and trans-oesophageal examination. This permits the tricuspid valve anatomy to be evaluated from its atrial or ventricular aspect, as well as to analyse the structure of its valves, its anatomical variations. Furthermore, the different mechanisms or lesions that can affect its proper functioning and lead to tricuspid regurgitation, as well as the subsequent morbidity and mortality that may arise, can also be examined.
La enfermedad valvular del lado derecho del corazón tradicionalmente ha recibido menos atención que la enfermedad valvular mitral y aórtica. A la válvula tricúspide se le ha llamado incluso la válvula olvidada1. Esta hace parte de un sistema funcional complejo compuesto por aurícula derecha, aparato valvular y subvalvular, ventrículo derecho y circulación pulmonar.
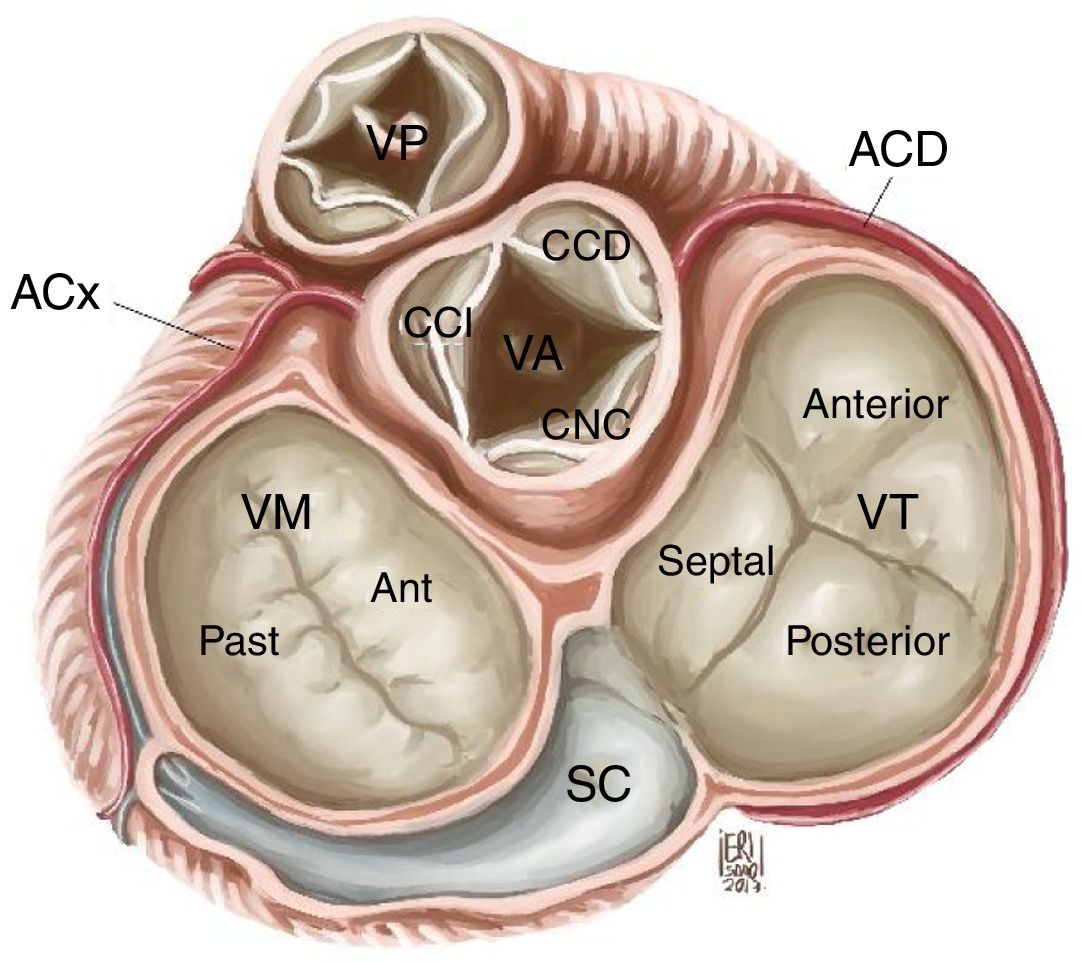
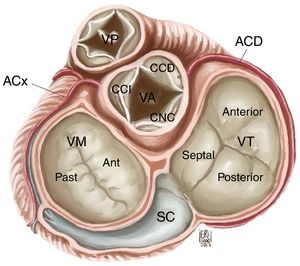
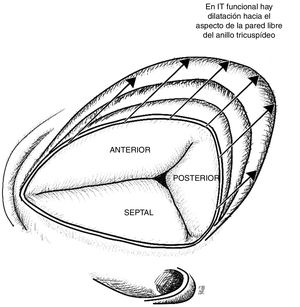
La estructura de la válvula tricúspide está ligada a un anillo fibroso, el anillo tricúspide, estructura no plana, en forma de silla de montar elíptica, al cual se anclan usualmente tres valvas: anterior, posterior y septal, que se encuentran separadas por tres comisuras: anteroposterior, posteroseptal y anteroseptal (fig. 1). Sin embargo, estudios anatómicos han demostrado que la válvula tricúspide no necesariamente está conformada por tres valvas y se han descrito válvulas con dos, cuatro o incluso seis cúspides2.
Anatomía de la válvula tricúspide. VT: válvula tricúspide, VM: válvula mitral, VA: válvula aórtica, VP: válvula pulmonar, SC: seno coronario, CCI: cúspide coronariana izquierda, CCD: cúspide coronariana derecha, CNC: cúspide no coronariana, ACx: arteria circunfleja, ACD: arteria coronaria derecha.
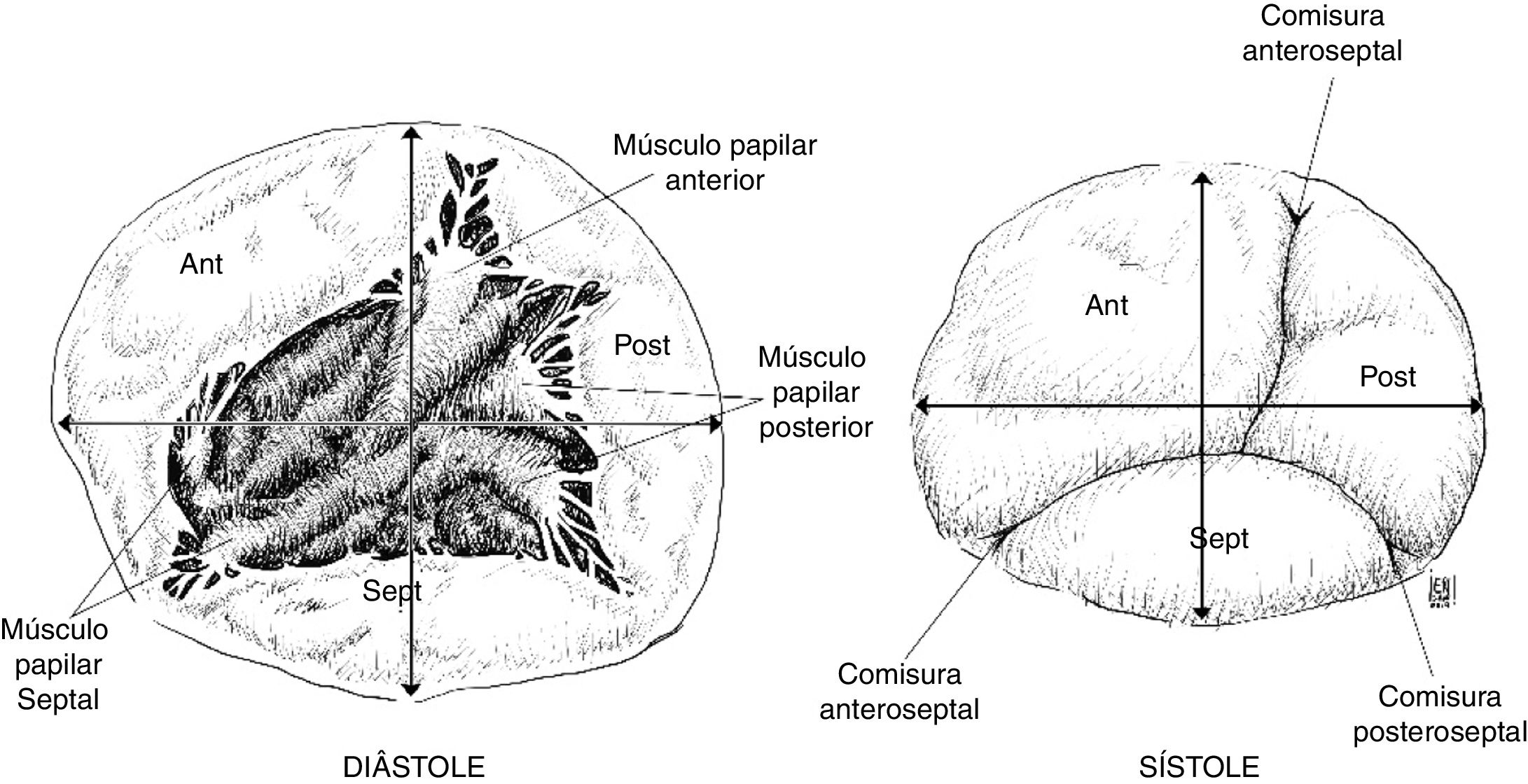
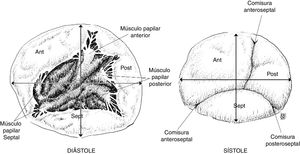
La forma del anillo varía durante el ciclo cardiaco: en diástole es circular con un diámetro transverso más grande que el diámetro anteroposterior. Durante la sístole el anillo se encoge en sentido anteroposterior quedando con forma ovalada, donde el diámetro transverso es el eje mayor del mismo3 (fig. 2).
La valva anterior de la tricúspide es la más amplia, seguida de la posterior, siendo la valva septal la de menor extensión. La valva anterior está anclada al tracto de salida del ventrículo derecho, la valva posterior a la pared muscular del ventrículo derecho, mientras que la valva septal al septum. Por la gran extensión de su superficie de coaptación, la valva anterior es la que más aporta a la competencia valvular durante la sístole. En sístole, las tres valvas convergen y la superficie de coaptación aparece trifurcada de forma asimétrica4.
La válvula tricúspide se encuentra conectada con el ventrículo derecho mediante un aparato subvalvular encargado de limitar el desplazamiento atrial durante la coaptación en sístole y facilitar su apertura activa en la diástole. El aparato subvalvular está conformado por músculos papilares y cuerdas tendinosas; los músculos papilares están anclados a la pared del ventrículo derecho y se ubican en tres grupos principales: músculo papilar anterior, posterior y septal. El músculo papilar anterior es predominante en tamaño5. Todos estos músculos están irrigados por arterias pequeñas provenientes de la arteria coronaria derecha. Las cuerdas tendinosas se extienden desde los músculos papilares hasta las valvas como el sistema de suspensión de un paracaídas; son alrededor de 25 cuerdas tendinosas las que se unen a las valvas, distribuidas a la base de la valva (cuerdas basales), a la porción intermedia de la superficie ventricular de la valva (cuerdas secundarias) o al margen libre de las valvas (cuerdas marginales). Las cuerdas tendinosas también pueden insertarse directamente a la pared del ventrículo derecho a diferencia del aparato subvalvular mitral, que necesariamente se origina en los músculos papilares6.
Insuficiencia o regurgitación tricúspide: mecanismos y fisiopatologíaLos primeros estudios permitieron observar una prevalencia de insuficiencia tricúspide en población normal entre el 0 y el 53% según las series7,8. Los grandes estudios poblacionales han evidenciado que hasta 65 a 75% de la población general puede tener insuficiencia tricúspide trivial o leve sin que ello constituya un evento anómalo con implicaciones clínicas, presentando valvas estructuralmente normales, anillos con diámetro normal y tamaño normal de aurículas y ventrículos9–13. El diagnóstico clínico de la insuficiencia tricúspide usualmente es difícil debido a que la mayoría de pacientes son asintomáticos y la auscultación cardiaca puede no detectar fácilmente el soplo en estadios leves, luego el diagnóstico se realiza casi siempre durante un examen ecocardiográfico hecho por alguna otra indicación14.
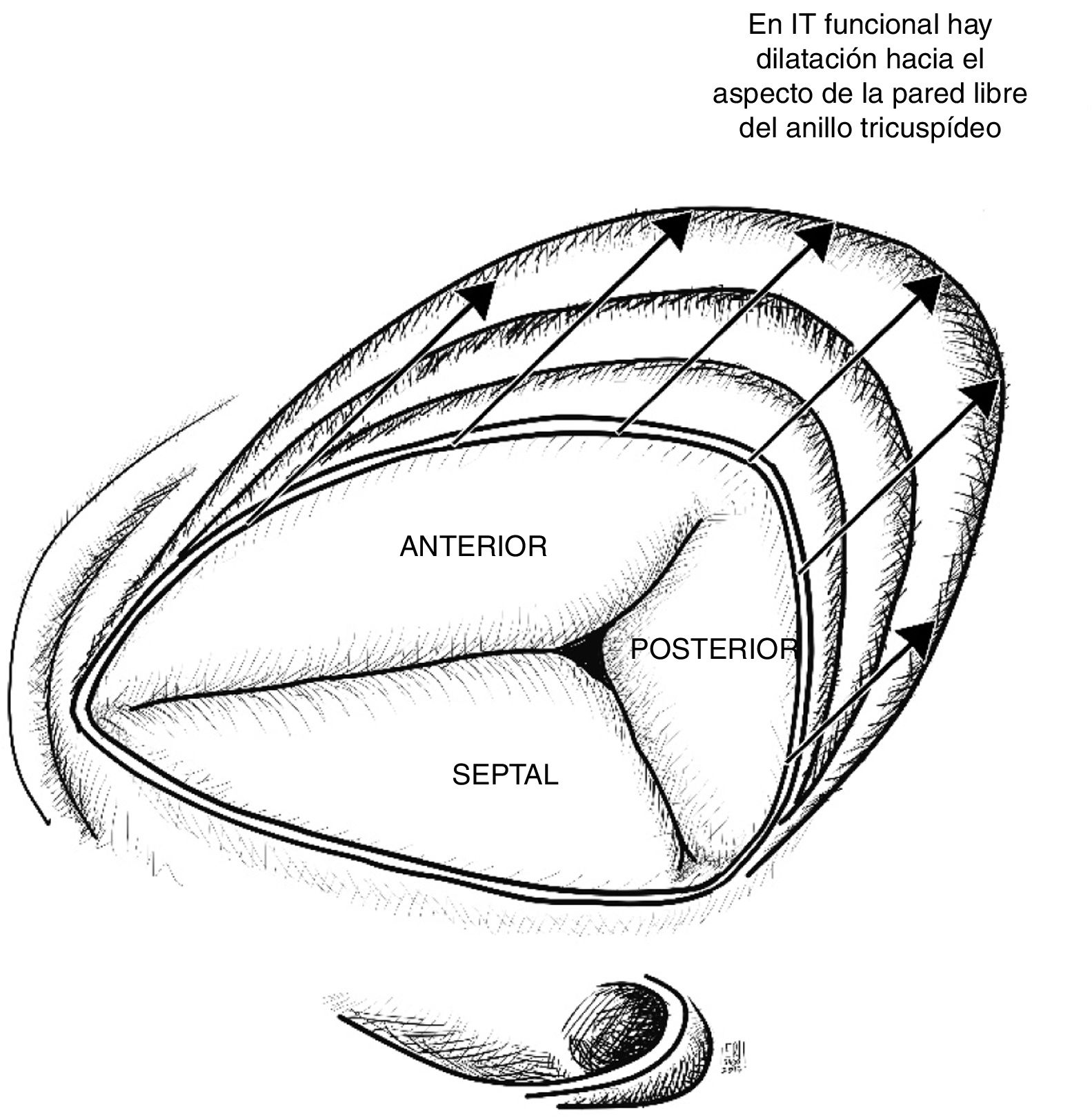
Al igual que la regurgitación mitral, la insuficiencia tricúspide puede clasificarse en dos tipos: primaria, cuando existe daño intrínseco de la válvula y secundaria o funcional, cuando es consecuencia de remodelación y/o disfunción del ventrículo derecho. La tabla 1 muestra las causas de insuficiencia tricúspide primaria más frecuentes las cuales explican el 20% de los casos; sin embargo, la funcional es de lejos la más común, como consecuencia de enfermedades frecuentes del lado izquierdo del corazón, siendo así la responsable en más del 80% de los casos15. La remodelación del ventrículo derecho y del anillo tricúspide explican en parte la patogenia de la insuficiencia tricúspide funcional. Si se tiene en cuenta que en la insuficiencia tricúspide funcional las valvas son morfológicamente normales, la integridad del aparato valvular tricúspide depende fundamentalmente del tamaño y función del ventrículo derecho; en la medida en que el ventrículo derecho aumenta de tamaño, el anillo tricúspide se dilata hacia la pared libre (aspectos anterior y posterior), tomando una forma más circular y favoreciendo la aparición de insuficiencia valvular16,17 (fig. 3).
Causas más comunes de insuficiencia tricúspide primaria (orgánica)
| Por enfermedad adquirida | Por enfermedad congénita |
|---|---|
| Flail o prolapso de la válvula (degeneración mixomatosa) | Anomalía de Ebstein |
| Enfermedad reumática | Displasia de la válvula tricúspide |
| Endocarditis | Válvula de doble orificio |
| Asociada a electrodos de dispositivos de estimulación | Hipoplasia o cleft valvular |
| Trauma cerrado de tórax | Traccionamiento de la válvula asociado a CIV perimembranosa con aneurisma del septum interventricular |
| Biopsia endomiocárdica del ventrículo derecho | Tetralogía de Fallot reparada |
| Enfermedad carcinoide | L-transposición de grandes arterias |
| Radiación | |
| Disfunción de prótesis tricúspide |
Válvula tricúspide vista desde la aurícula derecha. En la insuficiencia tricúspide funcional se evidencia dilatación progresiva del anillo hacia su aspecto anterior y posterior afectando progresivamente la coaptación, lo cual empeora la insuficiencia. Basado en estudio de Ton-Nu et al.17.
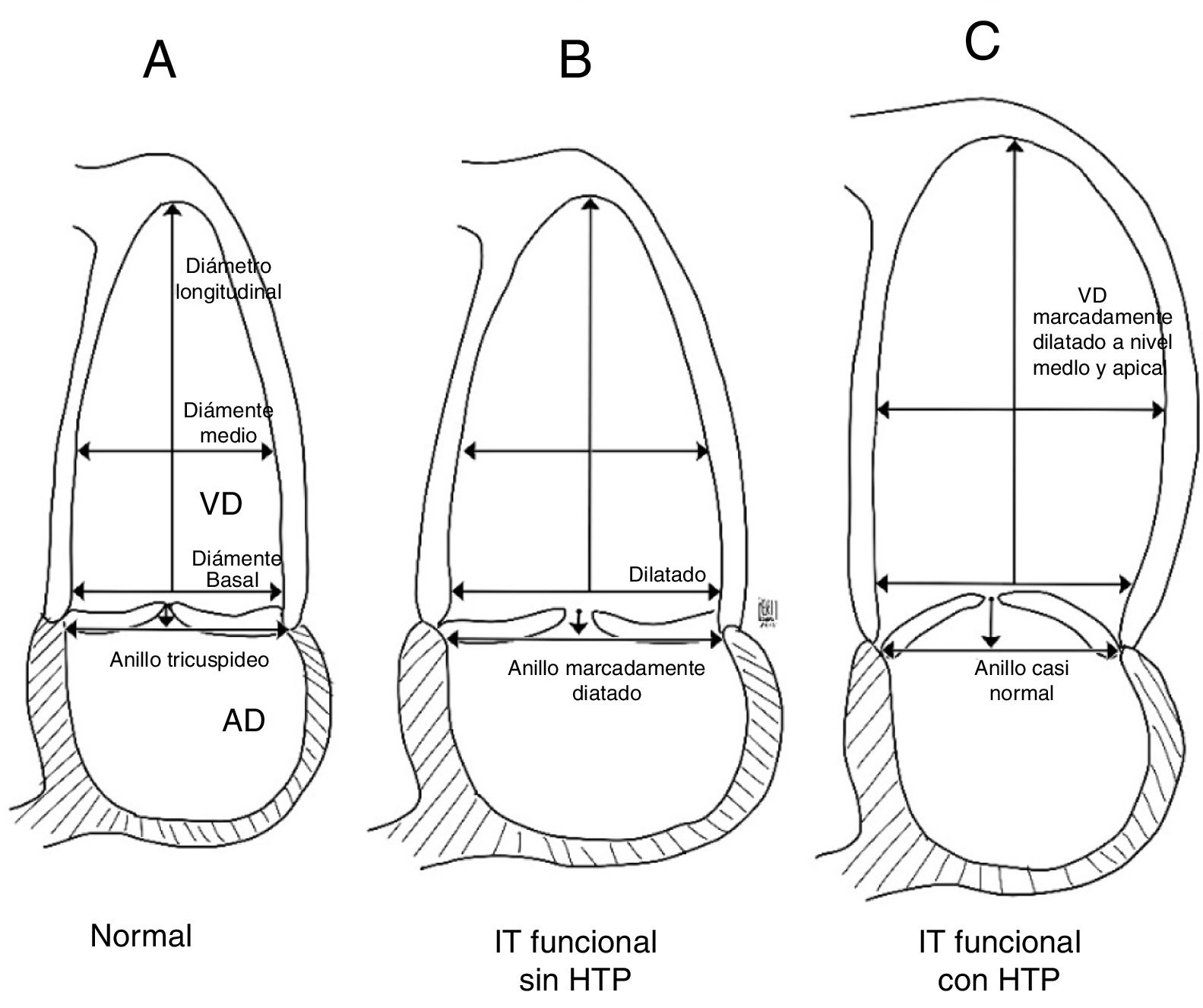
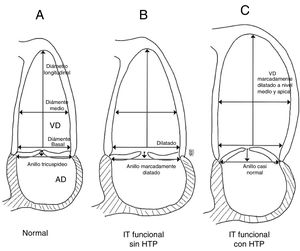
Topilsky et al., describieron dos tipos de remodelado del ventrículo derecho: la primera, está ligada a patología del lado izquierdo del corazón, en donde aumenta el diámetro basal del ventrículo derecho usualmente con dilatación del anillo, lo cual origina la insuficiencia. La segunda causa está la asociada a hipertensión pulmonar, en la cual se remodela el cuerpo y ápex del ventrículo derecho alterando la posición de sus músculos papilares y de esta forma se restringe su movimiento impidiendo el cierre valvular adecuado (fig. 4)18. En las afecciones del lado izquierdo del corazón la causa más común de insuficiencia tricúspide es la enfermedad valvular mitral, con una prevalencia en los estudios de entre un 8 a un 65% de los casos que van a cirugía; así mismo la disfunción sistólica y/o diastólica del ventrículo izquierdo pueden generar insuficiencia tricúspide funcional en algún momento de su evolución9–12.
Remodelación de las cavidades derechas en insuficiencia tricúspide funcional en pacientes con y sin hipertensión pulmonar. Esquema A: representa un ventrículo derecho normal. Esquema B: muestra como en pacientes con patología del lado izquierdo sin HTP se dilata significativamente el anillo tricúspide y el diámetro basal del ventrículo derecho evitando la coaptación adecuada de las valvas durante la sístole. Esquema C: en pacientes con HTP, el diámetro del anillo tricúspide se conserva pero la dilatación y el remodelado excéntrico medio-apical del ventrículo llevan a traccionamiento apical de las valvas y aumento en la altura de coaptación; debido a esto se genera la insuficiencia tricúspide. Basado en el estudio de Topilsky et al18.
Por otra parte, el anillo tricúspide se puede dilatar de manera aislada en pacientes con fibrilación auricular crónica, la cual a largo plazo puede dilatar el ventrículo derecho, remodelándolo y esto a su vez empeora la insuficiencia tricúspide produciendo un círculo vicioso que lleva a más insuficiencia19. Otras causas de insuficiencia tricúspide secundaria incluyen el infarto del ventrículo derecho debido al remodelado adverso y más frecuentemente la disfunción miocárdica secundaria a la disincronía que genera la estimulación crónica del marcapasos sobre el ápex del ventrículo. Entre las cardiopatías congénitas no tricúspides, cualquiera que produzca sobrecarga de volumen o presión sobre el ventrículo derecho remodelándolo, podrá generar secundariamente insuficiencia tricúspide de cualquier grado (por ejemplo: defecto septal atrial, drenaje venoso anómalo pulmonar, etc.)11.
La misma insuficiencia tricúspide genera mayor insuficiencia en un ciclo repetitivo adverso, y por tanto aumenta el tamaño de la aurícula derecha, empeorando la dilatación del ventrículo derecho y del anillo tricúspide; finalmente, la insuficiencia tricúspide severa lleva a disfunción sistólica y diastólica del ventrículo derecho, aumento en sus presiones de llenado y desplazamiento del septum interventricular hacia la izquierda en diástole, con lo cual se reduce el tamaño del ventrículo izquierdo por compresión y restricción para su llenado adecuado, hecho que finalmente se traduce en aumento de la presión de fin de llenado del mismo y disfunción diastólica. De todo lo anterior, tal vez, los determinantes mayores de severidad de la insuficiencia tricúspide son la dilatación del anillo (el cual pierde su forma de silla de montar, se aplana y se distorsiona) y el traccionamiento de las valvas con restricción para su cierre en sístole debido a desplazamiento de los músculos papilares6,20.
Evaluación por ecocardiografíaEl ecocardiograma supera a la evaluación clínica en el diagnóstico preciso de la insuficiencia tricúspide. Su objetivo es detectarla, caracterizar su etiología, determinar su severidad, estimar la presión sistólica de la arteria pulmonar y evaluar la función del ventrículo derecho21. Cuando la insuficiencia tricúspide es secundaria a dilatación del anillo, la aurícula derecha, el ventrículo derecho y el anillo tricúspide se encuentran marcadamente dilatados22. Es importante medir el diámetro del anillo tricúspide en el plano apical de cuatro cámaras con proyección enfocada en el ventrículo derecho (desde el borde interno lateral hasta el borde interno septal), puesto que un anillo mayor de 40mm o de 21mm/m2 está relacionado con un mayor volumen regurgitante (insuficiencia más severa) y es un punto de corte a tener en cuenta para evaluar la posibilidad de reparo de la válvula tricúspide durante una cirugía por enfermedad valvular izquierda u otra indicación23–26.
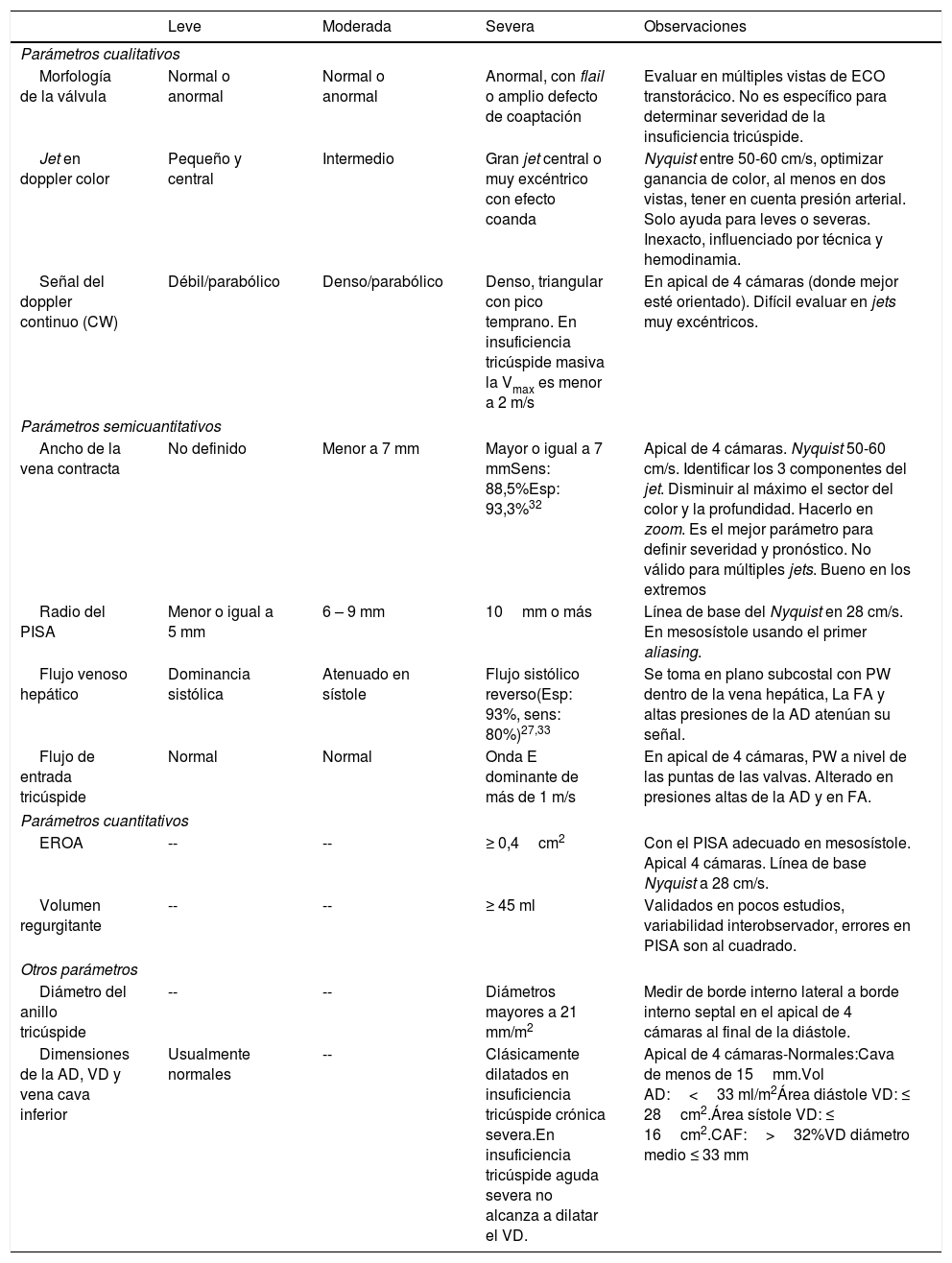
La determinación de la severidad de la insuficiencia tricúspide es compleja y requiere la integración por ecocardiografía de parámetros cualitativos, semicuantitativos y cuantitativos para intentar precisar su gravedad. Grant et al. diseñaron un estudio en el que demostraron alta variabilidad interobservador cuando se estimaba la severidad de la insuficiencia tricúspide con criterios cualitativos o semicuantitativos aisladamente; al incorporar varios criterios semicuantitativos y cuantitativos en un algoritmo de evaluación, la concordancia y precisión mejoraron de manera significativa27. Las diferentes guías europeas y americanas de cuantificación de severidad de las insuficiencias incorporan una mezcla de criterios en donde los cuantitativos son la piedra angular. La siguiente tabla muestra los parámetros más importantes que se deben evaluar para determinar la severidad de la insuficiencia tricúspide en todo estudio ecocardiográfico14,18–31.tabla 2
Evaluación ecocardiográfica de la insuficiencia tricúspide
| Leve | Moderada | Severa | Observaciones | |
|---|---|---|---|---|
| Parámetros cualitativos | ||||
| Morfología de la válvula | Normal o anormal | Normal o anormal | Anormal, con flail o amplio defecto de coaptación | Evaluar en múltiples vistas de ECO transtorácico. No es específico para determinar severidad de la insuficiencia tricúspide. |
| Jet en doppler color | Pequeño y central | Intermedio | Gran jet central o muy excéntrico con efecto coanda | Nyquist entre 50-60 cm/s, optimizar ganancia de color, al menos en dos vistas, tener en cuenta presión arterial. Solo ayuda para leves o severas. Inexacto, influenciado por técnica y hemodinamia. |
| Señal del doppler continuo (CW) | Débil/parabólico | Denso/parabólico | Denso, triangular con pico temprano. En insuficiencia tricúspide masiva la Vmax es menor a 2 m/s | En apical de 4 cámaras (donde mejor esté orientado). Difícil evaluar en jets muy excéntricos. |
| Parámetros semicuantitativos | ||||
| Ancho de la vena contracta | No definido | Menor a 7 mm | Mayor o igual a 7 mmSens: 88,5%Esp: 93,3%32 | Apical de 4 cámaras. Nyquist 50-60 cm/s. Identificar los 3 componentes del jet. Disminuir al máximo el sector del color y la profundidad. Hacerlo en zoom. Es el mejor parámetro para definir severidad y pronóstico. No válido para múltiples jets. Bueno en los extremos |
| Radio del PISA | Menor o igual a 5 mm | 6 – 9 mm | 10mm o más | Línea de base del Nyquist en 28 cm/s. En mesosístole usando el primer aliasing. |
| Flujo venoso hepático | Dominancia sistólica | Atenuado en sístole | Flujo sistólico reverso(Esp: 93%, sens: 80%)27,33 | Se toma en plano subcostal con PW dentro de la vena hepática, La FA y altas presiones de la AD atenúan su señal. |
| Flujo de entrada tricúspide | Normal | Normal | Onda E dominante de más de 1 m/s | En apical de 4 cámaras, PW a nivel de las puntas de las valvas. Alterado en presiones altas de la AD y en FA. |
| Parámetros cuantitativos | ||||
| EROA | -- | -- | ≥ 0,4cm2 | Con el PISA adecuado en mesosístole. Apical 4 cámaras. Línea de base Nyquist a 28 cm/s. |
| Volumen regurgitante | -- | -- | ≥ 45 ml | Validados en pocos estudios, variabilidad interobservador, errores en PISA son al cuadrado. |
| Otros parámetros | ||||
| Diámetro del anillo tricúspide | -- | -- | Diámetros mayores a 21 mm/m2 | Medir de borde interno lateral a borde interno septal en el apical de 4 cámaras al final de la diástole. |
| Dimensiones de la AD, VD y vena cava inferior | Usualmente normales | -- | Clásicamente dilatados en insuficiencia tricúspide crónica severa.En insuficiencia tricúspide aguda severa no alcanza a dilatar el VD. | Apical de 4 cámaras-Normales:Cava de menos de 15mm.Vol AD:<33 ml/m2Área diástole VD: ≤ 28cm2.Área sístole VD: ≤ 16cm2.CAF:>32%VD diámetro medio ≤ 33 mm |
ECO transtorácico: ecocardiograma transtorácico. Vmax: velocidad máxima del jet tricúspide. Sens: sensibilidad. Esp: especificidad. PW: doppler pulsado. FA: fibrilación auricular. AD: aurícula derecha. EROA: área del orificio regurgitante efectivo. VD: ventrículo derecho. CAF: cambio de área fraccional.
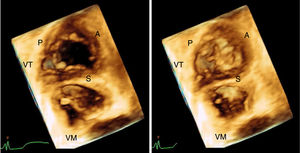
La tecnología 3D de los equipos contemporáneos de ecocardiografía permitió, mediante la adquisición rápida de un volumen de imagen en 3D, observar estructuras en tiempo real que no eran fácilmente caracterizadas durante una eco 2D; específicamente es posible observar “de frente” a la válvula tricúspide desde la aurícula o el ventrículo, dependiendo si la aproximación se realiza mediante eco transesofágico o eco transtorácico y visualizar las tres valvas al tiempo en movimiento durante sístole-diástole, su relación con el anillo y la coaptación34. Si se dispone de una buena ventana en el Eco 2D, la evaluación adecuada con 3D se logrará en más del 85% de los casos6 (fig. 5). Lang, en un destacado trabajo, demostró como los cortes tradicionales utilizados en Eco transtorácico 2D para identificar las cúspides de la válvula tricúspide fallaban en un porcentaje no despreciable en determinar la valva real; el Eco transtorácico 3D sugiere algunas proyecciones en 2D con estructuras anatómicas de referencia que pueden ayudar a identificar dicha cúspide cuando no es posible realizar un estudio 3D35. El Eco 3D además de lograr evaluar anomalías estructurales en detalle, ha sido fundamental en la evaluación de la afectación valvular secundaria a electrodos de dispositivos de estimulación cardiaca. Los dispositivos de estimulación cardiaca que se implantan en la actualidad en su mayoría requieren el posicionamiento de un electrodo ventricular derecho a través de la válvula tricúspide. La sensibilidad del Eco 3D para identificar la trayectoria del electrodo y su relación con las valvas de la tricúspide puede ser incluso del 94%36,37. El primer reporte de caso de insuficiencia tricúspide asociada a un electrodo de dispositivo fue mediante autopsia en la que se evidenció perforación de una de las valvas de la válvula tricúspide como causante de la insuficiencia tricúspide38. Los primeros estudios hechos en pacientes con dispositivos de estimulación implantados mostraron una prevalencia de insuficiencia tricúspide del 25 al 29%, significativamente mayor que con el grupo control39,40. La afección valvular puede ser de varias formas: interferencia mecánica en el cierre adecuado de las valvas, perforación de alguna cúspide, adherencia severa y daño directo del aparato subvalvular. Es importante mencionar que el ECO 3D no permite hasta el momento diferenciar entre interferencia mecánica pura sobre una valva o adherencia del electrodo a la misma con las consecuencias que esto genere, lo cual tendría algún impacto si se plantea la extracción percutánea del electrodo41. La valva comúnmente afectada por el electrodo es la septal (23%), seguida de la posterior (20%) y en menos porcentaje la anterior (4%). La severidad de la insuficiencia tricúspide es significativamente mayor en el grupo de pacientes con interferencia mecánica del electrodo cuando se encuentra ubicado a nivel del cuerpo de las valvas, comparado con los pacientes que tienen el electrodo ubicado en alguna comisura o en el centro del orificio42. En conclusión, al tomar todas las series publicadas hasta el momento desde los primeros estudios con autopsias, se encuentra una prevalencia de la insuficiencia tricúspide relacionada a dispositivos distribuida en un rango amplio, entre el 7 al 42% de acuerdo con la publicación37,43.
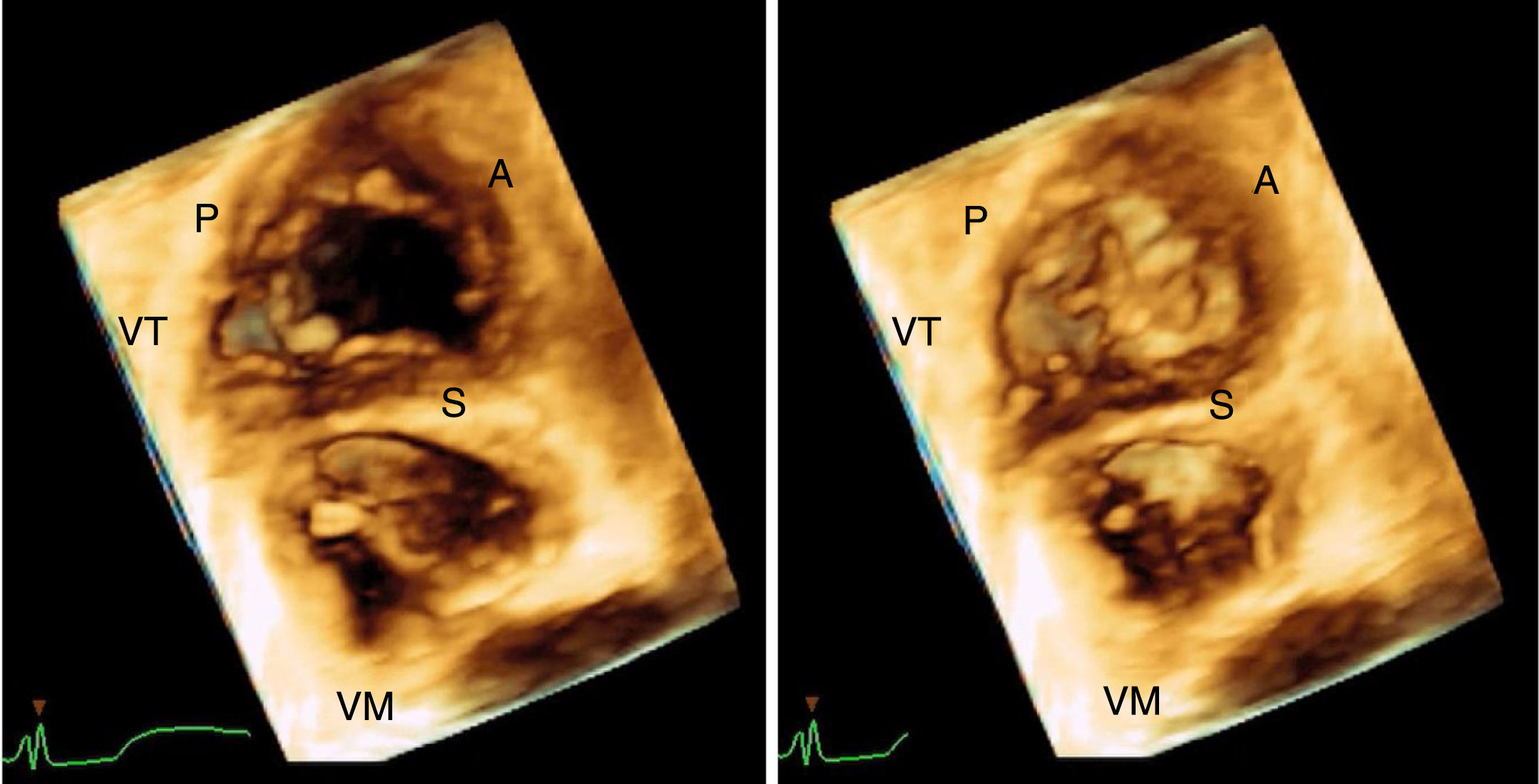
Imagen 3D de la válvula tricúspide obtenida en el laboratorio de la Fundación Cardioinfantil durante un Eco transtorácico empleando la herramienta de volumen completo en proyección apical de 4 cámaras y vista de frente desde el ventrículo derecho. A la izquierda en diástole ventricular y a la derecha en sístole. VT: válvula tricúspide. VM: válvula mitral. P: valva posterior tricúspide. S: valva septal. A: valva anterior.
La literatura publicada hasta el momento sobre la “válvula olvidada” ya es clara en demostrar que la insuficiencia tricúspide no es una entidad benigna; por tanto, el subdiagnóstico y la subestimación de la progresión de su severidad puede traer desenlaces clínicos desfavorables44. Está demostrado que tener insuficiencia tricúspide moderada o severa sin importar la causa, se asocia con mayor mortalidad a largo plazo aún después de ajustar por edad, fracción de eyección, presión sistólica de arteria pulmonar, tamaño y función del ventrículo derecho45. También se ha evaluado el pronóstico de la insuficiencia tricúspide asociada con el electrodo de dispositivos de estimulación: los escasos estudios sugieren que los pacientes que tienen un empeoramiento de la severidad de la insuficiencia tricúspide al comparar los ecocardiogramas previos al dispositivo y de control post implante, tienen una incidencia mayor de hospitalizaciones por falla (HR: 1,64, p=0,019) y mayor mortalidad por cualquier causa (HR: 1,68, p=0,04) comparado con pacientes sin insuficiencia tricúspide significativa46.
ConclusionesLa válvula tricúspide ya no es más la válvula olvidada. Gracias al desarrollo de la tecnología 3D y a la estandarización en la evaluación de la insuficiencia tricúspide, hoy es posible estimar de manera precisa y detallada el mecanismo y la severidad de dicha valvulopatía, información vital para decidir el tipo y momento de su intervención, aspecto que ha demostrado su relevancia en diversos estudios en los que la mortalidad y las hospitalizaciones aumentan si no se diagnostica e interviene a tiempo.
Conflicto de interesesNinguno.