Conocer las características de la población en riesgo de tromboembolia venosa y determinar si la profilaxis antitrombótica usada en patologías no quirúrgicas en un hospital universitario de tercer nivel, se adhiere a los protocolos de tromboprofilaxis establecidos.
MétodosSe llevó a cabo un estudio observacional de corte transversal, en el que se incluyeron pacientes mayores de 40 años, hospitalizados por patologías de tratamiento médico no quirúrgicas y con una permanencia de por lo menos 72 horas. Para evaluar el riesgo de trombembolia venosa y de sangrado se aplicaron las escalas PADUA e IMPROVE, respectivamente.
ResultadosLa muestra estuvo conformada por 233 pacientes, 56,6% del género masculino, con promedio de edad de 64,8 años ± 13,1. La inmovilidad prolongada fue el principal factor de riesgo para trombembolia venosa durante la hospitalización; ésta fue cercana al 48,9% en la muestra total y a 69,4% en los pacientes evaluados mediante la escala de PADUA ≥4 (p<0,01). Al determinar la frecuencia de tromboprofilaxis en los pacientes en riesgo, se determinó que 79,8% recibieron algún método de tromboprofilaxis. Entre los pacientes con puntaje en escala de PADUA < 4 se encontró que el 73,4% recibió tromboprofilaxis farmacológica.
ConclusionesEn nuestro medio la tromboprofilaxis farmacológica se basa principalmente en el uso de heparinas de bajo peso molecular y se puede afirmar que dicho uso es adecuado y está por encima de otras series previamente referenciadas.
To find out the characteristics of the population at risk of venous thromboembolism (VTE) and to determine whether antithrombotic prophylaxis used in nonsurgical conditions at a third level university hospital adheres to established protocols for thromboprophylaxis.
MethodsA cross-sectional observational study was conducted. Selected patients were over 40 years of age, hospitalized due to nonsurgical, medical conditions and hospitalized for at least 72 hours. The PADUA score was used to assess the risk for VTE, and the IMPROVE score was used to assess bleeding.
ResultsThe sample consisted of 233 patients, 56.6% of whom were men, with an average age of 64.8 ± 13.1 years. The main risk factor for VTE during hospitalization was prolonged immobility, at 48.9% of the total sample and 69.4% of patients with a Padua ≥4 (p=<0.01). When determining the frequency of thromboprophylaxis in patients at risk, results showed that 79.8% received some type of thromboprophylaxis. Among patients with a <4 Padua score it was found that 73.4% received pharmacologic thromboprophylaxis.
ConclusionsIn our field, pharmacologic thromboprophylaxis is mainly based on the use of low molecular weight heparins and it can be concluded that the use of thromboprophylaxis is appropriate and above that of other previously referenced series.
La trombembolia venosa en pacientes hospitalizados continúa siendo una patología de alta morbimortalidad, pero prevenible1. Su incidencia anual en Estados Unidos es de 117 por cada 100.000 habitantes2, presentándose entre 200.000 a 300.000 hospitalizaciones y entre 50.000 a 100.000 muertes anuales3,4. Ahora bien, con base en pacientes con patologías médicas, se ha descrito que aquellos hospitalizados por estas condiciones tienen un riesgo moderadamente alto para trombembolia venosa (42%). De igual manera, en estudios donde se registraron reportes de autopsias, la tromboembolia pulmonar estuvo presente en el 10% de los casos5.
Por otra parte, en la Unión Europea se reportan aproximadamente 160 casos de trombosis venosa profunda por cada 100.000 habitantes por año y particularmente en España se presentan anualmente cerca de 45.000 casos de embolia pulmonar6–8. Estudios en Colombia muestran una incidencia de tromboembolia venosa del 7% en pacientes hospitalizados por condiciones tanto médicas como quirúrgicas, y por otro lado se tienen cifras del 14,8% en cuanto a mortalidad hospitalaria9,10. A su vez, en ausencia de tromboprofilaxis, la incidencia de tromboembolia venosa se concentra entre un 10 y 20% en pacientes con condiciones médicas y en un 80% en pacientes con traumas, lesiones espinales y en aquellos que permanecen en unidades de cuidados intensivos11.
Así mismo, el tromboembolia venosa ha sido catalogada como una causa prevenible de muerte hospitalaria1; no obstante, pese a que existe evidencia favorable en cuanto a métodos farmacológicos y no farmacológicos para evitarla, una importante cantidad de pacientes no los reciben5. Los datos globales muestran diferencias entre los países en lo que respecta al uso de tromboprofilaxis en pacientes hospitalizados12,13. Hasta el año 2007 no se disponía de estudios que reportaran patrones de tromboprofilaxis en pacientes hospitalizados por patología médica. A raíz de lo anterior, se desarrolló el International Medical Prevention Registry on Venous thromboembolism (IMPROVE), un estudio multicéntrico que determinó que solo el 60% de los pacientes que reunían criterios de tromboprofilaxis, en efecto la recibieron14. Adicionalmente, es preciso comentar que en Norteamérica se han reportado tasas de tromboprofilaxis del 61%, aunque aplicada de forma adecuada solo alcanza el 33,9%15–17.
A su vez, el estudio ENDORSE (Epidemiologic International Day for the Evaluation of Patients at Risk for Venous Thromboembolism in the Acute Hospital Care Setting), que se llevó a cabo en 32 países, fue diseñado para identificar la prevalencia del riesgo de trombembolia venosa y la proporción de pacientes en riesgo, que recibieron tromboprofilaxis efectiva. Los resultados mostraron que según las guías del American College of Chest Physicians (ACCP), de los pacientes quirúrgicos en riesgo de tromboembolia, 58,5% recibieron tromboprofilaxis, mientras que entre los pacientes en riesgo con patología médica, solo accedió a ella el 39,5%5.
En vista de lo anterior y según las publicaciones disponibles, los resultados no son alentadores, puesto que, dado que existen guías con suficiente nivel de evidencia que establecen las indicaciones de tromboprofilaxis18, una importante proporción de pacientes no la reciben. Además, aun con la existencia de escalas de puntuación que establecen el riesgo de trombembolia venosa en pacientes hospitalizados19, dichas herramientas son conocidas vagamente por el personal de salud o resultan poco prácticas en el escenario clínico. A ello se suma el temor sobrevalorado del riesgo potencial de sangrado cuando se opta por indicar la tromboprofilaxis farmacológica20, hecho que sin duda se convierte en una barrera para la prevención de eventos tromboembólicos. Por su parte, el estudio ENDORSE reportó una frecuencia de tromboprofilaxis que varía entre el 3 al 70% entre los países participantes5, si bien este último dato tiene un rango amplio e inespecífico, que requiere que se adelanten investigaciones que evalúen estas prácticas teniendo en cuenta los referentes internacionales. Así pues, en el Departamento de Medicina Interna de la Universidad Industrial de Santander se desarrolló esta investigación que pretendió conocer las características de la población en riesgo de tromboembolia venosa y además determinar si la profilaxis antitrombótica usada en patologías no quirúrgicas en un hospital universitario de tercer nivel, se adhiere al protocolo de tromboprofilaxis establecido por la ACCP.
Material y métodosDiseño y población del estudioSe llevó a cabo un estudio observacional de corte transversal, en el que se incluyeron pacientes mayores de 40 años y que estuvieran hospitalizados por lo menos 72 horas a causa de patologías de tratamiento médico no quirúrgicas. Por otra parte, se excluyeron pacientes que recibieran dosis de anticoagulación con heparina no fraccionada, heparina de bajo peso molecular, warfarina o nuevos anticoagulantes orales, y aquellos con condiciones hemorrágicas al ingreso de su hospitalización. La recolección de los pacientes inició en octubre de 2013 y concluyó en noviembre de 2014. El lugar donde se captaron los pacientes fue el Hospital Universitario de Santander el cual es una entidad de tercer nivel, ubicada en el Departamento de Santander, al noreste de Colombia, que alberga aproximadamente 2.100.000 habitantes21
Muestreo y proceso de captación de pacientesPara el cálculo de tamaño de la muestra se tuvo en cuenta la prevalencia del riesgo de tromboembolia venosa, la cual se estimó en 51%, de acuerdo con un estudio nacional previo22; además, se tuvo en cuenta un nivel de confianza del 95% y un margen de error del 5%, que arrojó un cálculo de 233 pacientes. Se revisaron las historias clínicas de ingreso de los pacientes que cumplían con los criterios de inclusión, a fin de capturar los datos que requería el cuestionario. Para el registro de los mismos, se obtuvo el instrumento utilizado en el estudio original ENDORSE con previa autorización del autor5,9. Cada encuesta tuvo una codificación pertinente a salvaguardar el principio ético de confidencialidad del paciente. Las encuestas se aplicaron a partir de las primeras 72 horas del ingreso del paciente en los servicios de hospitalización.
Valoración del riesgo de tromboembolia venosa y sangradoLos pacientes con patologías médicas generalmente pueden ser clasificados en escalas de riesgo para tromboembolia venosa teniendo en cuenta la presencia de comorbilidades o patologías de base. De acuerdo con dichas condiciones, figura la escala de predicción de PADUA, la cual tiene en cuenta 12 parámetros con puntuaciones específicas que establecen un puntaje total, considerándose riesgo alto una puntuación igual o mayor a 4 puntos19,23. La ACCP en su novena edición de 201218, recomienda la tromboprofilaxis farmacológica con heparina no fraccionada, heparinas de bajo peso molecular o fondaparinux en pacientes con puntaje de PADUA mayor o igual 4 puntos en quienes no existan contraindicaciones y tromboprofilaxis con medidas no farmacológicas. Es de resaltar que se conoce que el uso de una profilaxis antitrombótica adecuada se asocia de manera significativa con un riesgo reducido de tromboembolia venosa clínica en comparación con el no uso de ningún método24.
Por otra parte, las escalas actuales para establecer el riesgo de sangrado, como HAS–BLED o índice de riesgo HEMORR2HAGES, solo están validadas para pacientes ambulatorios que toman anticoagulantes orales25,26. En el estudio IMPROVE mencionado previamente, surgió la escala de riesgo para sangrado que lleva su mismo nombre5,27. En este sentido, el panel de la ACCP considera que los pacientes hospitalizados por patología médica tienen alto riesgo de sangrado si presentan al menos uno de los tres factores de riesgo asociados fuertemente con sangrado: úlcera gastroduodenal activa, sangrado en los últimos 3 meses previos a la admisión y conteo de plaquetas menor18 de 50.000 mm3. En términos de puntaje, un valor mayor a 7, se asocia con un riesgo de sangrado exponencial mayor, dado a que en el estudio IMPROVE más de la mitad de todos los sangrados mayores y en más de un tercio de cualquier sangrado (mayor o no mayor pero clínicamente significativo), se registró dicho puntaje en el 10% de los pacientes agudamente enfermos24.
Análisis estadísticoPara este estudio con fines descriptivos, las variables continuas se describieron en promedios o medianas de acuerdo con la distribución de cada variable; las categóricas se expresaron en proporciones. Para realizar la comparación de proporciones el estadístico de prueba utilizado fue Z o Chi2 según la variable categórica a evaluar. Por otra parte, en la tabla 1 se especifican intervalos de confianza para cada variable; en términos de significancia estadística cuando se realizaron comparaciones, se tomó el valor menor a 0,05 como significativo. El análisis de los datos se realizó en Stata 12.
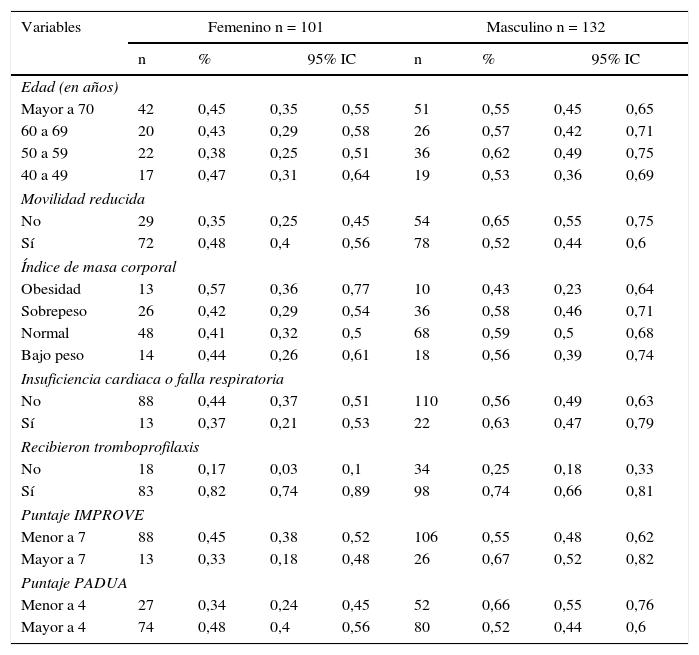
Distribución de principales variables clínicas de acuerdo con el género
| Variables | Femenino n = 101 | Masculino n = 132 | ||||||
|---|---|---|---|---|---|---|---|---|
| n | % | 95% IC | n | % | 95% IC | |||
| Edad (en años) | ||||||||
| Mayor a 70 | 42 | 0,45 | 0,35 | 0,55 | 51 | 0,55 | 0,45 | 0,65 |
| 60 a 69 | 20 | 0,43 | 0,29 | 0,58 | 26 | 0,57 | 0,42 | 0,71 |
| 50 a 59 | 22 | 0,38 | 0,25 | 0,51 | 36 | 0,62 | 0,49 | 0,75 |
| 40 a 49 | 17 | 0,47 | 0,31 | 0,64 | 19 | 0,53 | 0,36 | 0,69 |
| Movilidad reducida | ||||||||
| No | 29 | 0,35 | 0,25 | 0,45 | 54 | 0,65 | 0,55 | 0,75 |
| Sí | 72 | 0,48 | 0,4 | 0,56 | 78 | 0,52 | 0,44 | 0,6 |
| Índice de masa corporal | ||||||||
| Obesidad | 13 | 0,57 | 0,36 | 0,77 | 10 | 0,43 | 0,23 | 0,64 |
| Sobrepeso | 26 | 0,42 | 0,29 | 0,54 | 36 | 0,58 | 0,46 | 0,71 |
| Normal | 48 | 0,41 | 0,32 | 0,5 | 68 | 0,59 | 0,5 | 0,68 |
| Bajo peso | 14 | 0,44 | 0,26 | 0,61 | 18 | 0,56 | 0,39 | 0,74 |
| Insuficiencia cardiaca o falla respiratoria | ||||||||
| No | 88 | 0,44 | 0,37 | 0,51 | 110 | 0,56 | 0,49 | 0,63 |
| Sí | 13 | 0,37 | 0,21 | 0,53 | 22 | 0,63 | 0,47 | 0,79 |
| Recibieron tromboprofilaxis | ||||||||
| No | 18 | 0,17 | 0,03 | 0,1 | 34 | 0,25 | 0,18 | 0,33 |
| Sí | 83 | 0,82 | 0,74 | 0,89 | 98 | 0,74 | 0,66 | 0,81 |
| Puntaje IMPROVE | ||||||||
| Menor a 7 | 88 | 0,45 | 0,38 | 0,52 | 106 | 0,55 | 0,48 | 0,62 |
| Mayor a 7 | 13 | 0,33 | 0,18 | 0,48 | 26 | 0,67 | 0,52 | 0,82 |
| Puntaje PADUA | ||||||||
| Menor a 4 | 27 | 0,34 | 0,24 | 0,45 | 52 | 0,66 | 0,55 | 0,76 |
| Mayor a 4 | 74 | 0,48 | 0,4 | 0,56 | 80 | 0,52 | 0,44 | 0,6 |
n=frecuencia
%=porcentaje
Este protocolo ha sido formulado de acuerdo con la reglamentación ética vigente mundial (Declaración de Helsinki/Reporte Belmont/Pautas CIOMS) y la normatividad nacional (Resolución 8430 de1993) del Ministerio de Salud de Colombia28,29. Se solicitó consentimiento informado escrito al paciente y el estudio en su totalidad fue evaluado y aprobado por el comité de ética de la Universidad Industrial de Santander.
ResultadosLa muestra estuvo conformada por 233 pacientes, de los cuales un 56,6% correspondió al género masculino, con promedio de edad de 64,8 años±13,1. La mayoría presentó un índice de masa corporal con tendencia a considerarse normal; adicionalmente se encontró una cifra importante de bajo peso. En la tabla 1 se aprecia la distribución de variables clínicas y su distribución según la variable género; entre ellas se puede apreciar la distribución de acuerdo con los puntajes PADUA e IMPROVE.
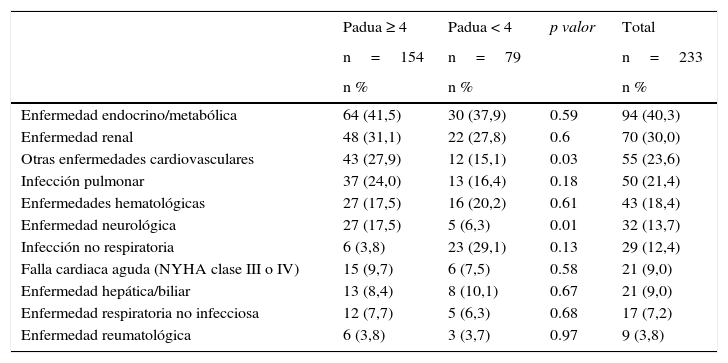
Al ingreso al hospital, las condiciones médicas identificadas con mayor frecuencia fueron las enfermedades endocrino/metabólicas (40,3%), la enfermedad renal (30%), las enfermedades cardiovasculares (23,6%) y la infección pulmonar (21,4%). En la tabla 2 se resumen las principales condiciones médicas al momento de la hospitalización, así como los factores de riesgo para tromboembolia venosa teniendo en cuenta el puntaje de PADUA. Con base en éste se encontraron diferencias significativas en enfermedades cardiovasculares y neurológicas.
Condiciones médicas al momento de la hospitalización según el índice de Padua
| Padua ≥ 4 | Padua < 4 | p valor | Total | |
|---|---|---|---|---|
| n=154 | n=79 | n=233 | ||
| n % | n % | n % | ||
| Enfermedad endocrino/metabólica | 64 (41,5) | 30 (37,9) | 0.59 | 94 (40,3) |
| Enfermedad renal | 48 (31,1) | 22 (27,8) | 0.6 | 70 (30,0) |
| Otras enfermedades cardiovasculares | 43 (27,9) | 12 (15,1) | 0.03 | 55 (23,6) |
| Infección pulmonar | 37 (24,0) | 13 (16,4) | 0.18 | 50 (21,4) |
| Enfermedades hematológicas | 27 (17,5) | 16 (20,2) | 0.61 | 43 (18,4) |
| Enfermedad neurológica | 27 (17,5) | 5 (6,3) | 0.01 | 32 (13,7) |
| Infección no respiratoria | 6 (3,8) | 23 (29,1) | 0.13 | 29 (12,4) |
| Falla cardiaca aguda (NYHA clase III o IV) | 15 (9,7) | 6 (7,5) | 0.58 | 21 (9,0) |
| Enfermedad hepática/biliar | 13 (8,4) | 8 (10,1) | 0.67 | 21 (9,0) |
| Enfermedad respiratoria no infecciosa | 12 (7,7) | 5 (6,3) | 0.68 | 17 (7,2) |
| Enfermedad reumatológica | 6 (3,8) | 3 (3,7) | 0.97 | 9 (3,8) |
n=frecuencia
%=porcentaje
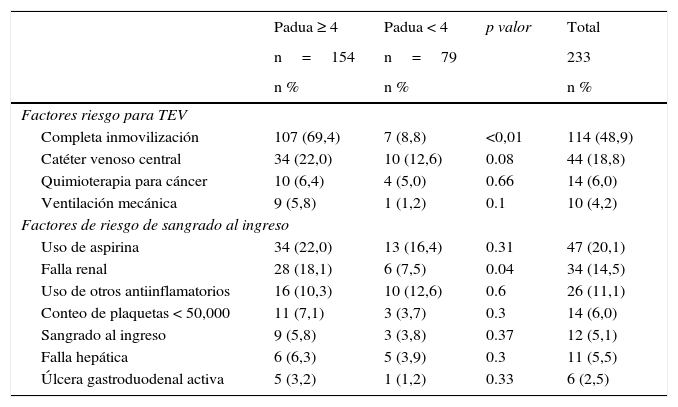
El principal factor de riesgo para tromboembolia venosa durante la hospitalización fue la inmovilidad prolongada, la cual fue cercana al 49% en la muestra total y al 69,4% en aquellos pacientes con puntaje de PADUA ≥ 4; este último dato es significativo. Otros factores de riesgo se describen en la tabla 3. Así mismo, en los pacientes en riesgo de tromboembolia venosa pueden coexistir algunos factores para sangrado; entre los más frecuentes se identificaron el uso de aspirina (20,1%), la falla renal (14,5%) y el empleo de antiinflamatorios no esteroideos (11,1%). Los factores de riesgo para sangrado al ingreso también se describen en la tabla 3.
Factores de riesgo para tromboembolia venosa y sangrado de acuerdo con el puntaje Padua
| Padua ≥ 4 | Padua < 4 | p valor | Total | |
|---|---|---|---|---|
| n=154 | n=79 | 233 | ||
| n % | n % | n % | ||
| Factores riesgo para TEV | ||||
| Completa inmovilización | 107 (69,4) | 7 (8,8) | <0,01 | 114 (48,9) |
| Catéter venoso central | 34 (22,0) | 10 (12,6) | 0.08 | 44 (18,8) |
| Quimioterapia para cáncer | 10 (6,4) | 4 (5,0) | 0.66 | 14 (6,0) |
| Ventilación mecánica | 9 (5,8) | 1 (1,2) | 0.1 | 10 (4,2) |
| Factores de riesgo de sangrado al ingreso | ||||
| Uso de aspirina | 34 (22,0) | 13 (16,4) | 0.31 | 47 (20,1) |
| Falla renal | 28 (18,1) | 6 (7,5) | 0.04 | 34 (14,5) |
| Uso de otros antiinflamatorios | 16 (10,3) | 10 (12,6) | 0.6 | 26 (11,1) |
| Conteo de plaquetas < 50,000 | 11 (7,1) | 3 (3,7) | 0.3 | 14 (6,0) |
| Sangrado al ingreso | 9 (5,8) | 3 (3,8) | 0.37 | 12 (5,1) |
| Falla hepática | 6 (6,3) | 5 (3,9) | 0.3 | 11 (5,5) |
| Úlcera gastroduodenal activa | 5 (3,2) | 1 (1,2) | 0.33 | 6 (2,5) |
n=frecuencia
%=porcentaje
TEV: tromboembolia venosa.
Al determinar la frecuencia de tromboprofilaxis en los pacientes en riesgo, se encontró que el 79,8% (123 pacientes, IC 95% 72,6-85,8%) recibieron algún método de tromboprofilaxis, y a su vez, 73,4% (58 pacientes) recibieron tromboprofilaxis sin tener indicación. Entre los pacientes con puntaje en escala de PADUA < 4 se encontró que el 73,4% recibieron tromboprofilaxis farmacológica, y aquellos con puntaje de PADUA mayor a 4, 79,8% recibieron tromboprofilaxis. Respecto a los métodos de tromboprofilaxis usados en los pacientes en riesgo, las heparinas de bajo peso molecular se emplearon con más frecuencia (86,7%), seguidas de la heparina no fraccionada (13,2%). En cuanto a los métodos no farmacológicos, en solo 2 pacientes (1,1%) se indicaron medias elásticas compresivas y en ningún caso se ordenó compresión neumática intermitente. Al aplicar la escala IMPROVE se determinó que la población de estudio, 16,7% (39 pacientes), presentó riesgo de sangrado, y que el 20,1% (31 pacientes) estaba en riesgo de tromboembolia. De estos últimos, 15 recibieron tromboprofilaxis farmacológica.
DiscusiónEl estudio cumplió con el objetivo de describir el uso de la tromboprofilaxis anticoagulante tomando como referencia escalas internacionales en una muestra importante de pacientes con patología médica en un hospital universitario. En la muestra estudiada, cerca del 70% se encontró en riesgo de tromboembolia venosa y un poco más de las tres cuartas partes recibió algún tipo de tromboprofilaxis ya fuera farmacológica o no. Los datos globales muestran diferencias entre los países en cuanto al uso de tromboprofilaxis en pacientes hospitalizados12,13. Al comparar estos resultados con los del estudio ENDORSE para los seis continentes5, este mostró un riesgo de trombembolia venosa en 41,5% de los pacientes hospitalizados por condiciones médicas y de ellos solo 39,5% recibieron algún tipo de tromboprofilaxis. A su vez, los resultados del ENDORSE para Colombia9, mostraron que en pacientes hospitalizados por condiciones médicas, estos registraron un 39,6% de riesgo de tromboembolia venosa, y de ellos 64% recibió tromboprofilaxis. De igual manera, estudios en Argentina, México, Brasil y Venezuela reportan cifras de tromboprofilaxis adecuada del 76,2, 36,9, 59 y 38%, respectivamente1,5,30.
En nuestros hallazgos, la frecuencia de tromboprofilaxis adecuada fue mayor en comparación con la muestra nacional e internacional, aunque es relevante comentar que el hospital en donde se desarrolló la investigación es un centro universitario en el cual existe formación de profesionales de salud en diferentes especialidades de la medicina en pregrado y postgrado. Por tanto es posible que el conocimiento, la socialización y la aplicación de guías de tromboprofilaxis esté más al alcance de dicho personal de salud, lo que claramente incrementa la probabilidad de adquirir hábitos adecuados en cuanto a la valoración del riesgo de trombembolia venosa. Por ejemplo, en centros hospitalarios académicos se han reportado frecuencias de tromboprofilaxis de 59% en pacientes con condiciones médicas17. Lo anterior contrasta con un estudio adelantado en Canadá y Estados Unidos en donde se estudiaron las barreras y los facilitadores de la tromboprofilaxis en las unidades de cuidados intensivos, y se concluyó que una de las más sobresalientes es la educación inadecuada de los residentes20.
Por otra parte, nuestros resultados, sin considerar los elementos de juicio de los médicos tratantes en el momento de indicar la tromboprofilaxis farmacológica, mostraron que el 73,4% de los pacientes que no cumplían criterios para tromboprofilaxis, en efecto la recibieron. Si bien es cierto que se encuentra establecido el perfil de seguridad de las heparinas de bajo peso molecular, en determinadas circunstancias podrían resultar riesgosas para los pacientes, ser causa de eventos adversos sobre todo de tipo hemorrágico, e incrementar los costos de atención. Son escasos los estudios que evalúan el impacto de dicha práctica, pero sí se han reportado casos, especialmente en poblaciones en las cuales se han implementado estrategias para mejorar la tromboprofilaxis31. A su vez, y teniendo en cuenta que las frecuencias de tromboprofilaxis son similares en pacientes con o sin riesgo, esto podría reflejar que al momento de indicar un manejo tromboprofiláctico farmacológico no se categorizan los pacientes según el riesgo.
En cuanto a los tipos de tromboprofilaxis utilizada, se observó que las heparinas de bajo peso molecular y la heparina no fraccionada, representaron la mayoría de la terapia farmacológica utilizada, siendo similares con los resultados del ENDORSE para Colombia9. A su vez, no se utilizó la compresión mecánica como alternativa; si bien es cierto que existe literatura que apoya el empleo de estas medidas32,33, sería interesante conocer en futuros estudios qué tanto y cómo se utiliza esta medida en los ámbitos nacional y latinoamericano. Por otra parte, los autores consideran que la elaboración de guías de tromboprofilaxis y la educación continua al personal médico, mejoraría de manera sustancial el reconocimiento oportuno de los pacientes en riesgo, así como la indicación de una tromboprofilaxis adecuada. En un estudio en el cual se realizó educación al personal médico se demostró que al cuarto mes se logró un aumento de la tasa de tromboprofilaxis en un 34,9% a 43,2%34, aunque para otros autores la sola educación no es suficiente35. En este orden de ideas, se ha documentado que las alertas electrónicas mejoran de forma importante la tasa de tromboprofilaxis26,36. Cabe mencionar un estudio en Suiza, cuyos resultados posteriores a la introducción de alertas electrónicas en la historia clínica, evidenciaron incrementos significativos en la frecuencia de tromboprofilaxis de un 43,3% a un 73,6% y en un menor tiempo posterior al ingreso hospitalario23.
Nuestro estudio tiene algunas limitaciones, considerando que la recolección de los datos tomó un año, los hábitos de tromboprofilaxis podrían cambiar de forma dinámica teniendo en cuenta que el personal médico está cambiando continuamente en los servicios. Además, se trató de un estudio descriptivo de corte transversal. Por tanto, a futuro sería recomendable la realización de estudios que evalúen desenlaces de tipo tromboembólico venoso en dicha población, incluyendo periodos de seguimiento, en los que se evidencie que el buen uso y la aplicación de la profilaxis se da durante toda la hospitalización.
En este estudio solo se incluyeron pacientes con condiciones médicas. En sentido global, en algunas poblaciones las tasas de tromboprofilaxis son más altas en pacientes quirúrgicos9. Aun cuando la frecuencia de tromboprofilaxis en el Hospital Universitario es aceptablemente superior a la de otras instituciones de salud, sigue quedando una población de pacientes clasificados en riesgo de tromboembolia venosa que no reciben tratamiento preventivo. Por esta razón, los autores consideran que las estrategias que recuerden a los clínicos la existencia de escalas de riesgo validadas, la socialización y difusión de guías de tromboprofilaxis, la educación continua y el establecimiento de alertas electrónicas en la historia clínica impactarán de forma considerable en el aumento de la frecuencia de una indicación correcta de tromboprofilaxis.
Para concluir, dentro de la práctica clínica sería ideal incluir el uso de escalas de riesgo como las citadas en este estudio con el fin de utilizar de manera óptima la tromboprofilaxis, acción que redundaría en mejores cifras de desenlaces clínicos y en la optimización de recursos en salud. Probablemente, el hallazgo más sobresaliente fue determinar que 58 pacientes recibieron tromboprofilaxis sin tener indicación, hecho que en cierta medida podría disminuirse de modo considerable al hacer uso de estas herramientas y escalas de riesgo. Por último, en nuestro medio la tromboprofilaxis farmacológica se basa fundamentalmente en el uso de heparinas de bajo peso molecular y es posible afirmar también que dicho uso es correcto y está por encima de otras series previamente referenciadas, y que adicionalmente irá en aumento, teniendo en cuenta que esta práctica clínica debe asumirse como un factor evaluador de calidad dentro del día a día de un hospital o de cualquier servicio de salud que incluya a esta clase de pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interésLos autores declaran no tener conflicto de intereses.
FinanciaciónEl estudio no contó financiación por alguna convocatoria o agencia.