La influencia del sexo en la fisiopatología cardiovascular muestra como entre los sexos existen divergencias, desde las anatómicas básicas hasta la respuesta fisiológica, en lo relacionado con la trombosis, y diferencias sexuales reportadas en cuanto a la función plaquetaria y la actividad de los factores de coagulación.
La influencia del sexo femenino en lo concerniente a mayor riesgo trombótico, podría estar asociada con estímulos estrogénicos, hormona del crecimiento, progesterona y testosterona, y diferencias de sexo en la función plaquetaria, si bien en algunos aspectos estos factores podrían ser controversiales.
En pacientes con fibrilación auricular existe evidencia científica de mayor riesgo de ataques cerebrovasculares isquémicos en las mujeres que en los hombres.
Otro factor asociado con el estado protrombótico de las mujeres, que podría contribuir a los mayores eventos trombóticos, es la subutilización de la terapia anticoagulante reportada en los estudios observacionales.
A pesar de las diferencias encontradas en los estudios observacionales y clínicos controlados, no existe en la actualidad recomendación alguna sobre modificaciones en el tratamiento anticoagulante relacionadas con el sexo.
The influence of sex on cardiovascular pathophysiology shows that there are differences between the sexes, from basic anatomical differences to physiological responses, related to thrombosis. Sexual differences have also been reported regarding platelet function and the activity of clotting factors.
The influence of the female sex with regard to a greater thrombotic risk could be influenced by estrogen, growth hormone, progesterone and testosterone stimuli, as well as sexual differences in platelet function, although these factors could be controversial in some aspects.
In patients with atrial fibrillation, there is scientific evidence of a greater risk of ischemic cerebrovascular accidents in women than in men.
Another factor related to the prothrombotic state of women, which could contribute to the greater number of thrombotic events, is the underutilization of anticoagulant therapy reported in observational studies.
In spite of the differences found in observational studies and controlled clinical trials, there are no current recommendations regarding anticoagulant therapy modifications related to sex.
La influencia del sexo en la fisiopatología cardiovascular está teniendo mayor reconocimiento ya que muestra como entre los sexos existen diferencias, desde la anatomía, hasta la respuesta fisiológica1–4. También se ha creído que para ambos sexos difieren significativamente los niveles celular y molecular, con variables sexuales reportadas en cuanto a función plaquetaria y actividad de factores de coagulación5–10.
También se han visto diferencias importantes en la tasa de eventos cardiovasculares, como infarto de miocardio, ataque cerebrovascular y tromboembolia venosa (TEV), que avalan la idea que el sexo es una variable diferencial importante en el riesgo de enfermedad cardiovascular11–13.
Papel de las diferencias hormonales en la coagulaciónEstrógenosLos mecanismos precisos subyacentes a las diferencias sexuales en la trombosis, siguen siendo desconocidos. Sin embargo, las diferencias en el riesgo cardiovascular entre sexos se han atribuido ampliamente a los distintos perfiles hormonales de hombres y mujeres. Las acciones de los estrógenos dentro del sistema cardiovascular femenino han estado implicadas durante mucho tiempo en la protección relativa de las mujeres premenopáusicas en cuanto a eventos cardiovasculares. La evidencia de este efecto protector se apoya en el aumento del riesgo cardiovascular de las mujeres durante el cese de la producción natural de estradiol que ocurre en la menopausia14. Los estrógenos influyen de manera positiva en la biología cardiovascular al disminuir el tono vascular, potenciar la vasodilatación y la complacencia vascular, y adicionalmente generar un efecto antiinflamatorio, antioxidante, que mejora el perfil de lípidos15. Contrario a lo anterior, grandes ensayos clínicos controlados aleatorios, diseñados para determinar el efecto de los estrógenos suplementarios sobre las enfermedades cardiovasculares, han demostrado inequívocamente que el estrógeno oral aumenta la incidencia de TEV y otros eventos cardiovasculares16–19. No obstante, el mecanismo detrás de este riesgo aumentado aún no se entiende por completo. Hoy se cree que el estrógeno oral aumenta el riesgo de TEV a través de la resistencia a la proteína C activada con anticoagulante (APC). Esta llamada “resistencia adquirida a la APC” puede ocurrir a través de cambios en los niveles de proteína S, inhibidor de la proteína C y/u otros inhibidores de APC20. También se ha descubierto que los estrógenos orales aumentan los niveles de los fragmentos de protrombina 1 y 2, factor VII, factor X, factor XIII, fibrinógeno y otras proteínas procoagulantes20. En cambio, otros estudios observacionales sugieren que el estrógeno administrado en forma transdérmica tiene poco efecto sobre los marcadores de hemostasia y el riesgo de TEV21,22.
Hormona de crecimientoLa secreción masculina de hormona de crecimiento se caracteriza por presentarse en una forma pulsátil, con ráfagas episódicas que ocurren cada 2 a 3 horas sobre la secreción basal continua, con intervalos largos entre los pulsos. Por el contrario, el patrón de secreción femenina se caracteriza por pulsos más frecuentes y en intervalos más cortos, lo que conduce a la detección continua de hormona de crecimiento en el plasma. Estos patrones de secreción de hormona de crecimiento, específicos para el sexo, a su vez, afectan a la señalización celular y la transcripción de genes. Este efecto está particularmente descrito en el hígado, donde se ha demostrado que la hormona de crecimiento induce la expresión génica hepática específica de hombres y mujeres. El hígado, como se sabe, es el órgano principal para la biosíntesis de las proteínas pro- y anticoagulantes, lo que sugiere un papel de la hormona del crecimiento en el establecimiento de la coagulación dependiente del sexo.
Aunque el mecanismo implicado para el papel de la hormona del crecimiento en la trombosis aún no se ha definido claramente, se ha descrito en algunos estudios que la secreción de dicha hormona, puede afectar la expresión de genes que codifican los principales reguladores de la generación de trombina, como la proteína C, la antitrombina, el cofactor II de heparina y el inhibidor de la proteína C20.
El estrógeno oral aumenta los niveles de hormona del crecimiento20. Existen numerosas posibilidades para la interacción de la señalización de estrógeno y hormona del crecimiento, interferencia de señalización que puede ser fundamental para la trombosis dependiente del sexo20.
Progesterona y testosteronaOtras hormonas, como la progesterona y la testosterona, también pueden desempeñar un papel en la mediación de las diferencias de sexo en la trombosis. Un estudio reciente encontró que la adición de progesterona al estrógeno en la terapia de reemplazo hormonal, duplicaba el riesgo de TEV, aunque se necesitan estudios adicionales20. También se ha estudiado la testosterona por su posible papel en el aumento del riesgo trombótico en los hombres; sin embargo, numerosos estudios prospectivos de cohortes o de casos y controles no mostraron asociación clara. En este momento, no se ha dilucidado si la progesterona y la testosterona solas o en combinación con otras hormonas, tienen efectos significativos sobre la trombosis en hombres y mujeres.
Diferencias de sexo en la función plaquetariaTrabajos recientes han confirmado que el recuento de plaquetas varía significativamente según la edad y el sexo (con valores más altos en las mujeres frente a los hombres y en los jóvenes frente a los sujetos más viejos) y que las plaquetas en mujeres tienen mayor número de receptores de superficie para unir mayor cantidad de fibrinógeno23.
Por otra parte, la reducción de la reactividad plaquetaria en las mujeres premenopáusicas se ha relacionado con la presencia de receptores de estrógeno en la superficie de las plaquetas.
De cualquier forma, se debe tener precaución al interpretar los datos sobre las diferencias de sexo en la función plaquetaria, dado el potencial de sesgo de selección, los artefactos de laboratorio y la heterogeneidad in vitro, ex vivo e in vivo en diferentes entornos. Es importante resaltar que los datos disponibles parecen sugerir mayor actividad de la hemostasia primaria (es decir, adhesión plaquetaria mejorada y tiempos de sangrado más cortos) en los varones, pero más plaquetas reactivas en respuesta a agonistas ex vivo en mujeres23.
Riesgo trombótico en la mujerLos hombres se ven afectados por la enfermedad cardiaca coronaria más que las mujeres hasta la edad de 39 años, y casi igual entre 40 y 79 años.
El sexo femenino experimenta fluctuaciones frecuentes de la actividad protrombótica durante su vida relacionadas con los ciclos menstruales, el uso de anticonceptivos orales, el embarazo, la menopausia y la terapia de reemplazo hormonal, con un posible impacto en las manifestaciones clínicas de la enfermedad aterosclerótica. Se ha sugerido como hipótesis que las diferencias de género en la función plaquetaria ex vivo podrían ser el resultado de efectos directos de estrógenos, progesterona o andrógenos en las plaquetas, o podrían ser un efecto indirecto de las hormonas sexuales en la vasculatura.
Riesgo de sangrado en la mujerLos datos de 24.045 pacientes del Registro Global de Eventos Coronarios Agudos (GRACE) indicaron que las mujeres, a diferencia de los hombres, tenían un 43% más de riesgo de sangrado durante la hospitalización por enfermedad coronaria aguda; las mujeres sometidas a intervención coronaria percutánea (ICP) también mostraron una incidencia significativamente superior de hemorragias mayores en el hospital, incluidas las complicaciones relacionadas con el acceso vascular, en comparación con los hombres; este aumento del riesgo de sangrado parece estar relacionado con la dosificación inadecuada de fármacos antitrombóticos24,25.
Diferencias de género en la terapia anticoagulanteLa terapia antitrombótica es uno de los campos en los que la investigación específica de género ha tratado de suscitar más evidencia26.
Anticoagulantes y sexo femeninoInhibidores indirectos de la trombinaAdemás del peso corporal, la edad, la historia de tabaquismo y la diabetes mellitus, el género se considera uno de los factores que afectan la respuesta a la heparina no fraccionada. En particular, las mujeres son más propensas a lograr tiempo parcial de tromboplastina activado (PTTa) más largo, después de la administración de heparina no fraccionada. Además, el riesgo de trombocitopenia asociada con heparina se incrementa en un factor de 5 en las mujeres26.
Un análisis post hoc del TIMI-11A, un ensayo multicéntrico de determinación de dosis para evaluar la seguridad de la enoxaparina en pacientes con síndrome coronario agudo (SCA), mostró que los perfiles farmacocinéticos y farmacodinámicos después de la administración de enoxaparina eran consistentes entre sexos tanto masculino como femenino. Sin embargo, el único ensayo controlado con placebo de uso de la HBPM estratificado por género, fue del estudio FRISC (Fragmin y Revascularización Rápida durante In-Stability in Coronary Artery Disease), en el que se comparó dalteparina versus placebo en pacientes con SCA. Los resultados sugirieron que las mujeres fueron más sensibles que los hombres a la dalteparina pues estas presentaron mayores reducciones absolutas y relativas en el punto final compuesto de muerte e infarto de miocardio, junto con mayor incidencia de menor sangrado que los hombres26.
Datos adicionales de un metanálisis han demostrado la superioridad de la HBPM versus HNF para la reducción de los eventos cardiovasculares adversos mayores en pacientes con SCA en una amplia gama de subgrupos27. Curiosamente, otros ensayos clínicos no han podido reproducir la superioridad de la HBPM sobre la HNF, ni encontrar diferencias en la eficacia o en la toxicidad entre sexos28. Por último, el ExTRACT-TIMI 25 (Enoxaparin and Thrombolysis Reperfusion for Acute Myocardial Infarction Treatment-Thrombolysis in Myocardial Infarction) comparó enoxaparina versus HNF en pacientes con infarto de miocardio con elevación del segmento ST, sometidos a fibrinólisis29. Las mujeres experimentaron una reducción absoluta del riesgo, mayor que los hombres cuando se trataron con enoxaparina, pero la reducción relativa del riesgo fue comparable, lo cual sugiere que la reducción absoluta del riesgo probablemente se debe a las diferencias en el perfil de riesgo basal.
Inhibidores directos de la trombinaUna ventaja potencial de estos fármacos es su capacidad para inhibir también la activación mediada por la trombina de las plaquetas, lo que les da propiedades anticoagulantes y antiplaquetarias mixtas.
El uso de bivalirudina parece proporcionar beneficios similares en ambos sexos, pero las mujeres parecen estar en mayor riesgo de sangrado. Los estudios que muestran mayor incidencia de hemorragia en mujeres incluyen el ensayo REPLACE-2 (Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events-2) trial)30, el ACUITY (Acute Catheterization and Urgent Intervention Triage strategY)31 y los ensayos ISAR-REACT 4, ambos incluyeron pacientes con SCA, y un registro europeo que comprende pacientes con indicaciones variadas32. Sin embargo, no se encontraron diferencias en la eficacia o hemorragia mayor entre hombres y mujeres con STEMI sometidos a ICP en el marco del estudio HORIZONS-AMI (Harmonizing Outcomes with Revascularization and Stents in Acute Myocardial Infarction)33.
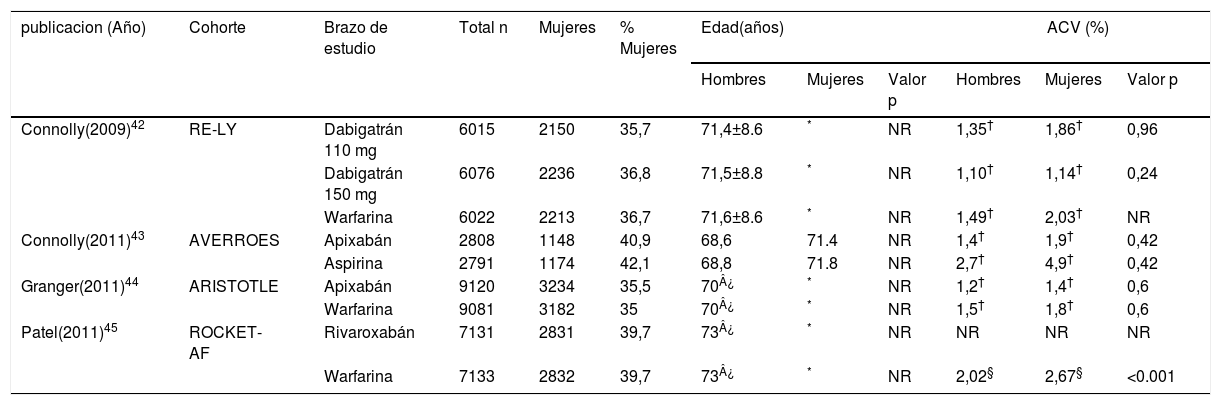
Dabigatrán es un inhibidor directo de la trombina que se administra dos veces al día por vía oral y no requiere monitorización de laboratorio. En el ensayo RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy), el dabigatrán cumplió los criterios de no inferioridad versus warfarina para la prevención de complicaciones tromboembólicas en pacientes con fibrilación auricular. No se observaron diferencias significativas entre los sexos.
Inhibidores del factor XaFondaparinux es un inhibidor selectivo del factor Xa. Los resultados para fondaparinux respecto a las diferencias entre sexos, son paralelas a las de la bivalirudina: beneficio clínico similar, aunque las mujeres presentaron mayor sangrado cuando la indicación era síndrome coronario agudo, sin claras diferencias cuando la indicación fue infarto con elevación del segmento ST. En el OASIS-5 (Organization to Assess Strategies in Acute Ischemic Syndromes) en la comparación de fondaparinux versus enoxaparina para el tratamiento de pacientes con síndrome coronario agudo, el primero fue no inferior a la segunda para la prevención de eventos isquémicos, y presentó menor incidencia de hemorragias mayores y tasas de mortalidad hasta seis meses34. En el análisis de subgrupos, la presencia de hemorragia fue más frecuente en mujeres que en hombres en el grupo de enoxaparina.
En el OASIS-6 (Sixth Organization to Assess Strategies in Acute Ischemic Syndromes) la comparación de fondaparinux versus heparina no fraccionada o placebo, en pacientes con infarto agudo de miocardio con elevación del segmento ST, fondaparinux redujo el punto final compuesto de muerte y re-infarto de miocardio a los 30 días, debido principalmente a su efecto superior en aquellos pacientes sometidos a fibrinólisis o sin estrategia de reperfusión. Este efecto fue similar en mujeres y hombres35.
Rivaroxabán, apixabán y edoxabán son también inhibidores selectivos del factor Xa, que se administran por vía oral en dosis una vez al día (rivaroxabán y edoxabán) o dos veces al día (apixabán). Rivaroxabán ha demostrado no inferioridad frente a enoxaparina seguido de antagonistas de la vitamina K para el tratamiento de la trombosis venosa profunda36 y la embolia pulmonar37. También ha demostrado ser no inferior al tratamiento crónico con antagonistas de la vitamina K para la prevención de embolia en pacientes con fibrilación auricular no valvular, sin diferencias significativas en la hemorragia mayor, pero con reducción de la hemorragia intracraneal y fatal en el grupo rivaroxabán38. En todas estas pruebas, el análisis de subgrupos pre-especificados no mostró ninguna diferencia en la eficacia o la seguridad entre hombres y mujeres. Apixabán redujo significativamente las tasas de ataque cerebrovascular o embolia sistémica, mortalidad general y hemorragia mayor en comparación con los antagonistas de la vitamina K para la prevención tromboembólica en pacientes con fibrilación auricular no valvular en el ARISTOTLE (Apixaban for Reduction In Stroke and Other Thromboembolic Events in atrial fibrillation)39.
Igualmente, este medicamento mostró eficacia comparable en ambos sexos, pero las mujeres tendieron a beneficiarse con más reducción de las complicaciones hemorrágicas mayores que los hombres cuando se les administró apixabán39. Curiosamente, esto no se ha observado con edoxabán; la reducción significativa en la incidencia de sangrado mayor o clínicamente relevante observada con este medicamento, fue significativa entre los hombres, pero no entre las mujeres40.
Antagonistas de la vitamina K (warfarina)Las mujeres con fibrilación auricular tienen un riesgo significativamente mayor de ataque cerebrovascular que los hombres41. Aunque la warfarina es al menos igual de eficaz para reducir el riesgo de tromboembolia en ambos sexos, algunos estudios han puesto de relieve un beneficio potencialmente mayor en las mujeres, lo que podría explicarse por el mayor riesgo basal42,43. No hay diferencias en el riesgo de sangrado mayor asociado con el uso de warfarina entre hombres y mujeres. Sin embargo, las mujeres podrían requerir dosis más bajas para lograr y mantener los niveles terapéuticos del INR.
Diferencias de sexo en los eventos tromboembólicos en fibrilación auricularLos hombres tienen mayor riesgo de desarrollar fibrilación auricular que las mujeres en un factor de 1,5 después de ajustar para otros factores de riesgo. Las mujeres constituyen alrededor del 60% de la población con fibrilación auricular mayor de 75 años, la edad promedio de inicio de la fibrilación auricular44.
Se han propuesto varios modelos para cuantificar el riesgo de ataque cerebrovascular en pacientes con fibrilación auricular. La inclusión del género femenino como un factor de riesgo independiente, ha sido objeto de un examen reciente. La fibrilación auricular se observa con mayor frecuencia en las mujeres que presentan ataques cerebrovasculares que en hombres; por otro lado, las mujeres tienen peor resultado por ataque cerebrovascular que los hombres en términos de función motora y cognitiva y actividades de la vida cotidiana44.
Como tal, la conciencia de la diferencia de sexo se hace útil cuando se necesita una decisión sobre anticoagulación y pocos o ningún otro factor de riesgo (tabla 1).
Estudios con anticoagulantes orales directos que referencian relación con el género
| publicacion (Año) | Cohorte | Brazo de estudio | Total n | Mujeres | % Mujeres | Edad(años) | ACV (%) | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Hombres | Mujeres | Valor p | Hombres | Mujeres | Valor p | ||||||
| Connolly(2009)42 | RE-LY | Dabigatrán 110 mg | 6015 | 2150 | 35,7 | 71,4±8.6 | * | NR | 1,35† | 1,86† | 0,96 |
| Dabigatrán 150 mg | 6076 | 2236 | 36,8 | 71,5±8.8 | * | NR | 1,10† | 1,14† | 0,24 | ||
| Warfarina | 6022 | 2213 | 36,7 | 71,6±8.6 | * | NR | 1,49† | 2,03† | NR | ||
| Connolly(2011)43 | AVERROES | Apixabán | 2808 | 1148 | 40,9 | 68,6 | 71.4 | NR | 1,4† | 1,9† | 0,42 |
| Aspirina | 2791 | 1174 | 42,1 | 68,8 | 71.8 | NR | 2,7† | 4,9† | 0,42 | ||
| Granger(2011)44 | ARISTOTLE | Apixabán | 9120 | 3234 | 35,5 | 70¿ | * | NR | 1,2† | 1,4† | 0,6 |
| Warfarina | 9081 | 3182 | 35 | 70¿ | * | NR | 1,5† | 1,8† | 0,6 | ||
| Patel(2011)45 | ROCKET-AF | Rivaroxabán | 7131 | 2831 | 39,7 | 73¿ | * | NR | NR | NR | NR |
| Warfarina | 7133 | 2832 | 39,7 | 73¿ | * | NR | 2,02§ | 2,67§ | <0.001 | ||
El estudio clínico controlado más grande fue el ATRIA (the Anticoagulation and Risk Factors in Atrial Fibrillation) con una cohorte de 13.559 adultos con fibrilación auricular45. Este estudio mostró suficientes puntos finales para examinar la influencia del sexo en el riesgo de ataque cerebrovascular. Informó, además, que la incidencia anual de tromboembolia frente a la warfarina fue del 3,5% para las mujeres frente al 1,8% para los hombres. La diferencia entre el RR de tromboembolia para mujeres versus hombres, para estos con edad menor o mayor a 75 años, no fue estadísticamente diferente.
Sexo como un factor de riesgo independiente de ataque cerebrovascular en fibrilación auricularUn metaanálisis de 17 estudios encontró 1,31 veces (IC 95%: 1,18 a 1,46) mayor riesgo de ataque cerebrovascular en mujeres con fibrilación auricular, especialmente aquellas mayores de 75 años de edad, independientemente de la anticoagulación oral46. Sin embargo, no hubo diferencias significativas con relación al sexo en el riesgo residual de ataque cerebrovascular y embolia sistémica en pacientes con fibrilación auricular en estudios con nuevos anticoagulantes47.
Razones potenciales por las cuales el riesgo de ataque cerebrovascular en la mujer puede estar aumentadoSe han formulado muchas hipótesis para explicar el aumento aparente de la trombogenicidad en las mujeres con fibrilación auricular; las diferencias en las características basales del paciente, que implican la presentación de la fibrilación auricular, las comorbilidades y los perfiles de riesgo de ataque cerebrovascular44, son algunas de ellas. La edad es un factor de riesgo bien conocido de ataque cerebrovascular y en la mayoría de los estudios las mujeres eran mayores. En el estudio de la gran cohorte sueca, la edad media fue seis años más alta en mujeres que en hombres47, argumentádose que esto podría explicar el aumento del riesgo tromboembólico. Las mujeres con fibrilación auricular también son más propensas a tener hipertensión preexistente, cardiopatía valvular e insuficiencia cardiaca con función ventricular izquierda preservada, pero menos probabilidades de tener enfermedad coronaria que los hombres.
Así mismo, son más proclives a tener anomalías preexistentes de la tiroides, circunstancia que también puede contribuir al incremento del riesgo tromboembólico.
Otras razones que se sugieren como responsables del aumento del riesgo de ataque cerebrovascular en las mujeres, incluyen la posibilidad de que éstas pueden tener un estado aumentado de hipercoagulabilidad, tales como disfunción endotelial y factores protrombóticos, incluyendo niveles elevados de fibrinógeno, factor de von Willebrand e incremento de la activación plaquetaria.
Importancia clínica de las diferencias de sexo en el riesgo tromboembólico en fibrilación auricularLas mujeres con fibrilación auricular son mayores que los hombres en el momento de la presentación de la fibrilación auricular44. Además de estas diferencias clínicas, también existen disparidades en el manejo médico de estos pacientes, específicamente de la fibrilación auricular, que pueden elevar el riesgo de ataque cerebrovascular.
En pacientes con síntomas atípicos o sin síntomas de fibrilación auricular incluidos en el Euro Heart Survey on Atrial Fibrillation, el tratamiento fue más conservador en las mujeres, con una utilización significativamente menor de las estrategias de control del ritmo que en los hombres48.
En un estudio reciente en Francia se encontró que las mujeres mayores de 75 años tenían 1/3 menos probabilidades de ser tratadas con anticoagulación sistémica que los hombres de edad similar49; este hecho también fue documentado en el Registro Canadiense de Fibrilación Atrial (CARAF)44. Según el Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM), las mujeres con fibrilación auricular en warfarina, estuvieron menos tiempo en el rango terapéutico (TTR) que los hombres, con más tiempo en rango subterapéutico50. Las diferencias en TTR, un importante predictor de los resultados tromboembólicos en fibrilación auricular, podrían indicar menor calidad de la anticoagulación con warfarina en las mujeres.
Por tanto, estas diferencias de sexo se hacen relevantes ya que, aunque las mujeres pueden obtener más beneficios de la anticoagulación sistémica que sus homólogos masculinos, pueden ser menos propensas a recibir anticoagulación sistémica y cuando están anticoaguladas, la calidad de la anticoagulación puede ser menor.
ConclusionesLa influencia del sexo en la fisiopatología cardiovascular viene mostrando como entre los sexos existen diferencias tanto anatómicas básicas, como en cuanto a la respuesta fisiológica en lo relacionado con trombosis, además de las diferencias sexuales reportadas en la función plaquetaria y la actividad de factores de coagulación.
La influencia del sexo femenino en mayor riesgo trombótico podría estar afectada por estímulo estrogénico, hormona del crecimiento, progesterona y testosterona, así como por diferencias de sexo en la función plaquetaria, aunque en algunos aspectos estos factores podrían ser controversiales.
En pacientes con fibrilación auricular existe evidencia científica de más riesgo de ataques cerebrovasculares isquémicos mayores en las mujeres que en los hombres, en la que concurren varios mecanismos potenciales para explicar este riesgo mayor, como las diferencias relacionadas con el sexo en la vasculatura y la estructura del miocardio que podrían predisponer a alteraciones en el flujo sanguíneo, el estrés por cizallamiento y la función endotelial alterada; adicionalmente hay evidencia que sugiere un potencial aumento en el sexo femenino (especialmente en el estado postmenopáusico) en marcadores inflamatorios y procoagulantes sistémicos, partículas trombogénicas y agregación plaquetaria, los cuales contribuyen a un medio protrombótico.
Otro factor asociado al estado protrombótico de las mujeres que podría contribuir a los mayores eventos trombóticos, es la subutilización de la terapia anticoagulante en los estudios observacionales.
Los retos futuros en la investigación serán comprender mejor la interacción de los mecanismos biológicos hipotéticos en relación con el sexo, identificar puntos estratégicos en estas vías fisiopatológicas que puedan ser susceptibles de intervención, y dilucidar el papel complejo de los estrógenos endógenos sobre la vasculatura, las plaquetas y las proteínas, relacionadas con la hemostasia global. Es importante destacar que la evidencia sugiere que después de la menopausia se producen cambios fundamentales nocivos, lo que subraya la necesidad de abordar específicamente la población femenina envejecida de 65 años o más.
A pesar de las diferencias encontradas en los estudios observacionales y clínicos controlados, al momento actual no existe ninguna recomendación sobre modificaciones en el tratamiento anticoagulante, relacionada con el sexo.
Conflicto de interesesNinguno.