La insuficiencia mitral severa es una entidad de alta prevalencia cuyo tratamiento de elección es quirúrgico. Sin embargo, la mayoría de veces una gran población no es intervenida por el alto riesgo quirúrgico. Por tal motivo ha surgido el reparo mitral percutáneo con dispositivo tipo MitraClip® (Abbott Vascular, Santa Clara California EEUU), para lograr corregir la insuficiencia mitral. En este artículo se describe la evidencia actual de esta técnica, así como el procedimiento y sus complicaciones.
Severe mitral insufficiency is a highly prevalent condition for which the treatment of choice is surgery. However, the majority of a large population is not often intervened due to the high surgical risk. For this reason, the use has been suggested of percutaneous mitral valve repair with a MitraClip® type device (Abbott Vascular, Santa Clara, California, USA), in order to correct the mitral insufficiency. In this article, a description is presented of the current evidence of this technique, as well as the procedure and its complications.
La insuficiencia de la válvula mitral tiene alta prevalencia (1,5-1,9%) en la población general, la cual alcanza hasta el 13,3% en pacientes por encima de 75 años1. Desde hace varios años se ha demostrado que el manejo quirúrgico temprano es superior al manejo médico óptimo o expectante en diversas etiologías2–4. Estas se han clasificado como primarias o causadas por daño degenerativo de la válvula mitral o el aparato subvalvular, y como secundarias, es decir sin daño estructural valvular pero sí por dilatación del anillo valvular o por disfunción ventricular izquierda5. Sin embargo, casi la mitad de los pacientes con clara indicación quirúrgica no son operados, en gran medida por ser considerados de alto riesgo para cirugía6. Por consiguiente, estos pacientes continúan sintomáticos a pesar de manejo médico óptimo.
El MitraClip® (Abbott Vascular, Santa Clara California EEUU) es un dispositivo de cromo cobalto, recubierto de poliéster que se implanta por vía endovascular venosa y punción transeptal, diseñado con el fin de atrapar las cúspides de las valvas anterior y posterior y así corregir o disminuir la insuficiencia mitral. Además, ejerce un efecto indirecto de anuloplastia mitral que puede coadyuvar a la remodelación ventricular2,7. Tiene CE Mark desde 2008 en Europa, INVIMA desde comienzos de 2013, y en noviembre de 2013 recibió el aval por parte de la Administración de Alimentos y Medicamentos (FDA) en Estados Unidos para casos seleccionados2,3.
EvidenciaEl reparo endovascular de válvula mitral con dispositivo MitraClip® ha sido evaluado extensivamente con estudios observacionales retrospectivos y prospectivos, pero muy escasamente por estudios experimentales aleatorizados.
Everest IIEs el único estudio multicéntrico pivotal, aleatorizado, doble ciego, en el que se incluyeron 279 pacientes con insuficiencia mitral severa, principalmente de origen degenerativo (74%), todos susceptibles de reparo o cambio valvular quirúrgico7. De estos pacientes, en relación 2:1, 184 fueron aleatorizados a reparo endovascular con MitraClip® y 95 pacientes fueron llevados a cirugía de reparo o cambio valvular quirúrgico. El objetivo primario de efectividad fue un punto compuesto de ausencia de mortalidad, ausencia de reintervención de la válvula mitral o ausencia de insuficiencia mitral grado III o IV en el seguimiento ecocardiográfico después de un año de la intervención inicial.
El estudio demostró que para alcanzar este objetivo primario, la cirugía fue superior al reparo endovascular de la válvula mitral con MitraClip® (73 vs. 55,2%; p<0,007), básicamente dado por una mayor tasa de requerimiento de reintervención quirúrgica posterior al procedimiento inicial, percutáneo o quirúrgico (20 vs. 2%; p<0001). Sin embargo, el objetivo concomitante de seguridad del compuesto de eventos adversos (muerte, infarto agudo de miocardio, reoperación por intervención fallida, cirugía urgente necesaria por eventos adversos, accidente cerebrovascular, insuficiencia renal, infección de tejidos profundos, requerimiento de ventilación mecánica por más de 48 horas, complicaciones gastrointestinales que requieren cirugía, aparición de fibrilación auricular permanente, sepsis, o necesidad de transfusión de dos o más unidades de componentes sanguíneos) a 30 días postintervención quirúrgica o percutánea, fue superior para el reparo con MitraClip® (57% de eventos para cirugía vs. 9,6% para MitraClip®; p<0,001), básicamente por persistencia de ventilación mecánica (4% de los pacientes en cirugía vs. 0% con MitraClip®; p<0,02) y por mayor requerimiento de transfusión en los pacientes quirúrgicos (45 vs. 13% para los de reparo endovascular; p<0,0001). En el seguimiento del objetivo primario compuesto de efectividad a 4 y 5 años, la terapia percutánea continuó mostrando superioridad de la técnica quirúrgica (44,2 vs. 64,3% p 0,01)8,9. Pero, la mortalidad en los dos grupos tratados persistió, siendo similar y sin diferencias significativas en el primer año con ambas terapias (6 vs. 6% p 1)7, y sin variación significativa en el seguimiento a cuatro años (20,8 vs. 26,8% p 0,36%)8. De manera interesante, después de los primeros seis meses en que la efectividad fue estadísticamente diferente, todos los parámetros de efectividad se mantuvieron iguales entre los dos grupos hasta el seguimiento a cinco años9.
Uno de los aspectos clínicos más impactantes de la terapia de reparo percutáneo con MitraClip® es la mejoría significativa de la clase funcional de disnea según la clasificación de la New York Heart Association (NYHA), mejoría que en esta cohorte se mantiene en el seguimiento de este objetivo secundario a cuatro y cinco años8,9. Los pacientes tratados con cirugía de reparo o cambio mitral y con MitraClip® pasaron de una clase funcional NYHA III o IV basal de 44,8 y 45,7% (p 0,11) a 13,4 y 2% (p 0,004) en el seguimiento a un año, respectivamente7, y 6,3 y 5,7% (p 0,01) en el seguimiento a cuatro años8. Desde el punto de vista ecocardiográfico, en el grupo de MitraClip® se demostró mayor disminución en los diámetros y volúmenes sistólicos y diastólicos del ventrículo izquierdo en el seguimiento de uno y cinco años9.
Sin embargo, después del análisis de subgrupos se pudo determinar que todos los resultados anteriores sólo podrían ser aplicables a pacientes con insuficiencia mitral de tipo degenerativo, por número reducido y bajo poder para pacientes con insuficiencia mitral funcional que fueron aleatorizados7. Es por esto que la FDA aprueba su uso solamente para pacientes con valvulopatía degenerativa3,10.
Estudios observacionales o registros del mundo cardiológico realEn el resto del mundo, especialmente en Europa, alrededor del 70% de los pacientes con insuficiencia mitral severa no quirúrgicos manejados con terapia de reparo percutáneo con MitraClip® son de origen secundario, incluida la cohorte prospectiva de alto riesgo del Everest II en el Estudio Realism11, y la correspondiente cohorte de alto riesgo europea en el Estudio Access EU12.
El Realism/Everest II High Risk Prospective Cohort11 es un estudio observacional, prospectivo, multicéntrico en Estados Unidos, con objetivo primario de efectividad y seguridad en el tratamiento percutáneo con MitraClip® de pacientes con insuficiencia mitral severa o masiva de origen funcional primordialmente (71%) y con alto riesgo quirúrgico (STS score>12), con seguimiento a un año. De 351 pacientes, la tasa de éxito de implante fue del 95,7%, con efectividad (definida como insuficiencia mitral residual menor que moderada) del 85,3% al egreso, y del 83,6% en el seguimiento a un año. La mortalidad a los treinta días fue del 4,8%, muy inferior a la esperada según su escala de riesgo STS, y de 22,8% al año. De todos los eventos adversos, el más frecuente fue la necesidad de transfusión de dos o más derivados sanguíneos (13,4%). Clínicamente, sólo el 17,1% de los pacientes permaneció en clase funcional NYHA III-IV, con reducción en la tasa de rehospitalización y mejoría significativa en las escalas de vida (SF-36), tanto en el componente físico como en el mental. Desde el punto de vista ecocardiográfico, hubo reducción significativa de los volúmenes de fin de diástole y sístole en el seguimiento a 12 meses sin cambios sustanciales en la fracción de eyección.
El Access EU12 es un estudio observacional, prospectivo, multicéntrico en catorce centros de la comunidad europea, post-comercial, destinado a evaluar la eficacia y seguridad del reparo endovascular con MitraClip® en 567 pacientes con insuficiencia mitral severa o masiva y alto riesgo quirúrgico, la mayoría de etiología funcional (77%). El promedio de la escala de riesgo europea (European System for Cardiac Operative Risk Evaluation – EuroSCORE) inicial fue de 23,0±18,3 con un 44,6% de pacientes con Euroscore> 20,0. Los pacientes con insuficiencia mitral funcional tendían a presentar una escala mayor de comorbilidades y de score logístico. El dispositivo fue implantado con éxito en el 99,6% de los 567 pacientes, con una eficacia del 91,2% al alta (según criterios del Everest II) y seguimiento hasta el primer año del procedimiento. La mortalidad fue del 3,4% a 30 días y 17,3% al año de seguimiento. Clínicamente, el 71,4% de los pacientes estaba en clase funcional I o II de NYHA al año, con disminución significativa en el índice de re-hospitalización, al igual que con mejoría significativa en las escalas de funcionabilidad de Minnesota y en el test de caminata de 6 minutos.
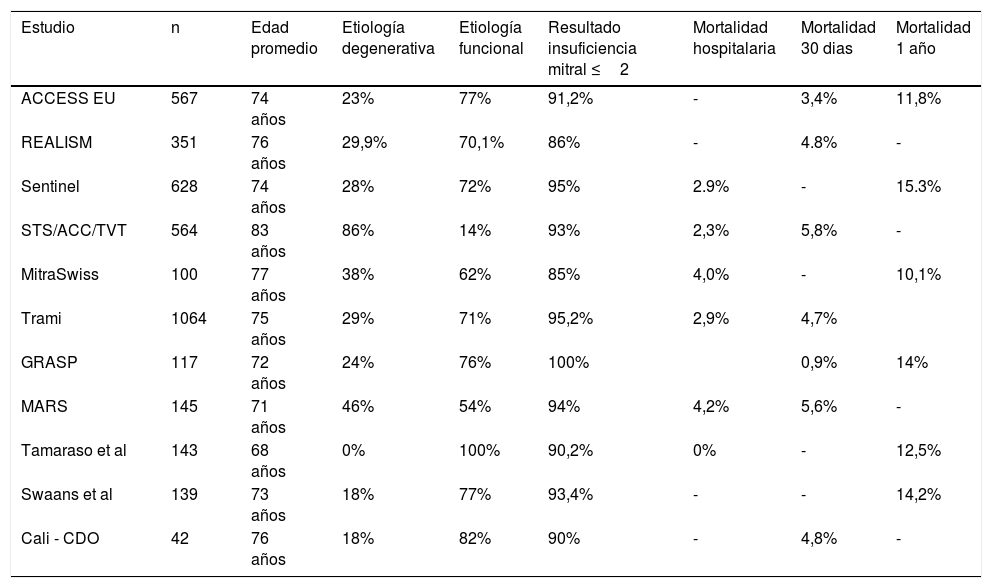
En la tabla 1 se muestran otros estudios observacionales o registros con resultados de la implantación de MitraClip13,14, dentro de los que se destacan el registro multicéntrico alemán TRAMI con 1.064 pacientes y 71% de etiología funcional, eficacia del 95,2% y mortalidad del 4,7% a los 30 días; el registro STS/TVT que se realiza en Estados Unidos, que cuenta con aprobación por la FDA solo para pacientes con etiología degenerativa (86%) con eficacia del 93% y mortalidad de 5,8% a 30 días; y se incluye la primera experiencia clínica latinoamericana en Cali, Colombia con eficacia del 90%, sólo 18% con etiología degenerativa pura, y mortalidad a 30 días del 4,8%.
Estudios observacionales – Reparo percutáneo de válvula mitral con MitraClip®
| Estudio | n | Edad promedio | Etiología degenerativa | Etiología funcional | Resultado insuficiencia mitral ≤2 | Mortalidad hospitalaria | Mortalidad 30 dias | Mortalidad 1 año |
|---|---|---|---|---|---|---|---|---|
| ACCESS EU | 567 | 74 años | 23% | 77% | 91,2% | - | 3,4% | 11,8% |
| REALISM | 351 | 76 años | 29,9% | 70,1% | 86% | - | 4.8% | - |
| Sentinel | 628 | 74 años | 28% | 72% | 95% | 2.9% | - | 15.3% |
| STS/ACC/TVT | 564 | 83 años | 86% | 14% | 93% | 2,3% | 5,8% | - |
| MitraSwiss | 100 | 77 años | 38% | 62% | 85% | 4,0% | - | 10,1% |
| Trami | 1064 | 75 años | 29% | 71% | 95,2% | 2,9% | 4,7% | |
| GRASP | 117 | 72 años | 24% | 76% | 100% | 0,9% | 14% | |
| MARS | 145 | 71 años | 46% | 54% | 94% | 4,2% | 5,6% | - |
| Tamaraso et al | 143 | 68 años | 0% | 100% | 90,2% | 0% | - | 12,5% |
| Swaans et al | 139 | 73 años | 18% | 77% | 93,4% | - | - | 14,2% |
| Cali - CDO | 42 | 76 años | 18% | 82% | 90% | - | 4,8% | - |
Adaptada de Sorajja et al.13.
Al cierre de esta edición fueron publicados dos estudios aleatorizados muy esperados porque justamente evalúan la terapia percutánea con Mitraclip® en pacientes con IM severa de etiología secundaria o funcional, con resultados disímiles. El estudio francés MitraFR15 realizado en 37 centros, mostró que en 304 pacientes sintomáticos en insuficiencia cardíaca congestiva (ICC) con IM severa de tipo funcional con criterio de inoperabilidad, con orificio regurgitante efectivo (ORE) > 20mm2, y fracción de eyección (FE) entre 15-40%, no se encontró diferencia significativa en el desenlace compuesto a 12 meses de muerte por cualquier causa u hospitalización no planeada (OR 1.16; IC 95%, 0,73-1,84; p=0.53), en los pacientes aleatorizados a manejo médico (78/152 pacientes; 51.3%) o a intervención percutánea con MitraClip® (83/152 pacientes; 54.6%). El estudio norteamericano COAPT (16), involucró 78 centros con pacientes en ICC (NYHA II-IV) con FE entre 20-50%, con IM moderada a Severa o Severa (GIII-IV) con criterio de inoperabilidad, quienes persistían con síntomas y signos de ICC a pesar de tratamiento médico óptimo recomendado por guías de manejo (GDMT por sus siglas en inglés). De los 614 pacientes incluidos, 312 fueron aleatorizados a continuar manejo médico (GDMT) y 302 a procedimiento de intervención percutánea con MitraClip®, para ser seguidos por 24 meses y teniendo como desenlace primario la frecuencia de hospitalización durante el seguimiento. En este estudio se encontró una tasa de hospitalización menor en el grupo de intervención frente al control de manejo médico: 35.8% por paciente/año para el grupo de intervención con MitraClip® vs 67.9% por paciente/año para el grupo de manejo médico (HR, 0.53; 95% IC; 0,40-0,70; p<0.0001). En el 96.6% del grupo de intervención no hubo eventos relacionados con el dispositivo a los 12 meses, con desenlace de muerte por cualquier causa menor en los pacientes intervenidos vs los pacientes en manejo médico (29,1% vs 46.1%, respectivamente; p<0.001).
La discusión inicial parece centrarse en la explicación de la diferencia en los resultados entre estos dos estudios para el manejo de la IM severa funcional. Hay diferencia en algunos criterios de inclusión: grado de IM para la cuantificación de la severidad de la IM según ORE (31mm2 ± 10 para MitraFR vs 41mm2 ± 15 para COAPT); volumen de fin de diástole (135ml/m2 ± 34 para MitraFR vs 101ml/m2 ± 34 para COAPT); tratamiento médico al momento de ingreso al estudio (ajustado a la práctica clínica en el MitraFR vs GDMT para el COAPT). En el COAPT se excluyeron pacientes con compromiso pulmonar significativo, hipertensión pulmonar severa o disfunción importante del VD. Y respecto al procedimiento y seguimiento: tasa de complicaciones (14.6% en MitraFR vs 8.5% en COAPT), e IM residual (9% en MitraFR vs 5% en COAPT)15,16.
Se espera que el análisis de estos estudios permita ir depurando y afinando los candidatos más idóneos para este tipo de intervenciones en pacientes inoperables con IM funcional.
Selección de pacientesEl tratamiento con reparo endovascular de válvula mitral con MitraClip® se reserva estrictamente para pacientes que cumplan los siguientes criterios clínicos15–19:
- •
Insuficiencia mitral severa de origen funcional o degenerativo.
- •
Clase funcional> II (NYHA) a pesar de estar en manejo médico y farmacológico óptimo para insuficiencia cardíaca.
- •
Riesgo alto o prohibitivo para cirugía cardiovascular.
- •
Cumplimiento estricto de los criterios anatómicos adecuados en la evaluación ecocardiográfica de la válvula mitral.
- •
Haber sido evaluados en una junta cardioquirúrgica (heart team) que defina y avale los puntos anteriores.
De acuerdo con los resultados del Everest II7, las guías norteamericanas para el manejo de la enfermedad valvular3 actualizadas en 201710, establecen las siguientes situaciones clínicas para considerar el reparo percutáneo con MitraClip® (indicación IIb y con nivel de evidencia B) en pacientes con:
- •
Insuficiencia mitral crónica de etiología degenerativa.
- •
Clase funcional III o IV.
- •
Anatomía favorable para reparo percutáneo y razonable expectativa de vida.
- •
Riesgo prohibitivo por comorbilidades severas.
- •
Persistencia de síntomas a pesar de terapia médica óptima por guías de manejo de insuficiencia cardiaca congestiva.
Se ha propuesto como criterios para considerar pacientes como de riesgo alto o prohibitivo para cirugía aquellos con una escala STS ≥ 8 para reemplazo valvular mitral, o que por evaluación cardioquirúrgica presenten cualesquiera de las siguientes condiciones no incluidas en el score del STS11,12,20:
- •
Aorta en porcelana o placas arterioescleróticas extensas y complejas en aorta ascendente.
- •
Fragilidad (evaluada en dos o más escalas).
- •
Tórax hostil (mediastinitis o irradiación previa del tórax o mediastino).
- •
Cirrosis hepática (clasificación: Model of End-stage Liver Disease - MELD score>12).
- •
Hipertensión pulmonar severa (PS arteria pulmonar> 2/3 de la PS sistémica).
- •
Antecedente de revascularización miocárdica con puentes permeables (especialmente dependiente de puente de mamaria interna).
- •
Insuficiencia mitral funcional y fracción de eyección del ventrículo izquierdo <40%.
- •
Otras características clínicas: disfunción ventricular derecha con insuficiencia tricúspide severa, en quimioterapia por malignidad, diátesis hemorrágica mayor, SIDA, alto riesgo de aspiración, demencia severa.
Los criterios ecocardiográficos para definir insuficiencia mitral severa (de origen degenerativo o funcional), deben seguir los lineamientos establecidos en diversas revisiones, algunas de las que se pueden resumir a continuación2,3,5,21–24:
Cualitativos- -
Morfología valvular: defecto de coaptación o prolapso/flail anormal
- -
Color del flujo del jet regurgitante: grande en jet central o variable en jets excéntricos.
- -
Señal del jet regurgitante por doppler continuo: densa/triangular
- -
Vena contracta: ≥ 7mm (≥ 8mm en biplano).
- -
Flujo de venas pulmonares: onda sistólica abatida o reversa.
- -
Otros: relación VTI mitral/VTI aórtico> 1,4 (en ausencia de estenosis mitral o aórtica).
- •
EROA: ≥ 40mm2 en primaria (degenerativa) o ≥ 20mm2 en secundaria (funcional).
- •
Volumen regurgitante: ≥ 60ml/lat en degenerativa o ≥ 40ml/lat en funcional.
- •
Fracción regurgitante: ≥ 50% tanto en primaria (degenerativa) como en secundaria (funcional).
El ecocardiograma transesofágico que se realiza como parte del protocolo de evaluación, permite establecer pacientes aptos para reparo endovascular de válvula mitral y debe aportar información suficiente para definir si un paciente cumple con todos los criterios anatómicos adecuados para la realización del procedimiento. Debe incluir las siguientes proyecciones17,25–29:
- •
Proyección 5 cámaras (0o superior): permite visualizar segmentos A1 y P1.
- •
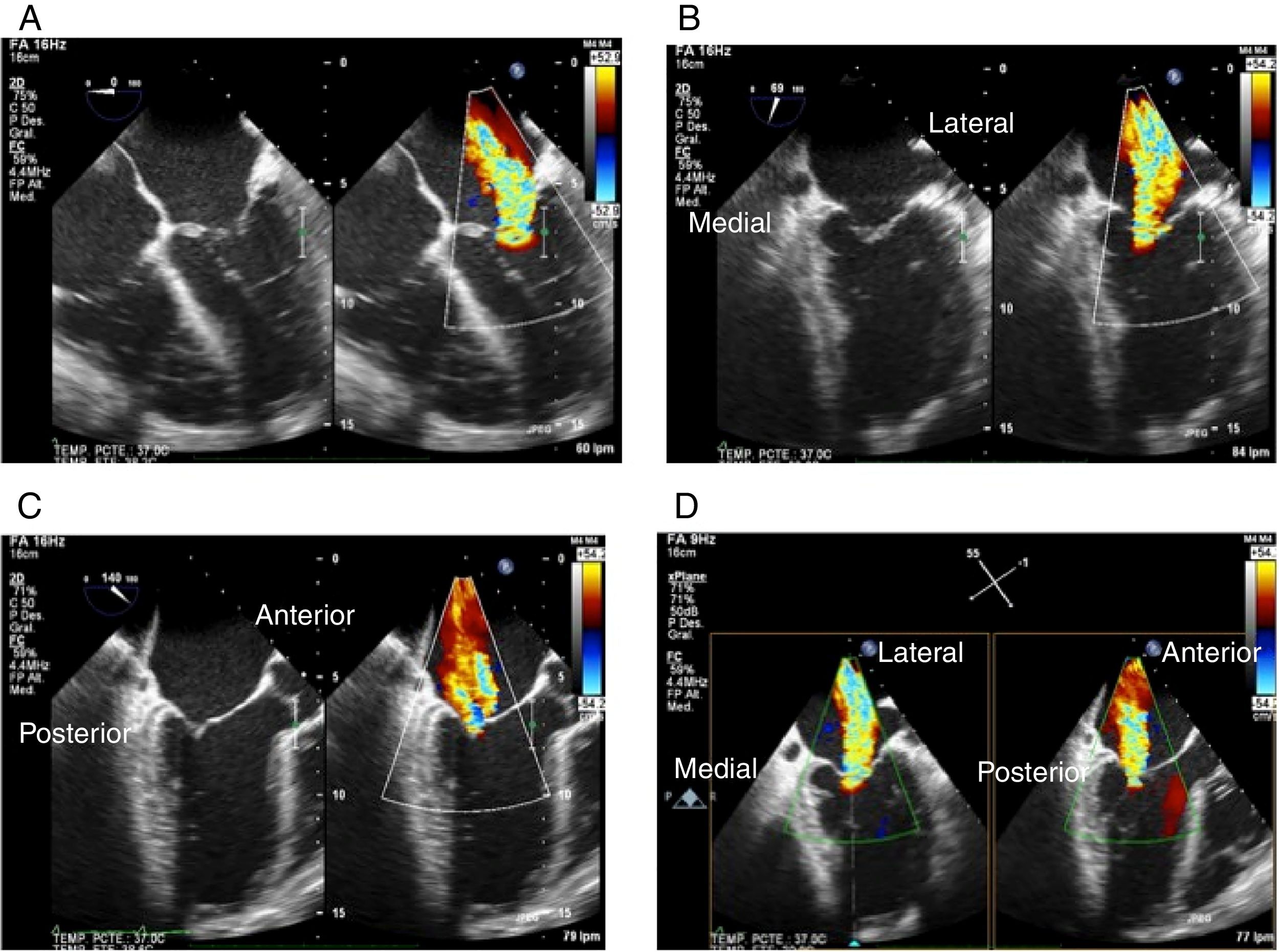
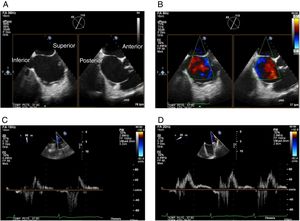
Proyección 4 cámaras (0o central): permite visualizar segmentos A2 y P2 (fig. 1Panel A).
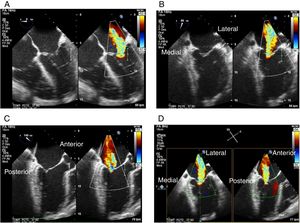
Figura 1.Panel A: proyección 4 cámaras 0o con color simultáneo; Panel B: proyección bicomisural con color simultáneo, en donde a manera de “rosa de los vientos” se obtienen los puntos cardinales medial y lateral; Panel C: proyección tracto de salida con color simultáneo, donde están los puntos cardinales perpendiculares que señalan la ubicación anterior y posterior; Panel D: proyección X-Plane de los cuatro puntos cardinales con las dos proyecciones simultáneas.
(0,4MB). - •
Proyección 4 cámaras (0o inferior): permite visualizar segmentos A3 y P3.
- •
Proyección bicomisural (± 60o) posición neutra: permite visualizar segmentos P1, A2 y P3 (Panel B).
- •
Proyección bicomisural (± 60o) rotación horaria: permite visualizar segmentos A1, A2 y A3.
- •
Proyección bicomisural (± 60o) rotación antihoraria: permite visualizar segmentos P1, P2 y P3.
- •
Proyección tracto de salida (± 140o) posición central: permite visualizar segmentos A2 y P2 (Panel C).
- •
Proyección tracto de salida (± 140o) rotación horaria: permite visualizar segmentos A3 y P3.
- •
Proyección tracto de salida (± 140o) rotación antihoraria: permite visualizar segmentos A1 y P1.
- •
Proyección X-plane o multiplanar desde bicomusiral con eje largo con y sin color (Panel D).
- •
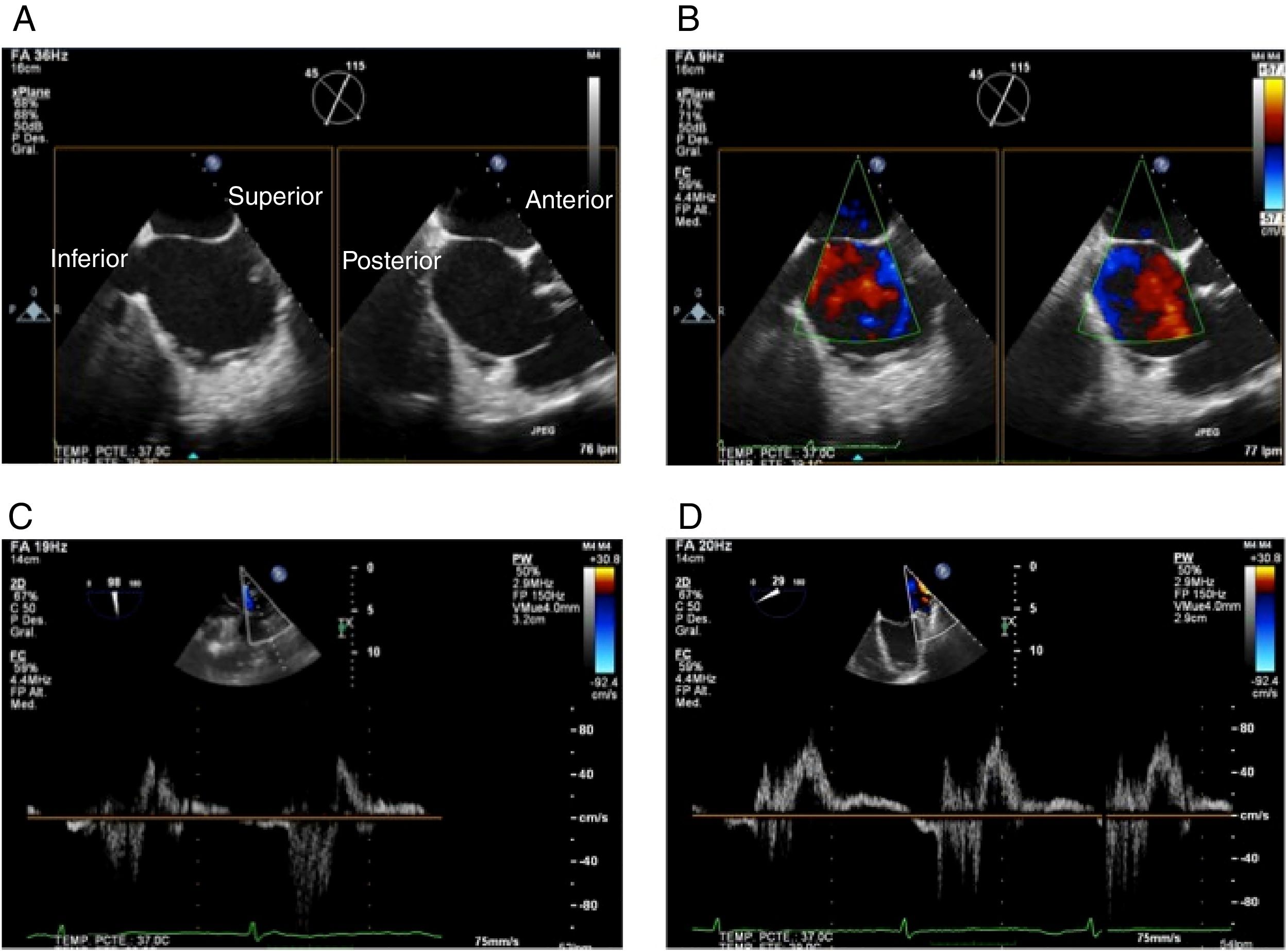
Proyección bicava (90-110): visualización de cava superior, septum interauricular y cava inferior.
- •
Eje corto en la base (± 45o): visualización de aorta, septum interauricular y paredes posteriores auriculares.
- •
Proyección X-plane o multiplanar bicavo y eje corto con y sin color (Panel A y B).
Figura 2.Panel A: proyección bicava (muestra ubicación superior e inferior) en X-plane con proyección de eje corto en la base (muestra ubicación anterior y posterior); Panel B: iguales proyecciones con color; Panel C: Doppler pulsado de vena pulmonar superior derecha; Panel D: Doppler pulsado de vena pulmonar superior izquierda.
(0,3MB). - •
Proyección venas pulmonares derechas (0 y 90-100o): valorar flujo con doppler pulsado y color (Panel C).
- •
Proyección venas pulmonares izquierdas (0 y 30o): valorar flujo con doppler pulsado y color (Panel D).
- •
Eje corto en transgástrico (0-20o): medición de área valvular y visualización de sitio del jet con doppler color.
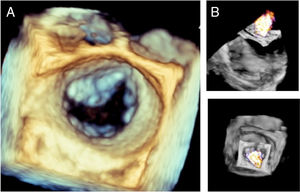
- •
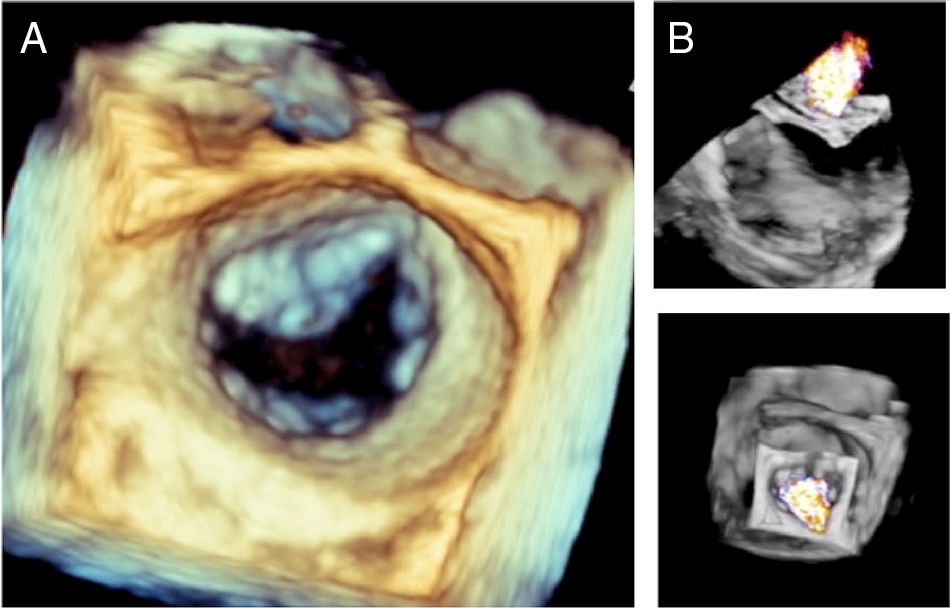
Proyección 3D: toma de imágenes en 3D con y sin color con vista quirúrgica (válvula aórtica ubicada en meridiano superior) (Panel A y B).
- •
Post-procesamiento de imágenes 3D para evaluación del plano valvular mitral.
Se debe tener en cuenta que estas proyecciones básicas serán usadas en su totalidad durante el procedimiento de implante del MitraClip®. En la tabla 2 se pueden verificar algunos aspectos morfológicos del TEE que hace el candidato ideal para el reparo percutáneo con MitraClip®19,30.
Criterios morfofuncionales del TEE para reparo mitral con MitraClip®
| Morfología valvular ideal | Morfología valvular inadecuada |
|---|---|
| Insuficiencia mitral originada en la porción media de la válvula (A2 y P2). | Perforación valvular o presencia de clefts. |
| Ausencia de calcificación en el área de captura de valvas. | Ausencia de soporte por cuerdas tendinosas primarias o secundarias. |
| Área valvular mitral> 4 cm2 | Severa calcificación en el sitio de clampeo. |
| Longitud de valva posterior> 10 mm | Longitud de valva posterior <7 mm. |
| Hendidura valvular (flail width) <15 mm. Tomar en eje corto transgástrico. | Antecedente de enfermedad reumática o secuelas de endocarditis infecciosa. |
| Gap valvular (flail gap) <10 mm. Tomar en proyección 4 cámaras. | Estenosis mitral moderada o severa. |
| Suficiente tejido para lograr coaptación mecánica.Profundidad coaptación <11 mm (4 cámaras longitud de coaptación> 2 mm (4 cámaras). | Ausencia de coaptación con distancia entre las valvas> 2 mm.Valva posterior <11 mm de longitud |
Con todos estos criterios, finalmente la junta cardio-quirúrgica (Heart Team) estudia, analiza y define si un paciente es apto para el reparo endovascular de la válvula mitral con MitraClip®19,30.
Procedimiento de reparo mitral percutáneo con MitraClipEl reparo endovascular de válvula mitral con MitraClip® es un procedimiento de altísima complejidad, lo cual sugiere que debe ser realizado únicamente en centros de excelencia cardiovascular que cuenten con la tecnología y el personal médico y paramédico que se describe a continuación19,25,29,30; además, supone una revisión cuidadosa de todos los aspectos del paciente a intervenir además de una planeación previa de la estrategia de intervención específica en cada caso.
- •
Equipo de Hemodinamia de alta calidad (idealmente sala híbrida).
- •
Ecocardiograma transesofágico con capacidad de realizar imágenes 3D.
- •
Respaldo de cirugía cardiovascular.
- •
Equipo para anestesia general.
- •
Unidad de cuidado intensivo con énfasis en patología cardiovascular.
- •
Unidad de cardiología clínica (idealmente clínica de falla cardiaca).
- •
Unidad de cardiología no invasiva e imágenes ecocardiográficas.
Para definir un reparo endovascular de valvula mitral con MitraClip® como procedimiento exitoso deben cumplirse los siguientes criterios7,11,12,19,29:
- •
Disminución de insuficiencia mitral <grado II (moderado).
- •
Gradiente transvalvular mitral medio <5mm Hg.
- •
Área valvular mitral efectiva> 2cm2.
Por las características del procedimiento, la implantación del MitraClip® es guiada por TEE intraprocedimental25 y el paso a paso debe seguirse en orden estricto:
- •
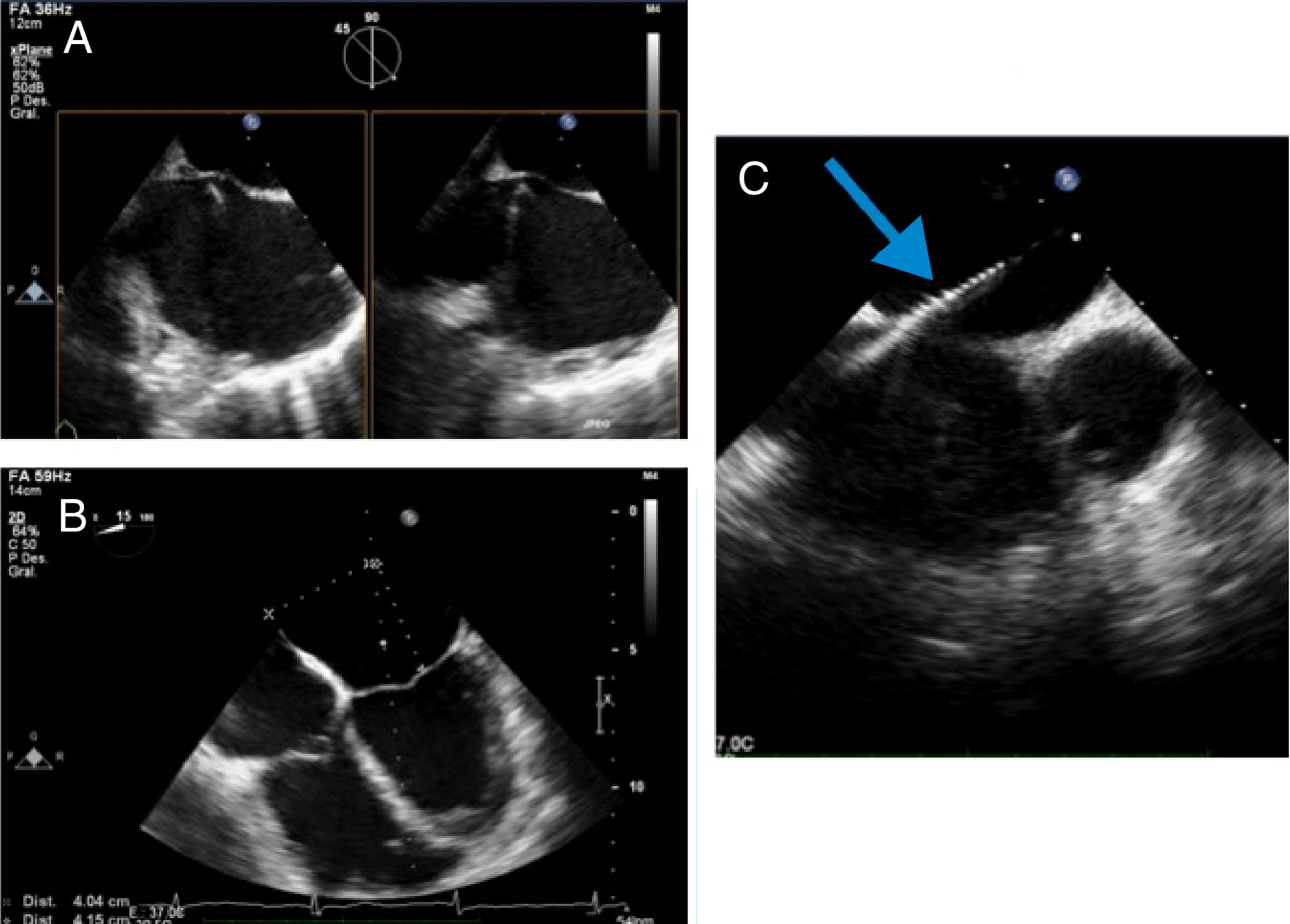
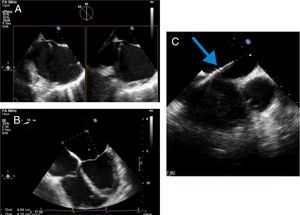
Realizar punción transeptal, idealmente superior y posterior (proyección X-plane o multiplanar del bicavo y eje corto en la base) con ubicación a 4,0-5,2cm por encima del plano valvular mitral (verificado en proyección 4 cámaras) (Panel A y B).
Figura 4.Panel A. Proyección X-plane bicavo y eje corto en la base para verificar “tenting” del introductor y aguja montada sobre el septum interauricular; Panel B: distancia teórica entre sitio de entrada a través del septum interauricular y el plano valvular en proyección de 4 cámaras; Panel C: visualización de marcas del introductor y el dilatador dentro de la aurícula izquierda en proyección de eje corto.
(0,21MB). - •
Apoyar al alojar la guía de alto soporte en la vena pulmonar superior izquierda idealmente (usando un paneo auricular en proyección de eje corto).
- •
Acompañar el paso del introductor y dilatador del dispositivo hacia la aurícula izquierda a través del septum interauricular, cuidando que la marca del introductor esté a más de 1,5cm dentro de la aurícula izquierda. Debe tenerse precaución en la dirección del ingreso del dilatador e introductor para evitar lesionar la pared posterior de la aurícula izquierda (paneo de la aurícula izquierda en eje corto) (Panel C).
- •
Vigilar el paso del MitraClip® a través del introductor hasta lograr alineación con el introductor (fluoroscopia) y verificar su salida completa en la aurícula izquierda. Debe tenerse precaución de la dirección para evitar lesionar la pared posterior de la aurícula izquierda o el ligamento de Marshall. También debe asegurarse en lo posible de mantener el introductor dentro de la aurícula izquierda (doble marca del introductor visible por ecocardiografía) (paneo en eje corto)
- •
Guiar el proceso de giro del MitraClip® en sentido medial para acomodarlo por encima del plano valvular mitral (paneo en proyecciones de eje corto y bicomisural).
- •
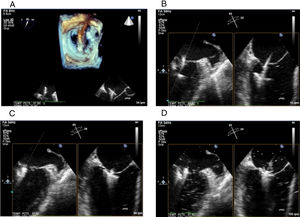
Orientar la orientación de los brazos abiertos del MitraClip® ® (proyección 3D con vista quirúrgica) y la simulación del probable camino de entrada del MitraClip® al ventrículo izquierdo (proyección X-plane o multiplanar: bicomisural y eje largo) (Panel A).
Figura 5.Panel A: imagen 3D en aurícula izquierda para dirigir apoyar la alineación perpendicular del clip; Panel B: proyección X-Plane bicomisural y tracto salida para acompañar la entrada al VI del clip; Panel C: proyección X-plane bicomisural y tracto de salida para acompañar el proceso de retiro del clip abierto a 120° para el agarre de las valvas anterior y posterior de la válvula mitral; Panel D: proyección X-Plane bicomisural y tracto de salida con aumento para realizar el “grasping” de las valvas al bajar los “grippers” del clip.
(0,37MB). - •
Acompañar el paso del MitraClip® abierto al ventrículo izquierdo (en caso de uno o más clips, debe considerarse pasar con el cerrado para evitar daño del primer agarre) y verificación de posición; izquierdo (proyección X-plane o multiplanar: bicomisural y eje largo) (Panel B).
- •
Guiar los intentos y el agarre final de las valvas anterior y posterior sobre el sitio designado según la estrategia de intervención de cada paciente (proyección X-Plane o Multiplanar: bicomisural y eje largo, o solamente en eje largo; ambas con ampliación o zoom dela imagen) (Panel C y D).
- •
Certificar el agarre adecuado y suficiente de las valvas (proyección X-Plane o multiplanar: bicomisural y eje largo, con y sin color, 3D con y sin color; transgástrico para revisión de agarre y medidas de áreas residuales según sea necesario) (Panel A y B). En caso de no ser satisfactoria, se puede soltar el clip y reposicionar.
- •
Revisar aspectos fisiológicos como flujo de venas pulmonares, gradientes y área valvular por tiempo de presión media en ambos neo-orificios mitrales o por planimetría de éstos, especialmente si el gradiente medio incrementa en forma importante. Ello definiría si es posible implantar o no otro clip en caso de necesitarlo, para replantear la estrategia de intervención.
- •
Acompañar el desacople del sistema liberador y el clip para verificar su estabilidad y funcionalidad, además de seguir el retiro de este sistema dentro del introductor, el cual debe asegurarse permanezca dentro de la aurícula izquierda mientras se verifican todos los parámetros anatómicos y funcionales para terminar el procedimiento o definir la implantación de otro MitraClip® (paneo de aurícula izquierda y septum interauricular en eje corto).
- •
Acompañar el retiro del introductor y revisar el tamaño y la magnitud del cortocircuito en septum interauricular y certificar la ausencia de derrame pericárdico (proyección bicava, eje corto y 4 cámaras). En caso de requerir nuevo MitraClip®, repetir pasos previos.
Pese a que el procedimiento de reparación percutánea de la válvula mitral con dispositivo MitraClip® ha demostrado ser seguro, puede haber complicaciones vasculares, y otras como evento cerebrovascular isquémico, perforación cardíaca con derrame pericárdico o taponamiento cardíaco, infarto de miocardio, estenosis mitral residual, comunicación interauricular residual iatrogénica, desprendimiento parcial o total (con embolización del dispositivo), endocarditis, sangrado, ruptura de cuerda mitral.
La estenosis mitral residual también es una complicación posible y que constituye un desafío diagnóstico y de detección durante el procedimiento, pero especialmente una apropiada medición del área planimétrica pre-procedimental durante el tamizaje el estudio del paciente antes de ser aceptado como elegible por el heart team. Ya durante el implante, debe procurarse que el gradiente medio residual no sea> 5mm Hg, y que tampoco se combine con una insuficiencia mitral residual ≥ 2, porque impacta negativamente en mortalidad, requerimiento de rehospitalización, uso posterior de dispositivos de asistencia ventricular y reintervención de la válvula mitral31. Por tanto, el reto intraprocedimental siempre será la determinación del gradiente medio residual, el área valvular tanto por tiempo de hemipresión como por planimetría 2D por proyección transgástrica o por análisis planimétrico 3D. Sin embargo, hay sobreestimación del área por estos métodos y por ende, se establece el gradiente medio como uno de los datos funcionales más confiables, aunque también tiene variaciones según el estado hemodinámico del paciente. Será la combinación de todas estas estrategias la que definirá la necesidad de reubicación o implante definitivo del MitraClip® durante el procedimiento y antes de definir la liberación completa del dispositivo. En caso de dudas, siempre existe la alternativa de soltar el MitraClip® aún no liberado, replantear estrategias según resultados de eficacia, área pre-procedimental y número posible de clips requeridos, para realizar nuevos agarres con menor cantidad de tejido o reposicionar el clip.
Aunque la prevalencia de la comunicación interatrial puede llegar a ser del 82% a los 30 días del procedimiento, por lo general no presenta compromiso hemodinámico, y por tanto, su cierre debe reservarse para casos individuales con repercusión clínica32. Esto generalmente se presenta cuando queda componente de estenosis mitral con gradiente medio elevado o por el contrario, insuficiencia mitral residual significativa con incremento severo de la presión intrauricular izquierda33.
El desprendimiento parcial (de una de las dos valvas) o total (de ambas valvas y embolización subsecuente) del MitraClip® ocurre en un 4,8%7,8,34. La endocarditis tiene una incidencia de 1,3%8; en una revisión sistemática se documentó que en el 60% de los casos el germen responsable fue el Staphylococcus aureus, causante de alta mortalidad35.
ConclusionesEl avance tecnológico ha permitido el desarrollo de varios dispositivos para el manejo de la insuficiencia mitral en pacientes con falla cardíaca aún en manejo óptimo desde el punto de vista médico36. El reparo percutáneo de la válvula mitral con MitraClip® ha demostrado ser un procedimiento eficaz y seguro para esta patología ya sea de etiología degenerativa (donde suele cambiarse el curso de la enfermedad) o funcional (menos claro el impacto sobre el curso de la enfermedad)2.
Los resultados de los estudios COAPT15 y MITRA-FR16, donde se compara el manejo medico óptimo en los pacientes con IM funcional de muy alto riesgo quirúrgico o inoperables con aquellos pacientes llevados a manejo con MitraClip®, han mostrado resultados diferentes. Sin embargo, su verdadero impacto se presentará paulatinamente en la práctica clínica diaria de la cardiología del mundo real, en la medida en que también se vayan depurando y afinando las indicaciones en los Consensos de Expertos reflejados en las Guías de Manejo Valvular. También se esperará el aporte del estudio RESHAPE-HF37, para sumarse a esta discusión, que seguramente permitirán expandir las fronteras de conocimiento para el manejo de esta patología. Lo cierto es que hasta el momento, realizando una adecuada selección de pacientes inoperables con IM severa y anatomía favorable, la única terapia aceptada globalmente es el reparo percutáneo con MitraClip®.
En esta evolución, la llamada Ecocardiografía Intervencionista ha sido pieza fundamental para estos logros actuales y continuará siendo el apoyo indispensable para los desarrollos futuros.
FinanciaciónNinguna.
Conflictos de interésLos Dres. Jaime Andrés Fonseca Caicedo y Luis Miguel Benítez, son Speakers y Proctors Clínicos para Latinoamérica: Abbott Laboratories.
A todo el personal médico, paramédico y administrativo de Ecocardiografía – Angiografía de la Clínica de Occidente – Cali, Colombia.