El propósito de este consenso es presentar un resumen de los principales estudios que han evaluado el implante valvular aórtico percutáneo como terapia alternativa en pacientes con estenosis aórtica sintomática severa, quienes no pueden ser sometidos a cirugía por un alto riesgo quirúrgico, o que se consideran inoperables por el “equipo cardiológico”, condiciones consideradas como indicación para dispositivos “off label”. Luego se describen métodos diagnósticos para la estenosis aórtica y ayudas para saber con cuál equipo de cardiología estructural contar en la planificación, se revisa el procedimiento y finalmente se mencionan las complicaciones y los riesgos del mismo.
The purpose of this guide is to present a quick overview of the major studies that have evaluated the valve implant percutaneous aortic as an alternative therapy in patients with severe symptomatic aortic stenosis who can not undergo surgery by a high surgical risk or be considered inoperable by the “Heart team” is considered the indications “off label” devices. Afterwards, diagnostic methods for aortic stenosis and helps with counting equipment structural cardiology to plan, the procedure is reviewed, and finally the complications and risks of the procedure are mentioned.
El reemplazo valvular aórtico quirúrgico es el tratamiento de elección para el manejo de pacientes con estenosis aórtica severa sintomáticos, pues mejora los síntomas y la calidad de vida y prolonga la sobrevida1.
Sin embargo, casi el 30-40% de los pacientes con estenosis aórtica sintomática, no son candidatos para cirugía por tener enfermedades asociadas que se traducen en un alto riesgo quirúrgico o los hace de riesgo prohibitivo para cirugía (inoperables)2.
Con base en los resultados del PARTNER B3, la Administración de Medicamentos y Alimentos (FDA, su sigla en inglés) aprobó en noviembre de 2011 la utilización de la válvula Edwards SAPIEN en pacientes inoperables y en aquellos de alto riesgo quirúrgico en octubre de 2012, PARTNER A4.
Así mismo, según el US PIVOTAL5 aprobó el uso de la válvula autoexpandible CoreValve para uso en pacientes inoperables en enero de 2014 y en aquellos de alto riesgo quirúrgico en junio de 2014, US PIVOTAL6.
Antes de indicar un implante valvular aórtico percutáneo (TAVI, su sigla en inglés) a un paciente, este debe ser evaluado por una junta médico quirúrgica (“heart team”), que determinará:
- 1.
Que la indicación sea adecuada (que clasifique en el grupo de pacientes con estenosis aórtica severa sintomática y riesgo quirúrgico prohibitivo (inoperable) o alto riesgo quirúrgico.
- 2.
Que haya factibilidad técnica del procedimiento.
- 3.
Que se identifiquen las contraindicaciones clínicas y anatómicas del procedimiento quirúrgico.
- 4.
Que los candidatos tengan una expectativa de vida mayor o igual a un año con posibilidad de mejorar su calidad de vida teniendo en cuenta sus comorbilidades.
Se define paciente con riesgo prohibitivo para cirugía (inoperable) aquel que por sus condiciones clínicas y anatómicas lo hacen un candidato imposible de llevar a cirugía de reemplazo valvular aórtico debido a la coexistencia de comorbilidades severas: el paciente tiene probabilidad mayor al 50% de morir en los primeros 30 días después de cirugía3. Ejemplos de estas situaciones son:
- -
Aorta en porcelana: en algunas series aproximadamente 20% (5 a 33%) de los pacientes que van a TAVI tiene aorta en porcelana7. Se describe como un problema clínico en el que se observa calcio en la pared de la aorta que impide la canulación aórtica, el clampeo aórtico o la aortotomía, o interfiere con la anastomosis del bypass. En los estudios PARTNER se define “aorta en porcelana” la calcificación casi completamente circunferencial de la aorta ascendente o el arco aórtico.
Otras situaciones en las cuales puede considerarse TAVI por criterio de riesgo quirúrgico prohibitivo para cirugía (inoperable) son:
- -
Antecedente de radioterapia a mediastino, injertos coronarios permeables; en especial si LIMA (mamaria interna) cursa cerca a la parte posterior del esternón, por riesgo de daño de la misma durante la esternotomía.
- -
Pacientes con fracción de eyección del ventrículo izquierdo severamente comprometida (FE< 25%): esta situación compromete la salida de bomba de circulación extracorpórea en el posquirúrgico inmediato.
- -
Pacientes con historia de cirugía de tórax previa (la dificultad quirúrgica aumenta con el número de cirugías de tórax del paciente; cuantas más intervenciones tenga, mayor el riesgo de más cantidad de adherencias en el tórax).
Se define paciente de alto riesgo para cirugía aquel con un EuroScore logístico mayor de 20%8. Sin embargo, el EuroScore tiende a sobrestimar la mortalidad peri-operatoria por lo que se ha estimado que una puntuación superior al 8% por STS (“Society of Thoracic Surgeons”), será más real9. En algunas situaciones puede considerarse TAVI pese a que el STS no sea > 8%; son las llamadas condiciones de comorbilidad y fragilidad extrema del paciente, las cuales se definen a continuación.
Comorbilidad extrema- 1.
Enfermedad pulmonar obstructiva crónica moderada o severa (paciente dependiente de oxígeno en casa o paciente con volumen espiratorio menor de 1.000ml).
- 2.
Cirrosis hepática.
- 3.
Enfermedad grave del tejido conectivo.
- 4.
Paciente en terapia con inmunosupresores.
- 1.
Anemia severa que requiere transfusión sanguínea.
- 2.
Índice de masa corporal menor de 21kg/m2.
- 3.
Albúmina menor de 3,3g/dl.
- 4.
Pérdida de peso no explicada mayor de 5kg por año.
- 5.
Imposibilidad para realizar un test de caminata: 160 metros en 6 minutos (no puede caminar 160 metros en 6 minutos).
Este grupo de pacientes que presentan las condiciones antes enunciadas en ausencia de un elevado riesgo quirúrgico (STS > 8%) pueden conducir a la junta medico quirúrgica a recomendar la decisión de TAVI.
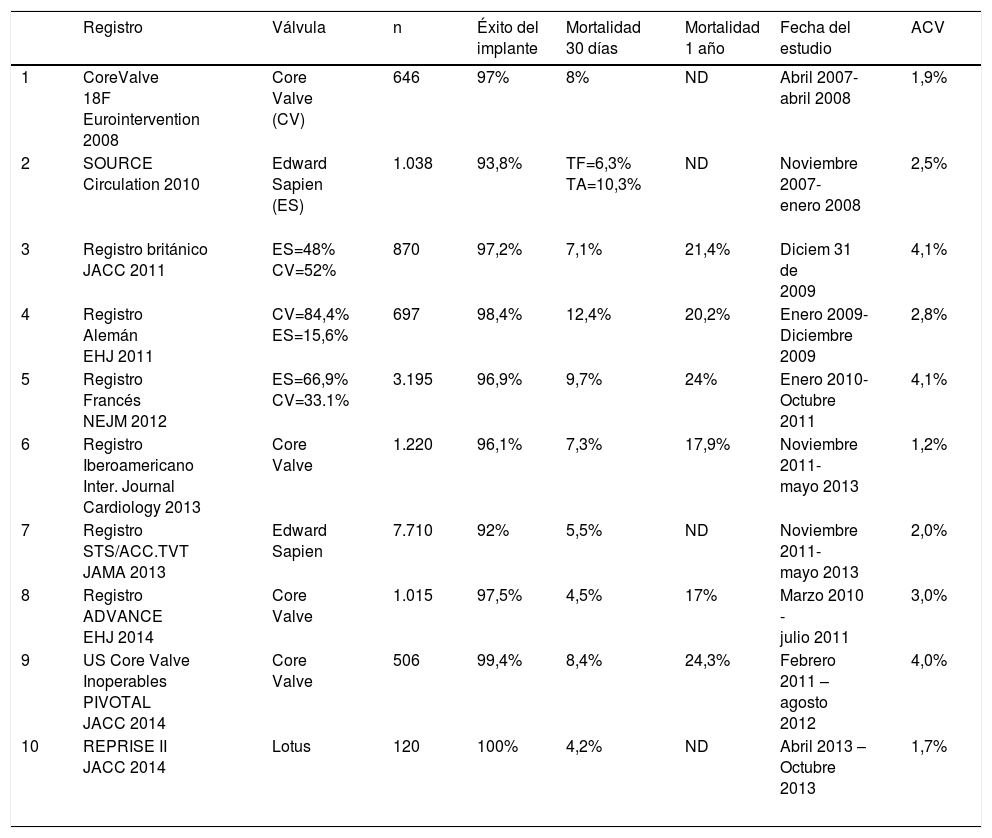
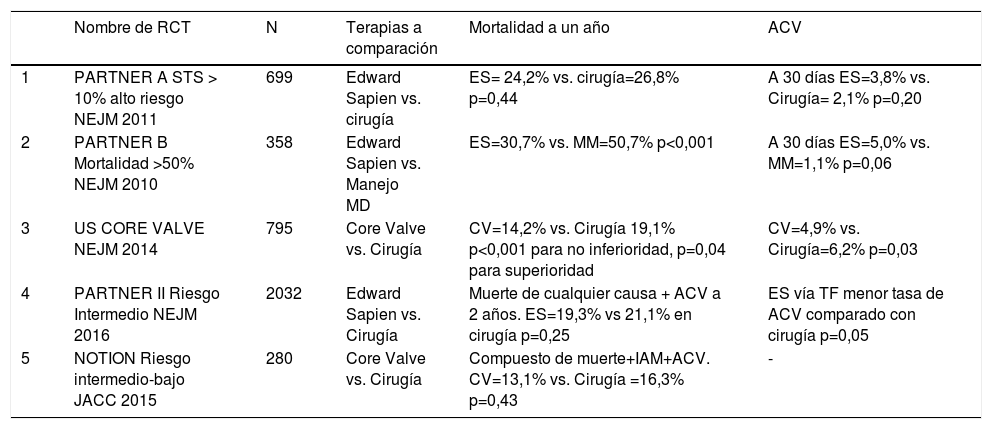
Evidencia para el uso de TAVI en pacientes con estenosis aórtica severa sintomáticaLa evidencia hace referencia a diez estudios observacionales los cuales se presentan en la tabla 1; se evalúa el tipo de válvula empleada, el número de pacientes registrados, el éxito primario en el implante y la mortalidad a 30 días y un año. La tabla 2 hace referencia a cinco estudios aleatorios prospectivos (RCT) que comparan la terapia de TAVI con cirugía10–27.
Estudios observacionales – Registros
| Registro | Válvula | n | Éxito del implante | Mortalidad 30 días | Mortalidad 1 año | Fecha del estudio | ACV | |
|---|---|---|---|---|---|---|---|---|
| 1 | CoreValve 18F Eurointervention 2008 | Core Valve (CV) | 646 | 97% | 8% | ND | Abril 2007- abril 2008 | 1,9% |
| 2 | SOURCE Circulation 2010 | Edward Sapien (ES) | 1.038 | 93,8% | TF=6,3% TA=10,3% | ND | Noviembre 2007- enero 2008 | 2,5% |
| 3 | Registro británico JACC 2011 | ES=48% CV=52% | 870 | 97,2% | 7,1% | 21,4% | Diciem 31 de 2009 | 4,1% |
| 4 | Registro Alemán EHJ 2011 | CV=84,4% ES=15,6% | 697 | 98,4% | 12,4% | 20,2% | Enero 2009- Diciembre 2009 | 2,8% |
| 5 | Registro Francés NEJM 2012 | ES=66,9% CV=33.1% | 3.195 | 96,9% | 9,7% | 24% | Enero 2010- Octubre 2011 | 4,1% |
| 6 | Registro Iberoamericano Inter. Journal Cardiology 2013 | Core Valve | 1.220 | 96,1% | 7,3% | 17,9% | Noviembre 2011- mayo 2013 | 1,2% |
| 7 | Registro STS/ACC.TVT JAMA 2013 | Edward Sapien | 7.710 | 92% | 5,5% | ND | Noviembre 2011- mayo 2013 | 2,0% |
| 8 | Registro ADVANCE EHJ 2014 | Core Valve | 1.015 | 97,5% | 4,5% | 17% | Marzo 2010 - julio 2011 | 3,0% |
| 9 | US Core Valve Inoperables PIVOTAL JACC 2014 | Core Valve | 506 | 99,4% | 8,4% | 24,3% | Febrero 2011 – agosto 2012 | 4,0% |
| 10 | REPRISE II JACC 2014 | Lotus | 120 | 100% | 4,2% | ND | Abril 2013 – Octubre 2013 | 1,7% |
ES=Edward Sapien, CV=Core Valve, TF= transfemoral, TA= transapical. ACV= ataque cerebrovascular.
RTC; Estudios aleatorios: 5 estudios aleatorios controlados prospectivos con TAVI
| Nombre de RCT | N | Terapias a comparación | Mortalidad a un año | ACV | |
|---|---|---|---|---|---|
| 1 | PARTNER A STS > 10% alto riesgo NEJM 2011 | 699 | Edward Sapien vs. cirugía | ES= 24,2% vs. cirugía=26,8% p=0,44 | A 30 días ES=3,8% vs. Cirugía= 2,1% p=0,20 |
| 2 | PARTNER B Mortalidad >50% NEJM 2010 | 358 | Edward Sapien vs. Manejo MD | ES=30,7% vs. MM=50,7% p<0,001 | A 30 días ES=5,0% vs. MM=1,1% p=0,06 |
| 3 | US CORE VALVE NEJM 2014 | 795 | Core Valve vs. Cirugía | CV=14,2% vs. Cirugía 19,1% p<0,001 para no inferioridad, p=0,04 para superioridad | CV=4,9% vs. Cirugía=6,2% p=0,03 |
| 4 | PARTNER II Riesgo Intermedio NEJM 2016 | 2032 | Edward Sapien vs. Cirugía | Muerte de cualquier causa + ACV a 2 años. ES=19,3% vs 21,1% en cirugía p=0,25 | ES vía TF menor tasa de ACV comparado con cirugía p=0,05 |
| 5 | NOTION Riesgo intermedio-bajo JACC 2015 | 280 | Core Valve vs. Cirugía | Compuesto de muerte+IAM+ACV. CV=13,1% vs. Cirugía =16,3% p=0,43 | - |
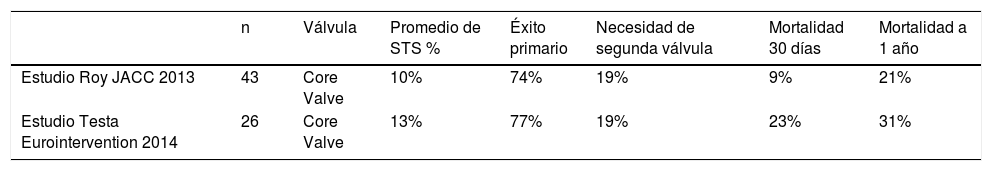
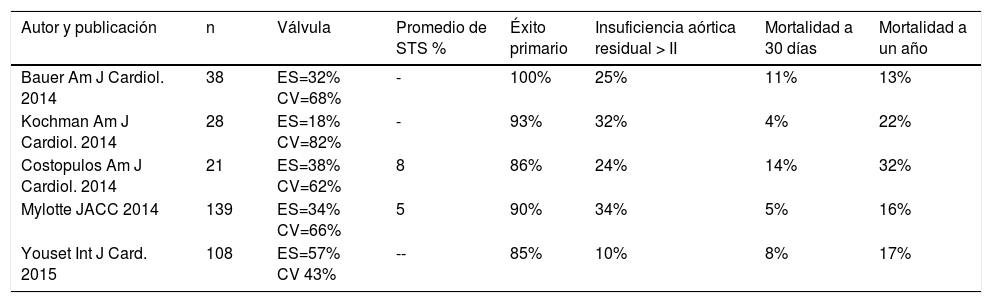
Se refiere a otras indicaciones en las cuales se usa la terapia de TAVI en el marco de pacientes considerados por la “junta médico quirúrgica” de riesgo quirúrgico prohibitivo (inoperables) o de alto riesgo quirúrgico, y son: insuficiencia aórtica (tabla 3), TAVI en aorta bicúspide (tabla 4) e implante valvular aórtico en prótesis aórtica degenerada (tabla 5).
TAVI en insuficiencia aórtica
| n | Válvula | Promedio de STS % | Éxito primario | Necesidad de segunda válvula | Mortalidad 30 días | Mortalidad a 1 año | |
|---|---|---|---|---|---|---|---|
| Estudio Roy JACC 2013 | 43 | Core Valve | 10% | 74% | 19% | 9% | 21% |
| Estudio Testa Eurointervention 2014 | 26 | Core Valve | 13% | 77% | 19% | 23% | 31% |
STS=“Society of Thoracic Surgeons”.
TAVI en aorta bicúspide
| Autor y publicación | n | Válvula | Promedio de STS % | Éxito primario | Insuficiencia aórtica residual > II | Mortalidad a 30 días | Mortalidad a un año |
|---|---|---|---|---|---|---|---|
| Bauer Am J Cardiol. 2014 | 38 | ES=32% CV=68% | - | 100% | 25% | 11% | 13% |
| Kochman Am J Cardiol. 2014 | 28 | ES=18% CV=82% | - | 93% | 32% | 4% | 22% |
| Costopulos Am J Cardiol. 2014 | 21 | ES=38% CV=62% | 8 | 86% | 24% | 14% | 32% |
| Mylotte JACC 2014 | 139 | ES=34% CV=66% | 5 | 90% | 34% | 5% | 16% |
| Youset Int J Card. 2015 | 108 | ES=57% CV 43% | -- | 85% | 10% | 8% | 17% |
ES= Edward Sapien, CV= Core Valve, STS= “Society of Thoracic Surgeons”.
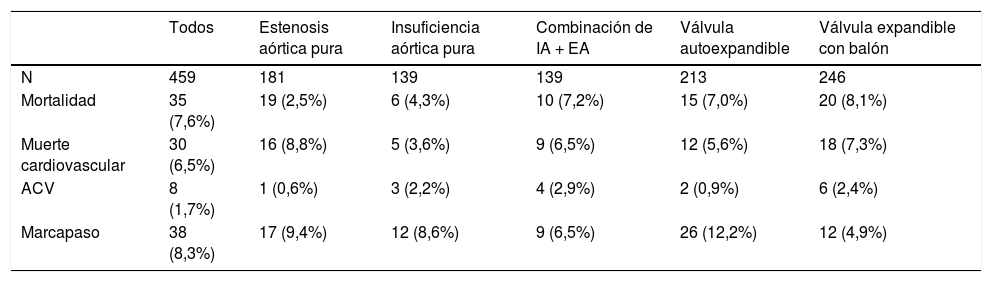
“TAVI en prótesis biológicas degenerada (o disfuncionante). For the Valve-in-Valve International Data Registry Investigators”28
| Todos | Estenosis aórtica pura | Insuficiencia aórtica pura | Combinación de IA + EA | Válvula autoexpandible | Válvula expandible con balón | |
|---|---|---|---|---|---|---|
| N | 459 | 181 | 139 | 139 | 213 | 246 |
| Mortalidad | 35 (7,6%) | 19 (2,5%) | 6 (4,3%) | 10 (7,2%) | 15 (7,0%) | 20 (8,1%) |
| Muerte cardiovascular | 30 (6,5%) | 16 (8,8%) | 5 (3,6%) | 9 (6,5%) | 12 (5,6%) | 18 (7,3%) |
| ACV | 8 (1,7%) | 1 (0,6%) | 3 (2,2%) | 4 (2,9%) | 2 (0,9%) | 6 (2,4%) |
| Marcapaso | 38 (8,3%) | 17 (9,4%) | 12 (8,6%) | 9 (6,5%) | 26 (12,2%) | 12 (4,9%) |
IA= insuficiencia aórtica, EA= estenosis aórtica, ACV= ataque cerebrovascular.
La Publicacion de Dvir (tabla 5)28, es un registro multinacional que englobó a 55 centros diferentes e incluyó en total 459 pacientes con prótesis biológicas degeneradas tratados con TAVI. El principal aporte del registro, adicional a que los datos concuerdan con los previos en cuanto a supervivencia, es la relevancia de la clasificación en función del tamaño de las prótesis biológicas a las que se practicará un Valve in Valve. En este registro, las prótesis valvulares se clasificaron en función del tamaño en pequeñas (≤ 21mm; 29,7%), intermedias (> 21 y < 25mm; 39,3%) y grandes (≥ 25mm; 31%).
El ecocardiograma como método de diagnóstico inicial de estenosis aórtica severaLa ecocardiografía Doppler es la técnica preferida para valorar la gravedad de la estenosis aórtica. En la práctica clínica diaria, los parámetros de ecografía Doppler más útiles para la cuantificación de la estenosis son la velocidad transvalvular aórtica máxima, el gradiente de presión transvalvular medio y el cálculo del área valvular mediante la ecuación de continuidad29. Se ha determinado que la estenosis valvular aórtica es grave30 cuando la velocidad transvalvular aórtica máxima supera los 4 m/s, el gradiente transvalvular aórtico medio es > 40mm Hg y el área valvular aórtica es < 1cm2. Cuando el área valvular es < 0,8cm2 la estenosis aórtica se considera crítica. En pacientes con una superficie corporal pequeña, es recomendable calcular el área valvular indexada por la superficie corporal. Un área valvular < 0,6cm2/m2, se considera grave.
Momento para intervenir la estenosis aórtica de acuerdo con guíasLas recomendaciones son válidas tanto para el reemplazo valvular aórtico en cirugía como para el remplazo valvular aórtico percutáneo (TAVI)31.
- 1.
Las guías recomiendan intervenir a todo paciente con estenosis aórtica severa si tiene cualquier síntoma secundario a la estenosis. En ausencia de comorbilidades importantes que limiten la esperanza o la calidad de vida, el cambio valvular aórtico está indicado para pacientes con estenosis aórtica severa sintomática. La edad no es una contraindicación para la cirugía.
- 2.
Cuando los síntomas aparecen en la prueba de esfuerzo, la recomendación de intervenir sigue siendo de clase I, y si durante la prueba de esfuerzo se produce una disminución de la presión arterial sistólica por debajo de la basal o cuando el incremento no es mayor a 20mm Hg respecto al valor basal, la recomendación es de clase IIa.
- 3.
La intervención también tiene nivel de recomendación clase I para pacientes asintomáticos con estenosis aórtica severa pero con disfunción del VI (fracción de eyección < 50%).
- 4.
El reemplazo valvular aórtico está indicado para pacientes con estenosis aórtica moderada o severa que requieren cirugía cardiaca por cualquier otra razón (aneurisma de aorta ascendente, cirugía de revascularización coronaria u otra valvulopatía). Se trata de recomendaciones de clase IIa y I respectivamente.
- 5.
Las guías también recomiendan la intervención (clase IIa) para pacientes asintomáticos con estenosis aórtica muy severa o crítica con área valvular menor de 0,8cm2 y bajo riesgo quirúrgico (puntuación < 4% -STS- en la escala de riesgo de la “Society of Thoracic Surgeons”). Para los pacientes con estenosis aórtica severa sintomática de bajo flujo y bajo gradiente y fracción de eyección del VI reducida, el tipo de recomendación está en función del resultado de la ecocardiografía de estrés con dobutamina.
- 1.
Junta médico quirúrgica (“heart team”): selecciona los pacientes para TAVI; está conformada por un cardiólogo clínico, un hemodinamista, un experto en imagen cardiaca y un cirujano cardiaco. La conducción del procedimiento en sala de Hemodinamia debe estar a cargo de un cardiólogo intervencionista que es la persona que más experiencia tiene en el manejo de catéteres y dispositivos endovasculares.
- 2.
Método para confirmar el diagnóstico de estenosis aórtica: la ecocardiografía es la técnica de imagen que permite la cuantificación de la gravedad de la estenosis aórtica. La guía europea de valvulopatías31 establece como criterios de gravedad un área valvular aórtica < 1cm2 o un índice de área < 0,6cm2/m2 y un gradiente medio > 40mm Hg. En casos con depresión de la función ventricular y bajo gradiente, puede ser necesaria una ecocardiografía con dobutamina para verificar la gravedad de la estenosis.
- 3.
Metodo para planear el implante aórtico: el mejor método para planear la intervención es la angioTAC de aorta con multidetectores con cortes para evaluar tracto de salida del VI, anillo aórtico, aorta ascendente y todo el eje aórtico y accesos vasculares. Se debe realizar:
- a.
Evaluación del tamaño del anillo valvular aórtico: sin duda, uno de los aspectos fundamentales en la selección de los pacientes candidatos a TAVI es determinar el tamaño del anillo valvular aórtico y, por lo tanto, el tamaño de la prótesis que se debería implantar. La reproducibilidad de la medida del anillo valvular aórtico es superior en la angioTAC vs. otros métodos ETE, ETT y angiografía32; por tanto la medición del anillo con angiotomografía es el patrón de oro para determinar el diámetro del anillo.
- b.
Valoración de los senos coronarios y del calcio paravalvular: con frecuencia, la estenosis aórtica grave se acompaña de calcificación de las sigmoideas con masas de calcio que se extienden dentro del plano del anillo. La angiotomografía sin contraste es la técnica de imagen de elección para la detección y la cuantificación de calcio. El grado de calcificación de los velos aórticos en la angioTAC previo al implante (> 2.000-3.000 unidades de Agatston) se correlaciona significativamente con el riesgo de complicaciones como insuficiencia residual33.
- c.
Valoración de la raíz aórtica y las coronarias: la distancia del anillo aórtico a los ostium coronarios, el tamaño de los senos coronarios, así como la profundidad de los senos valvulares, son datos importantes para planificar la estrategia durante el implante y disminuir el riesgo de obstrucción de la coronaria por la parte superior de la prótesis.
- d.
Plano de implantación valvular: la colocación coaxial del TAVI dentro del anillo aórtico requiere que la imagen de la fluoroscopia muestre un plano perfectamente ortogonal al del anillo. La naturaleza tridimensional de los datos de la angiotomografía permite valorar la posición del anillo dentro del paciente desde la posición neutra (el plano coronal de la angiotomografía equivale a un angiograma con el paciente en decúbito supino y el tubo sin angular) y modificar la angulación cráneo-caudal y lateral de la proyección hasta obtener un plano perfectamente transversal al del anillo34,35, idéntico al que se obtendría tras un angiograma biplanar. La posición ideal es la que alinea los bordes inferiores de las cúspides de los tres senos con el seno derecho parcialmente visible entre el seno no coronariano y el izquierdo.
- e.
Elección de la vía de implante: la angiotomografía permite realizar un estudio de toda la anatomía vascular relevante al TAVI. Ayuda a determinar la mejor vía de acceso.
- f.
Tratamiento de enfermedad coronaria en pacientes para TAVI: Snow et al.36 evaluaron el impacto de la enfermedad coronaria concomitante en pacientes remitidos para TAVI. Se informó enfermedad coronaria en 1.171 pacientes con compromiso del tronco principal izquierdo en el 12,4% de la cohorte (n = 145). La mayoría de los pacientes estaban libres de dolor en el pecho, pero limitado por la disnea (NYHA clase III y IV 81,9%). Sin embargo, la angina fue más frecuente en los pacientes con enfermedad coronaria (p <0,0001). La angioplastia + stent se recomienda en pacientes con lesiones del tronco coronario izquierdo o vasos principales en su tercio proximal.
- g.
Terapia antiagregante después de implante valvular: posterior a la implantación de la válvula aórtica con catéter (TAVI) la terapia antiplaquetaria dual (DAPT) con ácido acetilsalicílico y clopidogrel es una práctica común para reducir las complicaciones. En los casos que además el paciente requiera una anticoagulación formal (por ejemplo pacientes con fibrilación auricular), se prefiere la combinación clopidogrel + warfarina de forma indefinida o por lo menos mientras persista la indicación para anticoagular al paciente.
Ninguno.