Gracias a los avances en la terapia contra el cáncer que han incrementado la sobrevida de las mujeres, los efectos cardiovasculares de dicha terapia oncológica se conocen cada día más; estos efectos no solo se relacionan con la disfunción ventricular sino con todo el aparato cardiovascular. Las complicaciones cardiovasculares durante el tratamiento incluyen: insuficiencia cardiaca, arritmias, hipertensión arterial, isquemia miocárdica, pericarditis, entre otras. Se han determinado dos tipos de toxicidad: la tipo I, típica de los antracíclicos que generalmente es irreversible, y la tipo II producida por el trastuzumab que es reversible.
La estrategia principal es la estratificación del riesgo de las pacientes que recibirán quimioterapia, prevenir su aparición e intervenir, con el propósito de obtener un control adecuado de las posibles complicaciones y de esta forma facilitar al grupo de oncología completar exitosamente el tratamiento establecido. Esta estrategia de prevención, seguimiento y tratamiento debe realizarse antes, durante y después del tratamiento oncológico. La realización de un ecocardiograma con evolución de la fracción de eyección (FE) y preferiblemente evaluación de la deformación longitudinal global (GLS: Global Longitudinal Strain) basalmente para futuras comparaciones es imperativa. Por otra parte, biomarcadores como las troponinas y el péptido natriurético tipo B (BNP), mejoran la sensibilidad y especificidad para la detección de la cardiotoxicidad. Las opciones de tratamiento son enalapril, candesartán, carvedilol, nebivolol y estatinas. Se recomienda el manejo en equipo a cargo de un grupo de Cardio-Oncología.
Thanks to the advances in cancer treatment which have increased women's survival rates, the cardiovascular effects of this oncological therapy are seen more and more. These effects are not just related to ventricular dysfunction, but also to the entire cardiovascular apparatus. Cardiovascular complications during treatment include: heart failure, arrhythmias, arterial hypertension, myocardial ischemia and pericarditis, among others. Two types of toxicity have been defined: type I, typical of anthracyclines, which is generally irreversible; and type II, produced by trastuzumab, which is reversible.
The main strategy is risk stratification in patients who will receive chemotherapy, prevention of its occurrence, and intervention, in order to gain adequate control of possible complications, and thus aid the oncology group in successfully completing the established treatment. This prevention, follow up and treatment strategy should be carried out before, during and after cancer treatment. A baseline echocardiogram with ejection fraction (EF) evolution and, preferably, evaluation of the global longitudinal strain (GLS), for future comparisons, is imperative. Additionally, biomarkers such as troponins and B-type natriuretic peptide (BNP) improve the sensitivity and specificity of cardiotoxicity detection. Treatment options are enalapril, candesartan, carvedilol, nebivolol and the statins. Team management is recommended, led by a cardio-oncology group.
Uno de los aspectos importantes respecto a la gran cantidad de información disponible en la literatura médica, es seleccionar lo que es útil en la práctica clínica. En tal sentido, la cardiotoxicidad por quimioterapia no escapa a esta realidad. El objetivo de este capítulo es llevar al grupo de profesionales en forma sucinta, concreta y práctica lo que se conoce en este aspecto enfocado en la mujer.
Los nuevos tratamientos disponibles que han mejorado la sobrevida de las pacientes que padecen una patología oncológica, también tienen efectos secundarios principalmente sobre el aparato cardiovascular, condiciones clínicas que muchas veces no son diagnosticadas. De esta forma, los logros conseguidos por este tipo de tratamiento antineoplásico incluyen un impacto en la salud cardiovascular. Hoy se conoce que las complicaciones incluyen disfunción miocárdica, complicaciones pericárdicas, isquemia miocárdica, hipertensión tanto sistémica como pulmonar, arritmias y tromboembolia. Estas complicaciones cardiovasculares son ahora la segunda causa de morbilidad y mortalidad de los pacientes que han sobrevivido al cáncer1. Los pacientes con alto riesgo de desarrollar cardiotoxicidad deben ser evaluados por el cardiólogo y en el mejor de los casos por el grupo de Cardio-Oncología, disciplina que ha venido desarrollándose ante la necesidad de optimizar el cuidado de los pacientes para la toma de decisiones durante el tratamiento oncológico o en su sobrevida a largo plazo2.
Consideraciones epidemiológicasLas causas de muerte en Colombia son principalmente las cardiovasculares y en otros países como en los Estados Unidos le sigue en segundo lugar el cáncer. Los sitios donde la mujer desarrolla enfermedad oncológica son seno, pulmón y colon, según los datos publicados por el American Cancer Society3. Existen algunas diferencias en las que es más prevalente en la mujer el cáncer de tiroides, con una disminución de la mortalidad general del 25%; no ocurre lo mismo para el cáncer de útero, el cual se asocia fuertemente con la obesidad4. Se sabe que la cardiotoxicidad no es una complicación exclusiva en el tratamiento de las mujeres con cáncer, pero los agentes que más se relacionan con esta condición se usan en el tratamiento del cáncer de seno5. Aun se desconoce cuál es el impacto real de la cardiotoxicidad en las mujeres con cáncer de seno, si bien más de la mitad son mayores de 65 años al momento del diagnóstico, de ahí que la enfermedad cardiovascular pueda ser parte del proceso de envejecimiento, aunque el incremento de las enfermedades cardiovasculares en esta población es mayor del esperado. La evolución clínica posterior de las pacientes que sobreviven al cáncer, en especial al de seno, ha convertido a esta condición en una enfermedad crónica comparable con la cronicidad de la hipertensión arterial o a la diabetes mellitus, así que en realidad están en mayor riesgo de muerte por causas cardiovasculares que por el cáncer6; además, la cardiotoxicidad temprana puede limitar el completar un tratamiento antineoplásico efectivo.
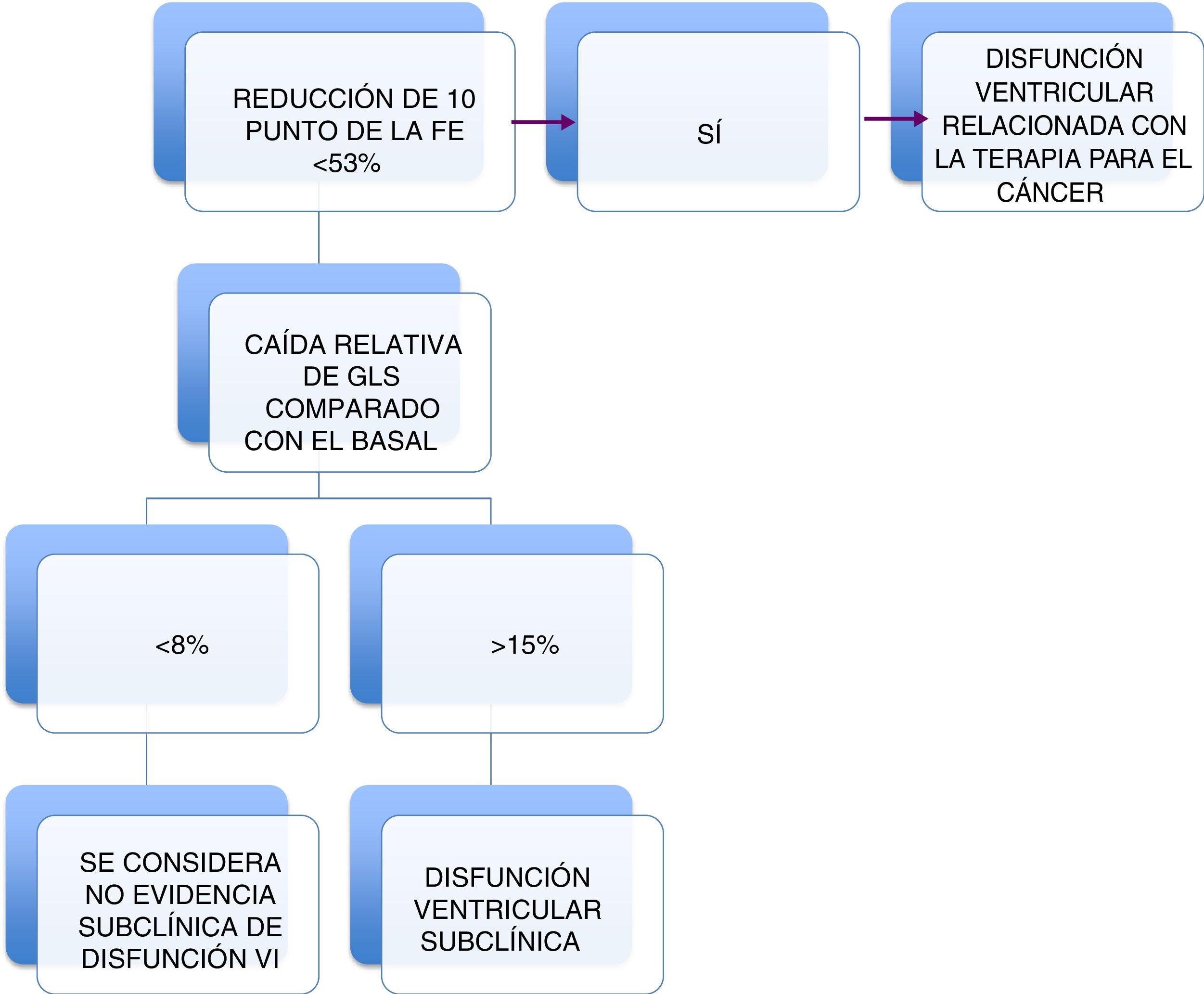
Concepto de cardiotoxicidadEste es el primer inconveniente dado que no hay un criterio único, si se tiene en consideración la definición de cardiotoxicidad del grupo de investigación y supervisión del trastuzumab7,8 o el del punto arbitrario tomado por el grupo de imagen de la Sociedad Europea de Cardiología y la Sociedad Americana de Ecocardiografía como reducción >10% de la fracción de eyección del ventrículo izquierdo (FEVI) a la que se agrega presentación o no de síntomas9. Este concepto solo hace referencia a la disfunción ventricular relacionada con la quimioterapia, por lo que una definición más amplia de la cardiotoxicidad debería incluir todo el espectro de las complicaciones cardiovasculares del tratamiento oncológico y considerar otras opciones diagnósticas de imagen y la anormalidad de los biomarcadores10. Por consiguiente, la cardiotoxicidad no solo se refiere a la disfunción ventricular sino a todo el complejo clínico de complicaciones cardiovasculares del tratamiento para el cáncer, que también incluye a la radioterapia. Acorde con el comité de expertos comentado en la evaluación de la multimodalidad de imagen en pacientes adultos antes y después del tratamiento del cáncer, la disfunción ventricular relacionada a la terapia del cáncer (Cancer Therapy–Related Cardiac Dysfunction and Heart Failure- CTRCD su sigla en inglés) se define como una disminución en la FEVI >10 puntos porcentuales, a un valor <53% (valor de referencia normal para la ecocardiográfica bidimensional (2D) con o sin síntomas de insuficiencia cardiaca, que es la definición adoptada en el momento.
Tipos de disfunción ventricular relacionada con la terapia del cáncerEsta condición anatomoclínica en la que el miocardio se ve afectado, se ha agrupado en dos tipos (tabla 1).
Este tipo de lesión miocárdica con daño celular típicamente irreversible lleva a la muerte celular, mediado por los radicales libres. La antraciclina, el representante de este grupo de medicamentos, forma un radical, la semiquinona, que se oxida rápidamente y genera una cantidad importante de peróxido de hidrógeno que al no ser catalizado de manera correcta, interactúa con el miocardio que es susceptible al daño11; son efectos dosis dependientes, con algún grado de predisposición genética y de la condición cardiaca basal del paciente. El factor más predecible que hace que un individuo tenga mayor susceptibilidad a una lesión cardiaca inducida por antraciclinas, es una historia de pérdida de reservas cardíacas de cualquier causa o experiencia previa de cualquier condición que comprometa la capacidad del cardiomiocito de tolerar un aumento del estrés en la pared o una lesión tóxica.
Tipo IIEste tipo de toxicidad generalmente no es dosis dependiente, reversible y sin daños ultraestructurales. El trastuzumab es la droga representativa de este tipo de efecto. Aquí el mecanismo más importante es el bloqueo de las vías de reparación celular, por otra parte inhibe la angiogénesis lo que lleva finalmente a la muerte y reducción de la recuperación funcional12.
Farmacología de las células tumoralesReunido en el grupo de la ciclosporina con efectos cardiacos, el 5 fluorouracilo (5 FU), es el medicamento que actúa inhibiendo la síntesis del material genético al ser similar a las pirimidinas. El 5-FU se usa en el tratamiento del cáncer de mama. Puede ocasionar un síndrome coronario agudo, que puede ir desde angina inestable hasta infarto agudo de miocardio (IAM), efecto relacionado con vasoespasmo, trombosis y alteraciones metabólicas, dependiente de la dosis y la velocidad de administración13.
Los agentes alquilantes (las primeras drogas utilizadas para tratar el cáncer) favorecen una unión fuerte del nitrógeno de la guanina del ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN) por lo que inhibe el proceso de replicación celular, produciendo principalmente miopericarditis como su efecto adverso cardiovascular más significativo.
El trastuzumab descrito previamente junto con el bevacizumab, pertenecen al grupo de los llamados anticuerpos monoclonales. El último se usa en el tratamiento de cáncer de seno y de ovario; su efecto es inhibir una serie de enzimas que promueven la división celular no controlada. El trastuzumab inhibe los receptores de factor de crecimiento epidérmico humano (HER- su sigla en inglés-), en cuyo caso, el subtipo dos (HER2) es un marcador y predictor de pronóstico en las mujeres con cáncer de seno. El resultado final de la estimulación del HER es la proliferación celular. El bevacizumab inhibe el factor de crecimiento derivado de las plaquetas y el endotelio vascular, lo que ocasiona la reducción de la angiogénesis y la metástasis del tumor.
Se encuentran también terapias oncológicas disponibles que inhiben una familia de enzimas llamadas inhibidores de la tirosina-quinasa. Su efecto final es la proliferación celular, los efectos antiapoptóticos y la promoción de la angiogénesis. A este grupo pertenece una subclase llamada pequeñas moléculas inhibidoras de la tirosina-quinasa, de las cuales el lapatinib se usa en el tratamiento del cáncer de mama metastásico. Los datos indican que el efecto de la disfunción ventricular, es más bajo que el observado con el trastuzumab.
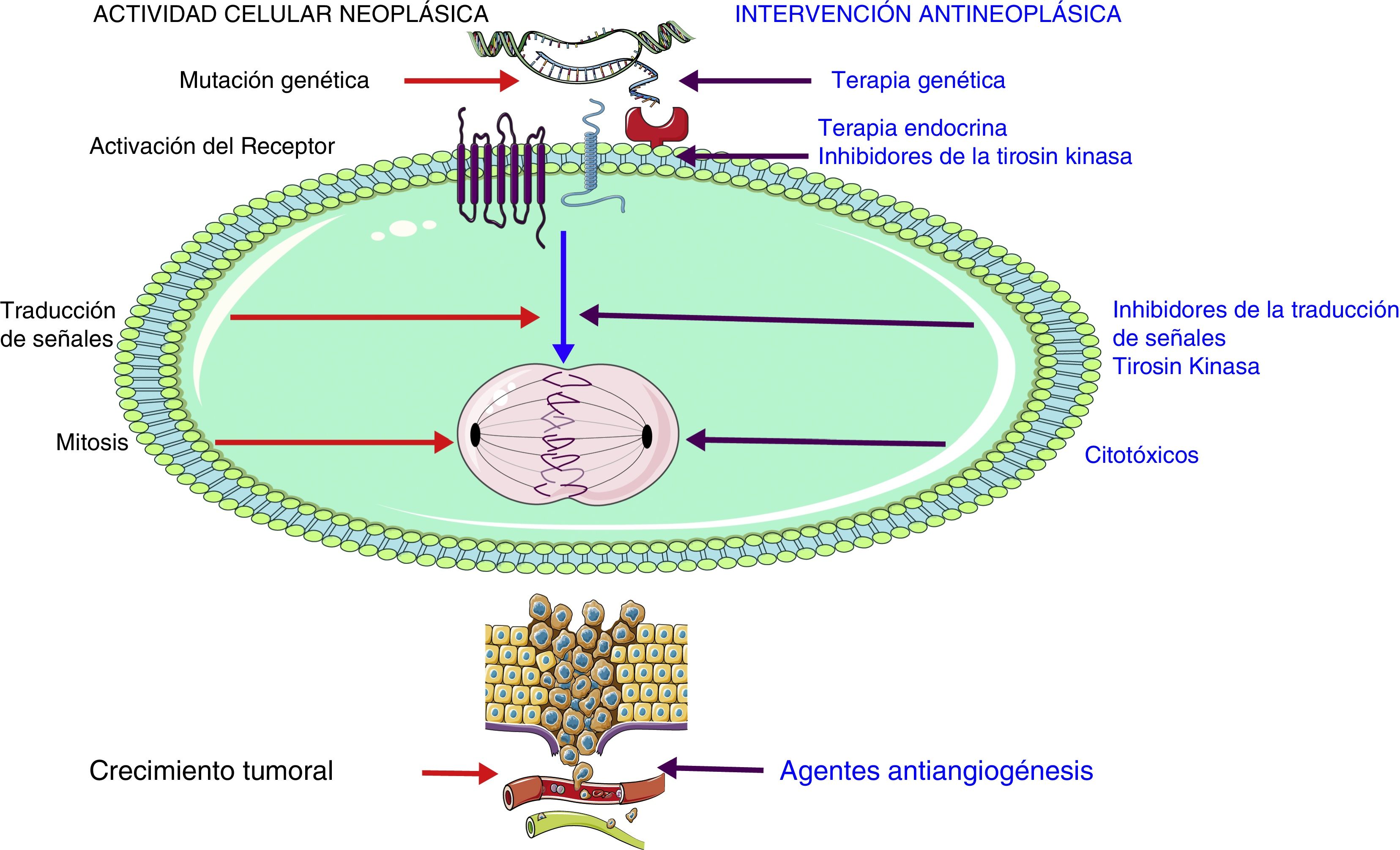
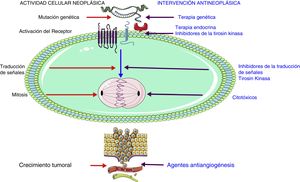
La mitosis celular necesita de la formación y ensamblaje de unas estructuras conocidas como microtúbulos, que forman el huso mitótico. Su función primordial es conducir los microsomas durante la duplicación celular en cada una de las células hijas. Se entenderá, por tanto, que el no ensamblaje de los microtúbulos detendrá el proceso de replicación; es precisamente en este momento crucial del proceso mitótico que es inhibido por agentes como los taxanos (paclitaxel) o los alcaloides vinca y que finalmente como consecuencia detendrá la mitosis14. Los taxanos se han vinculado con bradiarritmias y los alcaloides de la vinca con isquemia miocárdica. En la figura 1 se esquematiza el sitio de acción de los diferentes medicamentos antineoplásicos.
Enfoque clínicoCon base en lo anterior, se comprende que el compromiso cardiovascular de la terapia oncológica tiene un impacto clínico que ha venido tomando importancia y ha llamado la atención de oncólogos y cardiólogos, con el objetivo de mejorar el conocimiento del riesgo y tratamiento de estas complicaciones. Esta disciplina que ha tomado auge es la Cardio-Oncología. Dado el concepto de “puertas corredizas” por el conocimiento adquirido sobre la diversidad de efectos y mecanismos descritos anteriormente, existe una creciente conciencia de un trabajo en equipo y se impone la idea de que: “¿Es hora de que los oncólogos conozcan a sus cardiólogos?”15. Definidos ampliamente, los términos Cardio-Oncología comprenden una subespecialidad multidisciplinaria y colaborativa enfocada en prevención, manejo y mitigación de las enfermedades cardiovasculares en pacientes con cáncer para lograr resultados óptimos para el paciente.
Evaluación del riesgoEl grupo tratante debe saber que existen algunas diferencias etarias y de género que condicionan una mayor probabilidad para el desarrollo de cardiotoxicidad. Las mujeres tienen mayor riesgo de presentar eventos cardiovasculares con el uso de quimioterapia, pese a que los hombres tienen mayor posibilidad de desarrollar aterosclerosis16.
Riesgo de cardiotoxicidad para el tipo IEl conocimiento clínico completo de la paciente, es crucial para determinar el grado de riesgo para desarrollar miocardiopatía inducida por antracíclicos. La verificación de factores de riesgo cardiovascular, existencia de enfermedad cardiovascular previa, edad y conocimiento de la FE previa al tratamiento permite considerar tres categorías. Las pacientes con enfermedad cardiovascular activa y FE reducida están catalogadas en alto riesgo y no deben recibir antraciclinas. Aquellas mayores, con diabetes y enfermedad coronaria controlada son de riesgo moderado y se benefician de recibir agentes de antraciclinas liposomales —moléculas modificadas— que tienen menor potencial tóxico. Las pacientes de bajo riesgo son aquellas sin factores de riesgo que pueden recibir tratamiento con antraciclinas a dosis adecuada y monitorización ecocardiográfica periódica17. En tabla 2 se reúnen los criterios clínicos a considerar y clasificar el riesgo de desarrollar cardiotoxicidad tipo I.
Riesgo de cardiotoxicidad tipo II
| Evaluación clínica Factores de riesgo CVC Enfermedad CVC Ecocardiograma | ||
|---|---|---|
| Alto riesgo | Riesgo moderado | Riesgo bajo |
| Enfermedad CV activa o | 65 años | Sin factores de riesgo CV |
| FE baja | Diabetes, enfermedad coronaria controlada | |
| No antracíclicos | Antracíclicos liposomales | Antracíclicos |
CV: cardiovascular
Se han identificado algunos factores de riesgo para la toxicidad con inmunoterapia con anticuerpos monoclonales, que, como se ha comentado, bloquean el HER2 (inhibition of human epidermal growth factor receptor 2). Por consiguiente, se recomienda verificar en esta población:
- •
Exposición previa a antracíclicos
- •
Hipertensión preexistente
- •
Fracción de eyección baja
- •
Edad >65 años
El mecanismo por el cual los inhibidores HER2 producen cardiotoxicidad, subyace en los cambios funcionales y estructurales en las proteínas contráctiles y la mitocondria, que raramente producen la muerte celular, lo que explica su potencial reversibilidad. La interrupción de la administración de trastuzumab se asocia con recurrencia del cáncer en las pacientes con cáncer de seno y HER2-positivo. En la mayoría de estudios suspenden el tratamiento cuando aparece insuficiencia cardiaca o la función ventricular es menor del 45% (FEVI)18.
Existen otras condiciones que predisponen a mayor riesgo de toxicidad. Se debe tener en cuenta el otro extremo etario, la edad pediátrica y la edad menor a 18 años, la existencia de disfunción renal, radioterapia previa sobre la zona cardiaca y quimioterapia concomitante. Se ha propuesto que el polimorfismo genético predispone a la cardiotoxicidad a dosis relativamente bajas de ciertos medicamentos, como se ha descrito en pacientes pediátricos.
A la fecha no ha habido un consenso sobre la adopción de un score para la predicción del riesgo de toxicidad19. No obstante, se recomienda la evaluación de los factores de riesgo cardiovascular tradicionales como rutina de trabajo en todas las pacientes, antes, durante y después de recibir tratamiento para el cáncer20.
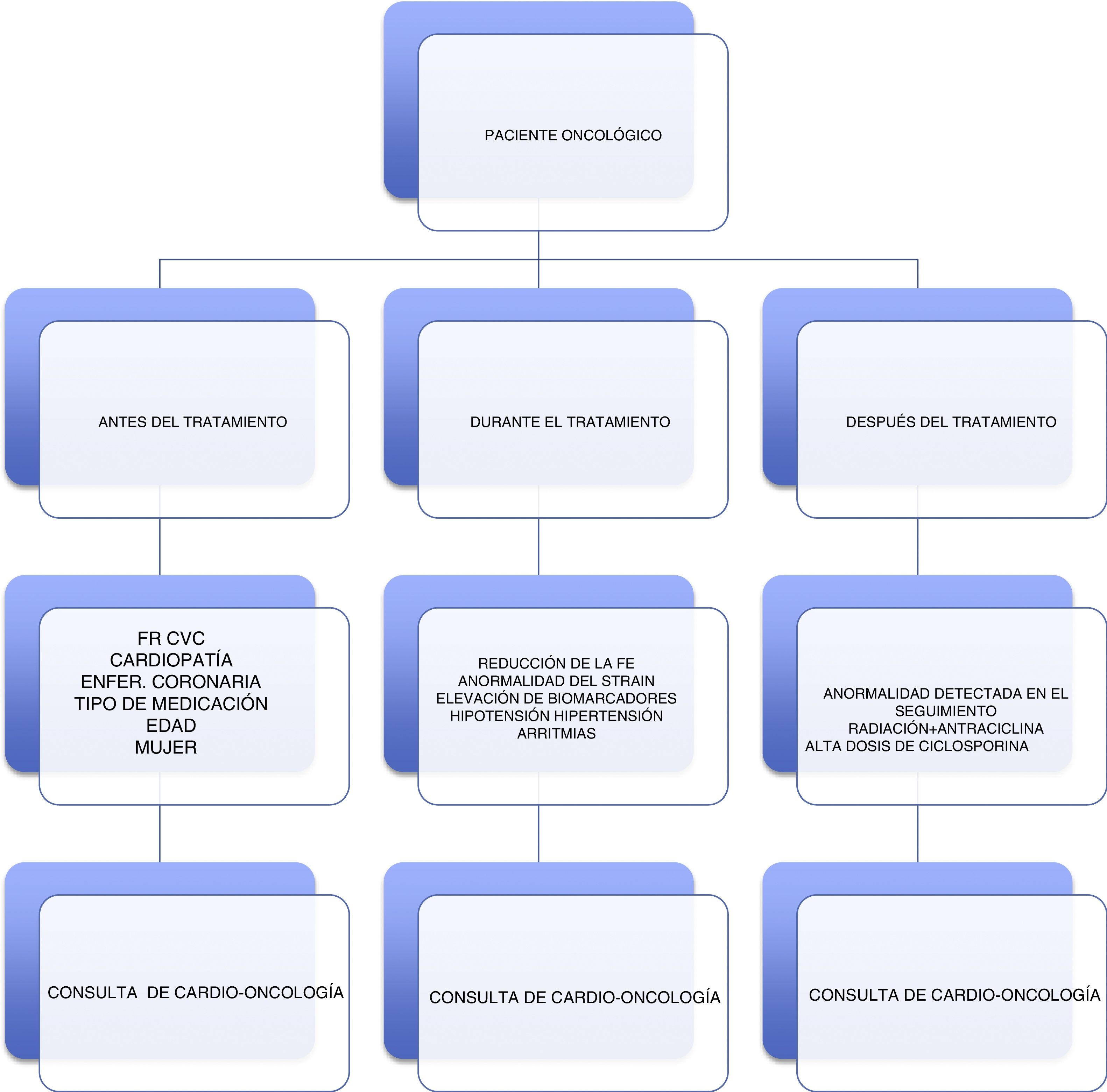
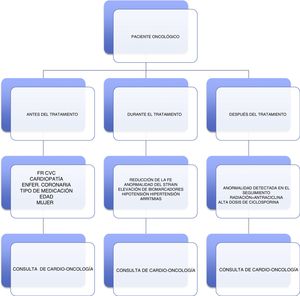
Evaluación de la cardiotoxicidadLa valoración multidisciplinaria entre Cardiología y Oncología es necesaria para la evaluación y el manejo a corto y largo plazo de las complicaciones cardiovasculares relacionadas con el tratamiento del cáncer. Como recomendación general, a todas las pacientes se les hará una historia clínica completa, un electrocardiograma y un ecocardiograma con evaluación del GLS. Previo al tratamiento se evaluarán los factores de riesgo cardiovascular, durante y después del tratamiento, así como la existencia de complicaciones cardiovasculares con la participación conjunta del cardiólogo y oncólogo, como lo recomienda la Mayo Clinic21 (fig. 2). Se recomienda hacer un ecocardiograma a las pacientes que recibirán medicación cardiotóxica, a fin evaluar la función ventricular20.
Los biomarcadores están siendo utilizados de manera no rutinaria para la identificación temprana, la estratificación del riesgo y la monitorización de la cardiotoxicidad relacionada con la quimioterapia. En el tratamiento del cáncer de seno, la troponina es un marcador sensible y específico de lesión miocárdica de los pacientes tratados con quimioterapia. Lo mismo ocurre con el péptido natriurético (BNP). Varios estudios indican que el incremento de los niveles de troponina y del BNP, indican lesión subclínica22. El punto a remarcar es que el uso de biomarcadores incrementa el valor predictivo de la disfunción ventricular asociada a la quimioterapia. Por otra parte, se recomienda el uso seriado de biomarcadores para la detección temprana de la cardiotoxicidad por quimioterapia.
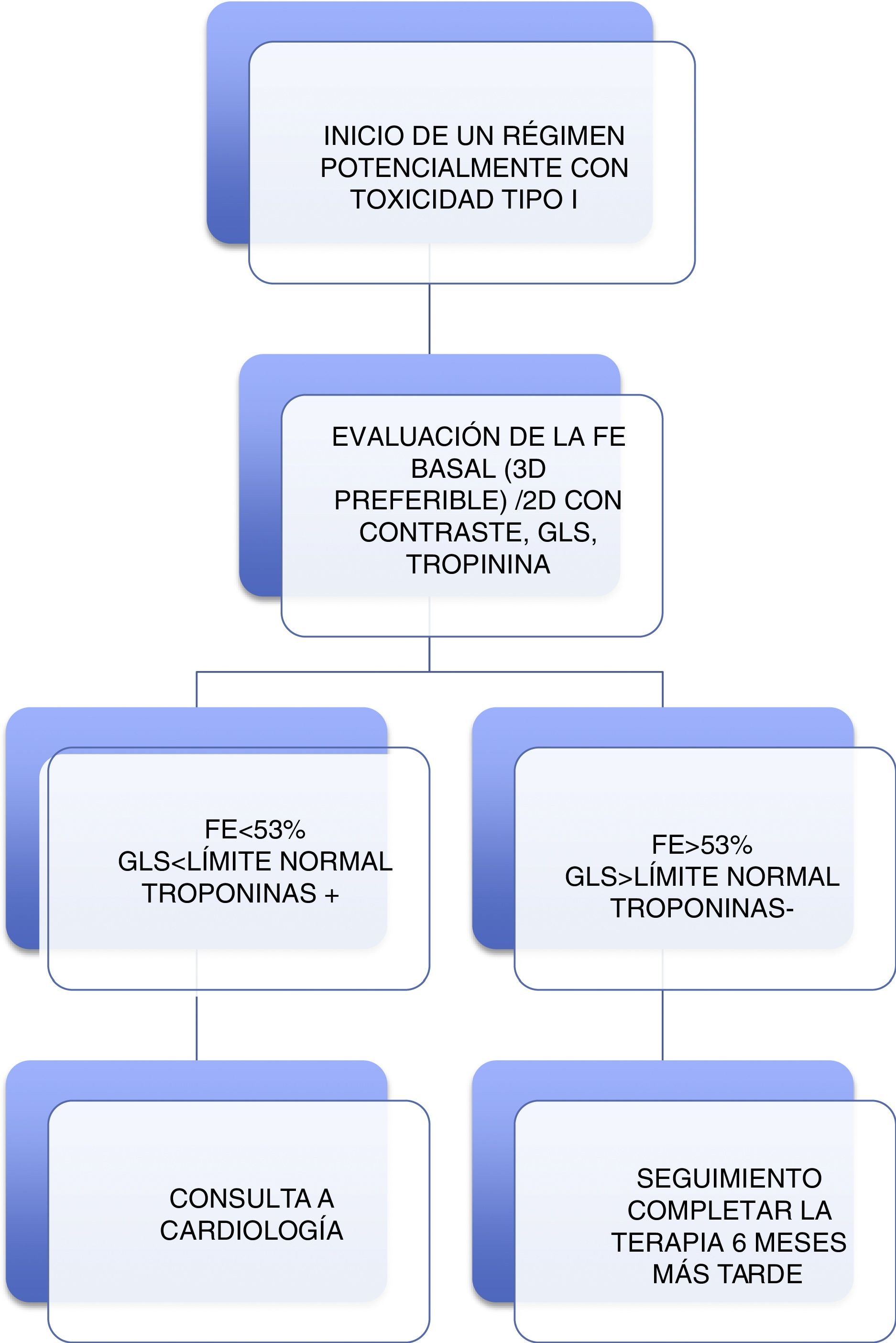
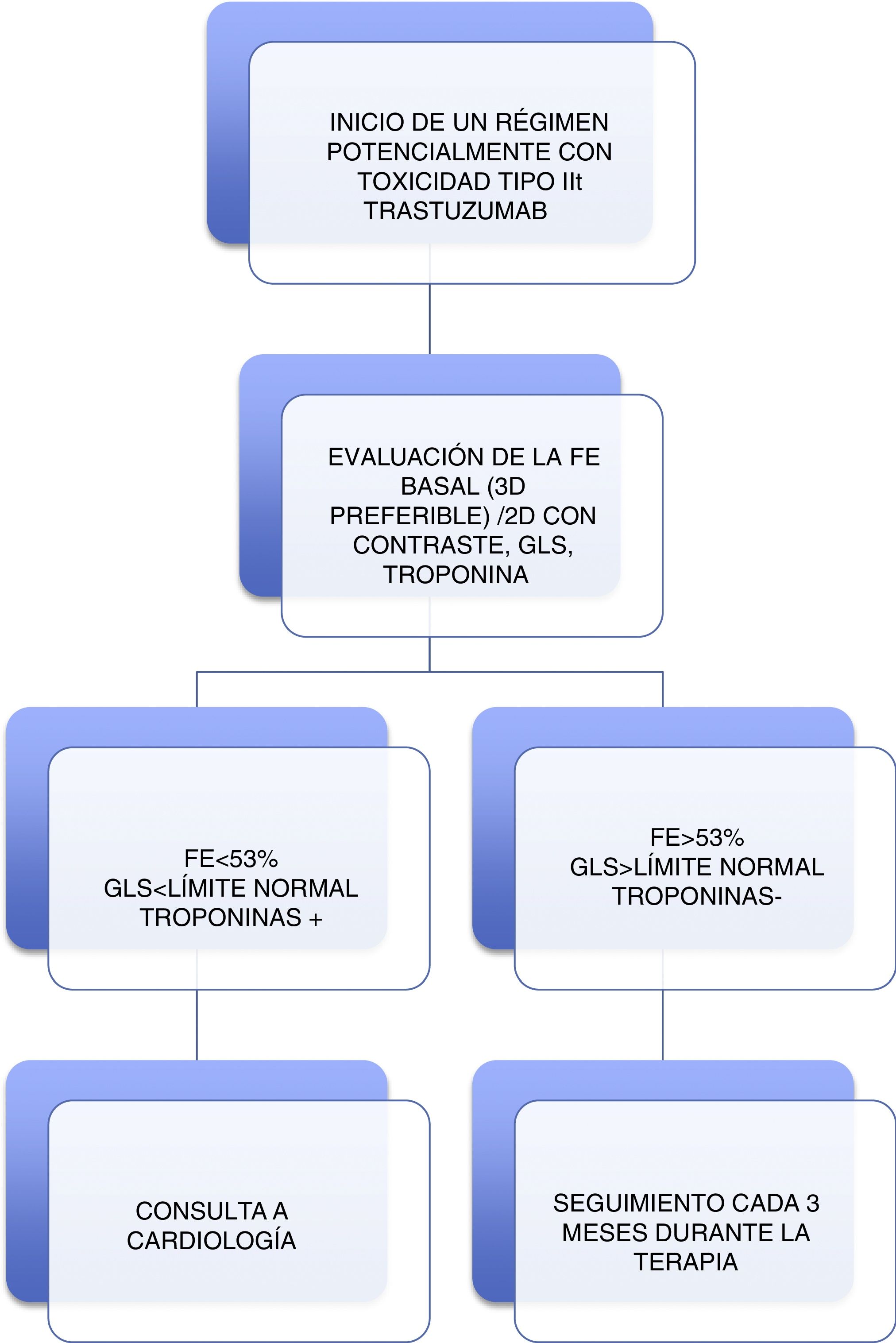
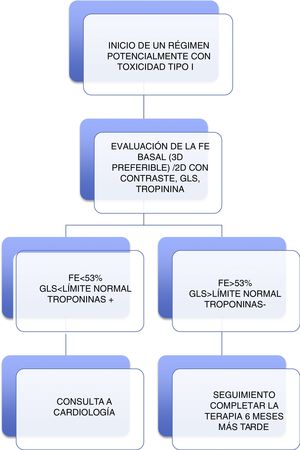
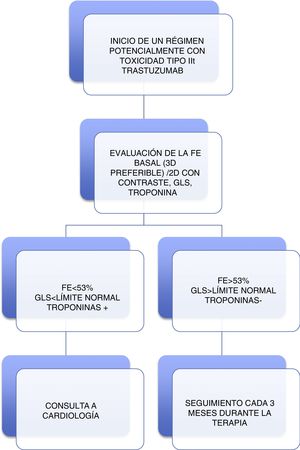
La evaluación de quienes recibirán terapia con un potencial riesgo de cardiotoxicidad tipo I, se representa en la figura 3, en la cual se puede apreciar que es crucial la evaluación de la función ventricular y la monitorización de biomarcadores. Se recomienda, así mismo, una evaluación basal que incluya mediciones de FE, GLS y troponina. Si alguno de estos parámetros es anormal, se recomienda una consulta de Cardiología. Se indica el seguimiento al finalizar el tratamiento y seis meses después para dosis <240mg /m2 o su equivalente. Una vez superada esta dosis, se continúan las medidas de FE, GLS y troponina antes de cada dosis adicional de 50mg/m2. Para los pacientes en quienes se inicia terapia del tipo trastuzumab, se indica una evaluación basal que incluya medidas de FE, GLS y troponina. Si alguno es anormal, se recomienda una consulta de Cardiología. Se ordenan mediciones de FE, GLS y troponinas cada tres meses9.
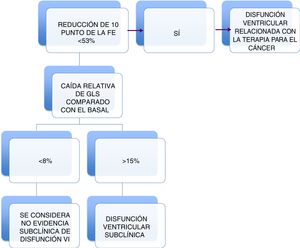
El reto de poder identificar a los pacientes que tienen compromiso subclínico es la estrategia ideal. En tal sentido, el grupo de expertos recomienda que para la detección de la disfunción subclínica del ventrículo izquierdo, se deben comparar las mediciones de GLS obtenidas durante la quimioterapia con la obtenida en el primer estudio basal permitiéndole al paciente servir como su propio control. Es probable que un porcentaje relativo de reducción en el GLS >15% sea anormal, mientras que un cambio de <8% no parece tener importancia clínica (fig. 4). El valor anormal de GLS debe confirmarse mediante un estudio repetido, el cual se hará de dos a tres semanas después del estudio anormal inicial.
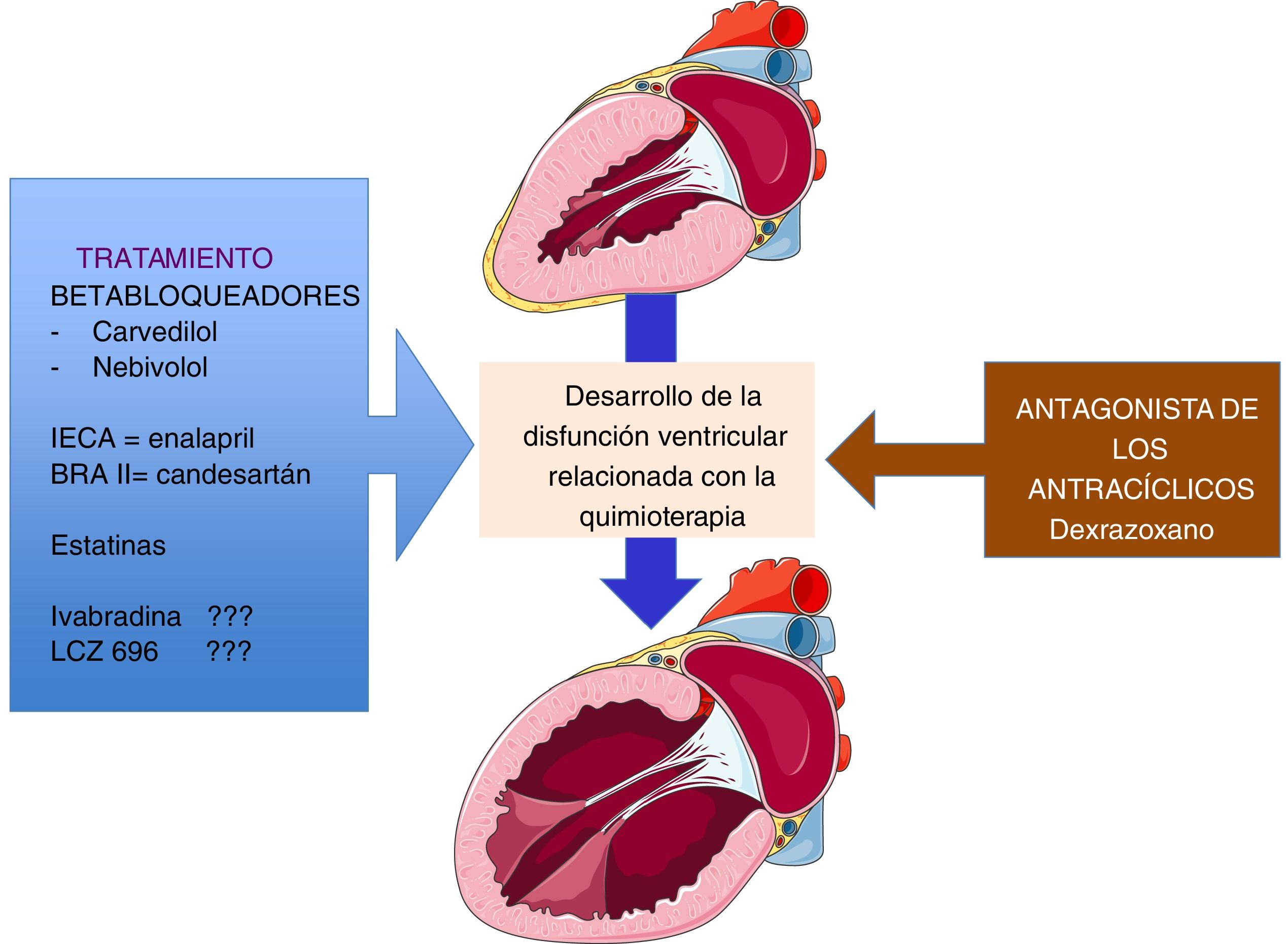
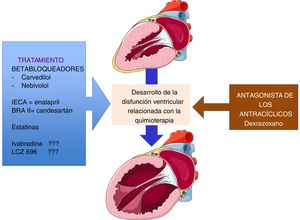
Prevención y tratamientoPueden considerarse las estrategias de prevención primaria para evitar el desarrollo de insuficiencia cardiaca, isquemia miocárdica, arritmia, hipertensión arterial o tromboembolia arterial, y deben ser la premisa fundamental en todas las pacientes que reciben tratamiento potencialmente cardiotóxico. Algunos estudios han publicado que el uso de inhibidores de la enzima convertidora de angiotensina (IECA), bloqueadores de los receptores de la angiotensina II (BRA II), betabloqueadores (BB), estatinas y dexrazoxane tienen efecto beneficioso; no obstante, tampoco hay un consenso para su uso rutinario (fig. 5).
El uso de los IECA es más aceptado ención de troponinas al inicio de la quimioterapia; en este sentido el estudio publicado mostró beneficios23. De los BRA II, el estudio PRADA (PRevention of cArdiac Dysfunction during Adjuvant breast cancer therapy) demostró, en mujeres con cáncer de seno, que el candesartán pero no el metoprolol administrado de forma concomitante durante la quimioterapia puede preservar la FE24,25. Los posibles mecanismos por los que la modulación del sistema renina-angiotensina-aldosterona (SRAA) es beneficiosa, se explica por la atenuación del estrés oxidativo, la reducción de la fibrosis intersticial y la regulación a la baja del sistema de las NRG-1/ErbB; sistema de señalización celular del cardiomiocito que inhibe el factor de crecimiento celular y la sobrevida de los cardiomiocitos26. Recuérdese que en él se ha demostrado que la neurregulina-1 (NRG-1), un factor de crecimiento cardioactivo liberado de las células endoteliales, es indispensable para la función normal del corazón del adulto al unirse a los receptores ErbB4 en los cardiomiocitos27.
De otra parte, los betabloqueantes han mostrado su beneficio; de estos solo el carvedilol y el nebivolol son los que han conseguido una mejor preservación de la FE cuando se usan en forma concomitante al inicio de la terapia con antracíclicos28. Por lo visto, hasta el presente, la evidencia disponible con el uso de los beta-bloqueantes es prometedora, pero parece depender del tipo de betabloqueador utilizado. Por otra parte, se sugiere que es crucial el momento de la iniciación del betabloqueador, ya que el tratamiento concomitante con este desde el inicio de la quimioterapia, tiene el mayor potencial29.
El último “jugador”, nombre con que se le conoce a la aldosterona por el eje del SRAA, ha mostrado también ser beneficioso en preservar la función ventricular en las pacientes con cáncer de seno cuando se usa en forma simultánea con los antracíclicos30. Finalmente, también se han usado las estatinas con base en las observaciones de que los pacientes que por alguna circunstancia la estaban usando en el momento de la quimioterapia tenían una mayor preservación de la función ventricular31. Otros tratamientos disponibles en insuficiencia cardiaca, como la ivabradina y el LCZ-696 (próximo a comercializarse en Colombia), pueden ser potencialmente beneficiosos pero aún se desconoce su efecto real (fig. 6).
El único medicamento que ha sido aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos para la prevención de la cardiotoxicidad relacionada con la antraciclina es el dexrazoxano, que es un agente similar al ácido etilendiaminotetracetico (EDTA) que actúa como quelador del hierro y por tanto inhibe la peroxidación de las membranas lipídicas; por este efecto actualmente se utiliza para prevenir la cardiotoxicidad inducida por antraciclinas8. Básicamente, no se utiliza en la práctica clínica debido a las preocupaciones sobre el potencial impacto negativo en la actividad antitumoral de las antraciclinas.
ConclusiónLos avances en la terapia contra el cáncer han incrementado la sobrevida de las mujeres con esta patología, pero también las posibles complicaciones inherentes al tratamiento. Esto ha generado un interés creciente por los grupos de trabajo de Cardio-Oncología. Por ahora, la disfunción ventricular relacionada con la quimioterapia es la que mayor interés ha despertado pero se debe considerar como toxicidad por quimioterapia todo el espectro de las complicaciones cardiovasculares que se pueden presentar (insuficiencia cardiaca, arritmias, HTA, isquemia miocárdica, pericarditis, etc.). Se describen dos tipos de toxicidad por quimioterapia: la tipo I, típica de los antracíclicos que generalmente es no reversible y la tipo II, típica del trastuzumab que es reversible en la mayoría de los casos. La estrategia de prevención y su seguimiento deben realizarse antes, durante y después del tratamiento oncológico. El estudio de imagen por ecocardiografía con la evolución de la FE y del GLS, así como el uso de biomarcadores como las troponinas y el BNP permiten la identificación temprana del compromiso cardiaco. Las opciones farmacológicas incluyen el uso de IECA tipo enalapril, BRA II como el candesartán y betabloqueadores como el carvedilol y el nebivolol, pero el manejo en equipo de Cardio-Oncología permitirá estimar el riesgo y planear estrategias más adecuadas para la prevención, el seguimiento y el tratamiento de la cardiotoxicidad.
Conflicto de interesesNinguno.