La enfermedad de Chagas es una entidad parasitaria ocasionada por el Tripanosoma cruzi muy prevalente en América, especialmente en América Latina. Su fase indeterminada dura entre 10 a 30 años, período en el que los pacientes no presentan síntomas y pueden emigrar a cualquier parte del mundo.
La consecuencia más relevante es la cardiopatía chagásica con diferentes manifestaciones. En muchas ocasiones la manifestación inicial de la cardiopatía es la insuficiencia cardiaca sobre un corazón dilatado lo que en ocasiones hace indispensable descartar un componente isquémico. La gammagrafía de perfusión miocárdica es una herramienta muy útil para el estudio de la cardiopatía isquémica, su alta sensibilidad permite observar defectos de perfusión diversos incluso en ausencia de la enfermedad aterosclerótica coronaria.
Presentamos el caso de un paciente con dolor torácico y enfermedad de Chagas con diversos defectos de perfusión de origen microvascular en la gammagrafía de perfusión miocárdica con evidencia de las arterias coronarias epicárdicas sanas.
Chagas disease is a parasitic entity caused by Tripanosoma cruzi with a high prevalence in America, mostly in Latin America. Its indeterminate phase lasts between 10 and 30 years. Within this period patients do not show symptoms and can migrate to anywhere in the world.
The most relevant consequence is chagasic cardiomyopathy with different manifestations. Many times the initial sign of this cardiomyopathy is cardiac insufficiency in a dilated heart, which on occasion makes it imperative to rule out an ischemic component. Myocardial perfusion scintigraphies are a useful tool to study myocardial ischemia, their high sensitivity allows to observe diverse perfusion defects, even in the absence of atherosclerotic coronary disease.
This study presents the case of a male patient with chest pain and Chagas disease showing multiple perfusion defects of microvascular origin in the myocardial perfusion scintigraphy, evidencing healthy epicardial coronary arteries.
La enfermedad de Chagas es causada por el parasito protozoario Tripanosoma cruzi. Su nombre es debido a que su descubridor fue el doctor Carlos Chagas en el año 19091,2. La transmisión está limitada a las áreas de América (norte, central y sur) y su principal vía de transmisión es la vectorial. Se puede transmitir también por las transfusiones, la vía oral, los trasplantes o la vía congénita3. Se calcula que aproximadamente 10 millones de personas están afectadas, 25 millones están en riesgo de contagio y 10.000 personas mueren al año a causa de la enfermedad4.
La consecuencia más importante de la infección es la cardiomiopatía chagásica que ocurre en 20-30% de las personas infectadas. Las fases clínicas de la enfermedad son la fase aguda que puede debutar con síntomas generales en la que el compromiso cardiaco se da en hasta el 90% de los casos por la falla cardiaca por miocarditis; la fase latente o indeterminada que dura de 10 a 30 años o durante toda la vida en la que los pacientes se presentan asintomáticos con serología positiva teniendo prácticamente todos los pacientes algún grado subclínico de compromiso cardiaco cuando se estudian mediante monitoría electrocardiográfica continua de 24 horas (Holter) y el ecocardiograma; la fase crónica en la que se presentan los signos y síntomas cardiacos de la enfermedad como: la insuficiencia cardiaca, las arritmias y los embolismos arterial o venoso.
En este contexto, la presencia del dolor torácico típico o atípico es bastante frecuente y requiere descartar la coexistencia de la enfermedad coronaria y orientar de manera adecuada su manejo4,5.
Los métodos de imagen no invasivos para el estudio de la enfermedad de Chagas incluyen: el angio-CT coronario, la resonancia nuclear magnética, la ecocardiografía y la gammagrafía de perfusión miocárdica6. La gammagrafía de perfusión miocárdica para el estudio de una posible enfermedad coronaria puede mostrar diferentes tipos de defectos, principalmente, no reversibles cuando ya existen cambios fibróticos en la miocardiopatía ya instalada. En algunos casos en los que dichos cambios típicos no se han desarrollado se pueden ver los defectos reversibles, generalmente, debidos a cambios de origen microvascular.
Presentamos el caso de un paciente con dolor precordial y antecedente de la enfermedad de Chagas, a quien en la gammagrafía de perfusión miocárdica se le encontraron hallazgos compatibles con la cardiopatía isquémica con defectos de perfusión fijos y reversibles de importante extensión pero con las arterias coronarias pericárdicas sanas.
Caso clínicoPaciente varón de 66 años de edad, proveniente de una zona endémica para la enfermedad de Chagas con antecedentes de: hipertensión arterial, hipotiroidismo, cardiopatía dilatada chagásica y portador de cardiodesfibrilador quien consulta por dolor torácico típico de 15 días de evolución. La causa del dolor se calificó como de riesgo intermedio para la enfermedad ateroesclerótica arterial coronaria/insuficiencia coronaria con marcadores de injuria miocárdica negativos. Se decidió entonces el estudio y la estratificación de la enfermedad coronaria mediante métodos no invasivos.
Se realizó la gammagrafía de perfusión miocárdica Gated-SPECT (estudio tomográfico sincronizado con el electrocardiograma) con 99mTc-MIBI (dosis total 1554 MBq) bajo protocolo de un día y en fases de estrés farmacológico con dipiridamol y de reposo. Se administró dipiridamol I.V. a dosis de 0,142mg/kg/min en infusión continua de 4 minutos e inyección de 99mTc–Sestamibi al minuto 8. Una hora más tarde se adquirió la secuencia tomográfica de emisión, con sincronización del QRS del electrocardiograma (Gated-SPECT), la cual se reconstruyó en los ejes largo vertical, largo horizontal y corto. En una sesión diferente se hizo otra inyección del radiotrazador con el paciente en reposo y se adquirió la segunda secuencia de imágenes siguiendo el mismo protocolo. Se realizó: análisis visual, semicuantitativo, estudio funcional y de la dinámica de las paredes en ambas fases.
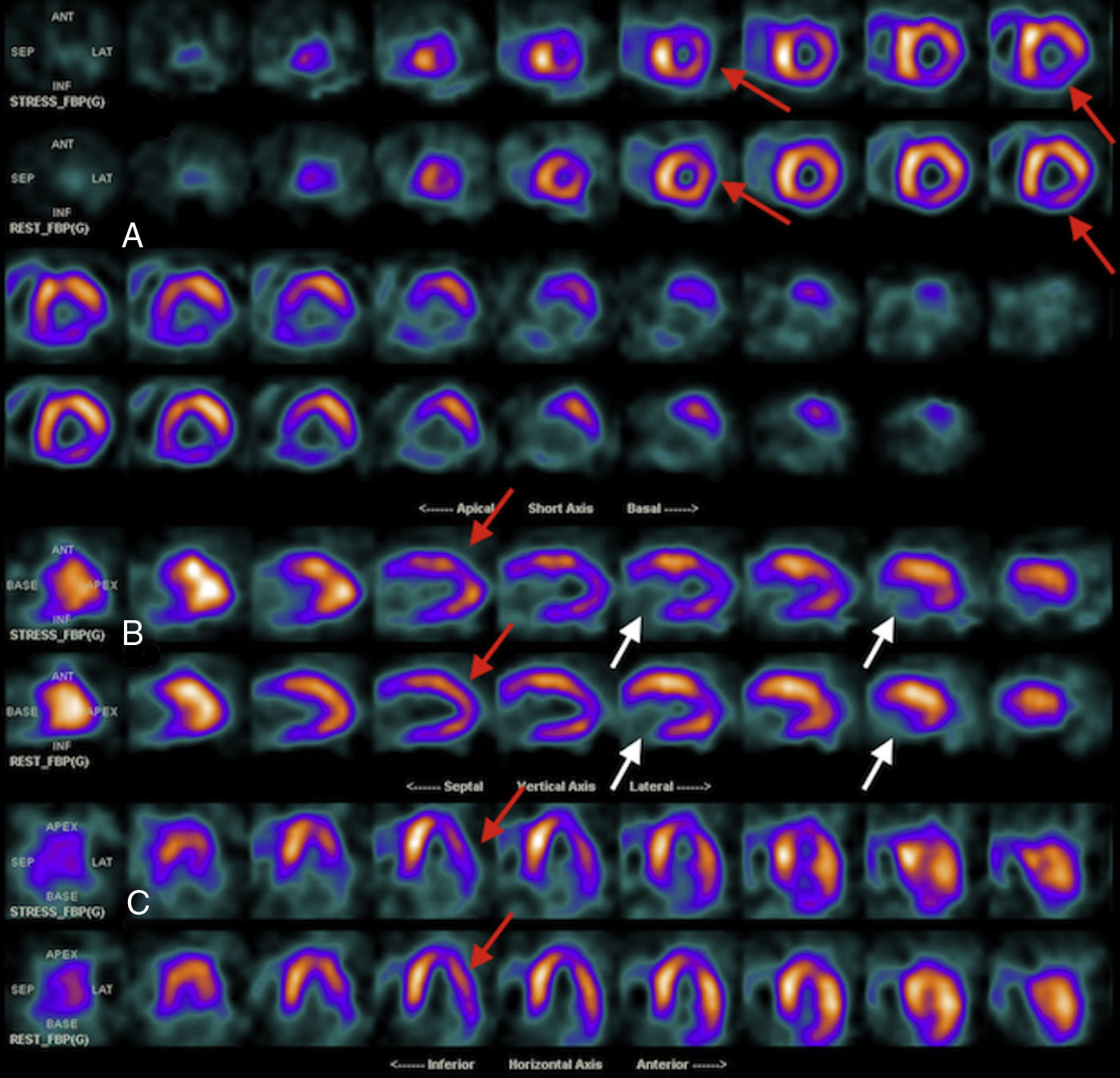
Las imágenes de estrés mostraron ausencia de captación del radiotrazador en la región basal de las paredes inferior e ínfero-lateral, hipocaptación leve-moderada de los segmentos apical y medial de las mismas caras, del ápex del segmento apical de la cara anterior así como hipocaptación leve en la región medio-basal de la cara antero-lateral.
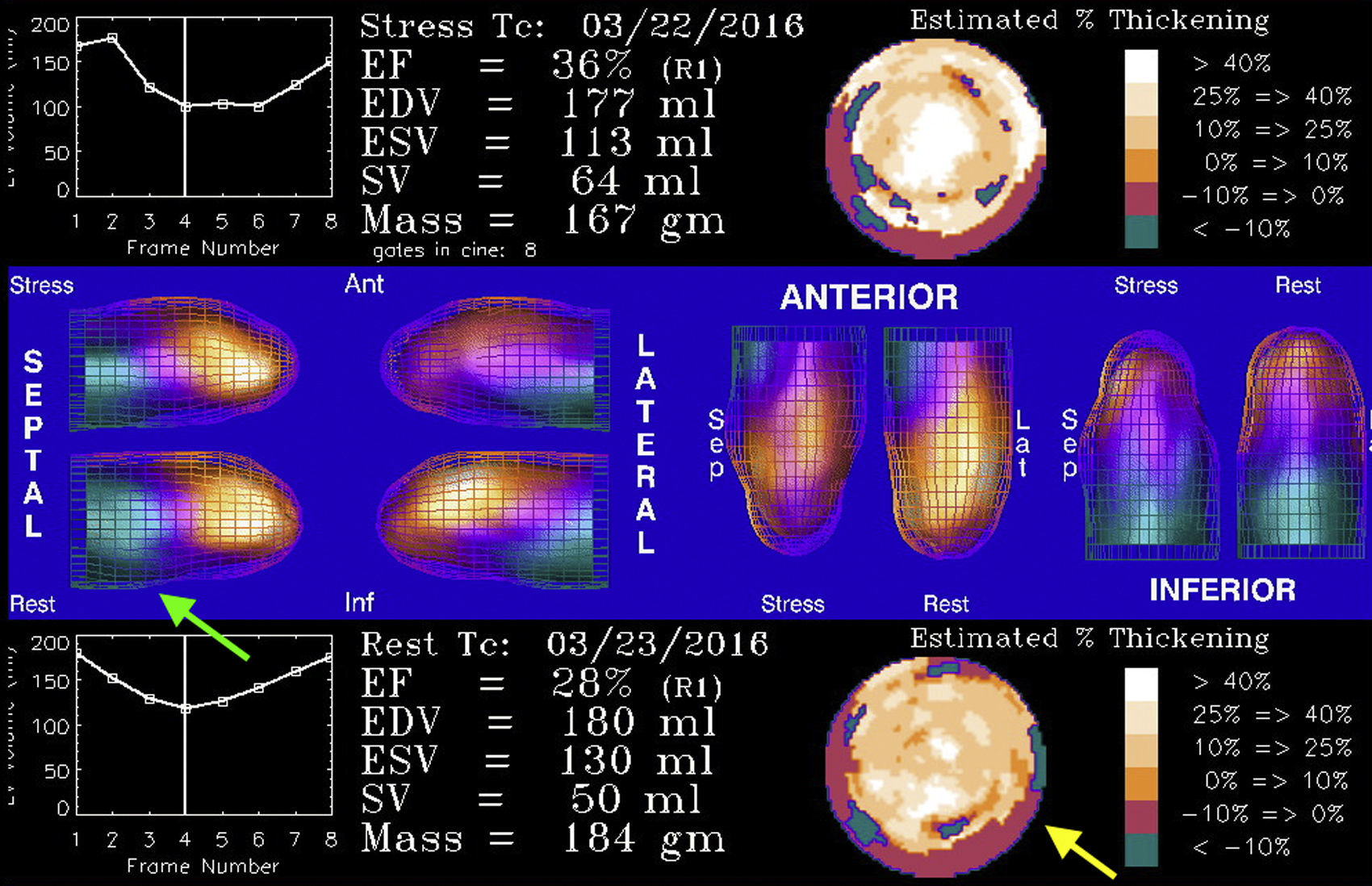
Las imágenes de reposo no mostraron cambios significativos respecto al estrés en la región basal de las paredes inferior e ínfero-lateral, mostrando mejoría en el resto de los territorios mencionados con defecto. Las imágenes del Gated-SPECT mostraron hipoquinesia global de predominio inferior e ínfero-lateral, medio-basal con engrosamiento sistólico severamente disminuido en las regiones basales de las paredes inferior e ínfero-lateral. La fracción de eyección en reposo fue del 28%, volumen de fin de diástole de 180ml, volumen de fin de sístole de 130ml. Se reportó necrosis transmural en la región basal de las paredes inferior e ínfero-lateral (extensión aproximada del 12% del ventrículo izquierdo) e isquemia leve-moderada en el ápex, en la zona medio-apical de las caras inferior, lateral y anterior así como en la región medio-basal de la cara antero-lateral inducida por el estrés vasodilatador con dipiridamol intravenoso (extensión aproximada del 30% del ventrículo izquierdo). Además, se observó disfunción sistólica y signos de hipertrofia y dilatación ventricular izquierda. (figs. 1 y 2).
Estudio isotópico de la perfusión miocárdica con 99mTc-MIBI en fases post-estrés farmacológico con dipiridamol intravenoso y reposo. Imágenes correspondientes a los ejes cortos (A), eje largo vertical (B) y eje largo horizontal (C) mostrando en las filas superiores las imágenes adquiridas posterior al estrés farmacológico y en las filas inferiores las imágenes adquiridas posteriores al reposo. En el estudio se observa la morfología irregular del ventrículo izquierdo por cardiomiopatía conocida. Además, se observa la hipocaptación de tipo reversible e indicativa de la isquemia en el ápex, el segmento apical de la cara anterior, en los segmentos apical y medial de las caras inferior e ínfero-lateral así como en la región medio-basal de la cara antero-lateral (flechas rojas). Por otra parte, se observa el defecto de captación severo y fijo entre las dos fases en la región basal de las paredes inferior e ínfero-lateral indicativo de la fibrosis/necrosis (flechas blancas).
Estudio isotópico de la perfusión miocárdica con 99mTc-MIBI en las fases post-estrés farmacológico y de reposo. Estudio Gated-SPECT posterior a la reconstrucción tridimensional para la determinación de los parámetros funcionales en el que se observa la disfunción sistólica y la dilatación ventricular izquierda con la hipoquinesia global más acentuada en la región basal de las caras inferior e infero-lateral (flecha verde) en donde el engrosamiento sistólico se encuentra prácticamente ausente (flecha amarilla).
Por las características clínicas y por los hallazgos de la gammagrafía de perfusión miocárdica se llevó a estratificación invasiva con la angiografía arterial coronaria que reportó las arterias coronarias sin lesiones significativas. Por tal motivo se decidió dar de alta hospitalaria con plan de optimizar manejo médico de la insuficiencia cardiaca.
DiscusiónLos hallazgos clínicos más frecuentes en los pacientes con cardiomiopatía chagásica son: las alteraciones eléctricas tales como los trastornos de conducción y las arritmias, además, del síncope, la dilatación y la insuficiencia cardiaca3. En presencia de factores de riesgo para la enfermedad ateroesclerótica, el dolor torácico relacionado y/o los cambios eléctricos y/o los mecánicos, en la evaluación ecocardiográfica se hace necesario descartar un posible componente isquémico en relación con la cardiopatía evaluada.
En este caso, además, del antecedente de la cardiopatía chagásica y la insuficiencia cardiaca el paciente presentó dolor torácico típico por lo que se decidió realizar la gammagrafía de perfusión miocárdica en la que se observaron defectos de perfusión reversibles y no reversibles con una extensión importante del ventrículo izquierdo sin evidencia de la enfermedad coronaria aterosclerótica obstructiva en las arterias epicárdicas.
Los defectos de perfusión en la gammagrafía de perfusión miocárdica son bastante frecuentes en los pacientes con la enfermedad crónica de Chagas, encontrándose hasta en el 78% de los pacientes y en muchos de ellos no se presenta enfermedad obstructiva en las coronarias epicárdicas. De ellos los más frecuentes son los defectos de perfusión fijos que están relacionados con la fibrosis miocárdica y la extensión de ésta a su vez está relacionada con el grado de disfunción ventricular7. Por otro lado, los defectos reversibles que son indicativos de la isquemia son debidos en su mayor parte a alteraciones a nivel de la microcirculación coronaria que en su gran mayoría pueden evolucionar a ser cambios fijos de tipo fibrótico. La causa de dicho compromiso microvascular no está del todo clara pero se ha observado en estudios postmortem que en dicha circulación existe engrosamiento de la membrana basal ocasionando vasodilatación y vasoconstricción microvascular. En varias ocasiones se han encontrado placas oclusivas a nivel intramural de las pequeñas arterias debido a la injuria local endotelial por el Tripanosoma Cruzi. La producción local de endotelina, tromboxano A2 y citoquinas ocasionando inflamación, reactividad microvascular e incluso formación de lesiones aneurismáticas de predominio en el ápice y en la pared posterior basal del ventrículo izquierdo, localizaciones en las que más frecuentemente se observan defectos de perfusión en la gammagrafía de perfusión miocárdica1,8,9. Se ha demostrado que la disfunción microvascular coronaria es importante debido a su relación con la fibrosis posterior y a que se ha considerado como predictor independiente de los eventos cardiacos en los pacientes con la cardiopatía dilatada, el incremento de riesgo de muerte y la progresión de la insuficiencia cardiaca7,10.
En consecuencia, el conocimiento de esta condición y sus posibles hallazgos en los estudios diagnósticos más específicamente en la gammagrafía de perfusión miocárdica por parte de todos los médicos involucrados es muy importante si se trata de los países o las regiones en los que la enfermedad no es endémica (debido a la emigración importante de las zonas endémicas) como en donde la enfermedad es endémica por la atención continua de estos pacientes.
Por lo tanto, en pacientes provenientes de las zonas endémicas y que cursen con insuficiencia y dilatación cardiaca, además, de la presencia de factores predictores para la enfermedad coronaria, que sean o hayan sido estudiados con la gammagrafía de perfusión miocárdica que muestre hallazgos compatibles con la insuficiencia coronaria generadora de isquemia o necrosis (defectos reversibles o fijos, respectivamente) pero que no tengan la enfermedad coronaria obstructiva evidente en la angiografía de las arterias coronarias, se debe tener en cuenta como diagnóstico diferencial la cardiopatía chagásica como patología de base causante de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses y otras consideracionesLa financiación del trabajo se realizó con recursos propios y no hubo otras fuentes. Los autores declaran no tener ningún conflicto de intereses.
En este artículo no aparecen datos de identificación del paciente. La responsabilidad de los conceptos que se publican es íntegramente de los autores.