Describir la experiencia en términos de supervivencia y complicaciones de los pacientes llevados a trasplante de células madre hematopoyéticos (TCMH) en los últimos 15 años.
Materiales y métodosSe realizó un estudio descriptivo, tipo cohorte retrospectiva en el que se incluyeron pacientes menores de 18 años con diagnóstico de leucemia mieloide aguda (LMA), leucemia mieloide crónica (LMC) y síndrome mielodisplásico (SMD) llevados a TCMH entre enero de 2001 y diciembre de 2015. Los desenlaces fueron supervivencia global, supervivencia libre de evento y las complicaciones relacionadas con el trasplante.
ResultadosDurante el periodo de estudio se trasplantaron: 43 pacientes con diagnóstico de neoplasias mieloides; 31 con LMA (72%); 4 con LMC (9%) y 8 con SMD (19%). Se realizaron 11 trasplantes de donante idéntico, 11 haploidénticos, 11 autólogos y 10 de sangre de cordón umbilical. De los pacientes con LMA (31 casos), el 58% fueron sometidos a trasplante en primera remisión completa y el 39% en segunda o subsecuente remisión completa. La supervivencia global y libre de evento a 5 años fue 56% y 38% respectivamente. La mortalidad relacionada al trasplante en el día 100 fue del 15%, la incidencia acumulada de enfermedad injerto contra huésped 59%, la infección por citomegalovirus 39%, las infecciones bacterianas 54% y la cistitis hemorrágica 14%.
ConclusiónLa baja tasa de mortalidad y complicaciones relacionadas al trasplante sugiere que el trasplante de células madre hematopoyéticas es una alternativa factible como tratamiento para pacientes con neoplasias mieloides en nuestro medio.
To describe the experience, in terms of survival and complications, with patients that received a haematopoietic stem cell transplantation (HSCT) in the last 15 years.
Materials and methodsA descriptive, retrospective, cohort study was conducted on patients less than 18 years-old with a diagnosis of acute myeloid leukaemia (AML), chronic myeloid leukaemia (CML), and myelodysplastic syndrome (MDS) and received HSCT between January 2001 and December 2015. The outcomes were, overall survival, event-free survival, and complications associated with the transplant.
ResultsDuring the study period, a total of 43 patients with myeloid neoplasms received a transplant, of which 31 (72%) had AML, 4 (9%) with CML, and 8 (19%) with MDS. A total of 11 identical donor transplants were performed, as well as 11 haploidentical, 11 autologous, and 10 with umbilical cord blood. Of the patients with AML (31 cases), 58% were subjected to a transplant in the first full remission, and 39% in the second or subsequent full remission. The overall and event-free survival at 5 years was 56% and 38%, respectively. The transplant-related mortality at day 100 was 15%, with an accumulated incidence of graft versus host disease of 59%, cytomegalovirus infection of 39%, with 54% bacterial infections, and 14% haemorrhagic cystitis.
ConclusionThe low mortality and complications rate associated with the transplant suggests that haematopoietic stem cell transplantation is a viable alternative as a treatment for patients with myeloid neoplasms in our country.
Las neoplasias mieloides son un grupo heterogéneo de patologías hematológicas y constituyen alrededor del 20 al 25% de los cánceres pediátricos1. La incidencia mundial de leucemia mieloide aguda (LMA) infantil en los países con datos disponibles varía entre 5-8 casos por millón de habitantes2. El tratamiento de esta patología está basado en quimioterapia y trasplante de células madre hematopoyéticas (TCMH) según el riesgo, en el mundo se han publicado diferentes estrategias de tratamiento las cuales han cambiado a través del tiempo3,4.
Actualmente para los pacientes con LMA el TCMH alogénico está indicado principalmente en los casos de: primera remisión completa en el grupo de pacientes clasificados como de alto riesgo; en los pacientes que presenten recaída; enfermedad refractaria y en algunos casos de riesgo intermedio según la disponibilidad de donante. Los pacientes con LMC deben llevarse a trasplante si tienen enfermedad progresiva a pesar del tratamiento con inhibidores de la tirosina quinasa. Y en los pacientes con SMD el TCMH es el único tratamiento curativo5–7.
No existen datos en Colombia sobre el resultado del TCMH en niños con diagnóstico de neoplasia mieloide. Es por esto que el objetivo de este estudio es presentar la experiencia en términos de supervivencia y complicaciones de los pacientes llevados a TCMH en los últimos 15 años en la Fundación Valle del Lili, institución de cuarto nivel localizada en Cali (Colombia) y donde se realiza un promedio de 30 trasplantes pediátricos al año.
MetodologíaPacientesSe realizó un estudio descriptivo, tipo cohorte retrospectiva en el que se incluyeron pacientes menores de 18 años con diagnóstico de LMA, LMC y SMD llevados a TCMH entre enero de 2001 y diciembre de 2015. Los pacientes fueron seguidos hasta la muerte o el último seguimiento registrado en la historia clínica. La recolección de datos se realizó después de la aprobación por el comité de ética del hospital.
Se incluyeron pacientes con trasplante autólogo y alogénico. La histocompatibilidad entre el donante y receptor fue determinada según el sistema HLA. Desde el 2001 hasta el 2011 se hacía análisis serológico de los loci HLA-A, B y DR. A partir del 2011 se introdujo la tipificación molecular por la técnica PCR-SSO en la plataforma Luminex y se tipifican los alelos de cada uno de los loci HLA-A, B, C, DRB1 y DQB1.
Por definición donante idéntico fue aquel con 6/6, 9/10 o 10/10 alelos compatibles, donante haploidéntico 5-8/10 alelos dado que estos trasplantes fueron realizados después del 2012 y a todos se les realizó tipificación de 5 loci del HLA. Las unidades de sangre de cordón umbilical tuvieron de 4-6/6 alelos compatibles en los loci A, B y DRB18.
Regímenes de condicionamientoEl régimen de condicionamiento para cada paciente se realizó según: la enfermedad de base, el tipo de donante y las comorbilidades. Se definió la intensidad del régimen de condicionamiento como mieloablativo y no mieloablativo según la literatura9.
Profilaxis de la enfermedad de injerto contra huésped (EICH)Los esquemas de profilaxis para EICH utilizados variaron según el tipo de trasplante realizado. Para los trasplantes de donante familiar idéntico y cordón umbilical se usaron regímenes basados en ciclosporina combinada con metotrexate, micofenolato o esteroides10–13. En los trasplantes haploidénticos se usó el régimen basado en ciclofosfamida postrasplante con ciclosporina, mini-metotrexate o micofenolato14–16.
Medidas de soporteTodos los pacientes recibieron: trimetropin/sulfametoxazol como profilaxis para Pneumocystis; fluoroquinolonas como profilaxis antimicrobiana; aciclovir durante el periodo de acondicionamiento e inmunosupresión y profilaxis antifúngica con voriconazol, itraconazol o posaconazol. La dosis y los esquemas se ajustaron según las guías internacionales vigentes durante cada periodo17.
DefinicionesEl injerto de neutrófilos se definió como el primer día cuando el conteo de neutrófilos fue>500 cel/μL durante tres días consecutivos. El injerto de plaquetas se definió como el primer día en que el recuento de plaquetas fue>20x 10^3/uL durante tres días consecutivos sin soporte transfusional. La falla primaria del injerto mieloide se definió como la ausencia de injerto después del TCMH hasta el día+28 para trasplante idéntico y haploidéntico, y+42 para cordón18.
La recaída de la enfermedad se basó en criterios clínicos y patológicos. La enfermedad injerto contra huésped fue diagnosticada y graduada según los criterios clínicos y paraclínicos de la escala de Glucksberg19.
Se consideró infección por Citomegalovirus (CMV) a los pacientes con carga viral> 500 copias (PCR por plataforma Rotor gene Q de Quiagen) o pp65 (+) (técnica por inmunofluorescencia de Biorad) en dos ensayos consecutivos y el diagnóstico de enfermedad se realizó teniendo en cuenta los síntomas del paciente, los signos clínicos o las manifestaciones de daño de órgano blanco reflejados en las pruebas de laboratorio.
Las infecciones bacterianas se definieron como cualquier infección documentada con cultivos positivos (hemocultivos, urocultivo) en el periodo postrasplante.
Análisis estadísticoSe realizó un análisis estadístico descriptivo para todas las variables consideradas en el análisis y para subgrupos según el tipo de trasplante. Las variables categóricas se resumen en proporciones y se compararon con chi-cuadrado. Las variables continuas se expresan como medianas con su respectivo rango intercuartil (RIC) y se compararon con Kruskal Wallis. Los desenlaces primarios del estudio fueron: la supervivencia global (SG) definida como el tiempo desde el trasplante hasta la fecha de muerte por cualquier causa y la supervivencia libre de evento (SLE) definida como el tiempo desde el trasplante hasta la fecha de recaída de la enfermedad, en el caso de los pacientes que recayeron o muerte en el caso de los pacientes que fallecieron sin recaída de la enfermedad. Para el análisis de la supervivencia en el caso de los pacientes vivos al momento del análisis fueron censurados en la última fecha de seguimiento20. Para el análisis de la incidencia de EICH agudo se excluyeron los pacientes con falla de injerto y trasplante autólogo. Para el análisis de injerto mieloide y plaquetar se excluyeron los pacientes que murieron antes de completar 28 días postrasplante.
El análisis de supervivencia se realizó con el método Kaplan-Meier y las comparaciones se hicieron con log-rank test. Para todas las comparaciones se consideraron valores estadísticamente significativos aquellos con una p<0,05. Todos los análisis se realizaron en el software estadístico STATA 12.
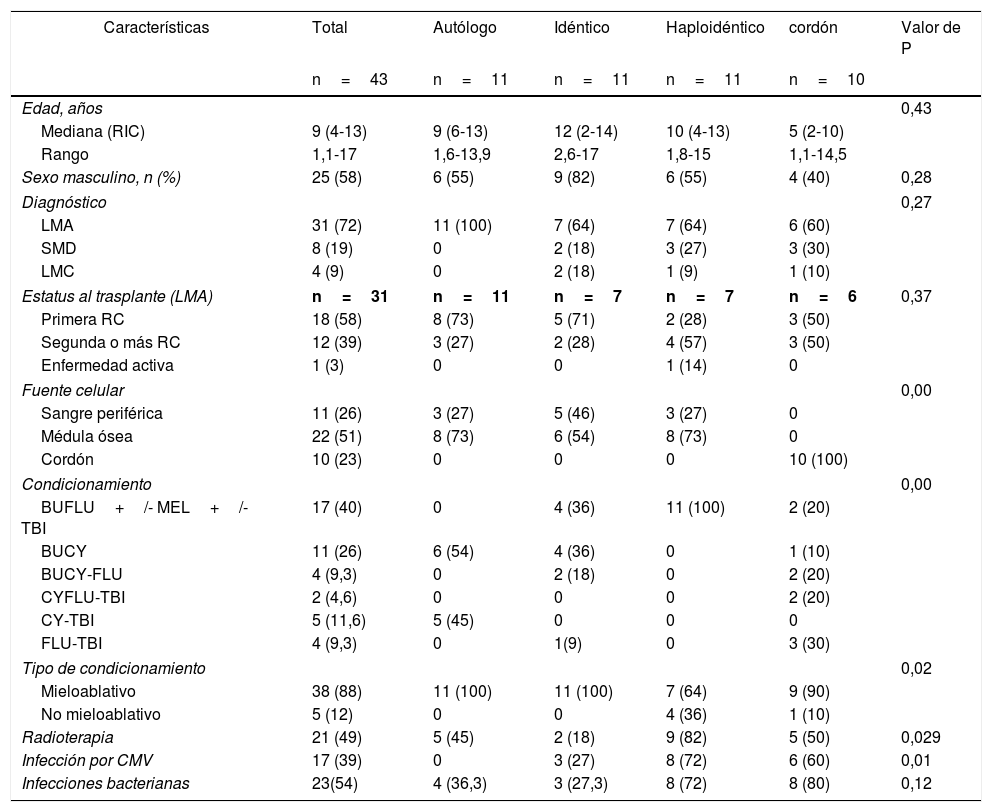
ResultadosDurante el periodo de estudio, se trasplantaron: 43 pacientes con diagnóstico de neoplasias mieloides, 31 pacientes con LMA (72%), 4 pacientes con LMC (9%) y 8 pacientes con síndrome mielodisplásico (19%). Las características basales de acuerdo con el tipo de trasplante se presentan en la tabla 1. La mediana de edad al momento del trasplante fue 9 años (RIC 4-13 años).
Características demográficas y del trasplante
| Características | Total | Autólogo | Idéntico | Haploidéntico | cordón | Valor de P |
|---|---|---|---|---|---|---|
| n=43 | n=11 | n=11 | n=11 | n=10 | ||
| Edad, años | 0,43 | |||||
| Mediana (RIC) | 9 (4-13) | 9 (6-13) | 12 (2-14) | 10 (4-13) | 5 (2-10) | |
| Rango | 1,1-17 | 1,6-13,9 | 2,6-17 | 1,8-15 | 1,1-14,5 | |
| Sexo masculino, n (%) | 25 (58) | 6 (55) | 9 (82) | 6 (55) | 4 (40) | 0,28 |
| Diagnóstico | 0,27 | |||||
| LMA | 31 (72) | 11 (100) | 7 (64) | 7 (64) | 6 (60) | |
| SMD | 8 (19) | 0 | 2 (18) | 3 (27) | 3 (30) | |
| LMC | 4 (9) | 0 | 2 (18) | 1 (9) | 1 (10) | |
| Estatus al trasplante (LMA) | n=31 | n=11 | n=7 | n=7 | n=6 | 0,37 |
| Primera RC | 18 (58) | 8 (73) | 5 (71) | 2 (28) | 3 (50) | |
| Segunda o más RC | 12 (39) | 3 (27) | 2 (28) | 4 (57) | 3 (50) | |
| Enfermedad activa | 1 (3) | 0 | 0 | 1 (14) | 0 | |
| Fuente celular | 0,00 | |||||
| Sangre periférica | 11 (26) | 3 (27) | 5 (46) | 3 (27) | 0 | |
| Médula ósea | 22 (51) | 8 (73) | 6 (54) | 8 (73) | 0 | |
| Cordón | 10 (23) | 0 | 0 | 0 | 10 (100) | |
| Condicionamiento | 0,00 | |||||
| BUFLU+/- MEL+/-TBI | 17 (40) | 0 | 4 (36) | 11 (100) | 2 (20) | |
| BUCY | 11 (26) | 6 (54) | 4 (36) | 0 | 1 (10) | |
| BUCY-FLU | 4 (9,3) | 0 | 2 (18) | 0 | 2 (20) | |
| CYFLU-TBI | 2 (4,6) | 0 | 0 | 0 | 2 (20) | |
| CY-TBI | 5 (11,6) | 5 (45) | 0 | 0 | 0 | |
| FLU-TBI | 4 (9,3) | 0 | 1(9) | 0 | 3 (30) | |
| Tipo de condicionamiento | 0,02 | |||||
| Mieloablativo | 38 (88) | 11 (100) | 11 (100) | 7 (64) | 9 (90) | |
| No mieloablativo | 5 (12) | 0 | 0 | 4 (36) | 1 (10) | |
| Radioterapia | 21 (49) | 5 (45) | 2 (18) | 9 (82) | 5 (50) | 0,029 |
| Infección por CMV | 17 (39) | 0 | 3 (27) | 8 (72) | 6 (60) | 0,01 |
| Infecciones bacterianas | 23(54) | 4 (36,3) | 3 (27,3) | 8 (72) | 8 (80) | 0,12 |
LMA: leucemia mieloide aguda, SMD: síndrome mielodisplásico, LMC: leucemia mieloide crónica, RC: remisión completa, BU: busulfan, FLU: fludarabina, MEL: melfalán, TBI: irradiación corporal total, CY: ciclofosfamida, CMV: citomegalovirus.
De los pacientes con LMA (31 casos), el 58% fueron sometidos a trasplante en primera remisión completa, el 39% en segunda o subsecuente remisión completa. Un paciente se encontraba en enfermedad activa al momento del trasplante.
Las fuentes de células madre fueron: médula ósea en 22 pacientes (51%), sangre periférica en 11 pacientes (26%) y células madre de cordón en 10 pacientes (23%). La mayoría de los regímenes de condicionamiento fueron mieloablativos, el más frecuente fue la combinación basada en busulfan más fludarabina (BUFLU), usada en los trasplantes haploidénticos (tabla 1).
De los 42 pacientes evaluables para injerto, 3 pacientes tuvieron falla de injerto para neutrófilos, 2 del grupo de cordón, 1 paciente con trasplante autólogo. En cuanto al injerto de plaquetas 7 pacientes tuvieron falla del injerto: 4 del grupo de cordón, 1 autólogo, 1 haploidéntico y 1 idéntico.
La incidencia acumulada de EICH agudo fue del 59% (17 eventos). Únicamente un paciente presentó EICH grado III-IV y los órganos afectados fueron el tracto gastrointestinal y el hígado.
En cuanto a complicaciones infecciosas se encontró que: 17 pacientes presentaron infección por CMV (39%). La mediana de infección desde el día de trasplante hasta la detección por carga viral fue 26 días RIC 18-40 días. Sin embargo, solo tres pacientes desarrollaron enfermedad, uno del grupo de cordón y dos del grupo de trasplante haploidéntico. El órgano blanco fue pulmón en dos pacientes y gastrointestinal en uno.
El 54% de los pacientes presentó alguna infección bacteriana en el periodo postrasplante. La mediana de tiempo entre el trasplante y la infección fue 24 días RIC 10-59 días. El porcentaje más alto de infecciones estuvo en los pacientes con trasplantes haploidéntico y de cordón.
El 14% de los pacientes presentó cistitis hemorrágica, la mediana de tiempo en que apareció la cistitis fue 28 días, RIC 27-59 días. Hubo mayor compromiso en los niños con trasplante haploidéntico (40%). Solo 4,6% del total presentó enfermedad venooclusiva hepática.
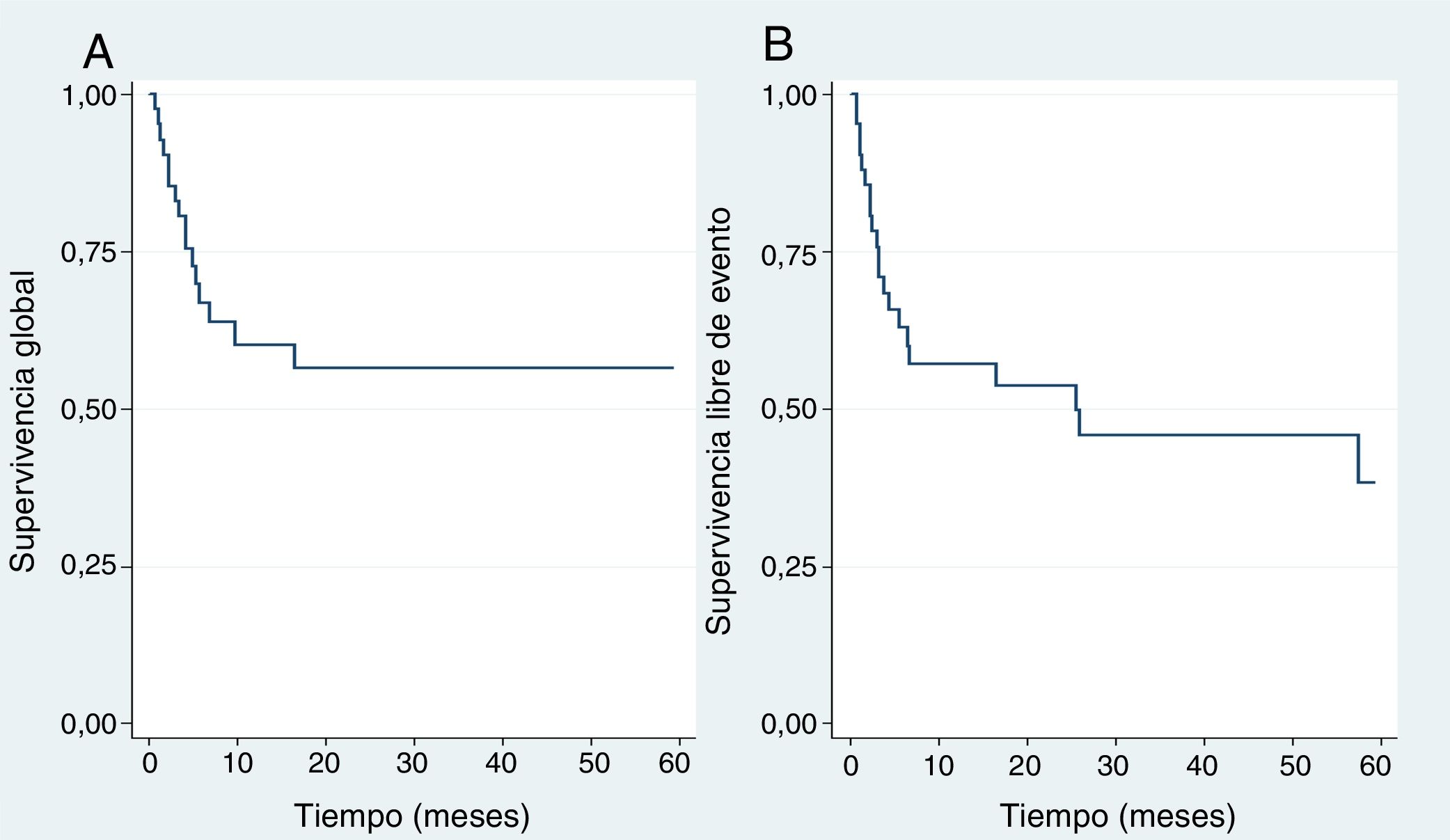
El tiempo medio de seguimiento fue de 22 meses (RIC 4,2-48 meses). En los pacientes analizados se encontró una supervivencia global a 1 y 5 años de año 60% y 56% respectivamente (fig. 1). En el análisis dependiendo del tipo de trasplante los resultados fueron supervivencia global en trasplante alogénico de 67% a 1 año y a 5 años 61%. Para el trasplante autólogo fue de 40% a 1 y 5 años (p=0,45). La supervivencia libre de evento para toda la cohorte a 1 y 5 años fue de 57% y 38% respectivamente (fig. 1); para el trasplante alogénico fue de 64% en el primer año y 44% a 5 años, para el trasplante autólogo fue de 36% a 1 año y 18% a 5 años (p=0,14).
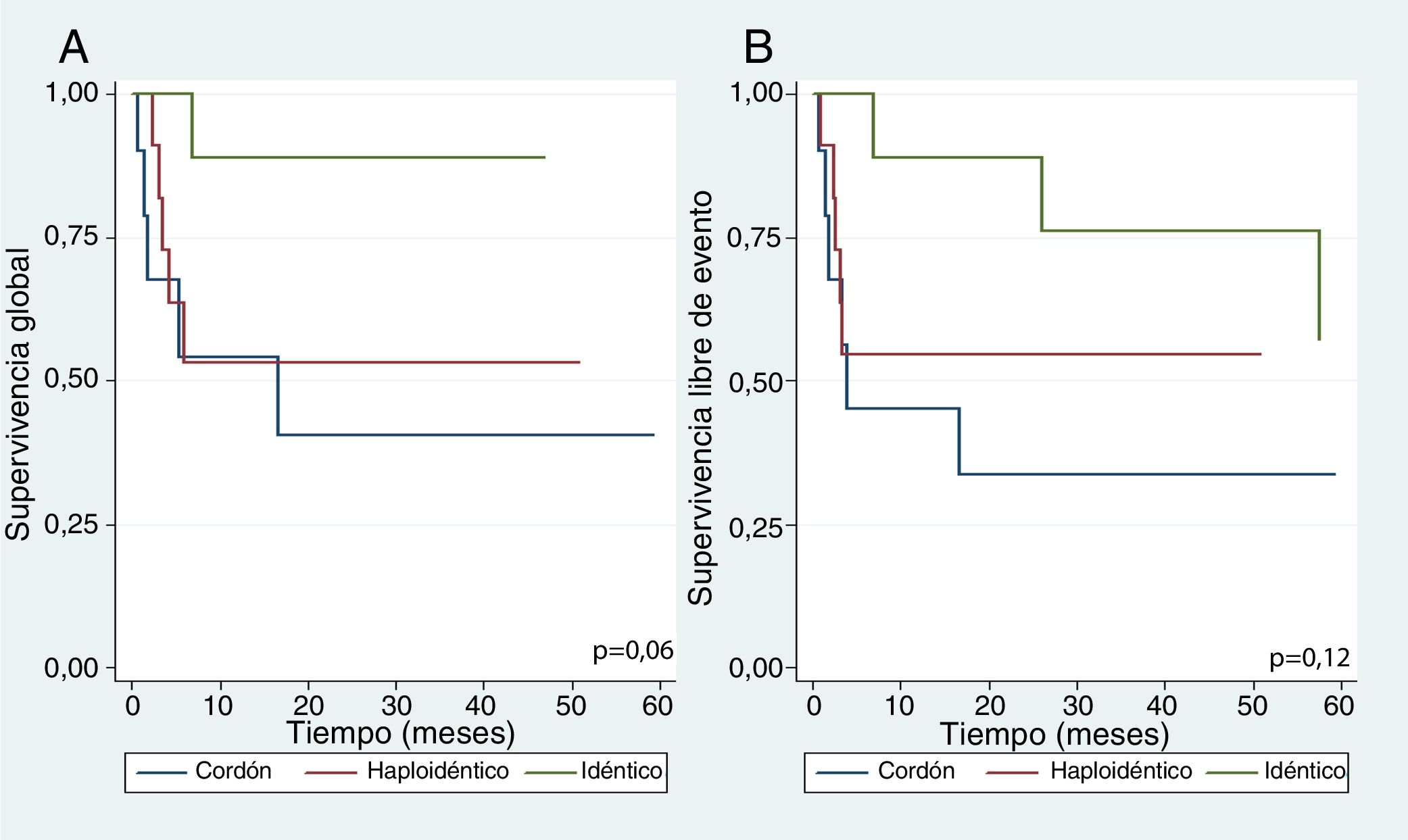
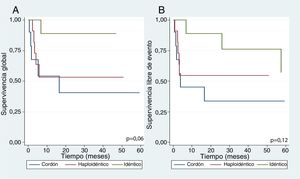
En el grupo de trasplante alogénico, se dividió el análisis de la supervivencia dependiendo del tipo de donante. La supervivencia global a 5 años para cada tipo de trasplante fue: cordón 40%, idéntico 89%, haploidéntico 53% (p=0,06). La supervivencia libre de evento a 5 años fue: cordón 34%, idéntico 57%, haploidéntico 54% (p=0,12) (fig. 2).
La mortalidad relacionada al trasplante a 100 días fue de 15% y a 1 año fue del 19%. En total 18 pacientes murieron (42%), la mediana de mortalidad fue 4 meses (2-7 meses) y la principal causa fue relacionada con la recaída (10 pacientes), seguida de causas relacionadas con el trasplante (8 pacientes) y generalmente estaban asociadas a complicaciones infecciosas.
DiscusiónEl TCMH es una opción de tratamiento para los pacientes con neoplasias mieloides, pues comparada con quimioterapia ofrece mejores tasas de supervivencia en ciertos grupos de pacientes21,22. En países de escasos recursos sin acceso a TCMH se ha reportado una tasa supervivencia global de 7% en niños con diagnóstico de LMA en recaída, atribuido a las limitaciones para acceder al tratamiento23.
La supervivencia global a 5 años de nuestra cohorte fue del 56%, lo cual es comparable con estudios previos24,25 y se evidenció una diferencia en la supervivencia de los pacientes con trasplante alogénico y autólogo, sin embargo, esta no fue significativa estadísticamente. Para Woods et al. la tasa de supervivencia global en el trasplante autólogo era similar a la quimioterapia, pero la toxicidad relacionada al tratamiento era significativamente mayor24, por lo cual no está indicado en la actualidad y en la institución se dejaron de realizar desde el 2008.
Para el grupo de trasplante alogénico la supervivencia global a 5 años fue del 61%, cifra similar a la encontrada en otros estudios donde las tasas oscilan entre 43%-72%24. Se debe tener en cuenta que nuestra población incluye pacientes con diagnóstico de LMA, LMC y SMD, pueden encontrarse variaciones al compararnos con otros estudios pues los resultados se modifican dependiendo del subtipo de LMA, el riesgo citogenético y las estrategias usadas en el trasplante. En el análisis de la supervivencia global y libre de evento para cada tipo de donante alogénico no se encontró diferencias significativas (p=0,06) y esto concuerda con otros estudios realizados26–28.
Una de las complicaciones más comunes del trasplante alogénico es la enfermedad de injerto contra huésped (EICH) y en nuestro caso el EICH global agudo fue de 59%. La incidencia de EICH agudo en otros estudios se encuentra entre el 35%-50%, las variaciones en los resultados depende de: la fuente de células madre, la edad del paciente, el acondicionamiento y la profilaxis utilizada29,30. En nuestra cohorte a pesar de una incidencia de EICH elevada solo un paciente presentó EICH severo.
La mortalidad relacionada al trasplante a un año fue del 19% lo cual es similar a lo reportado por Zittoun et al. (17,3%)31. Para Woods et al. la tasa de mortalidad no relacionada a recaída en pacientes con LMA en primera remisión completa fue del 14%24.
Nuestro estudio tuvo varias limitaciones, incluido un diseño retrospectivo, el número reducido de pacientes, además se debe tener en cuenta que en 15 años se han implementado cambios en el acceso a recursos de diagnóstico y de seguimiento, las indicaciones, la técnica y los cuidados de apoyo del trasplante lo cual puede sesgar los resultados del estudio. Según la literatura, existen otros factores que pueden influir en la supervivencia global y libre de evento en los pacientes con neoplasia mieloide, como: el nivel de enfermedad mínima residual antes del trasplante, las características citogenéticas y el tiempo entre el diagnóstico y el trasplante. En nuestro estudio no se evaluaron estos factores, debido a que estos datos no se encontraron en más del 20% de los registros.
La baja tasa de mortalidad y complicaciones relacionadas al trasplante sugiere que el trasplante de células madre hematopoyéticas es una alternativa factible como tratamiento para pacientes con neoplasias mieloides en nuestro medio.
Fuentes de apoyoFundación Valle del Lili.
Conflicto de interesesNinguno de los autores tiene algún conflicto de intereses en relación con la información de este artículo.