El mieloma múltiple representa la primera causa de trasplante autólogo de células madre hematopoyéticas (TCMH). El objetivo del presente trabajo es describir los resultados del TCMH en pacientes con diagnóstico de mieloma múltiple en la Fundación Valle del Lili.
Materiales y métodosSe realizó un estudio observacional, descriptivo de una cohorte retrospectiva, se incluyeron pacientes mayores de 18 años con TCMH autólogo tratados entre 2008 y 2016. Los desenlaces fueron: supervivencia global, supervivencia libre de progresión y la respuesta de la enfermedad postrasplante. Se realizó un análisis estadístico descriptivo y el análisis de supervivencia se hizo con el método Kaplan-Meier.
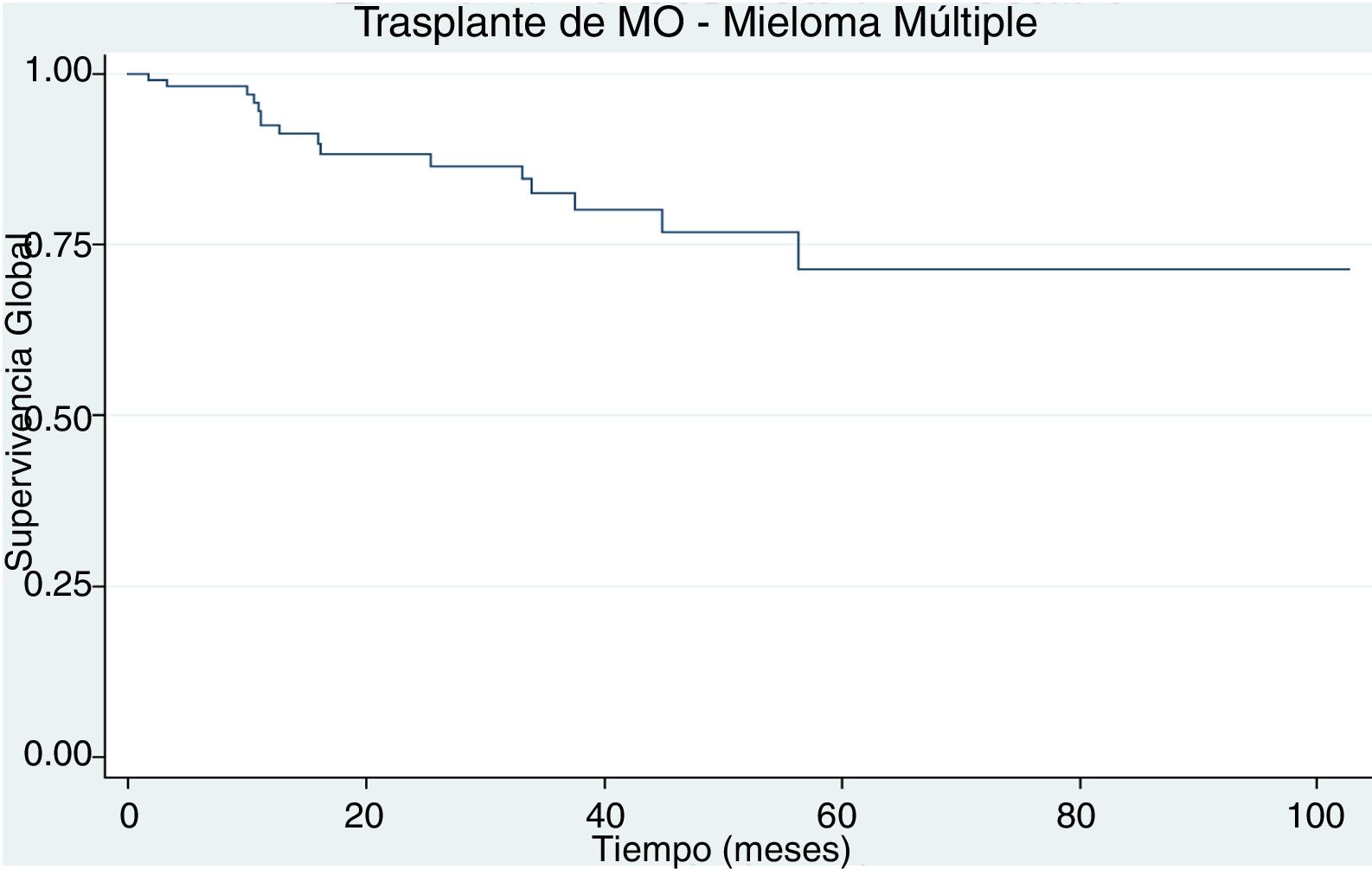
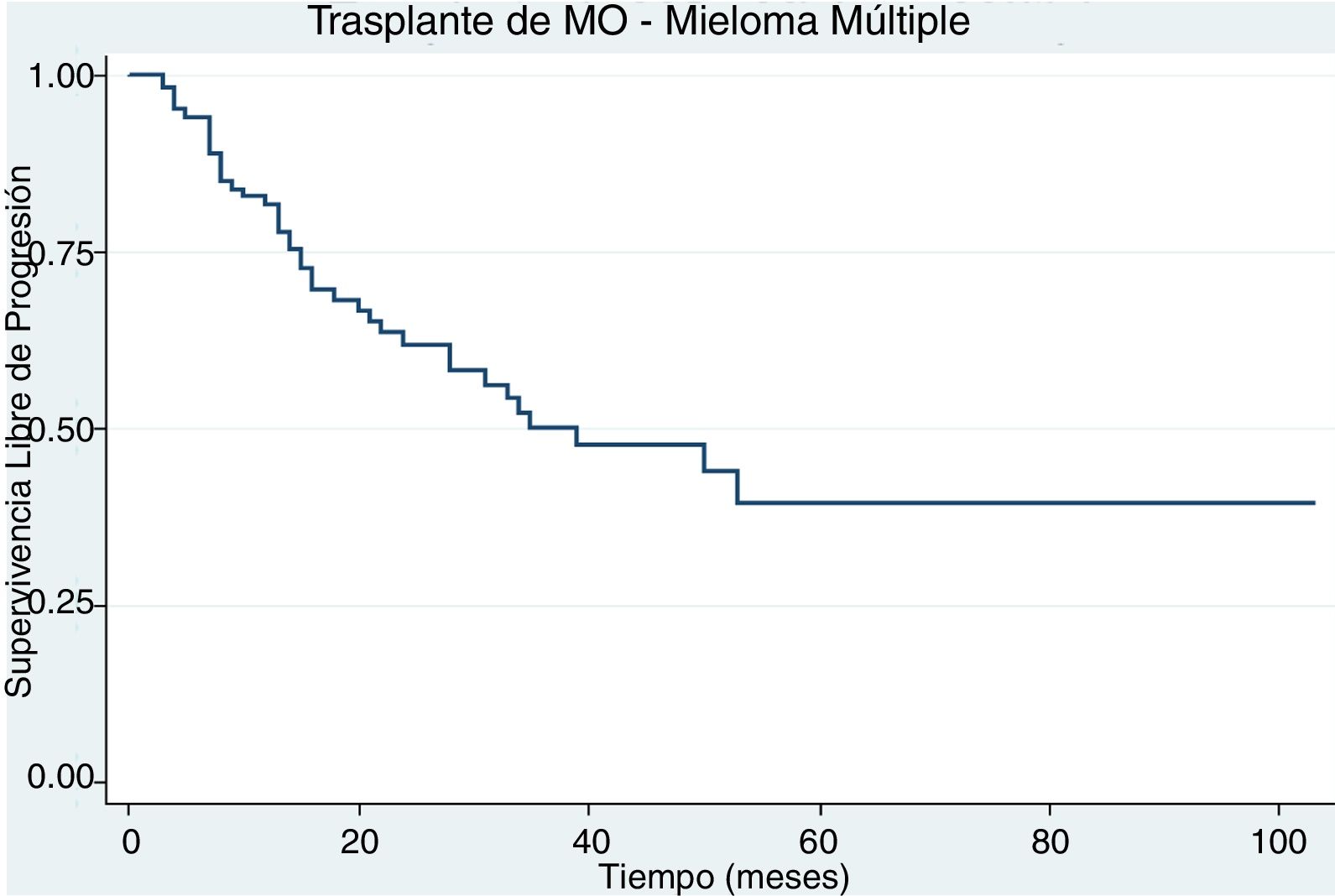
ResultadosDurante el periodo de estudio se trasplantaron 103 pacientes. La mediana de la edad fue 57 años. El subtipo de inmunoglobulina secretada fue: 75% de IgG, 18% de IgA, 5% no secretor y 2% oligosecretor. El estadio Durie Salmon en la mayoría fue IIIA (43,7%). Previo al trasplante la mayoría de los pacientes estaba en muy buena respuesta parcial (31%), seguido por respuesta completa (25,2%) y respuesta parcial (19,4%). La supervivencia global y libre de progresión a 5 años fue de 71% y de 40%, respectivamente. Posterior al trasplante: el 33% de los pacientes estaba en muy buena respuesta parcial, el 25% en respuesta completa estricta, el 22% en respuesta completa, el 12% en respuesta parcial y el 8% en enfermedad progresiva o recaída.
ConclusiónEl TCMH autólogo es una estrategia que se asocia a buenas tasas de supervivencia, baja toxicidad y adecuada respuesta de la enfermedad postrasplante.
Multiple myeloma in Colombia is the one of the main reasons for autologous hematopoietic stem cell transplantation (HSCT). The aim of this study is to describe the results of the HSCT in adult patients diagnosed with multiple myeloma in the Fundación Valle del Lili.
Materials and methodsAn observational, descriptive study of a retrospective cohort was carried out. Patients older than 18 years with a diagnosis of multiple myeloma with autologous HSCT between 2008 and 2016 were included. The outcomes were overall survival, progression-free survival, and post-transplant disease response. A descriptive statistical analysis was carried out for all the variables considered in the analysis. The survival analysis was performed using the Kaplan-Meier method.
ResultsDuring the study period, transplants were performed on 103 patients with a diagnosis of multiple myeloma. The median age was 57 years. The subtype of secreted immunoglobulin was 75% IgG, 18% IgA, 5% non-secretor, and 2% oligo-secretor. The majority of patients were in Durie Salmon stage was IIIA (43.7%). Prior to transplantation 31% had a very good partial response, 25.2% complete response, 19.4% partial response, 10.7% progressive disease, 6.8% stable disease, 2.9% complete strict response, and in 3.9% of the patients the report of the disease status was not found. The 5-year overall survival was 71% (95% CI: 53-83) and progression-free survival was 40% (95% CI 25-54). After transplantation 33% of the patients were in very good partial response, 25% in strict complete response, 22% in complete response, 12% partial response, and 8% progressive disease or relapse.
ConclusionAutologous HSCT is a strategy that is associated with good survival rates, low toxicity, and an adequate post-transplant disease response.
El mieloma múltiple (MM) es una proliferación clonal de células plasmáticas que producen una inmunoglobulina monoclonal y cadenas livianas libres. Representa el 10% de todas las enfermedades malignas hematológicas1 y se asocia con una morbilidad significativa debido a la destrucción del hueso por infiltración de células plasmáticas que genera dolor y fracturas, además del daño en otros órganos como el riñón por exceso de cadenas ligeras2.
El enfoque terapéutico ha cambiado a lo largo del tiempo con la introducción de nuevos regímenes de quimioterapia y el trasplante de médula ósea. Cuando se compara la quimioterapia sola con la quimioterapia intensificada seguida de trasplante de células madre hematopoyéticas (TCMH), esta última estrategia ha demostrado mayores tasas de supervivencia libre de progresión y supervivencia global3,4.
En este estudio se presentan los desenlaces de pacientes con mieloma múltiple llevados a trasplante autólogo en los últimos 9 años en un centro de atención de alta complejidad ubicado en el suroccidente colombiano.
MetodologíaSe incluyeron pacientes con diagnóstico de mieloma múltiple llevados a TCMH autólogo, entre enero de 2008 y diciembre de 2016 en la Fundación Valle del Lili. La recolección de datos se realizó después de la aprobación por el comité de ética del hospital.
Las células madre fueron obtenidas de sangre periférica, luego de movilización con filgrastim (5-10 mcg/kg de peso) o ciclofosfamida (2-4g/m2) más filgrastim, y recolectadas hasta un mínimo de 2 millones de células CD34+/Kg de peso.
El régimen de acondicionamiento consistió en melfalán 200mg/m2 o 140mg/m2 en pacientes con insuficiencia renal y la infusión de las células previamente criopreservadas. Todos los pacientes recibieron filgrastim 5 –10mg/kg/día desde el séptimo día después del trasplante hasta la recuperación de neutrófilos.
Los pacientes recibieron profilaxis antiinfecciosa, según el protocolo institucional.
La estadificación se llevó a cabo de acuerdo con los criterios Durie Salmon5. La respuesta fue evaluada según los criterios del International Myeloma Working Group (IMWG por sus siglas en inglés) con la información pretrasplante y nuevamente a los tres meses postrasplante6.
El injerto de neutrófilos se definió como el primer día a partir de un conteo de neutrófilos>500 cel/μL durante tres días consecutivos. El injerto de plaquetas se definió como el primer día en que el recuento de plaquetas fue>20x 10^3/uL durante tres días consecutivos sin soporte transfusional.
Se realizó un análisis estadístico descriptivo para todas las variables consideradas en el análisis. Las variables categóricas se resumen en proporciones y las variables continuas se expresan como mediana con su rango intercuartil (RIC). La supervivencia global se definió como la probabilidad de supervivencia independientemente del estado de la enfermedad y la supervivencia libre de progresión como la probabilidad de estar vivo y sin recaída. El análisis de supervivencia se realizó con el método Kaplan-Meier y las comparaciones en los subgrupos de interés se hicieron con log-rank test y el cálculo de los intervalos de confianza. Todos los análisis se realizaron en el software estadístico STATA 12.
ResultadosEn el periodo de estudio se hicieron 103 trasplantes de progenitores autólogo en pacientes con diagnóstico de mieloma múltiple. La mediana de seguimiento fue 24 meses RIC 11,6-43,6. Las características basales se muestran en la tabla 1. La mediana de edad al momento del trasplante fue 57 años (RIC 51-62 años). El subtipo de inmunoglobulina secretada más frecuente fue IgG en el 75% de los casos, seguido por el IgA en un 18%, no secretor en un 5% y oligosecretor con el 2%.
Características basales y del trasplante
| Característica | n=103 |
|---|---|
| Edad, años, mediana, RIC | 57 (51-62) |
| Rango | 35-67 |
| Género masculino, n (%) | 68 (66) |
| Tipo de mieloma, n (%) | |
| IgG | 77 (75) |
| IgA | 19 (18) |
| No secretor | 5 (5) |
| Oligosecretor | 2 (2) |
| Estadio Durie Salmon, n (%) | |
| IA | 10 (9,7) |
| IIA | 13 (12,6) |
| IIB | 2(2) |
| IIIA | 45 (43,7) |
| IIIB | 20 (19,4) |
| Sin dato | 13 (12,6) |
| Respuesta pretrasplante, n (%) | |
| Respuesta completa estricta | 3 (2,9) |
| Respuesta completa | 26 (25,2) |
| Respuesta parcial muy buena | 32 (31,1) |
| Respuesta parcial | 20 (19,4) |
| Enfermedad estable | 7 (6,8) |
| Enfermedad progresiva | 11 (10,7) |
| Sin dato | 4 (3,9) |
| Quimioterapia pretrasplante, n (%) | |
| VTD | 35 (33,9) |
| VTD seguido melfalan | 3 (2,9) |
| VTD seguido DVDox | 2 (1,9) |
| VTD seguido VRD | 3 (2,9) |
| CyBorD | 6 (5,8) |
| CyBorD seguido VTD | 7 (6,8) |
| CyBorD seguido VD | 3 (2,9) |
| CyBorD seguido VRD | 6 (5,8) |
| CyBorD seguido RD | 3 (2,9) |
| VRD | 10 (9,7) |
| VT | 5 (4,9) |
| VD | 9 (8,7) |
| Otros | 9 (8,7) |
| Sin dato | 2 (1,9) |
| Movilización, n (%) | |
| Filgrastrim | 15 (14,6) |
| Filgrastrim+CY | 88 (85,4) |
| Melfalan, n (%) | |
| 140 mg/m2 | 14 (13,6) |
| 200 mg/m2 | 89 (56,4) |
| Celulas CD34+reinfundidas, mediana, (RIC) | 7 (4-11) |
| Rango | 2-33 |
| Injerto de neutrófilos, mediana días (RIC) | 12 (11-12) |
| Rango | 10-17 |
| Injerto de plaquetas, mediana días (RIC) | 12 (11-14) |
| Rango | 9-34 |
| Muerte, n (%) | 13 (12,6) |
| Relacionada con el trasplante | 1 (1) |
| Relacionada con Recaída | 12 (11,7) |
VTD: bortezomib- talidomida-dexametasona, DVDox: dexametasona, bortezomib, doxorubicina, VRD: bortezomib- lenalidomida-dexametasona, CyBorD: Ciclofosfamida-bortezomib-dexametasona, VD: bortezomib-dexametasona, RD: talidomida-dexametasona, VT: bortezomib- talidomida
El estadio Durie Salmon en la mayoría fue IIIA (43,7%). En cuanto al estatus de la enfermedad antes del trasplante: el 31% de los pacientes estaban en muy buena respuesta parcial, el 25,2% en respuesta completa, el 19,4% en respuesta parcial, el 10,7% con enfermedad progresiva, el 6,8% con enfermedad estable, el 2,9% en respuesta completa estricta y en el 3,9% de los pacientes no se encontró el reporte del estado de enfermedad.
La mediana de células CD34+que fueron infundidas fue de 7x106 /kg de peso corporal (rango 2-33x106 /kg). La dosis de melfalan se redujo a 140mg/m2 en 14 pacientes por antecedente de insuficiencia renal. Todos los pacientes lograron injertar y la mediana de injerto para neutrófilos y plaquetas fue de 12 días.
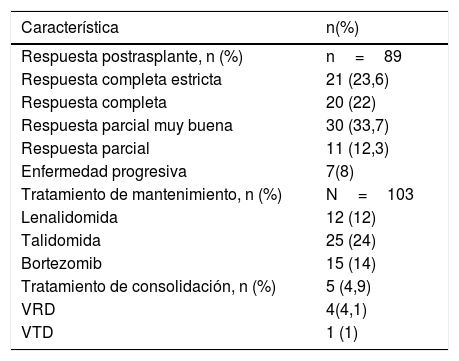
La respuesta postrasplante fue evaluada únicamente en 89 pacientes por pérdida de seguimiento y la evaluación se realizó al día 100 en la mayoría de los casos. Se encontró que el 33% de los pacientes estaba en muy buena respuesta parcial posterior al trasplante, el 25% en respuesta completa estricta, el 22% en respuesta completa, el 12% respuesta parcial y el 8% en enfermedad progresiva o recaída.
Posterior al trasplante: a 52 pacientes (50,5%) se les suministró terapia de mantenimiento (los medicamentos quimioterapéuticos usados se presentan en la tabla 2), cinco pacientes se les administro terapia de consolidación, cuatro pacientes recibieron VRD (bortezomib, lenalidomida, dexametasona) y un paciente recibió VTD (bortezomib, talidomida, dexametasona).
Respuesta postrasplante
| Característica | n(%) |
|---|---|
| Respuesta postrasplante, n (%) | n=89 |
| Respuesta completa estricta | 21 (23,6) |
| Respuesta completa | 20 (22) |
| Respuesta parcial muy buena | 30 (33,7) |
| Respuesta parcial | 11 (12,3) |
| Enfermedad progresiva | 7(8) |
| Tratamiento de mantenimiento, n (%) | N=103 |
| Lenalidomida | 12 (12) |
| Talidomida | 25 (24) |
| Bortezomib | 15 (14) |
| Tratamiento de consolidación, n (%) | 5 (4,9) |
| VRD | 4(4,1) |
| VTD | 1 (1) |
VRD: bortezomib- lenalidomida-dexametasona, VTD: bortezomib- talidomida-dexametasona
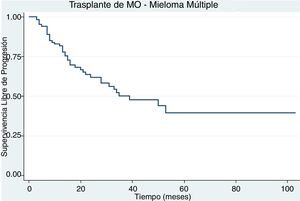
Un paciente falleció antes del día 100 posterior al trasplante asociado a sepsis por pseudomona aeruginosa multiresistente. La supervivencia global a 5 años fue del 71% (fig. 1) y la supervivencia libre de progresión a 5 años fue del 40% (fig. 2).
La supervivencia global para los pacientes con mantenimiento y sin mantenimiento a los 5 años fue del 61% (IC 95%:39-78) y del 90% (IC 95%: 75-96), respectivamente (p=0,1327).
La supervivencia libre de progresión para los pacientes con mantenimiento y sin mantenimiento a los 5 años fue del 37% (IC 95%: 21-55) y del 36% (IC 95%: 10-65) (p=0,9831).
La supervivencia global para los pacientes con respuesta completa y respuesta completa estricta pretrasplante fue del 76% (IC 95%: 46-91) a los 5 años, para el grupo de muy buena respuesta parcial y respuesta parcial fue del 67% (IC 95%: 42-83) (p=0,5293).
La supervivencia libre de progresión para los pacientes con respuesta completa y respuesta completa estricta pretrasplante fue del 55% (IC 95%: 27-76) a los 5 años, para el grupo de muy buena respuesta parcial y respuesta parcial fue del 28% (IC 95%: 11-48) p=0,0823.
DiscusiónEl trasplante autólogo de células madre hematopoyéticas es una estrategia que se asocia con mejores tasas de respuesta, de supervivencia libre de progresión y de supervivencia global comparada con el uso de quimioterapia7. En este estudio se evidenció una supervivencia global a 5 años del 71% lo cual es comparable con los ensayos clínicos en los que se usó melfalan seguido de TCMH8. Además, esta cifra es superior a las cohortes presentadas en Chile y Brasil, incluso teniendo en cuenta que esta población tenía mayor edad y un estado más avanzado de la enfermedad9,10.
La supervivencia libre de progresión para estos pacientes fue del 40% y esto es similar a lo reportado en ensayos clínicos usando protocolos similares al expuesto11,12. En la literatura se describen ciertos factores asociados a mejores tasas de supervivencia libre de evento tales como: citogenética de bajo riesgo, condicionamiento solo con melfalan, respuesta completa postrasplante y el uso de terapia de mantenimiento13. El 50% de los pacientes de nuestra cohorte recibió terapia de mantenimiento.
La evaluación de la respuesta al trasplante en el día 100 es importante para determinar el pronóstico de los pacientes. Se han reportado mejores tasas de supervivencia global y libre de evento en los pacientes que lograron respuesta completa o muy buena respuesta parcial14,15. En este estudio, el 25% se encontraba en respuesta completa estricta lo cual es similar a los resultados publicados en la literatura14,15.
El TCMH se asocia a una toxicidad relativamente baja con 0,9% de mortalidad relacionada al trasplante a los 100 días, acorde a los resultados presentados por cohortes internacionales14,15. No se presentó falla del injerto y en promedio el injerto mieloide y plaquetar fue de 12 días lo que está relacionado con estancias hospitalarias cortas.
La diferencia en la supervivencia global y libre de progresión de los pacientes a los que no se les administró mantenimiento comparado con los pacientes que sí recibieron terapia de mantenimiento no fue estadísticamente significativa. Este dato contrasta con múltiples estudios que desde 2012 evidencian que recibir terapia de mantenimiento aumentaba significativamente la supervivencia libre de progresión, probablemente porque los pacientes con terapia de mantenimiento tenían enfermedades más agresivas o con mayor progresión16,17.
Los pacientes con respuesta completa estricta y respuesta completa antes del trasplante tuvieron mejor supervivencia global y libre de progresión comparado con el grupo que se encontraba en muy buena respuesta parcial y respuesta parcial, pero no se encontró una diferencia estadísticamente significativa. En la literatura se ha encontrado que la presencia de respuesta completa pretrasplante es un factor pronóstico para una mejor supervivencia libre de evento sin impactar la supervivencia global8,18.
El presente estudio tuvo varias limitaciones, incluido un diseño retrospectivo. Se debe tener en cuenta que en 9 años se han implementado cambios en el acceso a recursos de diagnóstico, seguimiento y tratamiento. Las indicaciones, la técnica y los cuidados de apoyo del trasplante, lo cual puede sesgar los resultados del estudio.
Por último, se trata del reporte más extenso presentado en América Latina de pacientes con mieloma múltiple llevados a trasplante autólogo y la estrategia de tratamiento expuesta se asocia a buenas tasas de supervivencia, baja toxicidad y una adecuada respuesta de la enfermedad postrasplante.
Fuentes de apoyoEl estudio fue financiado por la Universidad Icesi, Cali, Colombia.
Conflicto de interesesNinguno de los autores tiene algún conflicto de intereses en relación a la información de este artículo.