Varios estudios han demostrado la efectividad de la laparoscopia en la evaluación de los pacientes con tumores avanzados. Sin embargo, no hay uniformidad con respecto a lo sistemático de su uso y diferentes autores han reportado indicaciones y resultados variables.
MétodosEstudio observacional, analítico, de corte transversal en el que se evaluó un modelo con un grupo de variables asociadas con el diagnóstico laparoscópico de carcinomatosis. Se incluyeron todos los pacientes con adenocarcinoma gástrico que fueron llevados a laparoscopia de estadificación desde enero de 2008 y hasta completar la muestra, que fue estimada en 153 casos. Las variables evaluadas fueron edad, género, pérdida de peso, valor de albúmina sérica, localización endoscópica del tumor, tipo histológico según la clasificación de Lauren, descripción tomográfica del tumor (T), presencia de adenopatías (N) y ascitis. La presencia de carcinomatosis fue definida por observación laparoscópica.
ResultadosFueron analizados 153 pacientes; 102 hombres (66%) y 51 mujeres (33%) con edades entre 28 y 86 años.
Los factores asociados de manera estadísticamente significativa con presencia de carcinomatosis peritoneal fueron edad menor de 65 años (OR=2,0; IC95%:1 a 4,2), género femenino (OR=2,2; IC95%: 1,06 a 4,7), localización cardial del tumor (OR=2,6; IC95%: 1,25 a 5,2), presencia de ascitis (OR=4,3; IC95%: 1,3 a 15,9) e histología del tipo difuso (OR=3,0; IC95%: 1,5 a 5,8).
ConclusionesLa laparoscopia de estadificación es una herramienta valiosa en el abordaje inicial de los pacientes con cáncer gástrico avanzado y los estudios de imagen no la reemplazan. Las mujeres, menores de 65 años, con tumores cardiales del tipo histológico difuso y con ascitis documentada en TAC tienen mayor riesgo de cursar con carcinomatosis peritoneal en el momento del diagnóstico, por lo que proponemos el uso sistemático de la laparoscopia de estadificación en los pacientes que cumplan una o más de estas características.
Several studies have demonstrated the effectiveness of laparoscopy in the evaluation of patients with advanced tumours. However, there is no uniformity with respect to its systematic use, with different authors having reported variable indications and outcomes.
MethodsAn observational, analytical, cross-sectional study in which a model was evaluated with a group of variables associated with the laparoscopic diagnosis of peritoneal carcinomatosis. The study included all patients with gastric adenocarcinoma who were submitted to staging laparoscopy from January 2008 until the sample was completed, which was estimated in 153 cases. The variables evaluated were age, gender, weight loss, serum albumin value, endoscopic tumour location, histological type, according to Lauren classification and tumour tomography (T), presence of lymphadenopathy (N), and ascites. The presence of peritoneal carcinomatosis was defined by laparoscopic observation.
ResultsA total of 153 cases of gastric adenocarcinoma patients submitted to staging laparoscopy were analysed in the Gastrointestinal Surgery Department of the National Cancer Institute. They included 102 men (66%) and 51 women (33%), aged between 28 and 86 years.
Statistically significant factors associated with the presence of peritoneal carcinomatosis were, age less than 65 years (OR = 2.0, 95% CI: 1 - 4.2), female gender (OR 2.2, 95% CI: 1.06 (OR = 2.6, 95% CI: 1.25 - 5.2), presence of ascites (OR = 4.3, 95% CI: 1.3 - 15.9), and histology of the diffuse type (OR 3.0; 95% CI: 1.5 - 5.8).
ConclusionsStaging laparoscopy is a valuable tool in the initial approach of patients with advanced gastric cancer, and imaging studies do not replace it. Women, younger than 65 years, with gastroesophageal junction (GEJ) tumours, of the diffuse histological type, and with documented ascites in computed tomography scan, are at greater risk of peritoneal carcinomatosis at the time of diagnosis. Thus, the systematic use of staging laparoscopy is proposed in patients who meet one or more of these characteristics.
La mayoría de los casos de cáncer gástrico en nuestro país se diagnostican en etapas avanzadas1–3; existe particular dificultad en estadificar de manera certera estos pacientes, puesto que las imágenes diagnósticas no son lo suficientemente precisas para descartar la presencia de compromiso peritoneal4.
La correcta clasificación inicial permite la elección adecuada del tratamiento y establece el pronóstico de la enfermedad5,6. Contrariamente, la inadecuada estadificación genera la realización de procedimientos innecesarios, como laparotomías no terapéuticas, con la consecuente convalecencia que retrasa el manejo óptimo para su enfermedad7,8.
El hallazgo que más frecuentemente contraindica la resección es la carcinomatosis peritoneal; este es un diagnóstico difícil de descartar por tomografía, que es el estudio imagenológico realizado rutinariamente9–11.
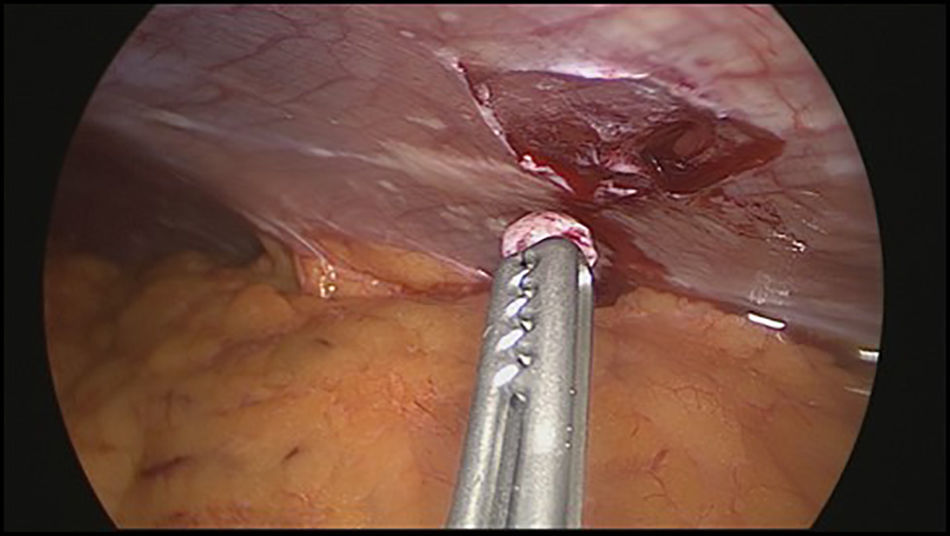
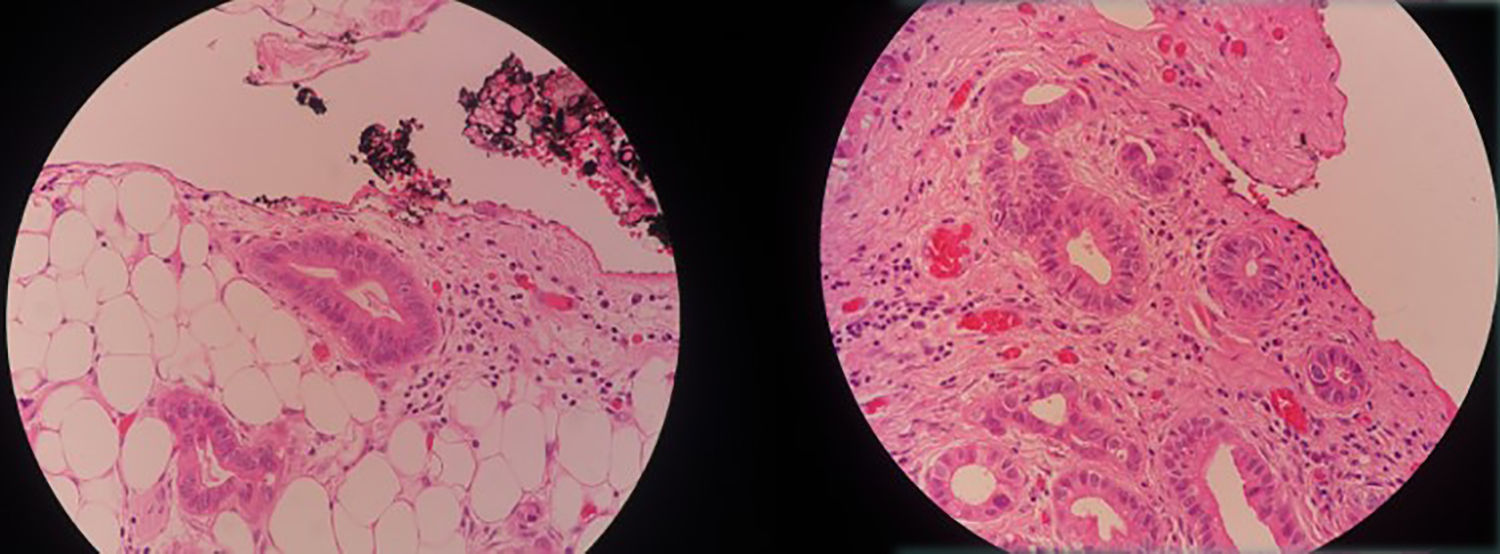
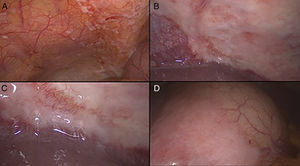
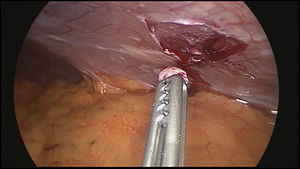
En este contexto la laparoscopia tiene un papel importante porque permite la visualización directa del compromiso tumoral del estómago, la extensión del mismo a órganos vecinos y sobre todo la evaluación del peritoneo, así como la toma de biopsias del mismo y/o citología del líquido peritoneal, ofreciendo los beneficios ya conocidos de la cirugía mínimamente invasiva12–16 (figs. 1–3).
A pesar de las bondades de la laparoscopia de estadificación, la realidad es que no se realiza rutinariamente en todos los centros, ya sea por disparidad de criterio con respecto a su indicación o por no disponibilidad de los recursos.
Algunos grupos abogan por la no realización de laparoscopia en pacientes que requieren paliación por obstrucción del tracto de salida gástrico y/o sangrado, puesto que estos síntomas deben ser manejados quirúrgicamente en la mayoría de los casos 17, sin embargo, con las tecnologías y destrezas adquiridas en endoscopia y radiología intervencionista, en servicios como el nuestro contamos con la posibilidad de manejar la obstrucción pilórica con prótesis autoexpansibles y el sangrado, no susceptible de manejo endoscópico, con embolización o radioterapia externa18.
Por otro lado, cuando existe indicación de paliación por obstrucción en pacientes severamente desnutridos, la laparoscopia permite seleccionar aquellos que tienen indicación de repleción nutricional previa a procedimientos de derivación en caso de descartar carcinomatosis, cuando se considera que el abordaje endoscópico no ofrecerá buenos resultados a mediano plazo, o reafirmar la necesidad de un esfuerzo endoscópico para restituir el tránsito, descartando dicha repleción en presencia de carcinomatosis, por el pobre pronóstico vital a corto plazo. Este enfoque permite ofrecer procedimientos menos mórbidos que la cirugía, de manera que, a nuestro parecer, estos pacientes son también candidatos a laparoscopia de estadificación con las consideraciones anotadas.
En nuestra institución, centro de referencia oncológico nacional, no está protocolizado el uso de la laparoscopia de estadificación en pacientes con cáncer gástrico ni ha sido evaluada su utilidad. En este trabajo buscamos definir los factores que están más fuertemente asociados con la presencia de carcinomatosis y que por tanto son útiles en la identificación de los pacientes con mayor riesgo.
Materiales y métodosEs un estudio observacional, analítico, de corte transversal en el que se evaluó un modelo con un grupo de variables asociadas con el diagnóstico laparoscópico de carcinomatosis. Para el cálculo del tamaño de muestra se tuvo en cuenta el análisis mediante regresión logística; en este modelo la variable dependiente fue la presencia de carcinomatosis y se buscaron estimadores de fuerza de asociación significativos (con OR de al menos 1,6) basados en lo reportado previamente en la literatura10. Con un poder del 80%, un nivel de significación del 5%, una probabilidad del evento -carcinomatosis- de 0,35 (valor tomado de revisión de archivos históricos del INC) para encontrar significación en los estimadores del valor planteado, o mayores, se definió un tamaño de muestra de 153 procedimientos laparoscópicos (cálculos efectuados con el programa PASS®). El diagnóstico de carcinomatosis fue establecido en este estudio como hallazgo quirúrgico en la laparoscopia, sin embargo, como se describe en los resultados, todos los casos fueron corroborados con patología.
Se incluyeron todos los pacientes mayores de 18 años con diagnóstico de adenocarcinoma gástrico, hecho por endoscopia digestiva alta y confirmado con reporte histopatológico de biopsia, llevados a laparoscopia de estadificación en el servicio de Cirugía Gastrointestinal del INC desde enero de 2008 hasta completar la muestra, lo cual se logró en julio de 2016. Antes del 2008 no existen registros sistematizados de las historias clínicas lo cual limitó el acceso a los datos y la confiablidad de los mismos. La decisión de realizar laparoscopia de estadificación fue tomada por el cirujano tratante según su criterio clínico.
Para el componente descriptivo se utilizaron las medidas de resumen adecuadas a las características de las variables: medias junto con sus correspondientes desviaciones estándar (DE) en el caso de variables continuas, o porcentajes en el caso de variables categóricas.
Para el componente analítico se realizaron dos pasos:
- a.
Análisis bivariados: Se evaluó la asociación cruda entre presencia de carcinomatosis y cada una de las siguientes variables independientes: edad, género, pérdida de peso, valor de albúmina sérica, localización endoscópica del tumor, tipo histológico según la clasificación de Lauren y descripción tomográfica del tumor (T), presencia de adenopatías (N) y ascitis; para esto se utilizaron pruebas de diferencia de medias o medianas (pruebas t de dos muestras o pruebas de suma de rangos, dependiendo del cumplimiento de supuestos para las pruebas paramétricas), o pruebas de asociación en tablas de contingencia (pruebas χ2 o pruebas exactas de Fisher de acuerdo con la frecuencia de valores esperados en las celdas de las tablas). En las tablas de contingencia de 2x2 se calcularon las razones de odds (OR) como estimadores de asociación.
- b.
Análisis multivariado: Se desarrolló un modelo de regresión logística binaria para evaluar la asociación entre presencia de carcinomatosis (variable dependiente, sí o no) y una serie de variables independientes ya mencionadas; en el desarrollo del modelo se incorporaron aquellas variables independientes que mostraron niveles de significación menores de 0,2 en los análisis bivariados. Para los demás casos se tomó como valor de significación el 5%. Las variables categóricas con más de dos niveles se manejaron como variables indicadoras (variables dummy), tomándose como categoría de referencia aquellas con la verosimilitud clínica de asociación más baja (supuesto teórico). Dado el hallazgo de predicción perfecta por parte de una de las variables (problema de separación) se efectuó un ajuste de los estimadores utilizando métodos de regresión logística con máxima verosimilitud penalizada19. Fueron evaluados los supuestos de adecuación del modelo, presencia de multicolinearidad y análisis de valores extremos para generar el modelo más parsimonioso y con mejor calidad de ajuste. Los procedimientos de análisis estadístico se efectuaron con el programa Stata 13®.
Entre enero de 2008 y julio de 2016, 169 pacientes fueron llevados a laparoscopia de estadificación por cáncer gástrico. Se excluyeron 16 casos en quienes no se disponía de imágenes ni reporte de tomografía axial computarizada (TAC) abdominal contrastada prequirúrgica y aquellos con datos insuficientes en la historia clínica, que no permitieron completar el formulario de recolección.
Fueron analizados 153 casos de pacientes con adenocarcinoma gástrico avanzado llevados a laparoscopia de estadificación en el servicio de Cirugía Gastrointestinal del Instituto Nacional de Cancerología. Se trata de 102 hombres (66%) y 51 mujeres (33%), con edades entre 28 y 86 años, para una edad media de 61,3 años (DE=12,4 años). 113 pacientes, que corresponden al 74%, reportaron pérdida de peso en la consulta inicial.
Con respecto a la localización tumoral encontramos 45 lesiones cardiales (30%) y 108 no cardiales (70%). La histología reportó 73 casos del tipo intestinal (48%) y 80 casos del tipo difuso (52%).
El valor de albumina sérica osciló entre 1,2mg/dl y 4,9mg/dl, con una media de 3,4mg/dl (DE=0,7mg/dl).
En cuanto a los hallazgos imagenológicos en TAC de abdomen, se describió el tumor T, dividiendo los casos en dos grupos: el primero, el de los tumores limitados a la pared gástrica con compromiso de mucosa, submucosa y muscular T1-T2 y, el segundo, los tumores con extensión a la subserosa, serosa y tejidos perigástricos T3-T4. También se evaluó la presencia o ausencia de adenopatías N y la presencia o ausencia de ascitis.
El 93% de los casos fueron tumores T3-T4 (142 casos) y solo un 7% (11 casos) correspondió a T1-T2. El 57% tenía adenopatías reportadas en la TAC (87 casos) y únicamente el 12% presentaba ascitis (19 casos).
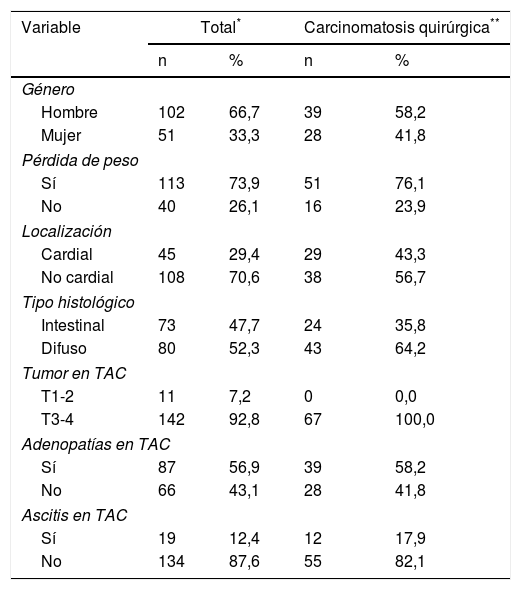
Ya en la laparoscopia de estadificación la presencia de carcinomatosis fue encontrada en 67 casos (44%) (tabla 1).
Presencia de carcinomatosis en relación con las variables analizadas
| Variable | Total* | Carcinomatosis quirúrgica** | ||
|---|---|---|---|---|
| n | % | n | % | |
| Género | ||||
| Hombre | 102 | 66,7 | 39 | 58,2 |
| Mujer | 51 | 33,3 | 28 | 41,8 |
| Pérdida de peso | ||||
| Sí | 113 | 73,9 | 51 | 76,1 |
| No | 40 | 26,1 | 16 | 23,9 |
| Localización | ||||
| Cardial | 45 | 29,4 | 29 | 43,3 |
| No cardial | 108 | 70,6 | 38 | 56,7 |
| Tipo histológico | ||||
| Intestinal | 73 | 47,7 | 24 | 35,8 |
| Difuso | 80 | 52,3 | 43 | 64,2 |
| Tumor en TAC | ||||
| T1-2 | 11 | 7,2 | 0 | 0,0 |
| T3-4 | 142 | 92,8 | 67 | 100,0 |
| Adenopatías en TAC | ||||
| Sí | 87 | 56,9 | 39 | 58,2 |
| No | 66 | 43,1 | 28 | 41,8 |
| Ascitis en TAC | ||||
| Sí | 19 | 12,4 | 12 | 17,9 |
| No | 134 | 87,6 | 55 | 82,1 |
De los 19 casos de ascitis reportada en TAC, se confirmó ascitis quirúrgica en 18 y se realizó citología. La citología fue positiva para malignidad en 10 casos y negativa en 8. De estos últimos, 4 casos tenían carcinomatosis macroscópica y la biopsia peritoneal fue positiva. Los 4 restantes corresponden a ascitis de origen no maligno.
Los restantes 53 casos de carcinomatosis fueron todos confirmados con biopsia peritoneal y no cursaban con ascitis.
En el análisis bivariado, las variables continuas edad y valor de albúmina, fueron re-categorizadas así: la edad fue dividida en menor o igual de 65 y más de 65 años y el valor de albúmina en menor o igual a 3mg/dl y más de 3mg/dl.
Se encontró asociación significativa entre presencia de carcinomatosis y las siguientes variables: edad menor de 65 años (OR=2,0; IC95%:1 a 4,2), género femenino (OR 2,2; IC95%: 1,06 a 4,7), localización cardial del tumor (OR=2,6; IC95%: 1,25 a 5,2), presencia de ascitis (OR=4,3; IC95%: 1,3 a 15,9) e histología del tipo difuso (OR 3,0; IC95%: 1,5 a 5,8). Ningún paciente con descripción tomográfica del tumor como T1-T2 presentó carcinomatosis (este hallazgo genera un problema de separación para el desarrollo de modelos logísticos). No se encontró asociación significativa con el valor de albúmina, la presencia de adenopatías ni la pérdida de peso.
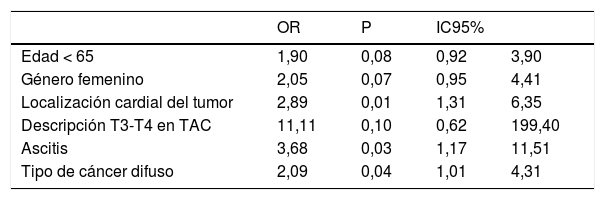
En el análisis multivariado, se excluyeron variables que en el análisis bivariado tuvieran valores de p >0,2. El resultado del modelo logístico ajustado con máxima verosimilitud penalizada se muestra en la tabla 2. Como puede verse, las variables significativamente asociadas con carcinomatosis son la localización del tumor, la presencia de ascitis y el tipo difuso; la edad y el género alcanzan una significación marginal.
Resultados del modelo logístico ajustado con máxima verosimilitud penalizada
| OR | P | IC95% | ||
|---|---|---|---|---|
| Edad < 65 | 1,90 | 0,08 | 0,92 | 3,90 |
| Género femenino | 2,05 | 0,07 | 0,95 | 4,41 |
| Localización cardial del tumor | 2,89 | 0,01 | 1,31 | 6,35 |
| Descripción T3-T4 en TAC | 11,11 | 0,10 | 0,62 | 199,40 |
| Ascitis | 3,68 | 0,03 | 1,17 | 11,51 |
| Tipo de cáncer difuso | 2,09 | 0,04 | 1,01 | 4,31 |
A pesar de los avances y desarrollos tecnológicos en imágenes diagnósticas, la certeza de la presencia o ausencia de compromiso peritoneal en el contexto de pacientes con adenocarcinoma gástrico sigue siendo un punto crítico, pues ninguna imagen tiene la precisión suficiente en la evaluación del peritoneo para descartarlo20–22.
Cuando la carcinomatosis es florida, la TAC puede documentarla y este hallazgo cambia el enfoque terapéutico de inmediato, pero cuando no la describe, sabemos que tampoco puede excluirla23,24.
Como se describió previamente, no existe unanimidad de criterios en la literatura sobre la realización de laparoscopia de estadificación. Las guías de la NCCN (National Comprehensive Cancer Network) recomiendan considerar la laparoscopia en todos los tumores >T1a5, otros autores abogan por realizarla en pacientes seleccionados con alto riesgo de carcinomatosis. Simon et al. encontraron como factores de riesgo tumores pobremente diferenciados, células en anillo de sello, linitis plástica y algunos hallazgos tomográficos25.
Particularmente en nuestro país, aún se realizan laparotomías no terapéuticas por cáncer gástrico26–28. En nuestro servicio de Cirugía Gastrointestinal, los pacientes con cáncer gástrico avanzado son llevados a laparoscopia de estadificación según el criterio del cirujano tratante. Sabemos que esta decisión está basada en la experiencia y juicio clínico, pero consideramos útil buscar mayor objetividad en la selección de casos.
Con este trabajo nos propusimos buscar asociación estadísticamente significativa entre algunos factores que evaluamos a diario en nuestros pacientes con adenocarcinoma gástrico y la presencia de carcinomatosis, para objetivar ese juicio clínico y tomar decisiones más acertadas.
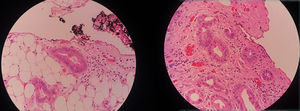
Aunque para nuestro trabajo la carcinomatosis fue definida como el hallazgo de siembras peritoneales documentadas laparoscópicamente por el cirujano, se revisaron los reportes de citología y biopsia encontrando correspondencia entre el hallazgo quirúrgico y la histopatología.
Los resultados muestran que existe asociación entre presencia de carcinomatosis peritoneal y localización cardial del tumor, ascitis en TAC, e histología del tipo difuso, con estimadores mayores que dos en todos los casos; existe una significación marginal de dos variables (edad y género) que podría estar reflejando limitaciones relacionadas con el tamaño de la muestra. La marcada imprecisión del estimador de asociación para descripción T3-T4 en TAC (intervalo de confianza demasiado amplio) puede estar reflejando la pequeña cantidad de casos en uno de los estratos (T1-T2).
Decidimos tomar como punto de corte el valor de albúmina de 3mg/dl porque es el valor por debajo del cual está indicado llevar a los pacientes a repleción nutricional prequirúrgica para cirugía resectiva, por haberse documentado más riesgo de infección y complicaciones en general en pacientes desnutridos29.
Con respecto a la pérdida de peso, sabemos que lo ideal sería tener documentada la magnitud de la pérdida y el índice de masa corporal al momento de la valoración inicial; sin embargo, encontramos que estos datos no son adecuadamente registrados en todas las historias clínicas de nuestros pacientes. No obstante, decidimos incluir como dato subjetivo, pero significativo para el paciente, la percepción de pérdida de peso asociada con su enfermedad.
Sabemos que este estudio tiene limitaciones por ser retrospectivo y que la escogencia de los pacientes para laparoscopia, según el criterio de cada cirujano, implica un sesgo de selección. Asimismo, el hecho de no incluir una muestra de validación para probar la capacidad del modelo es una debilidad metodológica, que sería pertinente tener en cuenta para un estudio futuro; sin embargo, consideramos que nuestro trabajo aporta luz sobre los factores de riesgo para carcinomatosis peritoneal en pacientes con adenocarcinoma gástrico avanzado.
Con nuestros hallazgos, recomendamos llevar a laparoscopia de estadificación, al menos, a todos los pacientes de este grupo clínico que tengan uno o más de los factores de riesgo asociados significativamente con carcinomatosis: mujeres, menores de 65 años, con tumores de la unión esófago-gástrica, difusos y presencia de ascitis en la TAC.
Es necesario realizar estudios prospectivos y comparar los hallazgos de la laparoscopia con los de laparotomías no terapéuticas para ampliar y mejorar el cuerpo de conocimientos en este campo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Jorge Mesa, Patólogo, por su ayuda con las imágenes de microscopía.