El cáncer de la glándula tiroides es una neoplasia cuya detección, diagnóstico y tratamiento se realiza de manera interdisciplinaria, por lo tanto el diagnóstico definitivo histopatológico debe ser completo y claro; de modo que pueda ser interpretado de la misma manera por parte del grupo médico tratante. De manera frecuente, los médicos no patólogos que reciben el reporte de un estudio histopatológico de tiroides se enfrentan con dificultades al momento de interpretar el reporte histopatológico y, por lo tanto, en definir la posterior conducta médica. El objetivo de este primer artículo es revisar de manera breve algunos de los diferentes temas que más generan dudas en la interpretación del reporte histopatológico y de las técnicas diagnósticas usadas en patología por parte de los médicos tratantes que tienen un impacto en las decisiones clínicas originadas a partir de la clasificación, estadificación, pronóstico y seguimiento de la enfermedad.
Cancer of the thyroid gland is a neoplasia for which its detection, diagnosis and treatment is interdisciplinary. For this reason, the definitive diagnosis by histopathology should be complete and clear so that it can be interpreted in the same way by the treating medical group. Non-pathology physicians who receive the report of a histopathological study of the thyroid often have difficulties when interpreting the report and therefore in defining the subsequent medical behaviour. The objective of this first article is to review briefly some of the different subjects that generate most doubts in the interpretation of the histopathology report, and the diagnostic techniques used in pathology by the attending physicians that have an impact on clinical decisions arising from the classification, staging, prognosis, and follow-up of the disease.
El cáncer de la glándula tiroides es la neoplasia más frecuente del sistema endocrino con un incremento llamativo de su incidencia en los últimos años1. Según datos del SEER (Surveillance, Epidemiology, and End Results Program) del National Cancer Institute, en Estados Unidos el cáncer de tiroides corresponde al 4% de todas las neoplasias recientemente diagnosticadas con aproximadamente 13,5 nuevos casos por cada 100.000 habitantes2. La tasa de sobrevida ha sido estimada en 97,9% a 5 años con una mortalidad baja, calculada en aproximadamente 0,5 por 100.000 personas/año2. Afecta con mayor frecuencia a las mujeres con una relación aproximada de 3 a 1 en países desarrollados3,4. La tasa ajustada de incidencia en Colombia para el período entre 2007 y 2011 fue de 1,1 por cada 100.000 hombres y 9,7 por cada 100.000 mujeres ocupando el décimo lugar en frecuencia5.
La comprensión clara del reporte histopatológico del cáncer de tiroides depende que el especialista a cargo del manejo médico (cirujano, endocrinólogo, médico nuclear) adopte decisiones calibradas a la justa medida del riesgo de persistencia, recurrencia y muerte por la enfermedad; ya que pequeños detalles en la patología pueden promover grandes diferencias de manejo.
El objetivo de este primer artículo es revisar brevemente algunos de los temas que más dudas generan al interpretar el reporte histopatológico del cáncer diferenciado de tiroides.
Variantes agresivas del carcinoma papilar de tiroides. ¿Cuándo son agresivas?El carcinoma papilar de tiroides (CPT) corresponde del 85 al 90% de las neoplasias malignas de la glándula tiroidea6,7. Tiene alrededor de 13 variantes histopatológicas (tabla 1) según la Organización Mundial la Salud (OMS) que comparten los rasgos citopatológicos del CPT8, pero algunas muestran perfiles genéticos diferentes9. Las variantes de mayor agresividad y riesgo comparadas con el CPT de patrón clásico son: esclerosante difusa, células altas, células columnares, patrón sólido8 y, más recientemente, la variante con células prominentes en forma de tachuela (hobnail)10. En la variante folicular pura del carcinoma papilar se han descrito tres subtipos de esta variante: encapsulado, difuso o multinodular y macrofolicular (goiter-like). El subtipo difuso está asociado a un mayor riesgo de invasión vascular, compromiso ganglionar y metástasis a distancia al diagnóstico. Se presume que en el futuro próximo podría ser categorizado como una variante de alto riesgo11.
Variantes histológicas del carcinoma papilar de tiroides
| 1. Microtumor papilar |
| 2. Microcarcinoma papilar |
| 3. Variante folicular |
| Variante o subvariante encapsulada |
| Variante o subvariante difusa |
| Variante o subvariante macrofolicular (Bocio-like) |
| 4. Variante célula alta |
| 5. Variante célula columnar |
| 6. Variante sólida |
| 7. Variante esclerosante difusa |
| 8. Variante oncocítica (células de Hurthle) |
| 9. Variante Whartin-like |
| 10. Variante célula clara |
| 11. Variante cribiforme-morular |
| 12. Carcinoma papilar con características prominentes en tachuela (hobnail) |
| 12. Carcinoma papilar con estroma fascitis-like |
Los patólogos frecuentemente basan sus reportes en las recomendaciones del Colegio Americano de Patología (CAP)12 y de la International Union Against Cancer (UICC)13. Existe consenso en torno a la recomendación de identificar y denominar las variantes del CPT en el reporte final de patología12–17. Cuando las células altas representan al menos el 50% del universo celular del tumor, se le denomina variante de células altas18,19. Lo mismo ocurre con la variante sólida20. Sin embargo, no hay criterios universales para establecer el porcentaje de representatividad que deben tener los demás tipos celulares para tipificar la variante como de alto riesgo. En el Instituto Nacional de Cancerología de Bogotá, Colombia (INC), se considera subjetivamente que para establecer la predominancia de una variante agresiva debe estar representada en al menos el 30% de las células tumorales.
Existen patrones combinados, es decir, con dos o más variantes histológicas. Se componen de un subtipo predominante, correspondiente a la variante histológica con la mayor representación porcentual entre las células tumorales, y de un subtipo secundario, correspondiente a la variante histológica con el siguiente porcentaje de frecuencia. Aún no se sabe si el comportamiento clínico de estos patrones es más agresivo. Los resultados obtenidos en estudios nacionales sugieren que los patrones combinados aumentan el riesgo de metástasis en ganglios linfáticos regionales y el riesgo de mayor extensión extratiroidea en comparación con los tumores de una sola variante20. En la serie de Nikiforov et al.21 los CPT de patrón combinado fueron las variantes más frecuentes inclusive entre los microcarcinomas papilares. El 44,1% de los microcarcinomas presentó un patrón combinado que desarrolló metástasis; 46,6% en ganglios linfáticos entre las cuales 26,6% cursaron con extensión tumoral al tejido adiposo periganglionar.
¿Microtumor papilar o microcarcinoma papilar? ¿Cuál es la diferencia?Históricamente a todo CPT con diámetro ≤ 1cm se le ha denominado microcarcinoma. Sin embargo, dado que no todos comparten el mismo comportamiento biológico y que eso impacta en las decisiones de manejo, se les ha dividido en microcarcinoma y microtumor papilar de tiroides22.
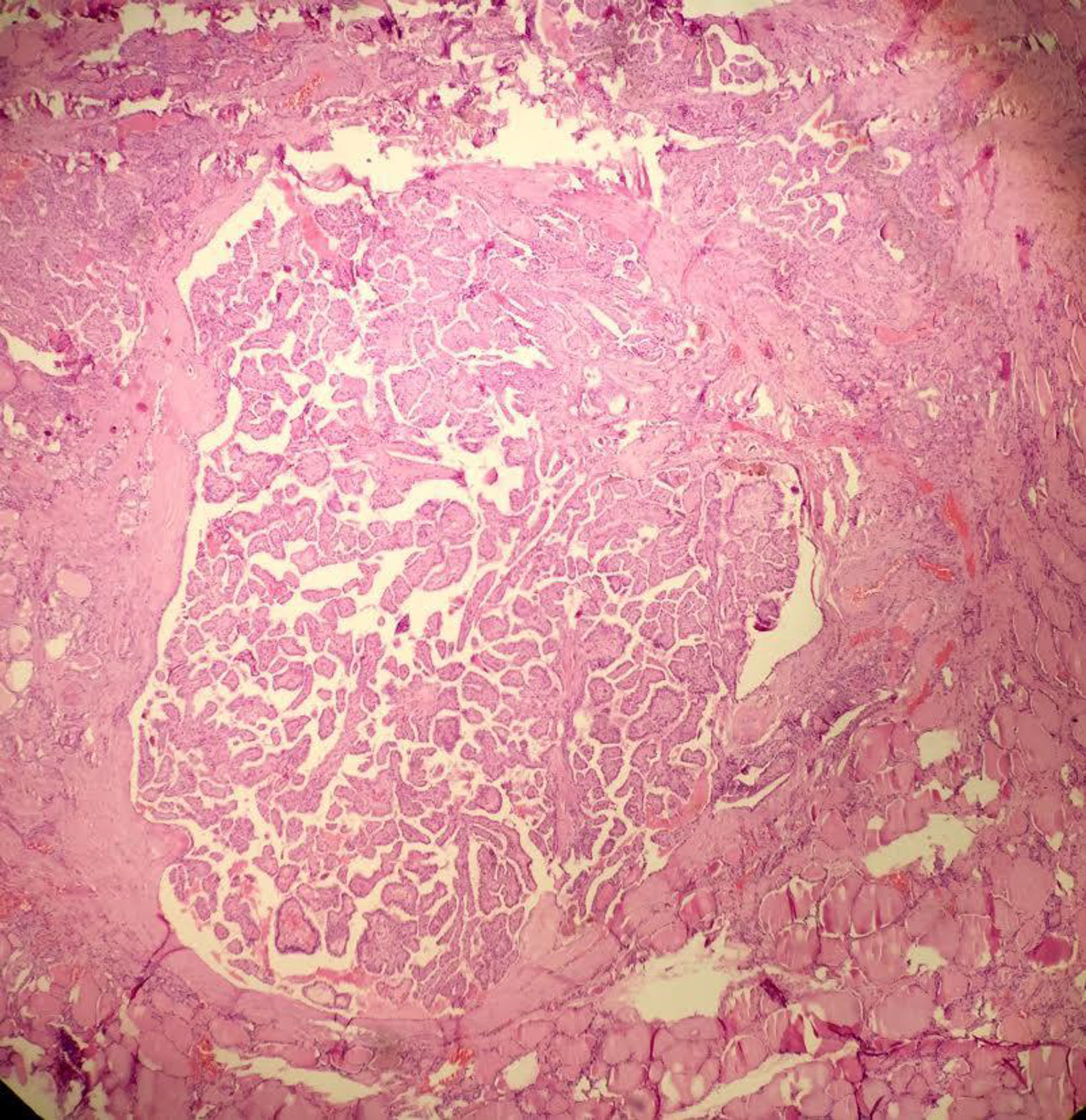
La OMS define el microcarcinoma papilar de tiroides como un carcinoma papilar (con las características citológicas clásicas) que casi siempre se diagnostica incidentalmente en el transcurso de la evaluación histopatológica o ecográfica de una alteración presumiblemente benigna ≤ 1cm de diámetro4. A pesar del comportamiento biológico, aparentemente “benigno” del microcarcinoma papilar, es bien sabido que se puede presentar metástasis u otros factores de agresividad como la invasión capsular o extratiroidea22–24 que en muchos casos hace necesario practicar manejos complementarios con cirugía y terapia con yodo radiactivo (I-131). En contraste, el microtumor papilar, también ≤ 1cm, tiene un comportamiento biológico más predecible puesto que no tiene características histológicas que le confieran riesgo de recaída, lo que prácticamente los convierte en lesiones “no malignas” o indolentes. En consecuencia, el tratamiento está limitado al acto quirúrgico inicial sin necesidad de manejos complementarios. Los criterios histológicos del microtumor papilar de tiroides son: a) tamaño menor ≤ a 1cm; b) ausencia de metástasis en el momento del diagnóstico; c) presente solo en pacientes adultos (se excluye todo paciente menor de 19 años); d) lesión unifocal o lesiones multifocales, dos o más lesiones ≤ 1cm (en el caso de ser multifocal que la sumatoria de los diámetros no exceda 1cm); e) sin invasión capsular, sin compromiso vascular (venoso o arterial) y sin variante histológica de alto riesgo (como células altas o células columnares); f) puede presentarse concomitante con lesión benigna; g) puede detectarse en el preoperatorio por imágenes diagnosticas o que sea un hallazgo incidental en la pieza quirúrgica22. Este término ya está aceptado por la OMS y mundialmente está teniendo un incremento en su diagnóstico23,25,26 (fig. 1).
Tumores tiroideos borderline. ¿Qué hacer con ellos?Los tumores tiroideos en el límite de la malignidad (borderline) son categorías poco conocidas por el clínico en donde se clasifican las lesiones tiroides y no es claro su comportamiento biológico23,27,28; en estas incluyen:
- a.
Tumor bien diferenciado de potencial de malignidad incierto (WT-UMP): Se define como tumor primario tiroideo, encapsulado, constituido por células foliculares bien diferenciadas con cambios citológicos cuestionables de CPT, sin evidencia de invasión vascular y en donde la invasión capsular está ausente o es cuestionable. Se entiende por cambios citológicos cuestionables de carcinoma papilar aquellos cambios que no alcanzan a completar la citología típica de CPT.
- b.
Tumor folicular de potencial de malignidad incierto (FT-UMP): Tumor primario tiroideo, encapsulado, constituido por células foliculares bien diferenciadas con invasión capsular cuestionable, sin invasión vascular y sin cambios citológicos de CPT.
- c.
Carcinoma bien diferenciado sin otra especificación (WDC-NOS): Es un tumor encapsulado, constituido por células foliculares bien diferenciadas que muestran obvia e inequívoca invasión vascular y/o capsular pero que tiene características citológicas “cuestionables” de CPT.
- d.
Adenoma folicular atípico (AFA): Se refiere a una neoplasia folicular encapsulada que exhibe alta celularidad, atipia nuclear o algún patrón histológico inusual (incremento en la actividad mitótica, patrón fusocelular, etc.), pero que carece de invasión vascular o capsular.
El manejo de las lesiones que sean clasificadas como WT-UMP, FT-UMP o AFA, debe ser el seguimiento y control clínico, mientras que los WDC-NOS han de manejarse como un carcinoma diferenciado de tiroides dependiendo del riesgo en que se clasifique la lesión.
Grado histológico de los carcinomas tiroideos. ¿Se debe asignar?Asignar graduación histológica al CPT o al carcinoma folicular (CFT) tiene muy poca utilidad ya que el 95% de estos son bien diferenciados29.
La UICC recomienda que todos los carcinomas de cabeza y cuello (haciendo el comentario extensivo a los de la glándula tiroides) se les debe asignar grado histológico de la forma tradicional conocida9; sin embargo, este sistema de graduación está basado principalmente sobre carcinoma escamocelular del tracto aerodigestivo, pero que no necesariamente se acomodan a los carcinomas tiroideos. La OMS en general clasifica los carcinomas primarios tiroideos de origen folicular en: papilar, folicular, pobremente diferenciado e indiferenciado o anaplásico, siendo para el clínico el CPT y el CFT los carcinomas diferenciados. Entonces, ¿dónde quedaría el moderadamente diferenciado? La respuesta es: NO existe. Por lo cual la sugerencia de la UICC no sería plausible aplicarla a tiroides. Es por esto que no se deben graduar los carcinomas tiroideos, siendo esta consideración la misma sugerencia de la OMS6.
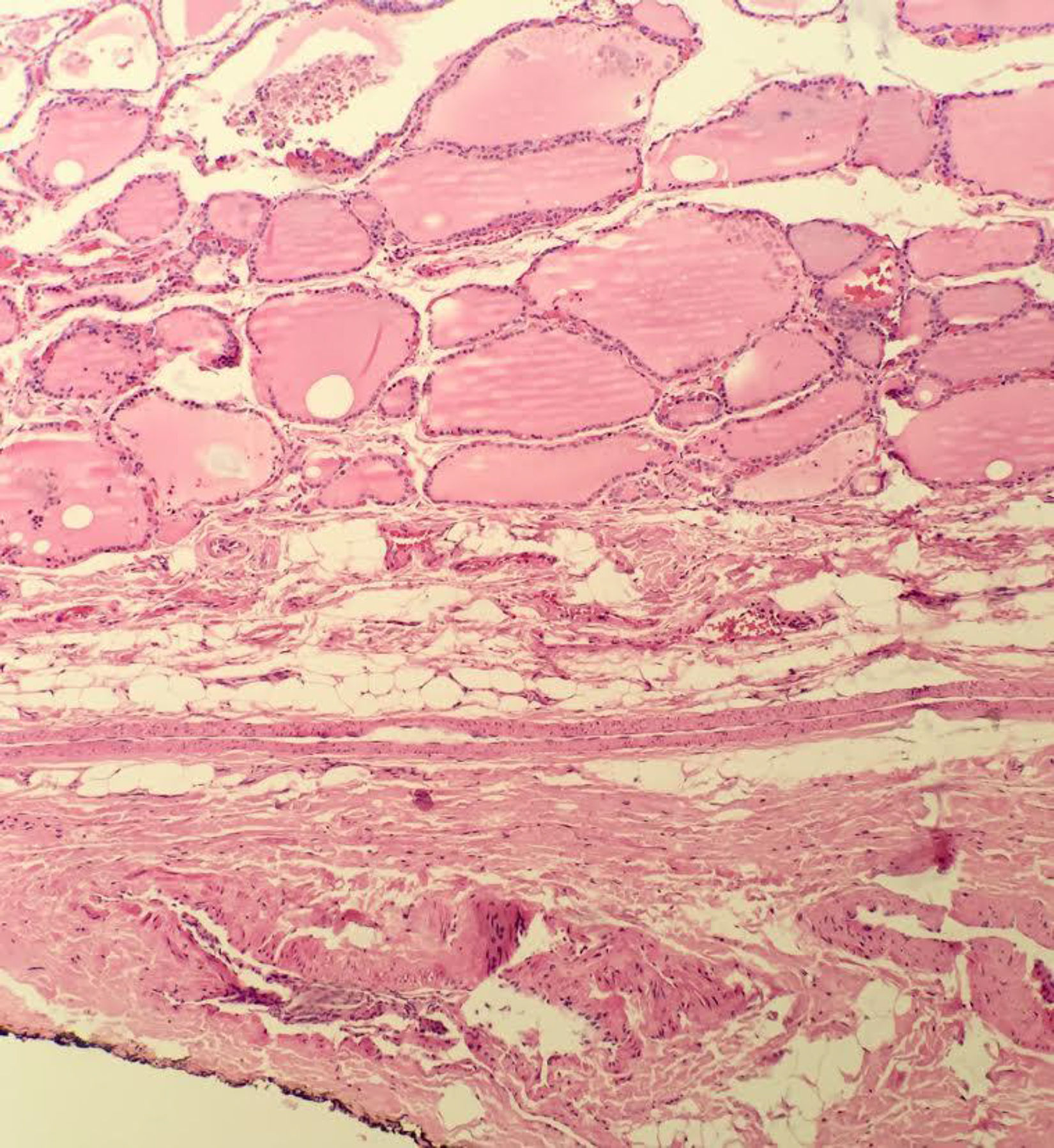
Extensión tumoral extratiroidea (ETE). ¿Cómo definir una extensión extratiroidea mínima?La ETE constituye uno de los peores factores pronósticos en CPT siendo este hallazgo una variable independiente asociada con un incremento hasta de seis veces la mortalidad asociada al tumor, sin siquiera mencionar el asociado a la recaída locorregional30,31.
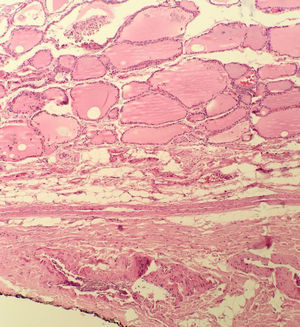
La ETE está definida como el compromiso de la lesión tumoral primaria a los tejidos blandos peritiroideos. La glándula tiroides en general no tiene una cápsula fibrosa anatómica bien definida, por lo tanto en muchos casos el tejido “peritiroideo” (que en general es tejido adiposo, vasos sanguíneos o pequeños filetes nerviosos) entra íntimamente en contacto con el parénquima haciendo que se diagnostique la ETE fácilmente si hay tumor en estos tejidos (fig. 2).
Sin embargo, esta invasión aparentemente “obvia” no se considera para algunos autores como una verdadera ETE y sugieren que más bien la invasión del músculo esquelético en los lóbulos laterales del tiroides es la principal clave diagnóstica para evaluar la ETE. Esto a diferencia del istmo, que normalmente puede estar en contacto o incluso dentro de la misma glándula (fibras musculares esqueléticas del músculo de Soemmrring o musculo elevador del tiroides), por lo cual la interpretación de la ETE en un nódulo del istmo requiere una estricta correlación con los hallazgos intraoperatorios y de los hallazgos en el examen histológico en busca de invasión en otras estructuras del cuello, tales como cartílago laríngeo o esófago15.
La ETE extensa sí es más fácil de definir así como para estadificar (T4), ya que por lo general se define clínicamente (específicamente por el cirujano) por la documentación de carcinoma mucho más allá de la glándula tiroides con invasión directa (es decir, no metástasis) en una o más de las siguientes estructuras: tejidos blandos subcutáneos, vísceras adyacentes (incluyendo la laringe, la tráquea y/o el esófago), nervio laríngeo recurrente, arteria carótida o los vasos sanguíneos del mediastino. Por lo tanto, la ETE mínima podría definirse como todo compromiso de tejidos blandos extratiroideos que no cumpla los criterios de un T4.
Bordes de sección y marcación con tinta china. ¿Cuál es su importancia?En histopatología oncológica es una práctica convencional informar el estado de los márgenes de resección y la glándula tiroides no es la excepción. Sin embargo, a diferencia de lo que ocurre con órganos huecos, tales como los del tracto gastrointestinal donde hay continuidad de las vísceras, la resección completa de la tiroides no deja un margen quirúrgico o patológico verdadero. El margen se define como la superficie más externa de la glándula o el borde entintado de la muestra. La presencia de tumor en dicho margen no necesariamente significa que se ha hecho una escisión incompleta de la glándula, aunque la presencia de tumor en contacto con la tinta china sí implica que por lo menos hay células tumorales microscópicas residuales12.
No hay datos concretos sobre el impacto de reportar “tumor en contacto con la tinta china” como una variable independiente o conjunta, más aún, un estudio reciente sugiere que no tiene valor pronóstico como predictor independiente para recaída local32.
De rutina el patólogo pinta con tinta china los bordes de la glándula tiroides para describir en detalle la extensión microscópica del tumor. La información puede serle útil al médico tratante para la toma de decisiones de manejo, especialmente al asumirla en compendio con otros factores de agresividad.
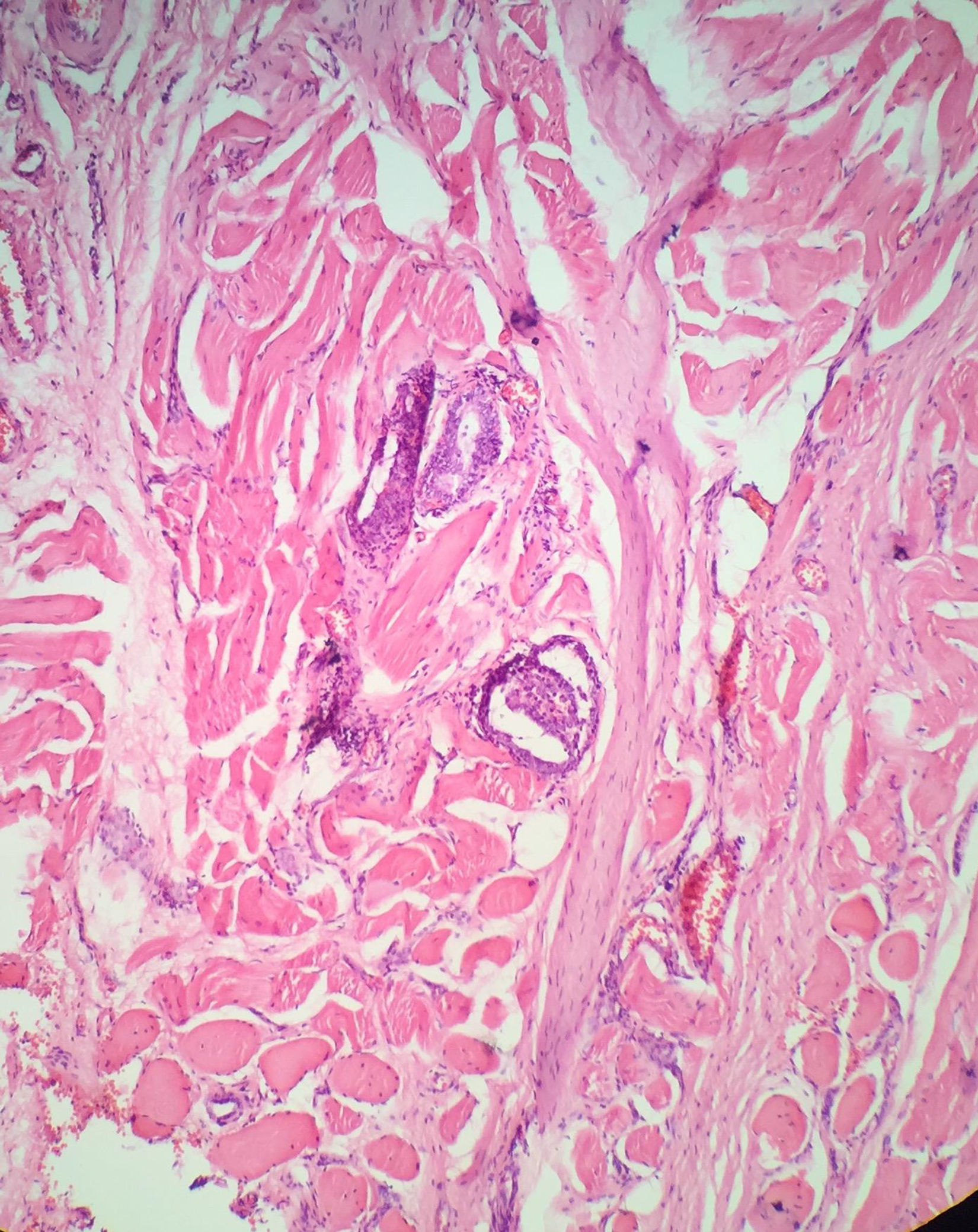
Cápsula tiroidea y cápsula tumoral. ¿Cuál es la que interesa?Como se mencionó previamente la glándula tiroides no tiene una cápsula fibrosa anatómica bien definida.
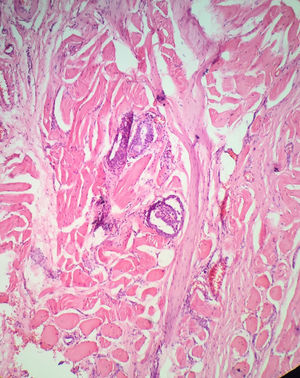
Al momento de examinar la lesión tumoral en el microscopio es importante ver el margen marcado con tinta para conocer la localización del tumor y reconocer si la lesión tiene una cápsula bien definida. El término de invasión capsular debe aplicarse únicamente para la cápsula tumoral (CT) y no para la cápsula de la glándula tiroides (CGT) en caso de que esta exista. La invasión de la CT se define como la transgresión completa e inequívoca de la cápsula fibrosa por las células tumorales33. No es infrecuente que el patólogo reporte el compromiso de la cápsula del órgano sin ETE. En este caso lo que está traduciendo es que el órgano sí tiene cápsula y que esta está comprometida por el tumor, pero que todavía no hay extensión a los tejidos blandos peritiroideos (tumor limitado a la glándula tiroides), es decir que máximo sería un T2 y no un T3 como hasta hace algún tiempo fue interpretado34 (fig. 3).
Invasión vascular linfática y no linfática. ¿Qué es entonces la angioinvasión?Debe diferenciarse entre invasión linfática y no linfática (venosa o arterial, o también llamada angioinvasión), ya que esto es un factor importante en el pronóstico del paciente. Por lo general los CPT tienden a realizar metástasis a través de invasión linfática, mientras que los carcinomas foliculares por vía hematógena8.
La angioinvasión se define como la penetración de células tumorales en el lumen vascular y que deben estar recubiertas por una capa de células endoteliales. La presencia exclusiva de células tumorales en la luz del vaso perse no hace diagnóstico de invasión, ya que como es frecuentemente reportado, puede haber “arrastramiento” de células tumorales en el procesamiento inicial de la pieza quirúrgica incurriendo en la posibilidad de sobre diagnosticar la invasión vascular, por lo cual se debe ser estricto en visualizar la endotelización del foco tumoral y en el caso que no se observe este recubrimiento; la presencia de un trombo tumoral puede utilizarse como criterio de invasión vascular33.
RecomendaciónUna clara comunicación entre el patólogo y el clínico son los elementos fundamentales para evitar inadecuadas interpretaciones sobre el reporte histopatológico. Constituye entonces una obligación del patólogo reportar de forma clara todos aquellos ítems que puedan crear dudas al clínico con el fin de evitar tratamientos complementarios inadecuados o subtratamientos a los pacientes y, recíprocamente, el clínico entender y comprender el significado de los hallazgos histopatológicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.