De todas las neoplasias malignas de mama los carcinomas ductales son los más frecuentes. Menos del 5% son denaturaleza metaplásica y 0,04%-0,1% presentan diferenciación de células escamosas, subtipo que se considera más agresivo. Debido a los pocos casos en la literatura,no hay consenso sobre su diagnósticoy tratamiento. Presentamos tres casos con ese diagnóstico vistos entre 2014 y 2015 en nuestra institución y que corresponden a mujeres de 57, 49 y 65 años sin factores de riesgo y que presentaron cuadros clínicos similares consistentes con aparición de masa de crecimiento rápido. Dos de las pacientes se habían diagnosticado previamente con carcinoma ductal infiltrante de tipo no especial en biopsias por tru-cut con diagnóstico definitivo en la mastectomía radical que reportó en todos los casos carcinoma metaplásico escamoso confirmado por inmunohistoquímica.
Ductal carcinomas are the most common of all breast malignancies, less than 5% are of metaplastic nature, and 0.04% to 0.1% have squamous cell differentiation. These special subtypes are considered more aggressive. Due to the few cases in the literature, there is no consensus about its diagnosis and treatment. Three cases are presented with this diagnosis, seen in our institution between 2014 and 2015. They were women of 57, 49, and 65 years old with no risk factors, and who presented with similar clinical features, consisting of the appearance of a rapid growing mass. Two of the patients had been previously diagnosed with infiltrating ductal carcinoma of no special type by core needle biopsy, with a definitive diagnosis in radical mastectomy, which reported squamous metaplastic carcinoma confirmed by immunohistochemistry.
El carcinoma metaplásico de mama (MBC) se refiere a un tipo de neoplasias mamarias que muestran características microscópicas que distan de la diferenciación glandular usual. El MBC es infrecuente y tiene una prevalencia de 0,2-5% respecto a todas las neoplasias malignas mamarias1,2, con riesgo de desarrollarlo en otras entidades benignas como papilomas o en el tejido mamario ectópico3. El MBC en la variedad de células escamosas (SCC) es una entidad aún más rara con una prevalencia estimada de 0,1%4,5. Su diagnóstico clínico y radiológico es difícil por lo que muchas veces se confunde con lesiones benignas6 aunque su rápido crecimiento alerta sobre su comportamiento agresivo.
Se ha visto que los factores pronósticos más importantes son el tamaño tumoral y la edad, característica que comparte con otros tipos de carcinoma7. Su diagnóstico puede representar desafíos principalmente por la dificultad en reconocer el componente metaplásico como primario en mama1,2. Por lo inusual de este subtipo, en la presente revisión se exponen los casos de tres pacientes diagnosticadas con carcinoma metaplásico escamoso de mama que fueron identificados en el Hospital Universitario del Caribe en Cartagena de Indias entre 2014 y 2015. El diagnóstico definitivo fue hecho en espécimen completo; dos de ellas tenían diagnóstico anatomopatológico previo por biopsia con aguja tru-cut de carcinoma ductal infiltrante de tipo no especial. A los tres casos se le hizo confirmación por inmunohistoquímica.
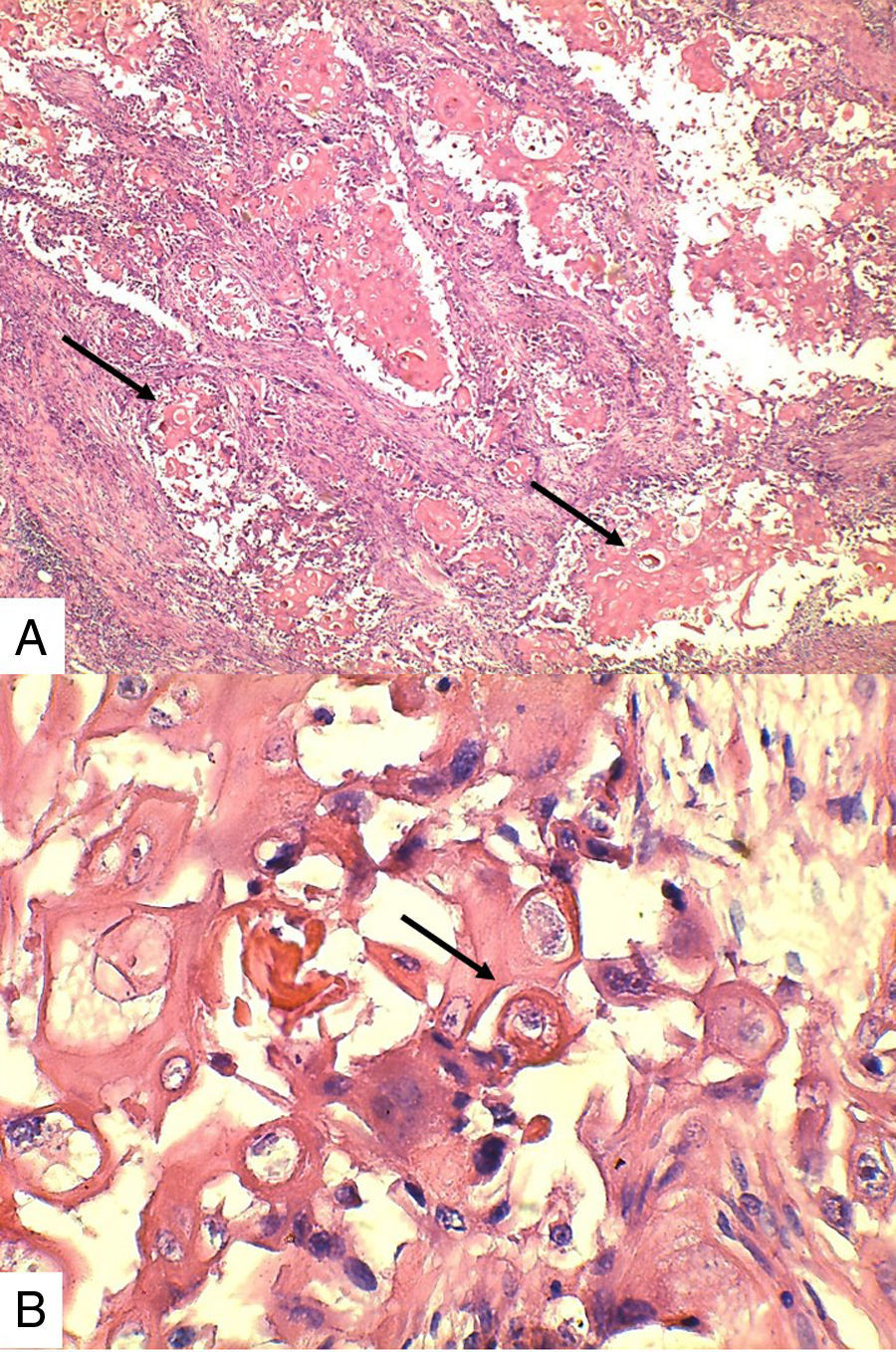
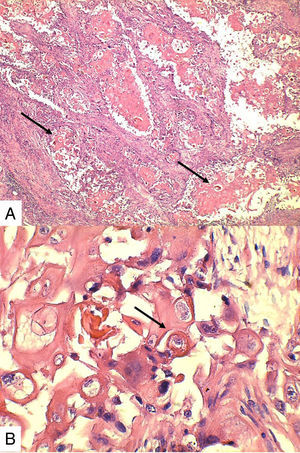
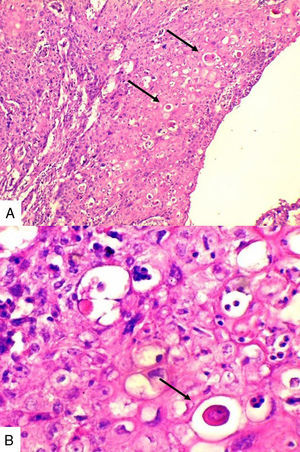
Caso 1Paciente de 57 años natural de Barranquilla, no fumadora sin antecedentes personales ni familiares de neoplasia, con cuadro clínico de tres meses de evolución consistente en sensación de masa dolorosa en mama izquierda con aumento de tamaño. Presentó mamografía que reportaba BIRADS III probablemente benigna. En otra institución se le solicitó biopsia mediante aguja tru-cut y reportó carcinoma escamocelular de mama. En la valoración clínica se identificó lesión ulcerada en mama izquierda con secreción serohemática compatible con sobreinfección bacteriana. Madre de dos hijos obtenidos por vía vaginal, antecedente quirúrgico de enucleación de ojo izquierdo secundario a trauma. Se recibió en el laboratorio de patología producto de mastectomía radical izquierda con vaciamiento ganglionar con nódulo blanquecino localizado en cuadrante inferior interno. Al corte se reconoció lesión cavitada de 6x5cm en relación con nódulo antes descrito. Al disecar la grasa axilar se obtuvieron siete nódulos que en promedio midieron 2x2cm. Los hallazgos histológicos evidenciaron lesión tumoral maligna de linaje epitelial constituido por proliferación de células grandes pleomórficas, con núcleos grandes e hipercromáticos con mitosis atípicas, que se disponen en nidos sólidos invadiendo el estroma, con formación de perlas de queratina y necrosis, sin compromiso de vasos linfáticos dérmicos(fig. 1). La lesión estaba en contacto con el margen de resección profundo. Todos los ganglios linfáticos se encontraron comprometidos por lesión tumoral.
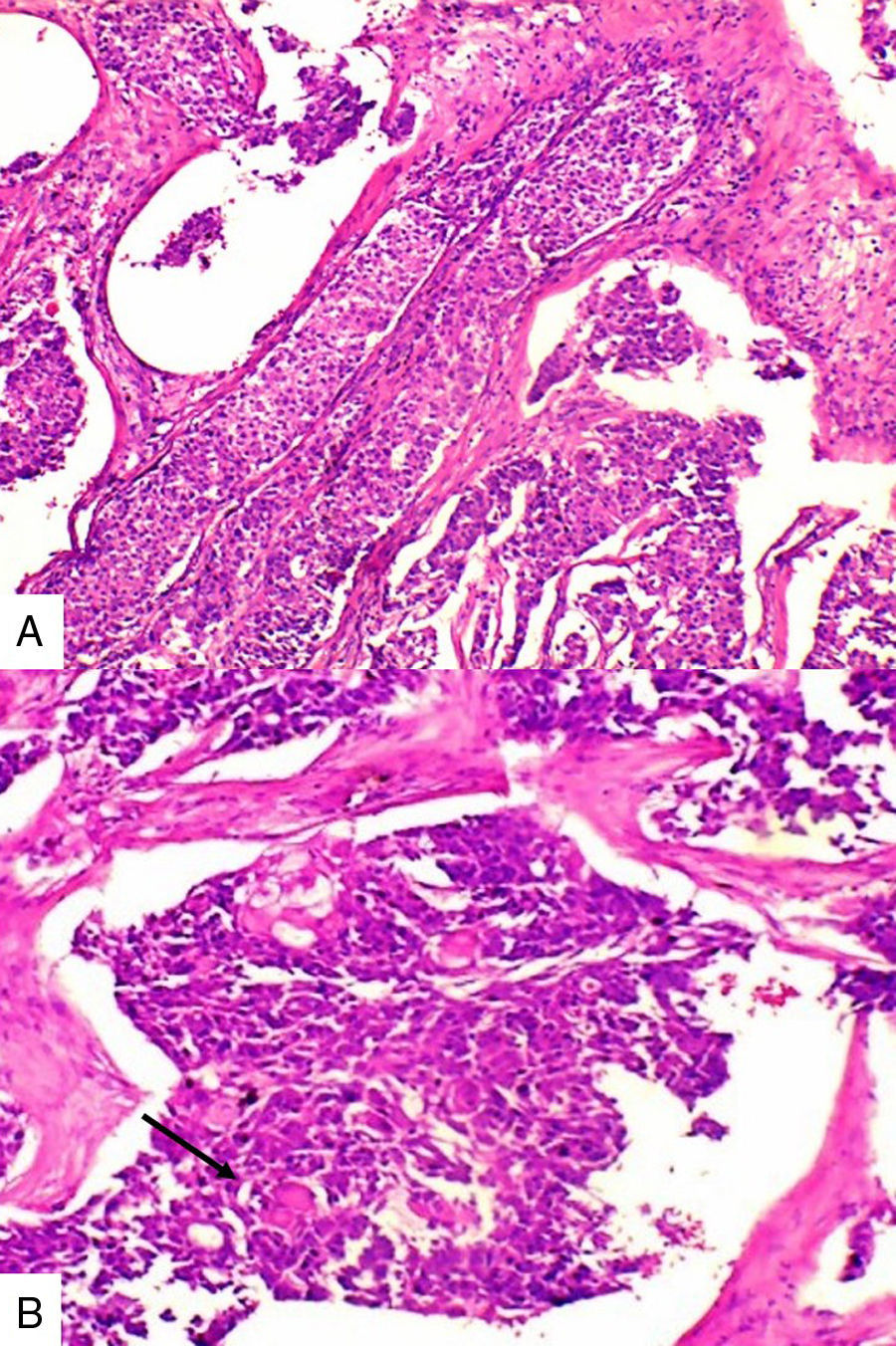
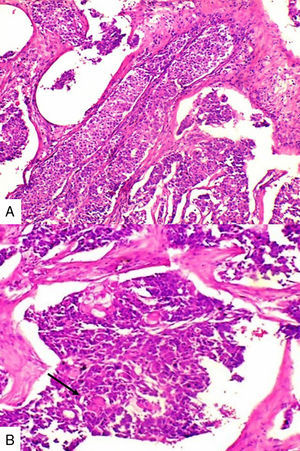
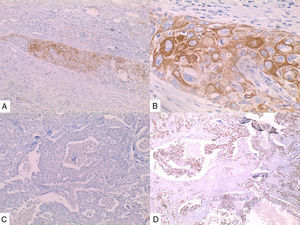
Caso 2Paciente de 49 años natural de Cartagena, no fumadora con antecedente de hipertensión arterial y diabetes mellitus tipo 2 en tratamiento oral. En una biopsia por aguja tru-cut en 2014 se diagnosticó carcinoma ductal infiltrante de tipo no especial. La inmunohistoquímica reportó triple negatividad. Se le inició tratamiento neoadyuvante que fue suspendido debido a trámites administrativos. Dos meses después consultó por masa en axila derecha, dura, fija y dolorosa a la palpación. Durante su valoración se encontró una segunda masa indolora en el cuadrante superior de la mama derecha. Se le practicó mastectomía radical modificada derecha con vaciamiento axilar. En la superficie de corte se mostró masa de 5,2x5cm con áreas de necrosis central y hemorragia, distante del margen de resección profundo a 0,65cm. Se disecaron 9 nódulos, el mayor de 1,2x1cm. Microscópicamente se identificó proliferación de células de tamaño pequeño de aspecto epidermoide pleomorfas, con alta tasa de figuras mitóticas que formaban perlas de queratina y se disponían en nidos sólidos (fig. 2), acompañado de componente in situ. Se evidenció invasión linfovascular. Todos los ganglios linfáticos resecados se vieron comprometidos, con extensión extranodal.
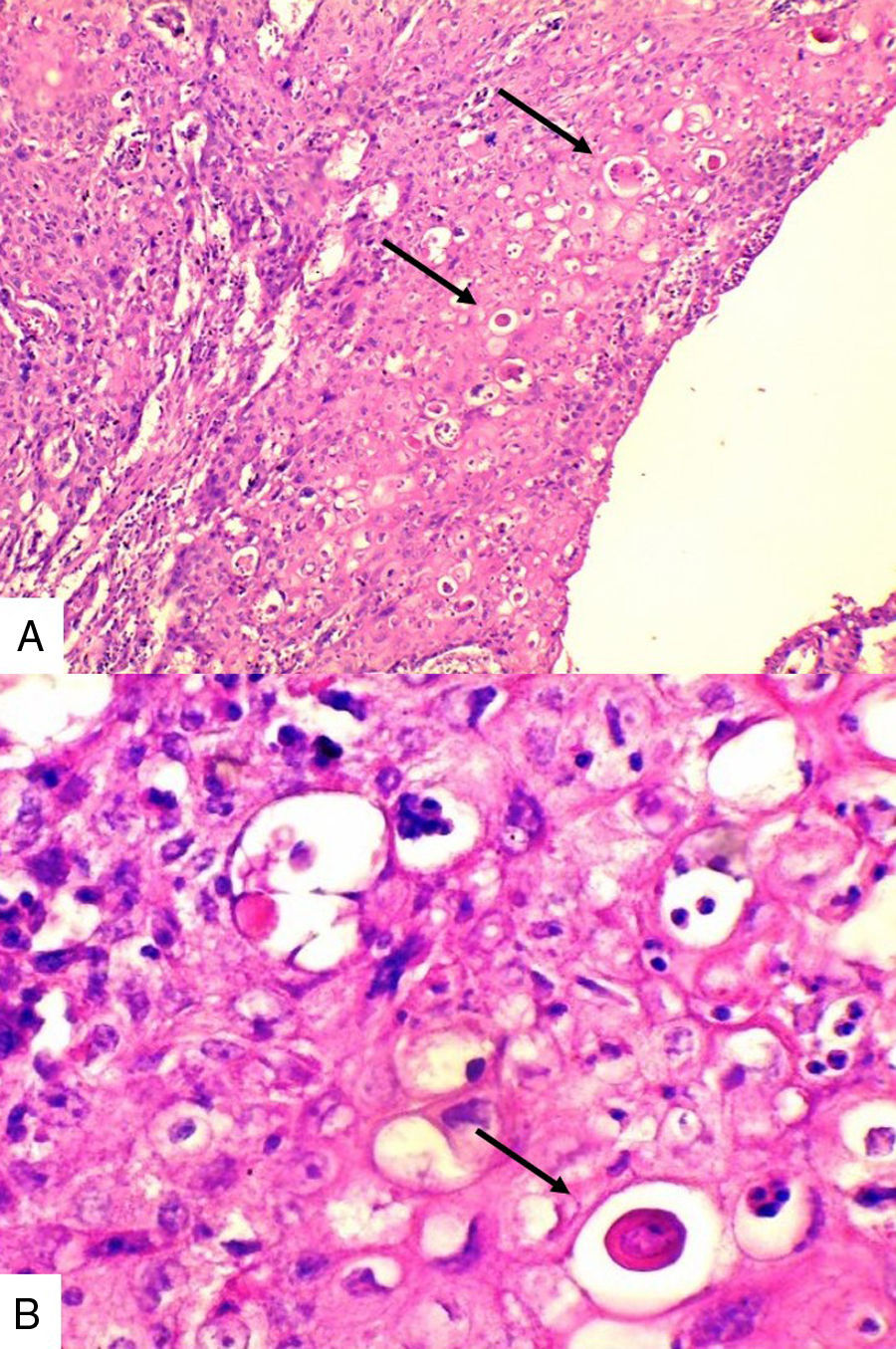
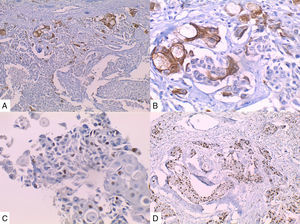
Caso 3Mujer de 65 años natural de Cartagena, no fumadora, con antecedente de cardiopatía isquémica que presentaba cuadro de cinco meses de evolución caracterizado por masa indurada en mama derecha, dolorosa y de crecimiento rápido en el último mes. La mamografía reportaba BIRADS V. En abril de 2015 se le hizo biopsia por aguja tru-cut y se reportó carcinoma ductal infiltrante grado histológico 3. Posteriormente se le realizó terapia neoadyuvante y se le practicó mastectomía radical modificada, espécimen que pesó 1060g. Al corte se identificó lesión cavitada de 6x5,5cm en la confluencia de los cuadrantes laterales, distando 0,7cm del margen profundo. Al disecar la grasa axilar se obtuvieron 12 nódulos, el mayor de 2cm. En los hallazgos histológicos se observó una neoplasia maligna epitelial conformada por células epidermoides intermedias, muy pleomórficas con queratinización y alta tasa de mitosis que formaban nidos sólidos infiltrando el estroma circundante (fig. 3). Se evidenciaron dos ganglios comprometidos por macrometástasis sin extensión extranodal.
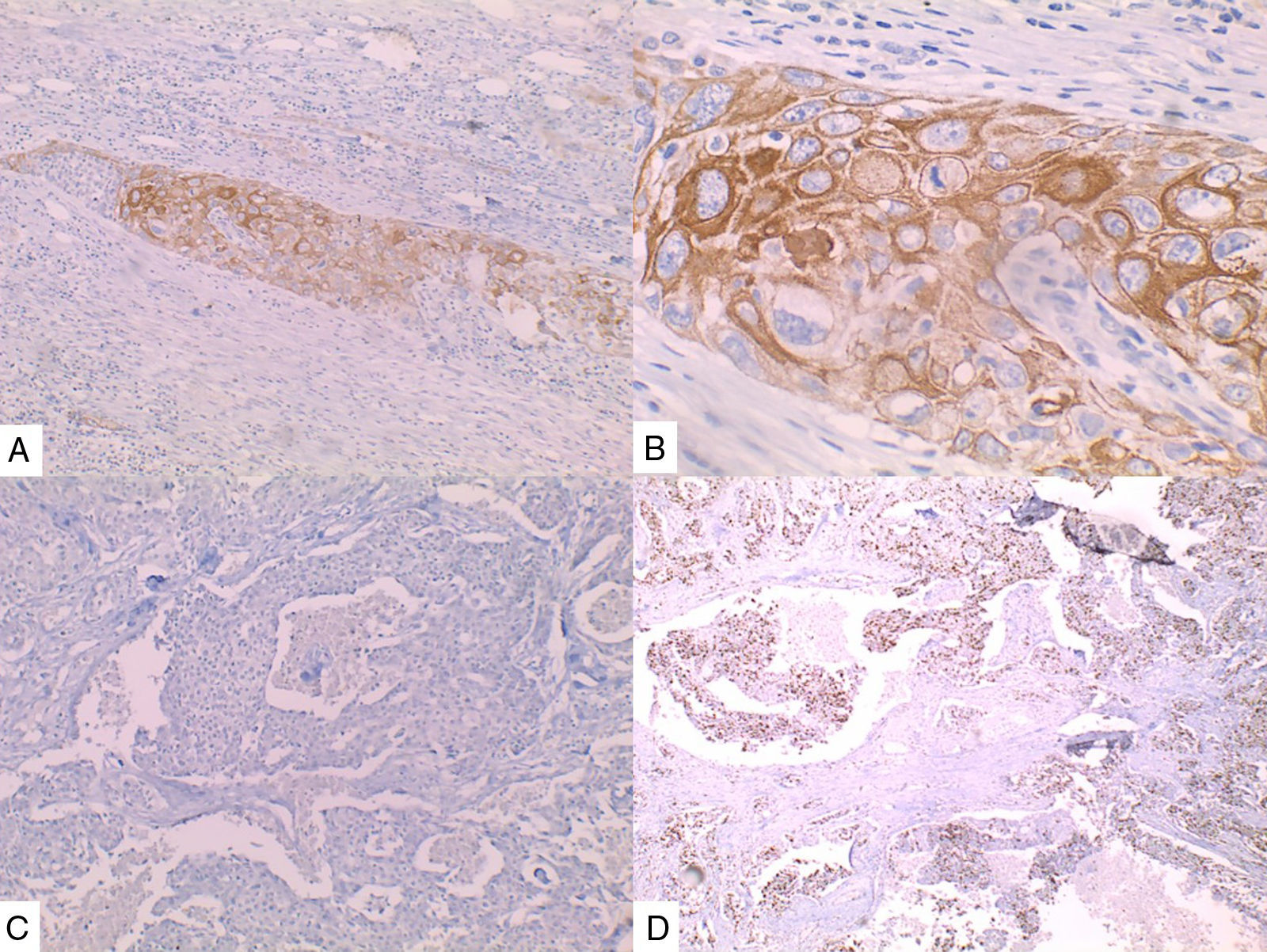
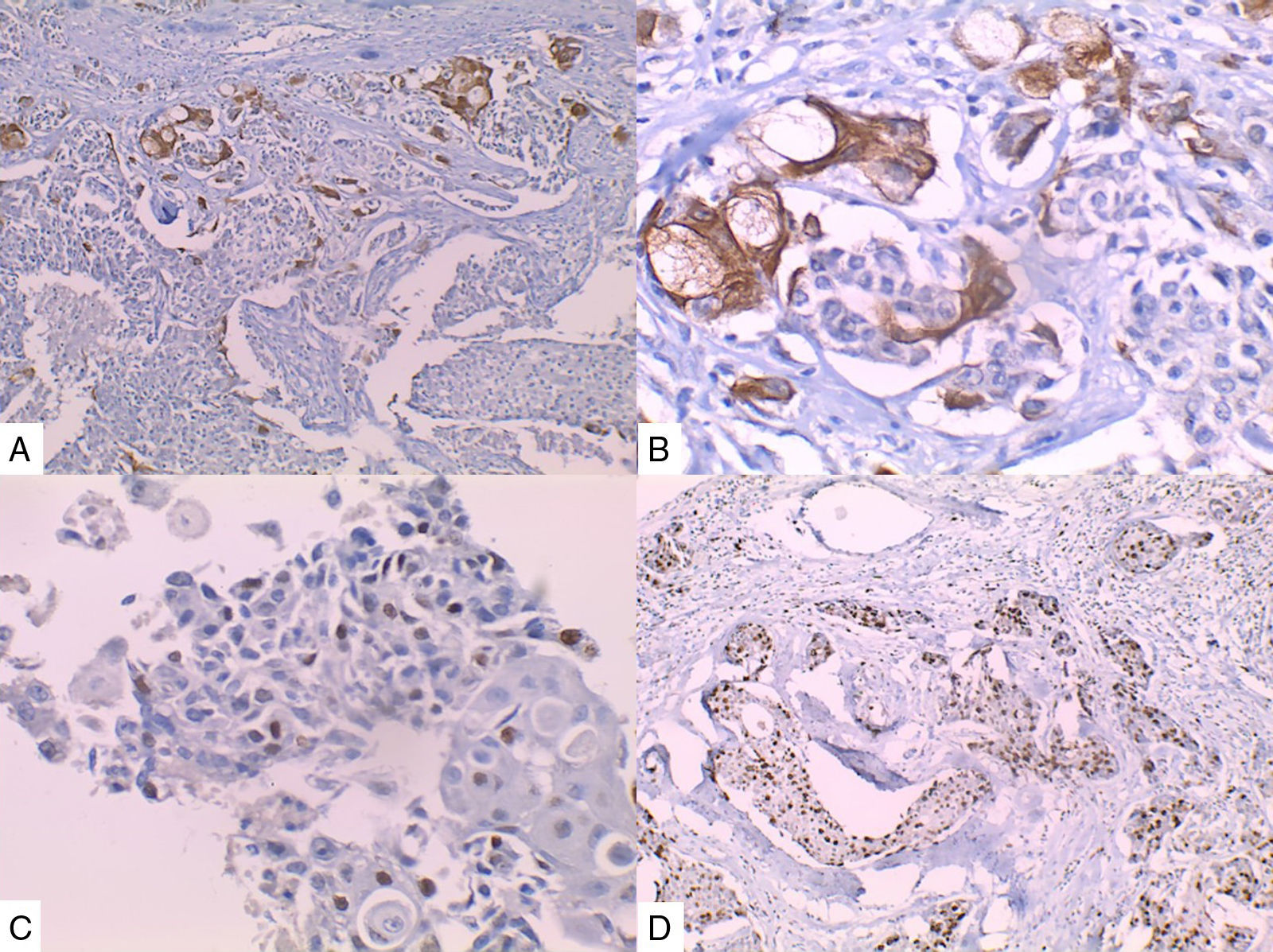
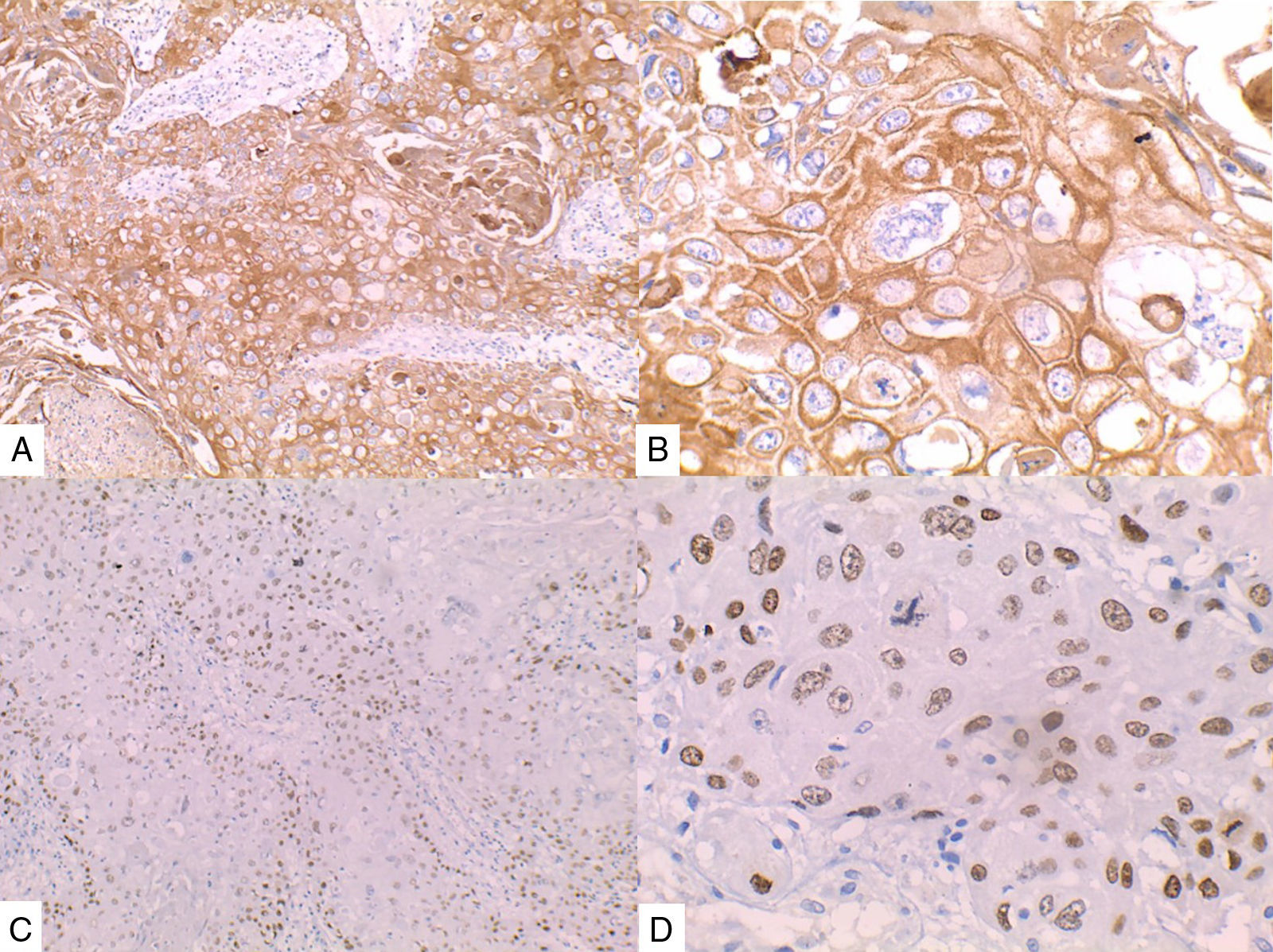
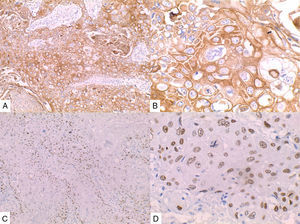
La inmunohistoquímica de los tres casos mostró positividad para P63, CK 5/6 y negatividad para RE y RP (figs. 4, 5 y 6), así como para el receptor del factor de crecimiento epidérmico humano (HER2) con tasa de proliferación superiores al 14% (medida por Ki 67). Considerando los hallazgos se diagnosticó MBC de células escamosas con inmunoperfil triple negativo. Todos los casos tenían componente ductal infiltrante grado nuclear II: el caso 1y3 en un 5% y el caso 2 en un 10%.
El carcinoma ductal infiltrante es el más frecuente de todas las neoplasias malignas de mama. Eventualmente todo o una porción del epitelio maligno detectado en un carcinoma de mama se somete a un proceso de metaplasia, siguiendo un patrón de crecimiento diferente del glandular y suele caracterizarse por una mezcla de dos o más componentes. Los carcinomas metaplásicos corresponden al 5% de todos los carcinomas primarios de mama1, pudiendo presentar manifestaciones clínicas similares y distribución por edad igual a otros carcinomas invasivos de mama1,8.
La Organización Mundial de la Salud (OMS) clasifica el MBC en tipo epitelial y de tipo mixto9. El primero se clasifica a su vez en carcinoma de células escamosas, adenocarcinoma de células fusiformes, y carcinoma adenoescamoso9,10. El pronóstico en cada uno de ellos varía ampliamente, lo que suele ser un problema en la práctica clínica. Es recurrente la carencia de una correlación entre el patrón microscópico y el pronóstico, concluyendo que la subclasificación patológica no tiene significación clínica por lo que el MBC debe ser considerado como una sola entidad2,10–13. Los 3 casos descritos corresponden a un MBC escamoso.
La variedad de células escamosas (SCC) es una entidad muy rara con muy pocos casos publicados en la literatura médica. Su prevalencia se estima del 0,04% al 0,1%4,5 de todas las neoplasias malignas de mama siendo incluso difícil esta prevalencia de definir1,9,12,13. Al revisar las bases de datos disponibles de Latinoamérica se encontró un solo caso documentado en Colombia en 201113 que tenía un patrón histológico escamoso puro lo que es coherente con la prevalencia planteada antes.
Macroscópicamente el SCC suele ser un tumor sólido y bien delineado9, ocasionalmente con áreas de necrosis2,9. En algunas series, macroscópicamente pueden presentar áreas de color blanco asociadas en un 50% de los casos a cavidades quísticas de gran tamaño4, como en el caso 3. Las metástasis son comunes en el SCC (15% a ganglios axilares y 21% metástasis a distancia principalmente pulmón)9,13.
No existe un consenso en los criterios diagnósticos del SCC y la OMS no ha establecido el porcentaje de células escamosas, sin embargo, algunos enlistan los siguientes aspectos: origen diferente de la piel y el pezón; ausencia de otros elementos neoplásicos invasivos; exclusión de otros sitios primarios (piel, pulmón, cuello uterino, vejiga, esófago y orofaringe), y la presencia de más del 90% de las células de tipo escamoso que ayuda a distinguir entre un verdadero SCC y una metaplasia escamosa dentro de un carcinoma intraductal. En el SCC puro, la mayoría de las células tienen queratinización10 e infiltran el estroma adyacente en forma de trabéculas, cordones y nidos1,9,10. Al intentar distinguirlo de las metástasis, en la mayoría de las situaciones la variante epitelial del SCC no plantea problemas diagnósticos, no así en el tipo mixto14.
En la mayoría de los casos el SCC expone: positividad en su elemento epitelial para un amplio espectro de citoqueratinas de alto peso molecular como CK5/6, y arreactividad para marcadores vasculares endoteliales, receptores de estrógenos y progestágenos y para el factor de crecimiento epidérmico humano (HER2); esto quiere decir que se comportan como triple negativos15–17 aunque existen reportes de expresión de receptores hormonales entre un 0%-25%14.
No se conocen muy bien los mecanismos moleculares que conducen al desarrollo de MBC. Algunos estudios apoyan la hipótesis de que derivan fenotípicamente de un carcinoma ductal convencional; favoreciendo el concepto de desdiferenciación tumoral18, idea que debemos considerar dados los hallazgos en biopsias previas de los casos 2 y 3.
Al no ser un carcinoma de origen glandular, en teoría no sería útil graduarlo, por lo que el sistema de estratificación del carcinoma ductal (sistema de Nottingham) no sería aplicable para estas neoplasias1,10,12. La OMS recomienda hacerlo basándose en los hallazgos nucleares9,15 y se entiende que su pronóstico suele ser aciago19 pese a que se ha observado que puede ser comparable al de un carcinoma ductal20 en similares grupos etarios, estadio TNM13,15,21,22, grado y receptores hormonales2. Más allá de eso, se considera que la supervivencia global es ostensiblemente baja, incluso al compararlo con el carcinoma ductal infiltrante triple negativo19,23.
En este estudio se determinó lo siguiente: los factores pronósticos más importantes del SCC son la edad, el tamaño, el compromiso ganglionar y las metástasis; no se pudieron establecer factores de riesgo definibles; la media de edad de los tres casos fue coherente con la reportada en la literatura; el perfil de inmunohistoquímica fue el esperado; en algunos de los casos presentados las imágenes fueron correlacionables al resultado histológico de alto grado, interrogándose variabilidad imagenológica como se sugiere en la literatura 24, y los resultados anatomopatológicos previos de los casos 2 y 3sugieren plasticidad fenotípica de este subtipo histológico por lo que se apoya la recomendación global de hacer el diagnóstico definitivo en el espécimen completo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Laboratorio de Patología de la E.S.E. Hospital Universitario del Caribe. Cartagena de Indias, Bolívar, Colombia.