El síndrome de apnea/hipopnea obstructiva del sueño (SAHOS) es un trastorno respiratorio con complicaciones perioperatorias que aumentan la morbimortalidad; las características de la población pediátrica hacen necesaria una cuidadosa valoración perioperatoria.
ObjetivoEste artículo aborda tópicos relevantes de la fisiopatología, la clínica, paraclínicos, tratamientos y cuidados perioperatorios de los pacientes pediátricos con SAHOS.
Materiales y métodosSe realizó una búsqueda de literatura, en base de datos de Pubmed y Embase, con los términos MESH: Syndromes sleep apnea, Obstructive sleep apnea, Physiopathology, Perioperative Period, Perioperative Care. Se revisaron los títulos y/o resúmenes de cada uno de los resultados obtenidos y se escogieron finalmente 60 artículos.
Resultados y conclusiónEl conocimiento de la fisiopatología, la adecuada valoración preanestésica y la pertinente solicitud de paraclínicos permiten establecer el ajuste de los cuidados perioperatorios y mejorar los resultados del paciente.
Obstructive sleep apnea/hypopnea syndrome (OSAHS) is a respiratory disorder with perioperative complications, which increase morbidity and mortality. The characteristics of the pediatric population require a careful perioperative assessment.
ObjectiveThis article addresses relevant physiopathology, clinical and paraclinical topics, perioperative treatment and care of pediatric patients with OSAHS.
Materials and methodsA literature search was conducted in PubMed and Embase databases using the MeSH terms: Sleep apnea syndromes, Obstructive sleep apnea, Physiopathology, Perioperative Period, and Perioperative Care. The titles and/or the abstracts of each of the obtained results were reviewed and 60 articles were finally selected.
Results and conclusionThe knowledge of the physiopathology, the adequate preanesthetic assessment and the pertinent request of paraclinical care, allows for the adjustment of the perioperative care and to improve the results of the patient.
El síndrome de apnea/hipopnea obstructiva del sueño (SAHOS) hace parte de un grupo de enfermedades relacionadas, conocido como trastornos respiratorios del sueño, que incluye: ronquido primario, síndrome de resistencia de la vía aérea superior y el SAHOS; este último es la forma más severa y con mayor riesgo de complicaciones perioperatorias y repercusiones sistémicas que aumentan la morbilidad1-4.
La Sociedad Americana de Tórax y la clasificación internacional de trastornos del sueño1 definen el SAHOS como «un trastorno de la respiración durante el sueño caracterizado por una obstrucción parcial o completa, prolongada e intermitente de la vía aérea superior que altera la ventilación normal durante el sueño y los patrones de sueño normal»1.
Los episodios se caracterizan por presentar ronquido, desaturación, hipercapnia, esfuerzo respiratorio y cambios en la presión intratorácica, seguidos de activaciones corticales y subcorticales con regreso intermitente al patrón de sueño normal. Su prevalencia varía entre el 1 y el 5% y ocurre principalmente entre los 2 y 8años5-8.
El objetivo de la presente revisión es mostrar el abordaje del paciente pediátrico con SAHOS desde la fisiopatología, pasando por los datos epidemiológicos relevantes, abordando la valoración preanestésica (clínica y paraclínicos) y las recomendaciones acerca del tratamiento preoperatorio.
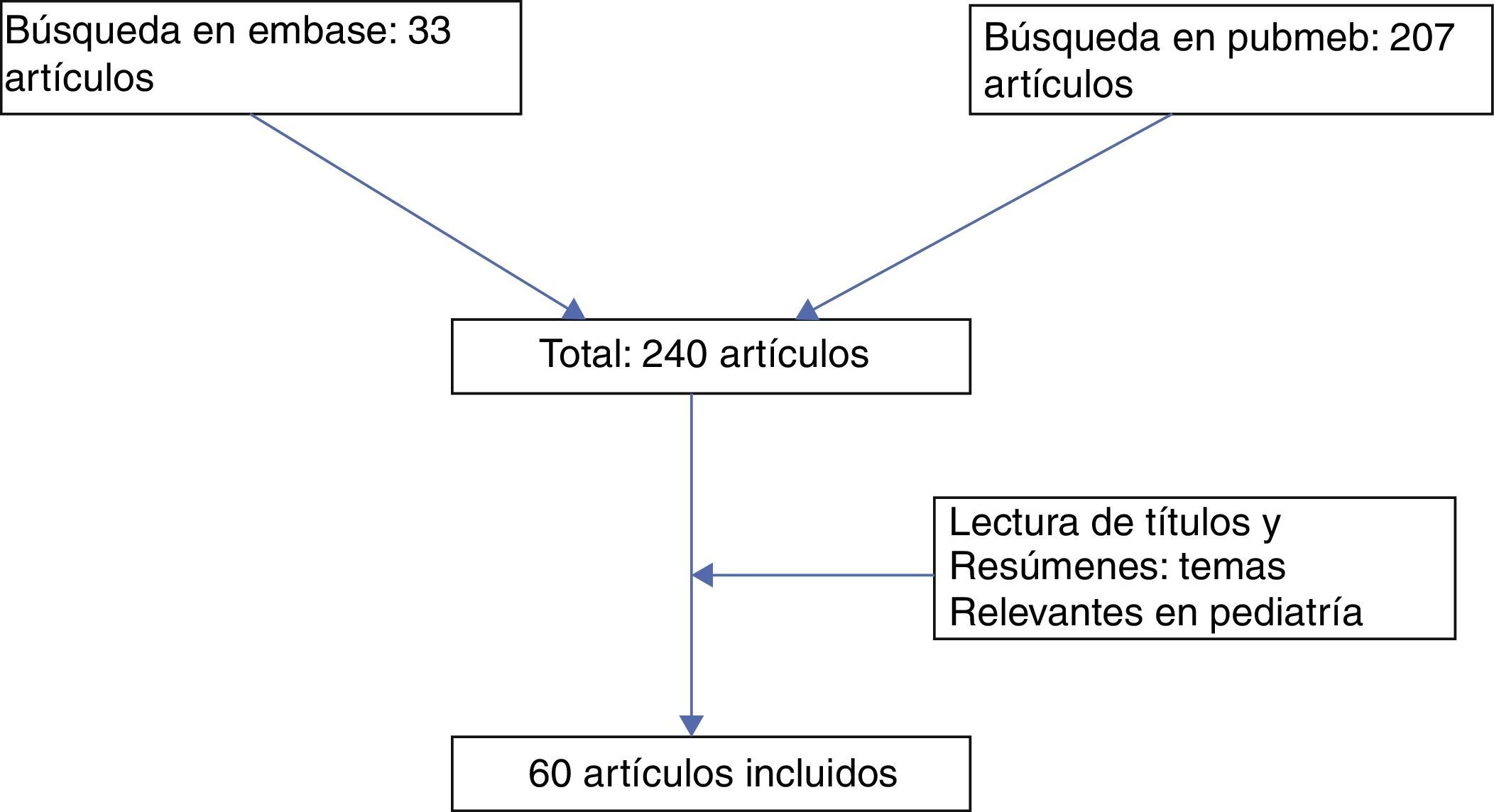
MetodologíaSe realizó un búsqueda de la literatura con los términos MESH: Syndromes sleep apnea, Obstructive sleep apnea, Physiopathology, Perioperative Period, Perioperative Care en las bases de datos Pubmed (207 artículos) y Embase (33 artículos), encontrando en total 240 artículos, de los cuales se revisaron los títulos y resúmenes, escogiendo finalmente 60 artículos según la inclusión de temas relevantes en población pediátrica (fig. 1).
Los resultados de la lectura de los artículos seleccionados se presentan a modo de resumen en subtemas como: fisiopatología, morbilidad, epidemiología, valoración preanestésica y tratamiento preoperatorio; así mismo, se establecen conclusiones derivadas de la interpretación de los artículos por parte de los autores.
FisiopatologíaPermeabilidad de la vía aérea faríngeaExisten dos modelos descritos que permiten entender los fenómenos que determinan la permeabilidad de la vía aérea: el modelo neural y el anatómico.
Modelo neuralEl tamaño de la vía aérea faríngea está determinado por el balance entre dos fuerzas antagónicas; las que colapsan la faringe son producidas por la contracción de los músculos inspiratorios (diafragma e intercostales externos) y generan un gradiente de presión negativo dentro de la faringe promoviendo el colapso de la vía aérea extratorácica9-11; este colapso es evitado por fuerzas de la faringe producidas por la contracción de los músculos dilatadores. La actividad de estas dos fuerzas está regulada por mecanismos neurales (estímulos químicos, estado de conciencia, reflejos de la vía aérea) que interactúan para mantener la vía aérea permeable. Los mecanismos neurales trabajan mejor durante los estados de vigilia; al reducir el nivel de conciencia disminuye la actividad de los músculos dilatadores de la faringe más que la actividad de los músculos inspiratorios, resultando en una pérdida del equilibrio del balance neural, favoreciendo el estrechamiento de la vía aérea faríngea10,11.
Modelo anatómicoPropuesto por Isono12, describe que la vía aérea superior pasa por un compartimento dentro del cual está el tejido blando faríngeo, el cual a su vez está limitado por varias estructuras óseas, tales como: base de cráneo, columna cervical y mandíbula10,11,13. Durante el sueño, el calibre de la vía aérea está determinado por el tejido blando, por las estructuras óseas y por el tono de los músculos dilatadores de la faringe (geniogloso, geniohioideo y músculos velopalatinos)10,11,13. Durante la contracción de los músculos inspiratorios se generan fuerzas que colapsan la vía aérea por la presión intraluminal negativa; normalmente la vía aérea faríngea no se colapsa hasta que se alcanzan presiones subatmosféricas; en el paciente con SAHOS el colapso de la vía aérea faríngea se produce a una presión positiva12.
El punto de equilibrio entre las dos fuerzas (tendencia al cierre, tendencia a la apertura) determina el balance anatómico de la vía aérea faríngea; su tamaño se condiciona por la interacción entre mecanismos neurales y anatómicos10,14-16.
El aumento de la resistencia en la vía aérea superior durante el sueño es una característica esencial del SAHOS. En niños, por lo general es un trastorno multifactorial donde convergen diversos factores como estenosis de las vías respiratorias superiores (por ejemplo, hipertrofia amigdalar), tono muscular de la vía aérea anormal y predisposición genética17.
Los factores fisiopatológicos involucrados se pueden dividir en:
Factores anatómicos craneofaciales: mandíbula pequeña, lengua grande o en retroposición, depósito graso faríngeo aumentado, tejidos linfoides de las vías respiratorias superiores hipertróficos (en particular de las adenoides y las amígdalas), hipertrofia de cornetes nasales inferiores, desviación del tabique nasal.
Factores que promueven mayor colapsabilidad: inflamación de la vía aérea superior y alteración de los reflejos neurológicos que controlan los músculos de las vías respiratorias superiores10,18.
Los eventos obstructivos durante el sueño en niños con SAHOS tienen un patrón inverso en relación a la etapa del sueño, en comparación con la observada en adultos con SAHOS. El 80% de los eventos obstructivos se producen durante el sueño REM, mientras que en adultos el 80% de los eventos obstructivos se producen durante el sueño no-REM. Los eventos obstructivos no-REM ocurren con menos frecuencia en niños, pero tienden a aumentar en los niños de mayor edad, en los niños afroamericanos, en posición lateral y con bajos niveles de saturación de oxihemoglobina. Los eventos obstructivos no-REM que conducen al despertar ocurren a una mayor saturación de oxígeno que los eventos durante el sueño REM16,19.
El SAHOS puede ser divido en dos tipos: tipoi, asociado a hipertrofia de tejido linfoadenoideo sin obesidad, y tipoii, asociado a obesidad con leve hiperplasia del tejido linfoadenoideo6.
El área de sección de la faringe en los niños con SAHOS es un 5 a 10% más pequeña que en niños sanos, y la respiración en un niño despierto con esta patología es normal. Durante anestesia general y el bloqueo neuromuscular la vía aérea superior disminuye su calibre; el incremento relativo en el tejido blando faríngeo es ocasionado por inhibición de los músculos dilatadores de la vía aérea y descenso en el volumen pulmonar que resulta en un desplazamiento cefálico del mediastino y un descenso en la tensión longitudinal sobre la vía aérea superior, incrementando la colapsabilidad de la vía aérea faríngea12,20.
MorbilidadEl SAHOS tiene repercusiones sistémicas que aumentan la morbilidad de los pacientes que lo padecen3,6. Se han encontrado en estos pacientes alteraciones en el comportamiento (hiperactividad, déficit de atención, déficit cognitivo y mal rendimiento escolar), somnolencia diurna, alteraciones cardiovasculares, alteraciones metabólicas, alteraciones en el crecimiento somático y síndrome metabólico21.
El SAHOS y la obesidad se consideran enfermedades inflamatorias; se ha observado un incremento de la proteína C reactiva que podría constituirse en un marcador importante en el diagnóstico de SAHOS. La evidencia actual sugiere la existencia de una susceptibilidad genética demostrada por la apolipoproteína épsilon 422,23. Los niños con SAHOS, particularmente los obesos, tienen tendencia a desarrollar síndrome metabólico e hígado graso6,24,25.
La morbilidad cardiovascular puede ser atribuible a una compleja interacción entre hipoxia intermitente, hipercapnia episódica, recurrentes altibajos de presión intratorácica e interrupción del sueño. El SAHOS puede afectar la función endotelial ocasionando hipertensión por aumento en la liberación de endotelinas y disminución en la producción de óxido nítrico; además, la activación simpática puede ejercer acción directa sobre el endotelio causando vasoconstricción. La inflamación puede contribuir a la disfunción endotelial incrementando la adhesión de mediadores inflamatorios y generando hipercoagulabilidad. En algunos estudios se ha mostrado que estas alteraciones pueden ser revertidas entre 4 a 6 semanas tras la realización de amigdalectomía22,26,27.
En algunos pacientes con SAHOS se ha observado retraso en el crecimiento y desarrollo que puede ser secundario a una alteración en el funcionamiento y/o liberación del factor de crecimiento tipo1 relacionado con insulina y de la hormona del crecimiento6.
EpidemiologíaLumeng y Chervin2 realizaron en el año 2008 una revisión sistemática de los estudios sobre la epidemiología de los trastornos respiratorios del sueño, encontrando las siguientes prevalencias: trastornos respiratorios del sueño reportados por los padres 4-11%, ronquido habitual 1,5-12%, eventos de apnea durante el sueño 0,2-4%; el SAHOS diagnosticado por diferentes criterios en estudios diagnósticos varía ampliamente entre el 0,1 y el 13%, pero la mayoría de los estudios reportan una cifra entre el 1 y el 4%13,25. En general, los trastornos respiratorios del sueño son más comunes en varones, niños con sobrepeso y afroamericanos. No hay datos que soporten claras diferencias en la prevalencia basados en la edad; sin embargo, algunos datos muestran una prevalencia pico entre los 2 y los 8años de edad11,18,28.
En niños menores de 2 años el SAHOS se asocia frecuentemente a malformaciones craneofaciales, anormalidades neurológicas y obesidad; en estos casos, el SAHOS por lo general es más severo y con una mayor recurrencia o recuperación incompleta tras la cirugía29.
La incidencia de complicaciones respiratorias postoperatorias en pacientes con SAHOS alcanza el 27% (6,4-27%), y varía según la edad, la severidad del SAHOS, los criterios diagnósticos utilizados y las comorbilidades. Niños <3años y un índice de apnea/hipopnea (IAH)>10 tienen dos veces más riesgo que niños entre 3-6años de edad. Estas complicaciones incluyen desaturación de oxígeno <90%, aumento del esfuerzo respiratorio, cambios radiográficos (edema, atelectasia, infiltrados, neumotórax, neumomediastino, derrame pleural), laringoespasmo, apnea, crisis de hipertensión pulmonar, neumonía y muerte perioperatoria, edema pulmonar por presión negativa17. Las complicaciones respiratorias posiblemente estén relacionadas con una alteración a la respuesta al hipoxemia e hipercapnia y a una sobreexpresión de receptores opioides22,30-32
Valoración preanestésicaEn todo paciente se debe realizar una historia clínica completa que incluya revisión de sistemas, énfasis en los factores de riesgo clínicos y realización de un examen físico específico. El niño con SAHOS está en riesgo de complicaciones respiratorias perioperatorias potencialmente mortales, por lo que el abordaje perioperatorio debe ser multidisciplinario (pediatría, cirugía, anestesia)14,33,34.
La mayoría de las complicaciones son respiratorias: los niños con SAHOS tienen un 20% más posibilidades de complicaciones en relación con los niños sanos sometidos a adenoamigdalectomía. En población general las complicaciones ocurren en el intraoperatorio en un 21%, en la unidad de cuidados postanestésicos en un 33% y en la habitación del paciente en un 46%; estas complicaciones pueden llevarlos a daño neurológico severo o a la muerte35-37. Se han observado otras complicaciones menos frecuentes, como el edema pulmonar por presión negativa y el sangrado22.
La mayor cantidad de la literatura se enfoca en el manejo perioperatorio del niño con SAHOS que será llevado a adenoamigdalectomía, a partir de lo cual se han extrapolado los principios de manejo para otras intervenciones quirúrgicas14. Los principios generales de manejo incluyen:
- •
Valoración preoperatoria del ronquido.
- •
Observación y monitoreo respiratorio estrictos.
- •
Técnicas analgésica y anestésica ahorradoras de opioides30.
- •
Técnicas de anestesia regional cuando sea posible11.
La presentación clínica varía dependiendo de la edad. En la infancia se debe tener un alto índice de sospecha ante dismorfia craneofacial, retraso del crecimiento, susceptibilidad a infecciones o retraso en el desarrollo del habla. En la edad escolar se puede manifestar como agitación, déficit de atención, bajo rendimiento escolar o enuresis secundaria. En la adolescencia el cuadro clínico se hace similar al del adulto14,28,33,38.
Ante la ausencia de síntomas característicos de SAHOS en la edad pediátrica, se puede esclarecer la situación con la aplicación sistemática de preguntas de tamización, haciendo énfasis en la presentación de síntomas nocturnos (ronquidos, sudoración excesiva, sueño agitado, respiración bucal, apneas, jadeo, respiración paradójica o laboriosa, hiperextensión del cuello durante el sueño), o la presencia de síntomas diurnos como dificultad para concentrarse, trastornos del comportamiento y del estado de ánimo, dolores de cabeza matutinos, somnolencia diurna excesiva y retraso del crecimiento39. Debe interrogarse directamente por la presencia de ronquido (la mayoría de niños con SAHOS ronca, y su ausencia hace mucho menos probable un diagnóstico de SAHOS, con una sensibilidad del 91% y una especificidad del 75%)17,27,33.
En el examen físico, los hallazgos sugestivos de SAHOS incluyen: presencia de respiración bucal, facies alargada, barbilla triangular y/o pequeña, retroposición de la mandíbula, paladar alto, retracciones del tórax, extremos de hábitos corporales (retraso en el desarrollo en bebés e infantes, y obesidad en niños y adolescentes), retraso del desarrollo. La magnitud de la hipertrofia amigdalina no se correlaciona con la severidad del SAHOS17,33.
Los cuestionarios y la historia clínica son útiles, pero no son adecuados en la práctica clínica para diferenciar el ronquido primario infantil (estudios polisomnográficos normales) del SAHOS pediátrico, y por lo tanto se requieren pruebas de diagnóstico adicional. La precisión de la evaluación clínica del SAHOS pediátrico en predecir positividad de estudios del sueño es variable, entre el 30 y el 85%14.
La polisomnografía realizada en un laboratorio nocturno del sueño se considera el estándar de oro para el diagnóstico y la evaluación del SAHOS en niños; idealmente esta prueba debe incluir monitoreo cardiorrespiratorio, electroencefalográfico, electrooculográfico y electromiográfico1,17,40. La polisomnografía está indicada en pacientes de alto riesgo y en la evaluación de las siguientes condiciones clínicas: falla del medro, policitemia inexplicada (en particular si se asocia a ronquido), enfermedad de células falciformes asociada con una historia clínica sugestiva de SAHOS o crisis venooclusivas frecuentes, obesidad mórbida, anomalías craneofaciales, trastornos neuromusculares, cor pulmonale, hipertensión arterial sistémica14,41.
En la polisomnografía se definen las siguientes mediciones17,18,33:
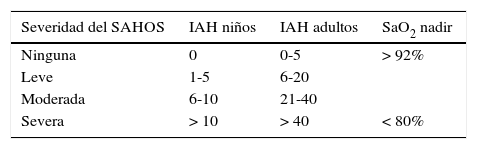
Índice apena-hipopnea (IAH): número medio de eventos (apnea-hipopnea) obstructivos por hora de sueño. Los criterios diagnósticos del SAHOS en adultos son producto de consenso de expertos e incluyen un IAH de 5 o más y evidencia de sueño no reparador o alterado, somnolencia diurna, u otros síntomas diurnos. Los puntos de corte de IAH de 5, 15 y 30 eventos/hora se han sugerido para indicar nivel leve, moderado y severo14,42. Hay pocos datos disponibles en la literatura para establecer criterios diagnósticos de SAHOS específico en niños a partir del IAH. En la actualidad, un IAH de 1 a 5 eventos por hora se utiliza en investigación para identificar niños con SAHOS; no obstante, se han utilizado definiciones muy variables1,33 (tabla 1).
Severidad de SAHOS en niños y adultos definido por el Grupo de Trabajo sobre Manejo Perioperatorio de Pacientes con Apnea Obstructiva del Sueño de la Sociedad Americana de Anestesiología
| Severidad del SAHOS | IAH niños | IAH adultos | SaO2 nadir |
|---|---|---|---|
| Ninguna | 0 | 0-5 | > 92% |
| Leve | 1-5 | 6-20 | |
| Moderada | 6-10 | 21-40 | |
| Severa | > 10 | > 40 | < 80% |
Nadir de saturación de oxígeno (ver tabla 1).
Índice de trastorno respiratorio (ITR): número de eventos de apnea/hipopnea por hora de sueño. No es específico de SAHOS, pues incluye episodios de apnea central y obstructiva18.
Dado el costo y la disponibilidad limitada en muchas comunidades de la polisomnografía realizada en el laboratorio de sueño, se han hecho importantes esfuerzos para explorar otras formas de diagnóstico. Se ha recurrido a las grabaciones de audio en el hogar durante la noche, la grabación en vídeo, oximetría de pulso, estudios cardiorrespiratorios y polisomnografía en el hogar; sin embargo, no se ha comparado la validez de cada uno de estos métodos con el estándar de oro en la población pediátrica43. No se descarta que alguna de estas modalidades pueda tener cierto valor diagnóstico en poblaciones específicas; Brouillette et al.44 en un estudio concluyen que en niños con sospecha de SAHOS la desaturación de oxígeno grave aislada (SaO2<80%) o agrupaciones de desaturación (más de tres episodios de SaO2<90%) se consideran anormales y tienen un valor predictivo positivo del 97%, pero un resultado negativo no descarta el diagnóstico de SAHOS.
Durante la evaluación del niño con SAHOS debería identificarse el sitio de obstrucción de la vía aérea. El estudio de los patrones de colapso dinámico de la vía aérea durante el sueño identifica las causas anatómicas de la obstrucción y facilita la planificación de las intervenciones para aliviar tal obstrucción. Para su estudio se ha recurrido al uso de presiones faríngeas diferenciales a través de catéteres colocados en diferentes niveles en la vía aérea superior, cinefluoroscopia, videoendoscopia, tomografía computarizada y broncoscopia de fibra óptica14,33.
Si bien la mayoría de niños programados para adenoamigdalectomía no requieren evaluación cardiaca, los pacientes con evidencia de hipertensión sistémica y/o de hipercapnia crónica (múltiples episodios de hipoxemia severa <70%, alcalosis metabólica compensatoria), que por lo general tienen aumento de las presiones pulmonares y por tanto están en riesgo de cor pulmonale, deberían tener al menos una evaluación con ecocardiograma antes de proceder con la cirugía electiva, aunque estas anormalidades cardiopulmonares se ven con menos frecuencia en niños en comparación con adultos24,26,46.
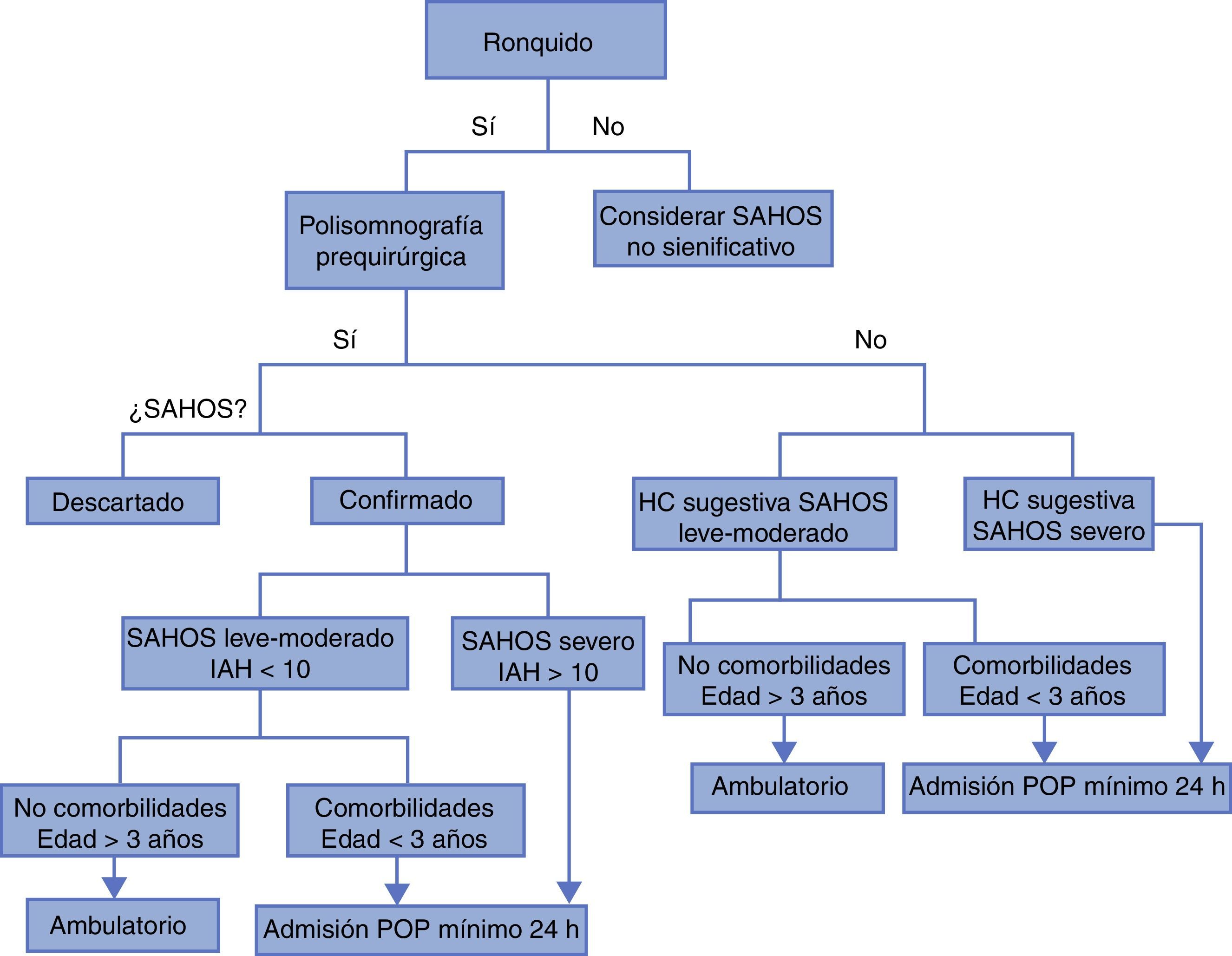
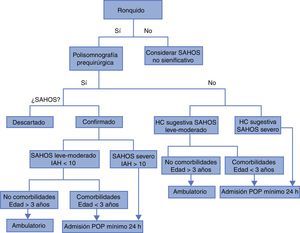
Los niños con alto riesgo de complicaciones respiratorias postoperatorias deben ser identificados desde la valoración preanestésica para planear su sitio de estancia postoperatoria. Aunque no hay evidencia clara sobre el tiempo de observación pertinente, algunas recomendaciones extraídas de la literatura pueden contribuir a la planeación adecuada del tratamiento perioperatorio del paciente y a disminuir la incidencia de complicaciones a través de monitorización postoperatoria adecuada (tabla 2)14,17,26,47:
- •
SAHOS leve o moderado sin ningún factor de riesgo: observación de 3 a 7 h.
- •
SAHOS leve moderado sin factores de riego pero con desaturación, requerimiento de oxígeno, dificultad de manejo vía aérea intraoperatoria u obstrucción postoperatoria: cuidados intermedios por 24 h.
- •
SAHOS leve/moderado sin factores de riego pero con dolor severo que requiere manejo con opioides: cuidados intermedios por 24 h.
- •
SAHOS leve o moderado con factores de riesgo: cuidados intermedios por 24 h.
- •
SAHOS severo: cuidados intensivos por 24 h (fig. 2).
Factores de riesgo para complicaciones pulmonares postoperatorias después de adenoamigdalectomía
| Niños<3 años de edad |
| SAHOS severo documentado por polisomnografía |
| Falla para prosperar |
| Obesidad |
| Compromiso cardiaco (cor pulmonale, hipertrofia VD, HTA) |
| Síndrome de Down |
| Historia de prematuridad |
| Anormalidades craneofaciales |
| Enfermedades neuromusculares |
| Enfermedad pulmonar crónica |
| Enfermedad de células falciformes |
| Problemas nasales (desviación septal, hipertrofia de cornetes) |
| Hipertrofia de adenoides |
| Mallampati 3-4 |
| Infección respiratoria superior en las 4 semanas previas |
| Marcada obstrucción con inducción inhalatoria |
| Dificultad respiratoria en la sala de recuperación |
La adenoamigdalectomía es el tratamiento inicial recomendado para el SAHOS pediátrico34,48. La ventilación con presión positiva (BiPAP/CPAP) en el período preoperatorio se ha usado para disminuir la tasa de complicaciones postoperatorias y aumentar la permeabilidad de la vía aérea en adultos, y podría ser útil en pacientes pediátricos con SAHOS severo y complicaciones cardiovasculares secundarias9,17,26,49, observándose mejoría en la hipertensión pulmonar y reducción del riesgo quirúrgico. Las presiones ajustadas por el neumólogo pediatra en el laboratorio de sueño son las usadas en el postoperatorio17,50,51.
Varios estudios comparan la realización adenoamigdalectomía temprana con conducta expectante en diferentes edades pediátricas de pacientes con SAHOS y otras enfermedades pulmonares, encontrando que no mejora significativamente la atención o la función ejecutiva medidas por pruebas neuropsicológicas, pero reduce los síntomas y mejora los resultados secundarios de conducta, calidad de vida y polisomnográficos51-56.
Las siguientes son recomendaciones de práctica basada en la evidencia para el diagnóstico y tratamiento de SAHOS57,58:
- •
La historia clínica y el examen físico no son suficientes para diferenciar entre ronquido primario y SAHOS, siendo la polisomnografía el estándar de oro para el diagnóstico de SAHOS.
- •
Los niños con síndrome de Down, anomalías craneofaciales, obesidad o síndrome de Prader-Willi tienen un mayor riesgo de SAHOS y frecuentemente requieren polisomnografía y terapias específicas.
- •
Los pilares de la terapia para el SAHOS en niños son la adenoamigdalectomía y el uso de dispositivos de presión positiva de la vía aérea9; el uso del CPAP es un tratamiento eficaz en niños, pero al igual que lo que ocurre en adultos, la adherencia es un problema importante, y puede haber efectos secundarios faciales en niños con el uso a largo plazo50.
- •
Las terapias no quirúrgicas, incluyendo medicamentos antiinflamatorios, aparatos dentales y pérdida de peso, pueden ser útiles en determinadas circunstancias, como el SAHOS leve, ya sea primario o persistente después adenoamigdalectomía, aunque son necesarios más datos9.
- •
La cirugía de la vía aérea ha demostrado ser eficaz en niños con anomalías craneofaciales, pero no en la población pediátrica general. La cirugía bariátrica es una opción para los adolescentes extremadamente obesos.
En cuanto a la premedicación, se debe tener precaución con los sedantes en niños con SAHOS grave; en caso de haberla recibido, deben estar continuamente monitorizados mediante observación clínica y, como mínimo, oximetría de pulso continua hasta el traslado a salas de cirugía. El efecto residual de estos medicamentos puede observarse incluso en la etapa de recuperación, sobre todo en procedimientos de corta duración14. Algunos datos sugieren que los niños con SAHOS pueden recibir sedantes, pero requieren monitorización hasta que se pueda demostrar recuperación completa17.
Las estrategias para mantener permeable la vía aérea faríngea consisten en expansión del límite óseo, reducción del volumen del tejido blando faríngeo y activación de los músculos dilatadores de la faringe12. La expansión del límite óseo se puede obtener con la triple maniobra; la reducción del volumen del tejido blando faríngeo se puede obtener con la utilización de presión positiva continua en la vía aérea (CPAP), que actúa como una férula neumática impidiendo que el tejido blando invada la vía aérea superior, y además incrementa el volumen pulmonar, resultando en un desplazamiento caudal del mediastino que aplica tensión longitudinal sobre la vía aérea faríngea, disminuyendo su colapso12,50. El reclutamiento de los músculos dilatadores de la vía aérea superior no es fácil debido a la inhibición selectiva de muchos anestésicos; el propofol, al parecer, preserva la actividad del músculo geniogloso12.
La posición del cuerpo influencia el volumen del tejido blando faríngeo; en la posición supina la oclusión de la vía aérea en niños con SAHOS ocurre en los dos tercios superiores de la vía aérea faríngea en el área entre el tejido adenoideo y las amígdalas; la posición lateral desplaza el tejido blando fuera de la vía aérea12,26.
ConclusiónEl SAHOS es una enfermedad cuya prevalencia en la población pediátrica hace conveniente un conocimiento profundo de su fisiopatología y de las comorbilidades que conlleva tanto a nivel pulmonar, cardiovascular, neurológico, metabólico y hematológico. De igual manera, el abordaje en la valoración preanestésica debe enfocarse en una evaluación clínica amplia, teniendo en cuenta la polisomnografía y la información derivada como una herramienta fundamental de diagnóstico que permite determinar la pertinencia de una evaluación paraclínica más amplia y así poder definir los parámetros de tratamiento preoperatorio y de cuidado postoperatorio para poder disminuir las complicaciones.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.