La pancreatitis aguda es una entidad de notable importancia debido a su elevada incidencia y a su no desdeñable morbimortalidad. Se conoce como pancreatitis aguda idiopática aquella en la que no se consigue determinar la causa del cuadro tras un estudio básico inicial. Conocer la etiología subyacente permite plantear un tratamiento dirigido para así disminuir el riesgo de recurrencia. La ecoendoscopia y la colangiografía por resonancia magnética son las pruebas de elección para profundizar en el estudio etiológico. La principal causa es la enfermedad litiásica no diagnosticada en el estudio inicial, cuyo tratamiento de elección es la colecistectomía. Por otra parte, la pancreatitis aguda recurrente se diagnostica tras la existencia de 2 o más episodios de pancreatitis aguda. El objetivo de esta revisión es proporcionar una aproximación actualizada de estas 2 entidades, repasando aspectos de su epidemiología, diagnóstico y alternativas terapéuticas disponibles.
Acute pancreatitis is an entity of notable importance due to its high incidence and its non-negligible morbidity and mortality. Idiopathic acute pancreatitis is that in which the cause of the clinical condition cannot be determined after an initial basic study. Understanding the underlying aetiology enables clinicians to propose a targeted treatment to reduce the risk of recurrence. Endoscopic ultrasonography and magnetic resonance cholangiopancreatography are the tests of choice to deepen the aetiological study. The main cause is undiagnosed lithiasic disease in the initial study, whose treatment of choice is cholecystectomy. Moreover, recurrent acute pancreatitis is diagnosed after 2 or more episodes of acute pancreatitis. The objective of this review is to provide an updated approach for these 2 entities, reviewing aspects of their epidemiology, diagnosis and available alternative therapies.
La pancreatitis aguda (PA) es un proceso inflamatorio del páncreas con afectación local y repercusión sistémica1. En la mayoría de los pacientes la existencia de enfermedad litiásica biliar, o el consumo de alcohol, se encuentran implicados su desarrollo. No obstante, existen otras muchas etiologías (tabla 1)1. La PA presenta una elevada incidencia que ronda los 15-45 casos por 100.000 habitantes/año2. Se trata de una entidad que asocia una importante morbilidad, una mortalidad no despreciable que alcanza el 5%, así como riesgo de progresión a pancreatitis crónica. Este riesgo será mayor en función de la gravedad del cuadro y del número de episodios. El principal factor predictor de recurrencia es el número de episodios previos3. Por ello, resulta fundamental investigar la etiología de la PA para plantear un tratamiento dirigido que permita disminuir la posibilidad de recurrencia y el potencial desarrollo de pancreatitis crónica.
Etiología de pancreatitis aguda
| Mecánica | Litiasis, microlitiasis o barro biliarTumores pancreáticos, peripancreáticos (sólidos/quísticos)Divertículos duodenales periampularesEstenosis/obstrucción duodenalPáncreas anularColedococeleParásitos (Ascaris)Páncreas divisumaDisfunción del esfínter de Oddia |
| Tóxicos | Etanol, metanolFármacosVeneno escorpión, insecticidas, organofosforados |
| Alteraciones metabólicas | HipertrigliceridemiaHipercalcemia |
| Infecciones | Virus (Coxsakie, VHB, VIH, CMV, VVZ, VHS, sarampión)Bacterias (Mycoplasma, Legionella, Leptospira, Salmonella)Hongos (Aspergillus, Pneumocistis)Parásitos (Toxoplasma, Criptospirdium, Ascarais) |
| Trastornos vasculares/isquemia pancreática | Vasculitis (LES, PAN)EmbolismosHipoperfusión |
| Traumatismo | Traumatismo o contusión abdominalCirugíaCPRECPTHEnteroscopia |
| Genética | PRSS1, CFTR, SPINK1 |
| Otros | Pancreatitis autoinmuneAnorexia nerviosaEnfermedad de CrohnEnfermedad celiacaDiálisis peritoneal, hemodiálisis |
| Idiopática |
CMV: citomegalovirus; CFTR: gen de la fibrosis quística; CPRE: colangiografía retrógrada endoscópica; CPTH: colangiografía transparietohepática; LES: lupus eritematoso sistémico; PAN: panarteritis nodosa; PRSS1: gen del tripsinógeno catiónico; SPINK: gen del inhibidor de la tripsina pancreática; VHB: virus hepatitis B; VHS: virus herpes simple; VIH: virus inmunodeficiencia humana; VVZ: virus varicela zóster.
Se entiende por PA idiopática (PAI) aquella en la que no se consigue determinar la etiología tras un estudio inicial de laboratorio y de imagen3. Dicho estudio debe incluir una anamnesis detallada, una analítica, una ecografía abdominal y en ocasiones una tomografía computarizada (TC). La anamnesis irá dirigida a identificar posibles factores de riesgo para el desarrollo de PA1 como el consumo de alcohol (habitualmente es necesario un consumo>50g/día prolongado durante al menos 5 años para considerarlo como causa de la pancreatitis)4 o fármacos, antecedentes de enfermedad biliar, antecedentes familiares de pancreatopatía, traumatismos previos, etc. La analítica deberá incluir perfil hepático (bilirrubina, transaminasas, FA y GGT), niveles de triglicéridos y calcio. La ecografía abdominal debe realizarse en todo paciente con PA para valorar la vesícula biliar, la vía biliar y el páncreas. Debe repetirse si el examen inicial es de baja calidad o si persiste sospecha clínica de etiología biliar. Cuando existan dudas diagnósticas, sospecha de complicaciones o riesgo de proceso patológico maligno subyacente (mayores de 40 años, diabetes mellitus de reciente aparición, síndrome constitucional) se deberá realizar una TC abdominal5. Tras la realización este estudio inicial, en un 10-30% de los casos no se logra establecer la etiología6. A continuación se detallan las posibles etiologías subyacentes en una pancreatitis clasificada inicialmente como idiopática, así como las pruebas complementarias disponibles para profundizar en el estudio.
EtiologíaBiliarLa enfermedad litiásica es la causa más frecuente de las PA inicialmente catalogadas como idiopáticas. Estudios recientes sugieren que la presencia de litiasis o microlitiasis (litiasis<3mm) es la causa de la PA hasta en el 75% de las inicialmente clasificadas como idiopáticas en pacientes con vesícula, descendiendo la cifra hasta el 10% en los pacientes colecistectomizados3,6. Sin embargo, la existencia de una asociación causal entre el barro biliar y la PA es controvertida7,8. En ausencia de otra etiología el barro biliar debe considerarse como la causa de la pancreatitis en pacientes con elevación transitoria en las pruebas hepáticas. El diagnóstico de PA de etiología biliar debe sospecharse en presencia de antecedentes de enfermedad biliar, litiasis biliar en pruebas de imagen y/o valores de laboratorio alterados durante el episodio agudo. Niveles de ALT>150U/l en las 48horas desde el inicio de los síntomas tienen un valor predictivo positivo de>85% para el diagnóstico de PA biliar9.
Alteraciones metabólicasLas alteraciones metabólicas se encuentran implicadas con cierta frecuencia y deben ser evaluadas con cautela. Durante el ayuno prolongado, las cifras de triglicéridos pueden encontrarse falsamente disminuidas, por lo que es importante solicitarlos precozmente. Por el contrario, la concentración de triglicéridos aumenta con el consumo perjudicial de alcohol y en la diabetes mellitus con mal control metabólico, sin ser necesariamente la causa de la pancreatitis10. Niveles>1.000mg/dl son necesarios para poder establecer un diagnóstico de PA secundaria a hipertrigliceridemia4.
Alteraciones anatómicasLas anomalías anatómicas, como el páncreas anular, el coledococele, la unión pancreatobiliar anómala, el quiste de duplicación duodenal o el divertículo periduodenal, entre otros, pueden encontrarse implicadas en el desarrollo de la PA. El páncreas divisum es la anomalía pancreática más frecuente con una prevalencia del 10-15%11. Se trata de un defecto congénito que resulta de la falta de unión de los conductos dorsal y ventral del páncreas durante en desarrollo. Así, la mayor parte de la secreción pancreática exocrina (producida en el páncreas dorsal) drena a través del conducto de Santorini o dorsal en la papila accesoria, y solo una pequeña parte del páncreas, el ventral, desagua a través del conducto pancreático principal o de Wirsung en la papila mayor. El 95% de los portadores de esta anomalía se encuentran asintomáticos, mientras que el 5% restante puede experimentar dolor de tipo pancreático o PA. Existe controversia sobre su implicación en el desarrollo de PA. Los defensores de su papel causal argumentan que los pacientes con PA recurrente tienen una frecuencia más alta de páncreas divisum que la población general12, existiendo estudios que señalan que la esfinterotomía endoscópica o la colocación de una endoprótesis a través de la papila menor disminuyen la tasa de pancreatitis recurrente13,14. Sus detractores se basan en otros estudios observacionales que muestran que la tasa de pancreatitis en los pacientes con páncreas divisum es la misma que en la población general11, en los problemas metodológicos en los estudios a favor derivados de su carácter observacional y retrospectivo, así como en la coexistencia de otras causas potenciales, ya que en un alto porcentaje de pacientes con páncreas divisum existe otra anomalía asociada como el páncreas anular, la disfunción del esfínter de Oddi o una mutación genética que podrían ser la causa real del episodio.
Se entiende por disfunción del esfínter de Oddi un síndrome clínico de obstrucción biliar o pancreática relacionado con una alteración mecánica o funcional del esfínter15. Se clasifica en 3 subtipos (tabla 2). El tipo iii se incluye en Roma IV como trastorno funcional16. Sin embargo, para algunos autores, los tipos i y ii son causa de PA al existir series observacionales que muestran que la esfinterotomía pancreática endoscópica o la esfinteroplastia quirúrgica disminuyen el número de crisis de pancreatitis. Sus detractores se basan en las deficiencias metodológicas en dichos estudios y en la ausencia de información sobre la cifra de presión normal del esfínter15.
Clasificación de la disfunción del esfínter de Oddi
| Tipo I | Tipo II | Tipo III |
|---|---|---|
| PA (dolor pancreático+elevación de enzimas)Dilatación de conducto biliar y/o conducto pancreático principal (Wirsung) | Dolor pancreático asociado con al menos uno:Pancreatitis agudaDilatación conducto Wirsung | Dolor pancreático (no elevación de enzimas)No dilatación de conducto de Wirsung |
| Anomalía estructural | Anomalía funcional o estructural | Anomalía funcional |
Los tumores peripancreáticos pueden causar PA probablemente por obstrucción del conducto pancreático. El tumor que presenta este curso clínico con más frecuencia es la neoplasia mucinosa papilar intraductal (NMPI). Asimismo, el adenocarcinoma pancreático o, en menor medida las metástasis pancreáticas de otros tumores primarios, pueden presentarse también como PA. Se estima que entre un 2,6% y un 13,8% de los pacientes con adenocarcinoma de páncreas presentan algún episodio de PA durante su evolución5. En ello radica la recomendación de realizar una TC abdominal en aquellos pacientes con un episodio de PA de etiología no filiada y factores de riesgo para la existencia de una neoplasia pancreática.
Pancreatitis crónicaEn ocasiones una PAI puede tratarse de una reagudicación de una pancreatitis crónica subyacente no diagnosticada previamente que puede pasar desapercibida en la ecografía abdominal.
Pancreatitis autoinmuneLa pancreatitis autoinmune fue descrita por primera vez en 196117. Se han descrito 2 patrones histológicos diferentes: tipo 1 (pancreatitis esclerosante linfoplasmocítica) y tipo 2 (pancreatitis ductal central idiopática), que difieren entre sí en varios aspectos clínicos, epidemiológicos e histológicos17, si bien ambas se relacionan con el desarrollo de episodios de PA, especialmente la tipo 2. La pancreatitis autoinmune tipo 1, englobada en el espectro de enfermedades IgG4, puede entenderse como la manifestación pancreática de un trastorno multiorgánico18, mientras que en el tipo 2 no existe una elevación sérica de IgG4. Suele manifestarse como ictericia obstructiva o masa pancreática.
Alteraciones genéticasEn los últimos años se han identificado diversas mutaciones y polimorfismos genéticos asociados a un riesgo variable de pancreatitis. Las mutaciones que confieren mayor riesgo se han identificado en los genes del tripsinógeno catiónico (PRSS1), en el inhibidor de la tripsina pancreática (SPINK1), en el gen de la fibrosis quística (CFTR), en los del quimiotripsinógeno C (CTRC) y en el receptor sensor del calcio (CASR)19. Sin embargo, el patrón de herencia no siempre sigue las leyes de la genética mendeliana, sino que radica en mecanismos complejos debidos a la interacción y sinergia entre múltiples factores genéticos y ambientales (consumo de tabaco o alcohol principalmente). Por ello, el componente genético atribuible es variable y no sencillo de establecer. Las mutaciones más comunes del PRSS1, que siguen un patrón de herencia autosómica dominante con penetrancia incompleta, serían aquellas en las que existe una máxima asociación genotípica-fenotípica. Las mutaciones de CFTR, con un patrón de herencia no mendeliano, confieren un riesgo moderado. En el extremo con menor representación fenotípica se encuentran las mutaciones del CTRC o del CASR que confieren riesgo leve y probablemente actúen en combinación con factores ambientales o con otras alteraciones genéticas, y las mutaciones de SPINK1 consideradas factores modificadores que actuarían disminuyendo el umbral de riesgo de otros factores predisponentes19.
Estudio complementarioAproximadamente un 25% de las pancreatitis de causa no tratada recidivan, y hasta el 50% de las PA recurrentes pueden evolucionar a pancreatitis crónicas20. Por tanto, parece clara la necesidad de plantear un estudio complementario en aquellos pacientes con PAI en un intento de identificar la etiología subyacente, para así ofrecer un tratamiento etiológico, evitar la aparición de recurrencias y prevenir el potencial desarrollo de pancreatitis crónica.
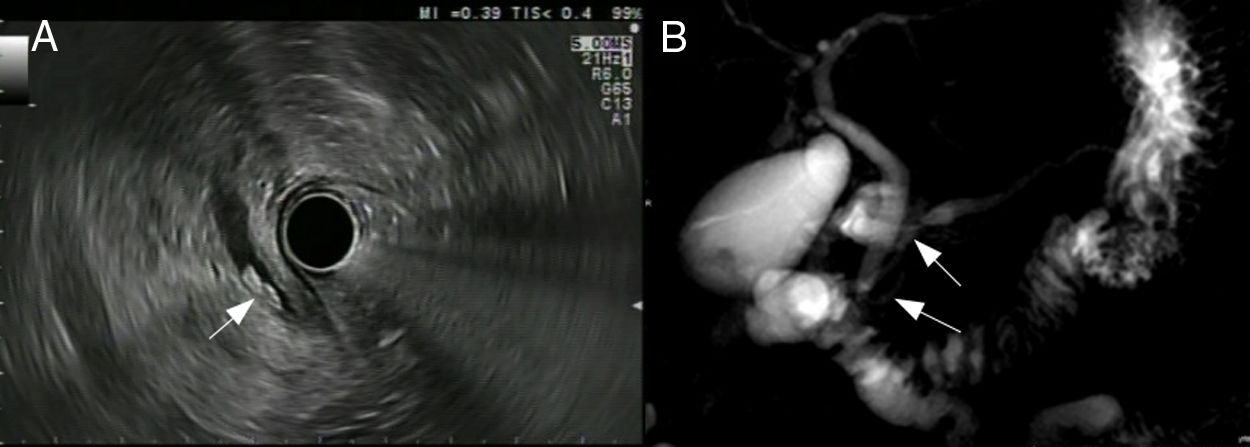
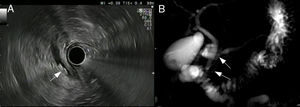
Pruebas de imagenLas 2 técnicas de imagen empleadas para profundizar en el estudio etiológico de la PA de causa no filiada son la colangiografía por resonancia magnética (CRMN) y la ecoendoscopia (USE) (fig. 1).
Pruebas de imagen en el estudio etiológico de pancreatitis aguda idiopática.
En la imagen A se observa (flecha blanca) una imagen compatible con la existencia de una coledocolitiasis. En la imagen B se señala con 2 flechas blancas la ausencia de fusión de los conductos pancreáticos dorsal y ventral y su diferente drenaje en la papila menor y en la papila mayor, respectivamente.
La CRMN es una técnica ampliamente disponible y poco invasiva que permite la obtención de imágenes de los sistemas hepatobiliar y pancreático sin contraste intravenoso ni radiación ionizante. Como ventaja frente a la USE es menos operador dependiente. Alcanza una precisión diagnóstica cercana al 30% en PAI21, con una mayor sensibilidad para la detección de tumores quísticos, alteraciones anatómicas pancreáticas (como páncreas anular) o del ducto pancreático (por ejemplo, páncreas divisum)21. Diversos estudios muestran un aumento del rendimiento diagnóstico de la CRMN cuando se realiza previa estimulación con secretina (S-CRMN)22, fundamentalmente para la detección de páncreas divisum. La secretina estimula la secreción exocrina del páncreas, permitiendo una mejor visualización del conducto pancreático y la medición de su diámetro.
La USE es una técnica poco invasiva, aunque más que la previa, y requiere sedación. Un metaanálisis reciente encuentra una precisión diagnóstica en PAI del 60%, mayor para enfermedad biliar, litiasis y alteraciones del ducto biliar (por ejemplo, coledococele)23-25. Diversas publicaciones sugieren que su precisión diagnóstica no se modifica con la gravedad del cuadro o la existencia de enfermedad recurrente26. Asimismo, una USE negativa tras un primer episodio de PAI se considera valor pronóstico de bajo riesgo de recurrencia26. Además, si bien la TC es la técnica de imagen de elección ante la sospecha de malignidad, el segundo lugar lo ocupa la USE, pudiendo sobrepasar a la primera para el diagnóstico de tumores de pequeño tamaño (<2,5cm)5,27. Por tanto, la USE permite diagnosticar enfermedad biliar oculta, neoplasias y pancreatitis crónica que hayan pasado desapercibidas en la ecografía abdominal.
El momento óptimo para la realización de USE no está claramente establecido. Varios autores recomiendan realizarla al menos un mes tras el episodio agudo para asegurar que los cambios inflamatorios en el parénquima pancreático se han resuelto, y permitir así una correcta visualización del páncreas y de las estructuras peripancréaticas24. Sin embargo, no debe diferirse demasiado dado el potencial riesgo de recurrencia. Debe recordarse también la posibilidad de obtener falsos positivos para el diagnóstico de barro biliar durante el ayuno prolongado.
La utilización de USE o CRMN permite un diagnóstico causal de la PA en el 50% de los casos, ascendiendo al 60% si se combinan ambas pruebas6. Hasta la fecha existen diversos estudios que comparan la utilidad de ambas técnicas en el estudio etiológico de PAI, que reflejan una mayor precisión de la USE frente a la CRMN6,28. La USE obtiene mejores resultados en el diagnóstico de enfermedad litiásica, mientras que los mejores resultados de la CRMN son en enfermedad ductal pancreática y NMPI, aumentando con la estimulación con secretina21,27. Por tanto, ambas técnicas podrían considerarse complementarias y la utilización de una u otra basarse en su disponibilidad, si bien a la luz de los resultados obtenidos en los recientes estudios podría considerarse la USE la técnica de elección, especialmente en los pacientes con vesícula biliar, mientras que la CRMN podría ser el procedimiento a realizar en primer lugar en pacientes colecistectomizados6.
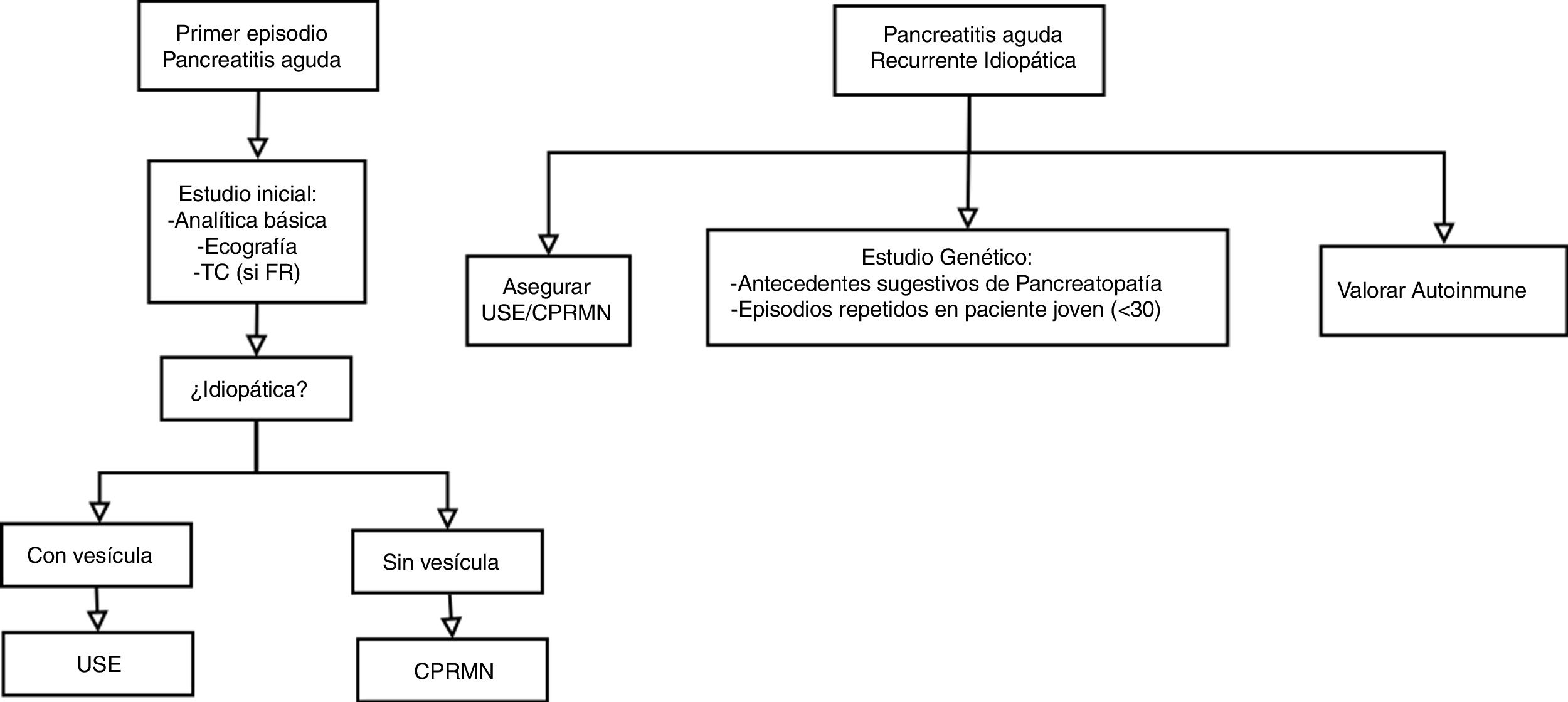
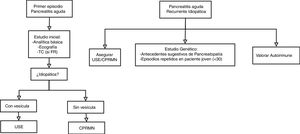
En pacientes con PAI la rentabilidad de realizar un estudio complementario tras un primer episodio es similar a la obtenida al hacerlo tras ataques recurrentes, por lo que parece razonable plantear el estudio desde el primer cuadro26. Las distintas sociedades científicas han emitido recomendaciones respecto a la técnica de imagen a emplear y a cuándo realizarla. La Sociedad Americana de Gastroenterología (American Gastroenterological Association)29 y la Sociedad Americana de Endoscopia Gastrointestinal (American Society for Gastrointestinal Endoscopy)30 sugieren realizar USE tras el primer episodio de PAI en los pacientes mayores de 40 años y en los casos de PAI recurrente. El Colegio Americano de Gastroenterología (American College of Gastroenterology)4 recomienda el uso indistinto de USE o CRMN en la PAI recurrente; mientras que la Asociación Internacional de Pancreatología (International Association of Pancreatology)31 aboga por la realización de USE tras el primer episodio de PAI, añadiendo CRMN con secretina si la USE no es diagnóstica. En función de las recomendaciones de las distintas sociedades científicas, así como los resultados de estudios recientes, podría plantearse el algoritmo diagnóstico recogido en la figura 2.
Estudio de pancreatitis autoinmuneEl diagnóstico de la pancreatitis autoinmune requiere un alto índice de sospecha por parte del clínico, debiendo plantear el principal diagnóstico diferencial con el adenocarcinoma pancreático32. El diagnóstico se basa en la clínica, los datos de laboratorio, las pruebas de imagen e histológicas. Los criterios diagnósticos más aceptados son los criterios HISORT modificados, propuestos por la Clínica Mayo33. La afectación de otros órganos es característica de la pancreatitis autoinmune tipo 1 al formar parte del espectro de enfermedades IgG4. Los criterios de imagen típicos incluyen un aumento difuso de la glándula pancreática con realce periférico en forma de halo en la TC/resonancia magnética, y el conducto pancreático principal difusamente irregular y atenuado. En pacientes con sospecha de pancreatitis autoinmune se pueden solicitar niveles de anticuerpos antinucleares y de IgG434.
Estudio genéticoEl estudio genético debe ser valorado en aquellos pacientes con una sospecha clínica elevada: pacientes jóvenes (<30 años) con episodios recurrentes de PA o antecedentes familiares de pancreatopatía y en pacientes con un episodio de PA documentada sin etiología identificada en la infancia. Se recomienda el estudio de pacientes asintomáticos con familiares de primer grado con una mutación demostrada en el gen PRSS1 dentro del contexto de un consejo genético35.
La identificación de una única mutación en el gen PRSS1, el más frecuentemente implicado, confirma el diagnóstico de pancreatitis hereditaria en pacientes sintomáticos. Por tanto, podría considerarse testar primero esta posibilidad, y si el análisis es negativo, llevar acabo la valoración de los genes CFTR, SPINK1, CASR y CTRC36.
Otras pruebas complementariasLa manometría del esfínter de Oddi es una técnica empleada para el diagnóstico de la disfunción de dicho esfínter. Debe tenerse en cuenta que no existe acuerdo sobre los valores normales de presión, siendo 40mmHg la cifra tomada como umbral por algunos autores. La realización de este procedimiento conlleva riesgo elevado de PA13,37.
Una técnica poco empleada dada su escasa disponibilidad y cuestionada utilidad es el estudio microscópico de la bilis o del aspirado duodenal. Permite detectar los cristales de carbonato cálcico, monohidrato de colesterol y bilirrubinato cálcico que, en ocasiones, no son detectados mediante otras técnicas38.
Pancreatitis aguda recurrenteLa PA recurrente (PAR) es una condición clínica caracterizada por la existencia de 2 o más episodios de PA39,40. Generalmente ocurre sobre una glándula pancreática funcional y morfológicamente normal. Sin embargo, en ocasiones, se pueden encontrar cambios pancreáticos leves que orienten hacia la existencia de una pancreatitis crónica bien tras el episodio agudo, bien durante el seguimiento posterior39. Este hecho sugiere la posibilidad de que los episodios de PA puedan complicar el curso de una pancreatitis crónica o, por el contrario, que episodios repetidos puedan desembocar en un daño crónico por insultos repetidos sobre la glándula41. Se estima que hasta un 20% de los pacientes con un primer episodio de PA desarrollan ataques posteriores, siendo el número de episodios un importante factor de recurrencia. Por ello, el manejo de la PAI continúa siendo un reto para el clínico, siendo de vital importancia conocer la etiología para plantear un tratamiento dirigido y así disminuir la posibilidad de recurrencia.
EtiologíaPrácticamente cualquier factor capaz de causar un episodio inicial de PA puede provocar episodios recurrentes. El mecanismo más frecuentemente implicado en el desarrollo de PAR es la obstrucción biliar, siendo el principal representante de este grupo la enfermedad litiásica39,41, alcanzando en algunas series el 40%6. Otras entidades implicadas son las alteraciones anatómicas, incluyendo el controvertido páncreas divisum, o las anomalías funcionales como la disfunción del esfínter de Oddi, también en entredicho39. El consumo de alcohol es responsable de un 30% de los casos, siendo junto con el tabaco los principales factores relacionados con la progresión hacia la cronicidad42. Otras posibilidades que deben ser tenidas en consideración son el origen genético o la pancreatitis autoinmune. A pesar de ello, en un 15% de los casos de PAR no se consigue identificar la etiología, hablando entonces de PAI recurrente (PAIR)39.
TratamientoPancreatitis aguda recurrente biliarPacientes no colecistectomizados. El tratamiento de elección de la PA litiásica es la colecistectomía30. Si bien en ocasiones las listas de espera no lo permiten, se recomienda la realización de dicha cirugía durante el ingreso tras el episodio agudo y no tras el alta, para así minimizar el riesgo de recurrencia (2-20% frente a 1-1,7%)43.
En aquellos pacientes en los que el elevado riesgo quirúrgico contraindique la realización de la colecistectomía, las distintas sociedades científicas sugieren la posibilidad de la realización de una colangiografía retrógrada endoscópica (CPRE) con esfinterotomía biliar profiláctica para disminuir el riesgo de nuevos episodios de pancreatitis aguda30,43-45, si bien no existe evidencia sólida al respecto. Un estudio retrospectivo reciente que evaluó 5.754 pacientes con PA litiásica desestimados para colecistectomía, encontró una tasa de recurrencia de pancreatitis durante el seguimiento significativamente menor en el grupo de pacientes a los que se realizó CPRE frente a aquellos en los que no se realizó ninguna intervención (8,2% frente a 17,1%)45.
Otra posible medida para disminuir el riesgo de recurrencia en pacientes con PA litiásica, en los que se desestima colecistectomía, es el ácido ursodeoxicólico (AUDC). Si bien no existen ensayos clínicos que sustenten su uso en este contexto, los resultados favorables obtenidos en estudios retrospectivos, junto con la baja tasa de efectos secundarios y su buena tolerancia, hace que el tratamiento con dosis de 8-10mg/kg/día sea recomendado por muchos autores46.
Pacientes colecistectomizados. En pacientes colecistectomizados con episodios repetidos de PA de etiología biliar se recomienda la realización de una CPRE con esfinterotomía biliar, con las mismas consideraciones previamente descritas en cuanto al tratamiento con AUDC28,44.
Pancreatitis aguda recurrente alcohólicaEn la pancreatitis de causa etílica resulta fundamental evitar y tratar de manera precoz el síndrome de privación alcohólica durante el ingreso. De cara a prevenir la aparición de nuevos episodios es imprescindible asegurar la abstinencia, y para ello en muchos casos es necesaria la participación de un especialista en adicciones para favorecer la deshabituación. Tradicionalmente se recomendaba la derivación al especialista en adicciones al alta, sin embargo, basándose en publicaciones recientes, la Sociedad Americana de Gastroenterología recomienda la valoración durante el ingreso28.
Pancreatitis aguda recurrente con alteraciones anatómicas o funcionalesPáncreas divisum. El tratamiento del páncreas divisum debe ser valorado en aquellos pacientes con episodios recurrentes de PA, si bien podría considerarse ante un primer episodio grave una vez excluidas otras causas28. El tratamiento consiste en la descomprensión de la papila menor por vía quirúrgica o endoscópica (esfinterotomía, esfinteroplastia, con o sin colocación de stent)29,47-49. Por el momento, la evidencia al respecto es escasa, no existiendo apenas ensayos clínicos que comparen las distintas opciones. Estudios retrospectivos sugieren que podría existir mejoría sintomática y disminución del número de recurrencias a corto plazo47, si bien parece que el beneficio disminuiría con el tiempo y sería menor en los pacientes con pancreatitis crónica establecida50. Asimismo, la manipulación de la papila menor conlleva un riesgo elevado de pancreatitis posprocedimiento, por lo que el tratamiento endoscópico debe plantearse solo en casos seleccionados. La estimulación con secretina, al permitir una mejor delimitación del conducto pancreático, podría resultar útil para seleccionar a aquellos pacientes con mayor grado de obstrucción que podrían beneficiarse de tratamiento descompresivo21.
Disfunción del esfínter de Oddi. El complejo del esfínter de Oddi incluye un esfínter común, un esfínter biliar y un esfínter pancreático. En función de la contribución de la porción común a la hipertensión de la porción pancreática, el tratamiento de la disfunción del esfínter de Oddi puede consistir en una esfinterotomía biliar simple (incluyendo la porción común y la porción biliar) o requerir una esfinterotomía pancreática. Clásicamente, los pacientes con tipo i se sometían a une esfinterotomía pancreática29. El manejo del tipo ii varía según los distintos autores y centros. Algunos realizan esfinterotomía biliar y/o pancreática empírica, otros realizan una manometría y plantean el tratamiento en función de los resultados obtenidos, mientras que otros sugieren el uso de la esfinterotomía biliar como primer escalón y reservan la realización de una manometría pancreática para los no respondedores51-53. De modo similar que en el manejo del páncreas divisum, existe controversia al respecto. Parece no obstante aceptada la falta de eficacia del tratamiento endoscópico de los pacientes con tipo iii42.
Pancreatitis aguda recurrente idiopáticaEn el manejo de la PAIR las distintas intervenciones propuestas han mostrado escaso beneficio. Algunos artículos recomiendan valorar la realización de una colecistectomía o el tratamiento con AUDC54 para tratar una posible etiología biliar oculta, mientras que otros sugieren la realización de una CPRE con esfinterotomía para cubrir una posible etiología biliar, así como una posible disfunción del esfínter de Oddi53. En la actualidad se encuentra en marcha un ensayo clínico con simvastatina en este contexto (https://www.clinicaltrialsregister.eu/ctr-search/trial/2016-002445-31/ES).
ConclusiónLa PA constituye una enfermedad frecuente en nuestro medio, con una importante morbimortalidad asociada. Establecer su etiología es relevante de cara a poder realizar un tratamiento dirigido y evitar así el riesgo de recurrencia y de progresión a pancreatitis crónica. Tras un estudio inicial (anamnesis completa; analítica con perfil hepático, triglicéridos y calcio; ecografía abdominal y una TC en pacientes>40 años) no se consigue identificar el agente causal en un 30% de los casos, hablando entonces de PAI. Este porcentaje disminuye al 10-15% tras un estudio complementario en el que la enfermedad biliar es la principal causa subyacente en la mayoría de las PA inicialmente catalogadas como idiopáticas. La CRMN y la USE son las 2 técnicas de elección para este estudio complementario. La primera obtiene mejores resultados para la valoración de alteraciones anatómicas pancreáticas, mientras que la segunda presenta mayor potencia diagnóstica para enfermedad biliar. Si bien la USE obtiene mejores resultados que la CRMN, ambas técnicas podrían considerarse complementarias y la elección de una u otra dependería de su disponibilidad. No obstante, dados los resultados obtenidos, parece oportuno recomendar la realización de una USE tras el primer episodio de PAI en aquellos pacientes con vesícula, y de una CRMN en aquellos colecistectomizados, asegurando la existencia de las 2 exploraciones en el caso de PAIR.
En el caso de nuestra paciente, con el diagnóstico de PA se instauró tratamiento analgésico, dieta absoluta y sueroterapia. Se realizó una anamnesis exhaustiva que no sugería la existencia de ningún factor de riesgo para el desarrollo de PA. Se realizó una ecografía abdominal que no mostró hallazgos significativos. La paciente evolucionó favorablemente, siendo dada de alta tras 4 días de ingreso hospitalario. Un mes y medio después se realizó USE visualizando una vía biliar de calibre normal, con una imagen sugestiva de coledocolitiasis (fig 1). Se realizó CPRE con esfinterotomía biliar y extracción de la litiasis. Un mes después se realizó colecistectomía laparoscópica. En la actualidad la paciente se encuentra asintomática.
Conflicto de interesesLos autores afirman no tener conflicto de intereses.