Un paciente de 60 años, con obesidad y diabetes mellitus tipo 2, consulta por presentar hipertensión arterial, temeroso de padecer una cardiopatía isquémica. También presenta antecedentes de tabaquismo de 20 cigarrillos/día desde hace 30 años, pero eso no le preocupa. En el interrogatorio refiere, sin darle importancia, y desde hace años tos y disnea de medianos esfuerzos. Muy probablemente ningún internista dude sobre si debemos evaluar y tratar su diabetes mellitus tipo 2 o su hipertensión arterial, estimar su riesgo cardiovascular o si padece un síndrome metabólico, intentar reducir su obesidad y que abandone el tabaquismo; pero ¿le etiquetaríamos de bronquitis crónica o de EPOC?, ¿debemos hacerle una espirometría y un test broncodilatador?, ¿tratar su probable EPOC? Todos sus síntomas actuales probablemente se deban solo a la EPOC.
A 60-year old male patient with obesity and type 2 diabetes mellitus consulted due to high blood pressure, fearful of suffering ischemic heart disease. He also had a background of smoking 20 cigarettes/day for the last 30 years, but this did not concern him. In the questioning, he reported, although he did not consider it important, that he had cough and dyspnea on moderate exertions for some years. It is very unlikely that any internal medicine physician would doubt about whether to evaluate and treat his type 2 diabetes mellitus or high blood pressure, calculate his cardiovascular risk or if he has a metabolic syndrome, attempt to reduce his obesity and to make him stop smoking. However, should we label him as having chronic bronchitis or COPD? Should we perform a spirometry and bronchodilater test, treat his probable COPD? All his current symptoms are probably only due to COPD.
Los síntomas de la EPOC son poco relevantes hasta que la enfermedad está bien establecida. Además, los pacientes suelen ser fumadores con poca motivación para dejar este hábito.
La EPOC se caracteriza por la presencia de limitación al flujo aéreo crónica, progresiva y poco reversible, asociada a una reacción inflamatoria, causada principalmente por el humo del tabaco1. Se considera que existe EPOC si el cociente de volumen máximo espirado en el primer segundo/capacidad vital forzada (FEV1/FVC) posbroncodilatador es menor de 0,7.
La bronquitis crónica se define por la presencia de tos y expectoración durante más de 3 meses al año y durante más de 2 años consecutivos, no debidas a otras causas conocidas. El enfisema pulmonar es una enfermedad definida según un criterio anatomopatológico por el agrandamiento permanente de los espacios aéreos distales a los bronquiolos terminales, con destrucción de la pared alveolar, sin fibrosis manifiesta2. Estos 2 procesos, suelen ser simultáneos en el mismo paciente y muy difíciles de diferenciar en vivo, motivo por el que han desaparecido ambos términos de las definiciones más recientes3. Además, algunos pacientes con bronquitis crónica y/o enfisema no presentan obstrucción bronquial, y por tanto no se clasifican como EPOC.
La EPOC se diferencia de otras enfermedades con disminución crónica del flujo aéreo (fibrosis quística, las bronquiectasias o la bronquiolitis obliterante) en que estas tienen una causa específica. El asma bronquial cursa característicamente con limitación reversible al flujo aéreo, que puede corregirse totalmente. El empleo de la TAC ha puesto de manifiesto que muchos pacientes con EPOC asocian bronquiectasias de pequeño tamaño, basales y de morfología cilíndrica4, lo cual no excluye el diagnóstico de EPOC.
Infra-diagnósticoSegún la OMS, 210 millones de personas en todo el mundo padecen EPOC5. Más de 3 millones de personas murieron por esta enfermedad en 2005 (5% del total de las defunciones registradas). Se estima que en el mundo se perdieron 30,2 millones de años de vida ajustados por discapacidad, lo cual supone el 2,0% sobre el total5. La OMS pronostica que en el 2030 la EPOC será la causante del 7,8% de todas las muertes y del 27% de las muertes relacionadas con el tabaco, solo superada por el cáncer (33%) y por las enfermedades cardiovasculares (29%)6.
El número estimado de pacientes diagnosticados de EPOC en el año 2000 en Estados Unidos fue de 10 millones de adultos, los resultados del estudio NHANES III indican que están infraestimados y que serían 24 millones de estadounidenses los afectados por la enfermedad7.
Según datos del Centro Nacional de Epidemiología, en el año 2005 en España murieron 17.571 personas a causa de la EPOC (74,3% hombres y 25,7% mujeres). Esta cifra ha ido incrementándose desde 1980 con tendencia a estabilizarse en los últimos años. En España la EPOC es la quinta causa de muerte entre los varones, con una tasa anual de 61 muertes por 100.000 habitantes, y la séptima para las mujeres, con una tasa anual de 20 muertes por 100.000 habitantes en el año 2005. Se estima que entre un 9–10% de la población adulta española de más de 40 años padece EPOC, y que un 70% de ellos permanece sin diagnosticar8.
En el estudio IBERPOC9, la prevalencia de EPOC por sexos fue del 4,3% en hombres y del 3,9% en mujeres. Este estudio evidenció, además, diferencias muy importantes según las diferentes áreas geográficas: desde el 4,9% en Cáceres hasta el 18% en Manlleu (Barcelona); estimándose que más de 1.200.000 españoles tenían obstrucción no reversible del flujo aéreo compatible con EPOC. Un aspecto muy importante de los resultados del estudio IBERPOC fue el alto grado de infradiagnóstico, pues el 78,2% de los casos confirmados por espirometría no tenían diagnóstico previo de EPOC.
Los resultados preliminares del estudio EPI-SCAN10, sitúan la prevalencia de EPOC en la población de 40–80 años en el 10,2% (15,1% en varones y 5,7% en mujeres). Comparado con el estudio IBERPOC, realizado en 1997, el infradiagnóstico de EPOC en España se redujo solo levemente y de forma no significativa (del 78a73%), aunque sí se apreció una reducción del infratratamiento de la EPOC en España (del 81a54%; p<0,05).
InfraevaluaciónLos síntomas de la EPOC son poco relevantes hasta que la enfermedad está bien establecida, y existe una falta de conocimiento de las características de la enfermedad por parte del público en general y de algunos profesionales sanitarios en particular, todo ello dificulta un diagnóstico precoz. A ello se suma la dificultad de acceso a la espirometría11.
Los programas de cribado masivo de la población en búsqueda de pacientes con EPOC resultan caros y no siempre producen los resultados deseados. La alternativa más eficiente, pasa por seleccionar poblaciones de alto riesgo y emplear en ellas pruebas diagnósticas que cumplan con los requisitos mínimos de sensibilidad, reproductibilidad y validación. Se debe sospechar EPOC en todo individuo mayor de 40 años, que tenga como factor de riesgo la exposición a humo de tabaco (>10 paquetes/año), y que presente síntomas compatibles con la enfermedad (tos, expectoración, disnea de esfuerzo); ya que se ha observado que en ellos la prevalencia de la EPOC es superior al 30%. Para realizar un cribado rápido en pacientes de alto riesgo de padecer EPOC, una opción es el empleo de espirómetros de bolsillo, empleando FEV1/FEV6 (sensibilidad del 94% y especificidad del 93,1%) para detectar obstrucción12,13. Este diagnóstico deberá confirmarse mediante la práctica de una espirometría forzada antes y después del tratamiento broncodilatador, que demuestre la existencia de limitación al flujo aéreo. La gravedad de esta limitación se valora mediante el valor de FEV1 expresado como porcentaje de un valor de referencia (que a su vez depende de la etnia, edad, género y talla del individuo). El FEV1 es un indicador sencillo de función pulmonar, valido, fiable y sensible al cambio14.
El comité GOLD15 y la normativa SEPAR-ALAT1 han elaborado unos niveles de gravedad de la limitación al flujo aéreo basados en el FEV1 que permiten guiar la terapéutica y se relacionan con el curso de la enfermedad, la supervivencia y la calidad de vida del paciente (tabla 1).
Niveles de gravedad de la limitación al flujo aéreo basados en el FEV11,15
| Estadio I o EPOC leve | Limitación leve del flujo aéreo (FEV1/FVC<0,70, FEV1≥80% del valor de referencia). Generalmente, se acompaña de tos crónica y aumento de la expectoración. El individuo puede ignorar que su función pulmonar es anormal |
| Estadio II o EPOC moderada | Mayor deterioro de la limitación del flujo aéreo (FEV1/FVC<0,70, 50% ≤FEV1<80% del valor de referencia). Progresión de los síntomas y de la disnea, característicamente durante el ejercicio. Los pacientes habitualmente ya solicitan atención médica debido a la disnea o a una exacerbación |
| Estadio III o EPOC grave | Limitación importante del flujo aéreo (FEV1/FVC<0,70, 30% ≤FEV1<50% del valor de referencia). Mayor disnea y disminución de la capacidad para el ejercicio, con exacerbaciones frecuentes y disminución de la calidad de vida |
| Estadio IV o EPOC muy grave | Grave limitación del flujo aéreo (FEV1/FVC<0,70; FEV1<30% del valor de referencia o FEV1<50%, en presencia de insuficiencia respiratoria (definida por la disminución de la presión parcial de oxígeno (PaO2) menor de 60mmHg con o sin hipercapnia (presión parcial de CO2 (PaCO2) mayor de 45mmHg), medidos a nivel del mar, respirando aire ambiente). La calidad de vida relacionada con la salud se encuentra significativamente disminuida, las exacerbaciones son frecuentes |
FEV1: volumen máximo espirado en el primer segundo; FVC: capacidad vital forzada.
La espirometría forzada es pues una exploración fundamental en el manejo de esta enfermedad, ya que permite establecer el diagnóstico, cuantificar su gravedad, monitorizar la evolución y valorar la gravedad de los episodios de agudización. Pero en la evaluación de la EPOC debemos ir más allá, valorando otros matices:
- 1)
Hiperinsuflación: es uno de los determinantes más destacados de la disnea en el paciente con EPOC, que se acentúa especialmente durante el ejercicio. La determinación de volúmenes pulmonares, mediante pletismografía, dilución de helio o lavado de nitrógeno, permite obtener datos funcionales más precisos en relación al atrapamiento aéreo. La determinación de los volúmenes pulmonares estáticos están especialmente indicados en pacientes con FEV1 por debajo del 50% o en aquellos que presentan disnea desproporcionada al grado de limitación al flujo aéreo16.
- 2)
Tolerancia al ejercicio: existen diversas pruebas de esfuerzo. Entre ellas, la distancia recorrida durante la caminata o marcha de los 6min (6MM) ha ganado una gran popularidad por su sencillez, su cercanía a la actividad física diaria y por estar incluida en el índice BODE. Se recomienda evaluar la tolerancia al ejercicio, especialmente en pacientes graves o muy graves16. También se recomienda su empleo en la valoración multidimensional (del paciente candidato a rehabilitación respiratoria.
- 3)
Intercambio de gases: la gasometría arterial en reposo está indicada si FEV1<50% del valor de referencia y en la prescripción de oxigenoterapia domiciliaria.
- 4)
Capacidad de difusión de monóxido de carbono: indicada si FEV1<50%, si se sospecha enfisema y en la valoración preoperatoria de candidatos a resección pulmonar.
- 5)
La tomografía computarizada torácica de alta resolución: se recomienda en la evaluación de tratamientos quirúrgicos y para el diagnóstico de procesos concomitantes (neoplasias, bronquiectasias asociadas, etc.).
- 6)
Valoración del componente perceptivo: existe un creciente interés por conocer la opinión de los pacientes y sus preferencias. Las escalas de disnea o los cuestionarios de calidad de vida son algunos ejemplos más conocidos. Respecto a la disnea, existen varios instrumentos de medida y valoración. El más utilizado y recomendado es la escala propuesta por el Medical Research Council británico17. En la fase final de la vida, la disnea es el síntoma más incapacitante y prevalente.
- 7)
Estudio nutricional: es un factor pronóstico independiente que se asocia a la supervivencia de los pacientes con EPOC. El índice de masa corporal (IMC=peso [kg]/talla [m2]) es el parámetro antropométrico más utilizado para su evaluación. No obstante, el IMC no considera posibles diferencias en la composición corporal.
- 8)
Valoración de la comorbilidad: ya que puede condicionar el tratamiento, las exacerbaciones, el consumo de recursos y el pronóstico de la enfermedad, se recomienda su valoración. Estudios observacionales recientes, sugieren que un adecuado tratamiento de la comorbilidad puede tener beneficios incluso en la supervivencia18,19.
- 9)
Registro de exacerbaciones: producen un deterioro del estado de salud de los pacientes, favorecen la progresión de la enfermedad e incluso afectan al pronóstico20. Los pacientes que presentan 3 o más exacerbaciones por año se les denomina «frecuentadores», y constituyen un grupo de alto riesgo con mayor morbi-mortalidad. Las exacerbaciones deben estar separadas entre sí al menos 2 semanas tras la finalización de la precedente, para poder distinguir la nueva exacerbación del fracaso terapéutico o recaída.
- 10)
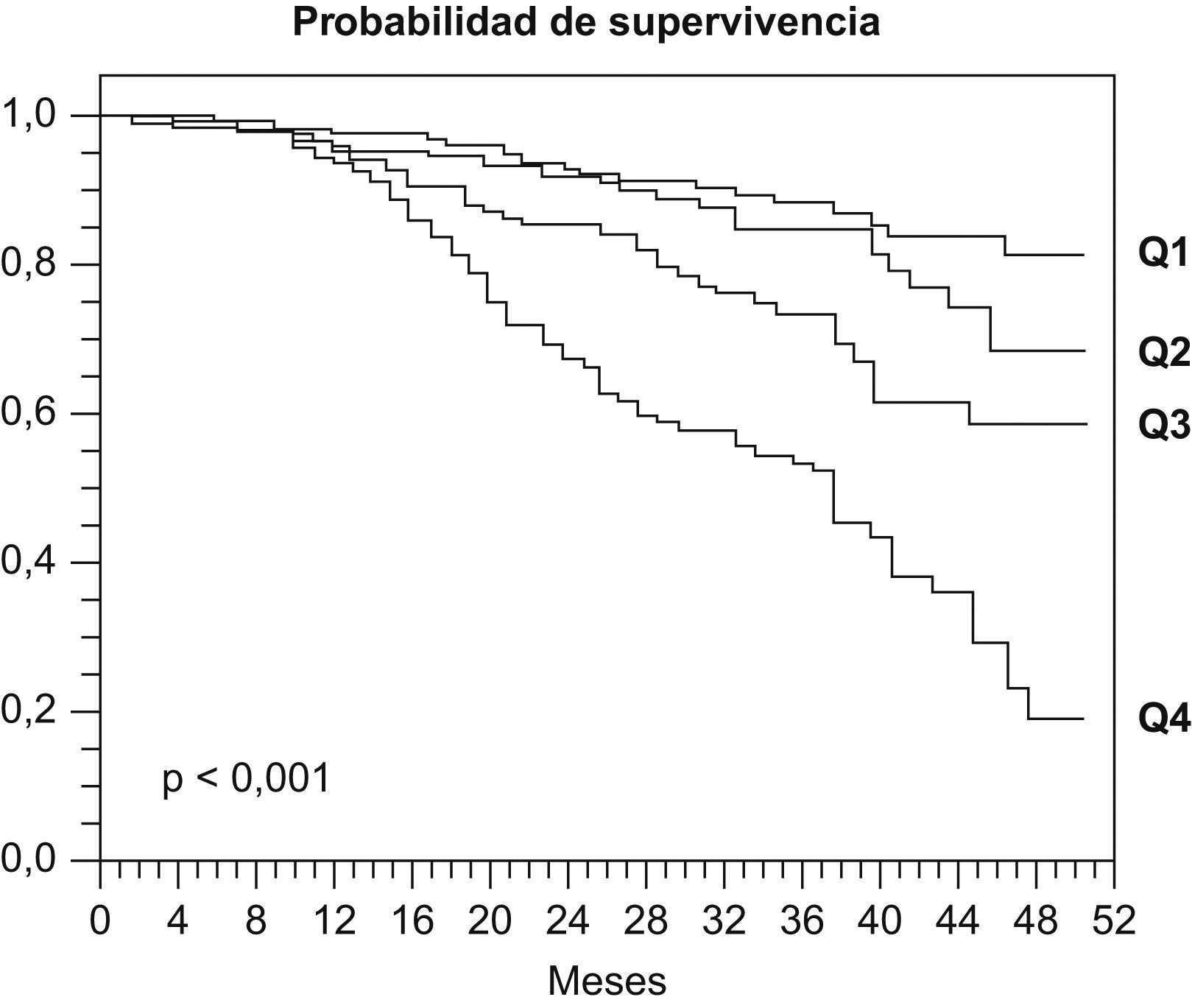
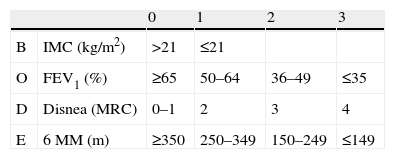
Escalas multidimensionales: la complejidad de la EPOC ha llevado a plantear escalas de valoración capaces de integrar varias de las dimensiones de la enfermedad. La más conocida es el índice BODE desarrollado por Celli et al21, un índice multidimensional capaz de integrar los principales determinantes pronósticos. Este índice recoge la información del IMC, obstrucción, disnea y capacidad de ejercicio, evaluada mediante la prueba de los 6MM. Cada una de estas variables se divide en rangos a los que se les asigna un valor (tablas 2 y 3). Un incremento en un punto del índice BODE se asocia a un aumento del 34% en la mortalidad (fig. 1) por todas las causas (HR: 1,34; IC95%: 1.26–1,42; p<0,001) y del 62% en la mortalidad de causa respiratoria (HR: 1,62; IC95%: 1,48–1,77; p<0,001). En su conjunto el índice BODE es más efectivo que el FEV1 como marcador pronóstico, en relación a diversas intervenciones terapéuticas o para predecir exacerbaciones22–25.
Tabla 2.Clasificación de gravedad multidimensional (índice BODE)21
0 1 2 3 B IMC (kg/m2) >21 ≤21 O FEV1 (%) ≥65 50–64 36–49 ≤35 D Disnea (MRC) 0–1 2 3 4 E 6MM (m) ≥350 250–349 150–249 ≤149 FEV1: volumen máximo espirado en el primer segundo; IMC: índice de masa corporal; MRC: escala modificada por el Medical Research Council británico; MM: minutos marcha.
Tabla 3.Valoración multidimensional por estadios o situaciones especiales (Modificada del British Medical Research Council)
Estadio Características I EPOC leve - •
FEV1
- •
Cuantificación de la disnea (escala MRC)
- •
Valoración nutricional simple (IMC)
- •
Comorbilidad
II EPOC moderada - •
FEV1
- •
Cuantificación de la disnea (escala MRC)
- •
Valoración nutricional simple (IMC)
- •
Exacerbaciones
- •
Comorbilidad
- •
Valoración de la técnica inhalatoria
- •
Valoración adherencia y cumplimiento del tratamiento
III y IV EPOC grave/muy grave - •
FEV1
- •
Cuantificación de la disnea (escala MRC)
- •
Valoración nutricional (composición corporal)
- •
Exacerbaciones
- •
Comorbilidad
- •
Prueba de esfuerzo
- •
Valoración de la hiperinsuflación
- •
Valoración de la técnica inhalatoria
- •
Valoración adherencia y cumplimiento del tratamiento
Situaciones especiales: Paciente candidato a rehabilitación respiratoria: - •
FEV1
- •
Cuantificación de la disnea (escala MRC, escala de Börg)
- •
Prueba de esfuerzo (6MM)
- •
Valoración nutricional
- •
Comorbilidad
- •
Gasometría arterial/Saturación arterial de oxígeno
Valoración en la fase final de vida: - •
Voluntades anticipadas
- •
Cuantificación de la disnea (escala analógica visual)
- •
Evaluación psicológica y social
- •
Escala de dolor
- •
Evaluación del cuidador
FEV1: volumen máximo espirado en el primer segundo; IMC: índice de masa corporal; MRC: Medical Research Council británico; MM: minutos marcha.
Figura 1.Probabilidad de supervivencia en cuartiles según valoración BODE21.
(0,12MB). - •
Recientemente, se han propuesto distintas modificaciones para maximizar la capacidad del índice BODE para predecir la muerte y para simplificar su realización. Así se ha propuesto el BOD26 (elimina la necesidad de la prueba de ejercicio) o el BODex27 (reemplaza el ejercicio por el registro de exacerbaciones graves) pero estos índices deben ser validados. En suma, el índice BODE ha demostrado ser superior al FEV1 como predictor de mortalidad y también ha demostrado su utilidad para predecir exacerbaciones o distinguir estados de salud.
InfratratamientoMuchos hospitales están dotados de UCI, pero la infraestructura para ventilación mecánica no invasiva es más precaria. Aún escasean más los programas de intervención más específicos como rehabilitación respiratoria, asistencia domiciliaria, equipos multidisciplinarios, cuidados paliativos o programas de coordinación.
En la tabla 4 se recogen las medidas terapéuticas y su grado de evidencia científica1. Estas medidas terapéuticas pueden ser difundidas y utilizadas de forma más eficiente.
Terapéutica en la EPOC y grado de evidencia1,15
| Tabaco | El abandono del hábito tabáquico es la intervención más importante para evitar el deterioro funcional del paciente con EPOC y debe indicarse en todos los pacientes (evidencia A). El tratamiento farmacológico con bupropión, vareniclina, o la terapia sustitutiva con nicotina, junto con medidas de apoyo, permite aumentar la tasa de abstinencia tabáquica (evidencia A) |
| Vacunas | La vacunación antigripal (evidencia A) y neumocócica (evidencia B) debe aconsejarse a todos los pacientes con EPOC. El uso de ambas puede tener un efecto sinérgico y reducir las neumonías más graves (evidencia C) |
| Broncodilatadores | En pacientes con síntomas ocasionales, los broncodilatadores de acción corta reduce los síntomas y mejora la tolerancia al esfuerzo (evidencia A). En pacientes con síntomas permanentes, el uso de broncodilatadores de acción prolongada permite un mayor control de los síntomas, mejora la calidad de vida, la función pulmonar y reducen el número de exacerbaciones (evidencia A). En pacientes con EPOC moderada y grave, la combinación de B2-agonistas de acción prolongada y corticoides inhalados produce una mejoría adicional sobre la función pulmonar, los síntomas, la calidad de vida y las exacerbaciones (evidencia A) |
| Rehabilitación y ejercicio físico | La rehabilitación respiratoria (RR) mejora la disnea, la capacidad de ejercicio y la calidad de vida relacionada con la salud (evidencia A). La RR disminuye la utilización de los servicios sanitarios y los ingresos hospitalarios (evidencia B), es coste-efectiva (evidencia B) y mejora el índice BODE. Los programas de rehabilitación que incluyen ejercicio y entrenamiento de las extremidades son los más eficaces (evidencia A).La aplicación de programas domiciliarios de mantenimiento, es una alternativa válida a la rehabilitación realizada en el hospital desde las fases iniciales de la enfermedad (evidencia B) |
| La actividad y el ejercicio físico diario son beneficiosos para los pacientes con EPOC (evidencia B). La realización de ejercicio físico regular es recomendable en todos los estadios de la enfermedad (evidencia C). Se debe recomendar la rehabilitación a todo paciente con EPOC que tras tratamiento optimizado siga estando limitado por la disnea para realizar sus actividades cotidianas (evidencia A) | |
| Oxigenoterapia domiciliaria | El tratamiento con oxigenoterapia continua domiciliaria (OCD) aumenta la supervivencia de los pacientes con EPOC grave e insuficiencia respiratoria (evidencia A). Los criterios para indicar OCD exigen una PaO2<55mmHg (evidencia A), o entre 55–60mmHg cuando se acompaña de poliglobulia, arritmias, hipertensión arterial pulmonar o signos de insuficiencia cardiaca derecha (evidencia C) o de signos de insuficiencia cardiaca derecha, respirando aire ambiente a nivel del mar (evidencia A). El objetivo es mantener una PaO2>60mmHg o SaO2>90% (evidencia D). El efecto de la oxigenoterapia depende de la duración de su administración. Con 18h/día los efectos son superiores a los producidos con 15 o 12h/día (evidencia A) |
| En ausencia de criterios de OCD, la oxigenoterapia durante el sueño está indicada si además de desaturaciones prolongadas existe poliglobulia o signos de insuficiencia cardiaca derecha | |
| Oxigenoterapia en la exacerbación | El objetivo es conseguir una cifra de PaO2≥60mmHg sin provocar acidosis respiratoria (evidencia C). Una FiO2 entre 24–35% es generalmente suficiente. Inicialmente, el oxígeno debe ser aportado con una mascarilla tipo Venturi, pasando después a gafas nasales. En los casos que cursen con acidosis o hipercapnia, la monitorización terapéutica debe ser con gasometría, siendo recomendable un primer control a los 30min del inicio de la terapia. La gasometría también es recomendable siempre que existan signos de deterioro. La pulsioximetría ayudará en la monitorización y ajuste posterior de los niveles de FiO2 |
| Tratamiento de la exacerbación- | Durante la exacerbación se potenciará el tratamiento broncodilatador con un agonista beta-2 de acción corta y/o bromuro de ipratropio (evidencia A). La corticoterapia sistémica es de elección en la exacerbación de la EPOC grave (evidencia A). En la exacerbación de una EPOC leve/moderada se recomienda su uso cuando la evolución inicial no es favorable |
| La teofilina puede añadirse al tratamiento en los pacientes que permanecen sintomáticos con tratamiento óptimo o en aquellos en los que sea necesario utilizar la vía oral (evidencia D) | |
| El uso de mucolíticos y/o antioxidantes puede valorarse en pacientes con expectoración habitual y/o exacerbaciones frecuentes (evidencia B). El empleo sustitutivo con alfa-1-antitripsina está indicado en pacientes seleccionados con déficit en esta enzima (evidencia B). Actualmente no existe ninguna evidencia para recomendar el uso de antitusivos, antileucotrienos, antibióticos profilácticos ni estimulantes respiratorios | |
| En un 50–75% de las exacerbaciones de la EPOC se aísla en el esputo un agente infeccioso, bacteriano en cerca de la mitad de los casos y vírico en un tercio. La antibioterapia es recomendable en las exacerbaciones que presenten, además de disnea, aumento del volumen de la expectoración habitual y/o purulencia | |
| Ventilación mecánica | La ventilación mecánica está indicada cuando a pesar del tratamiento farmacológico y de oxigenoterapia, el paciente sigue presentando un pH <7,35 (evidencia A). Se puede aplicar de forma no invasiva (VNI) o invasiva (VI) por vía endotraqueal. La supervivencia del paciente con exacerbación de EPOC que requiere VI, no es inferior a la presentada cuando la VI es requerida por otras causas. No existe evidencia científica que justifique el uso crónico de la VNI en pacientes con EPOC estable |
| Lugar de tratamiento | La exacerbación de la EPOC leve-moderada puede ser tratada de manera ambulatoria como primera opción. Los criterios de alta hospitalaria se basan en la estabilización clínico-gasométrica y la capacidad del paciente para poder controlar la enfermedad en su domicilio. La hospitalización a domicilio puede ser una opción de tratamiento de la exacerbación de la EPOC con eficacia equivalente a la hospitalización convencional |
| Tratamiento quirúrgico | Pueden proporcionar mejoría clínica en pacientes con EPOC muy grave altamente seleccionados. La cirugía de reducción de volumen pulmonar (CRVP) proporciona mejoría funcional y sintomática en pacientes con enfisema heterogéneo de predominio en lóbulos superiores y baja tolerancia al esfuerzo (evidencia A). En estos pacientes, la CRVP aumenta la supervivencia (Evidencia B). La CRVP está contraindicada en los pacientes con enfisema homogéneo, FEV1<20% ó DLCO <20% (evidencia A). En pacientas altamente seleccionados la bullectomía puede mejorar la función pulmonar y la disnea (evidencia C) |
| Trasplante pulmonar | Proporciona mejoría funcional y sintomática (evidencia C). Esta opción terapéutica se puede considerar en pacientes menores de 65 años y enfermedad muy avanzada, que cumplan los criterios generales de trasplante |
Es necesario que desde la Medicina Interna hagamos un esfuerzo para reducir el infradiagnóstico de la EPOC. Debemos emplear instrumentos de cribado, como los espirómetros de bolsillo basados en el cociente FEV1/FEV6, especialmente en individuos mayores de 40 años, que tengan como factor de riesgo fumar más de 10 paquetes/año y que presenten tos, expectoración o disnea de esfuerzo. La espirometría forzada, antes y después del tratamiento broncodilatador, permitirá establecer con seguridad el diagnóstico de EPOC. Debemos mejorar la evaluación de los pacientes, con herramientas de gran utilidad y no solo con el FEV1. Debemos aplicar los conocimientos actuales para evitar un infratratamiento que ha demostrado mejorar la vida de los pacientes con EPOC.
Conflicto de interesesHe recibido ayudas a la investigación en los últimos 5 años por parte de Pfizer, GlaxoSmith-Kline, Boehringer-Ingelheim y Sanofi-Aventis. También he recibido honorarios por ponencias de AstraZeneca,Boehringer-Ingelheim, Bristol-Myers Squibb, Chiesi, GlaxoSmith-Kline, Juste, Menarini, Merck Sharp & Dohme, Novartis, Pfizer, Sanofi-Aventis y Servier.