La enfermedad por arañazo de gato (EAG) causada por Bartonella henselae tiene prevalencia e incidencia desconocida en la población pediátrica chilena. La presentación como linfoadenopatía regional es la más frecuente, y sus formas atípicas constituyen un reto diagnóstico.
ObjetivoComunicar un caso de EAG con osteomielitis vertebral y entregar posibles lineamientos respecto al tratamiento.
Cuadro clínicoEscolar de 8 años con síndrome febril prolongado y dolor dorsal con rigidez cervical. En estudio destaca IgG para Bartonella henselae positiva, ecotomografía abdominal con microabscesos esplénicos y resonancia magnética con lesiones vertebrales sugerentes de osteomielitis.
DiscusiónEl diagnóstico de las formas atípicas requiere de un alto índice de sospecha, como en este caso, en que el paciente con síndrome febril manifiesta sintomatología musculoesquelética, lo que nos lleva a estudiar posibles complicaciones de la enfermedad. El conocimiento actual del tratamiento de EAG atípica o complicada se deriva de la observación de estudios de casos y no de ensayos aleatorios; se sugiere analizar de manera individual la terapia antimicrobiana y con ayuda de especialistas.
ConclusiónSe discute y enfatiza la importancia de la alta sospecha clínica y se exponen algunas alternativas de tratamiento en función de la evidencia de la literatura actual.
Cat scratch disease (CSD) is caused by Bartonella henselae, with unknown prevalence and incidence in the Chilean paediatric population. Regional lymphadenopathy is the most common presentation, while atypical forms constitute a diagnostic challenge.
ObjectiveTo report a case of CSD with osteomyelitis and present guidelines regarding treatment.
Clinical caseAn eight year-old patient, with prolonged febrile illness, back pain and neck stiffness. Laboratory studies highlight positive IgG for Bartonella henselae. The abdominal ultrasound showed splenic micro-abscesses, and the MRI showing vertebral lesions suggestive of osteomyelitis.
DiscussionThe diagnosis of atypical forms requires a high rate of suspicion, as in this case, in which the patient manifested the musculoskeletal symptoms simultaneously with the febrile syndrome, which led us to study possible complications of the disease. Current knowledge of the treatment of atypical or complicated CSD is derived from the observation of case studies, rather than randomized trials. It is suggested that antibiotic therapy is analysed individually, with the help of a specialist.
ConclusionThe importance of high clinical suspicion are emphasised and discussed, as well presenting some treatment options based on the evidence from the current literature.
La enfermedad por arañazo de gato (EAG) agrupa las diversas enfermedades causadas por Bartonella henselae, un bacilo Gram negativo pleomórfico, fastidioso y de crecimiento lento, con una clínica que varía dependiendo de su extensión, severidad y estado inmunitario del hospedero.
La infección por Bartonella henselae afecta principalmente a niños y adultos jóvenes, con estudios que reportan entre 54% y 87% de los casos de EAG en pacientes menores de 18 años de edad1. En Chile se desconoce la real incidencia de la enfermedad, y el único reporte publicado señala una prevalencia de 13,3% en niños2. Esta infección afecta en mayor porcentaje al sexo masculino, fundamentalmente por juegos agresivos con los felinos, siendo una de las causas más comunes de linfoadenopatía crónica en dicho género1.
Para el desarrollo de la EAG, y posterior a la inoculación del agente, se define un periodo de incubación de 7 a 12 días hasta la aparición de la lesión primaria en la piel (pápula) y luego un período 5 a 50 días para la aparición de la linfoadenopatía3. Entre sus manifestaciones clínicas lo más frecuente es la presencia de una linfoadenopatía regional con compromiso sistémico leve en pacientes inmunocompetentes, siendo sus formas atípicas las de mayor reto diagnóstico.
Presentamos el caso de un escolar, varón de 8 años de edad, que consulta por síndrome febril prolongado con linfoadenopatía en el triángulo submandibular izquierdo, con antecedentes de contacto intradomiciliario con gatos jóvenes, que evoluciona con dolor en el dorso e importante rigidez cervical. El objetivo de nuestra presentación es dar a conocer un caso de EAG diseminada (forma atípica) con compromiso óseo y revisión bibliográfica de alternativas terapéuticas.
Caso clínicoEscolar de 8 años de edad, con antecedentes de otitis media crónica, trastorno del desarrollo del lenguaje y trastorno de déficit atencional con hiperactividad. Ingresa en el Servicio de Pediatría del Hospital Clínico San Borja Arriarán, presentando un cuadro febril prolongado de 16 días de evolución de hasta 40°C axilar, y aparición de linfoadenopatía cervical izquierda al cuarto día del inicio de la fiebre. Consultó en 6 oportunidades en el servicio de urgencia, en donde se prescribe amoxicilina con ácido clavulánico por 10 días más ibuprofeno, sin mejoría clínica. Al décimo tercer día de evolución se deriva al policlínico de infectología de este centro asistencial, en donde se recoge el antecedente de contacto intradomiciliario con gatos jóvenes. Al examen físico destacaba linfoadenopatía en el triángulo submandibular izquierdo, sensible y móvil, de aproximadamente 1,5cm de diámetro y consistencia gomosa; múltiples puntos dolorosos en procesos espinosos de la columna vertebral, imposibilidad de realizar flexión de la columna dorsolumbar, marcada rigidez cervical y movimientos en bloque, con pérdida de la curvatura normal y contracción de la musculatura paravertebral, sin afectación neurológica periférica, por lo que se decide hospitalizar para estudio focalizado de EAG.
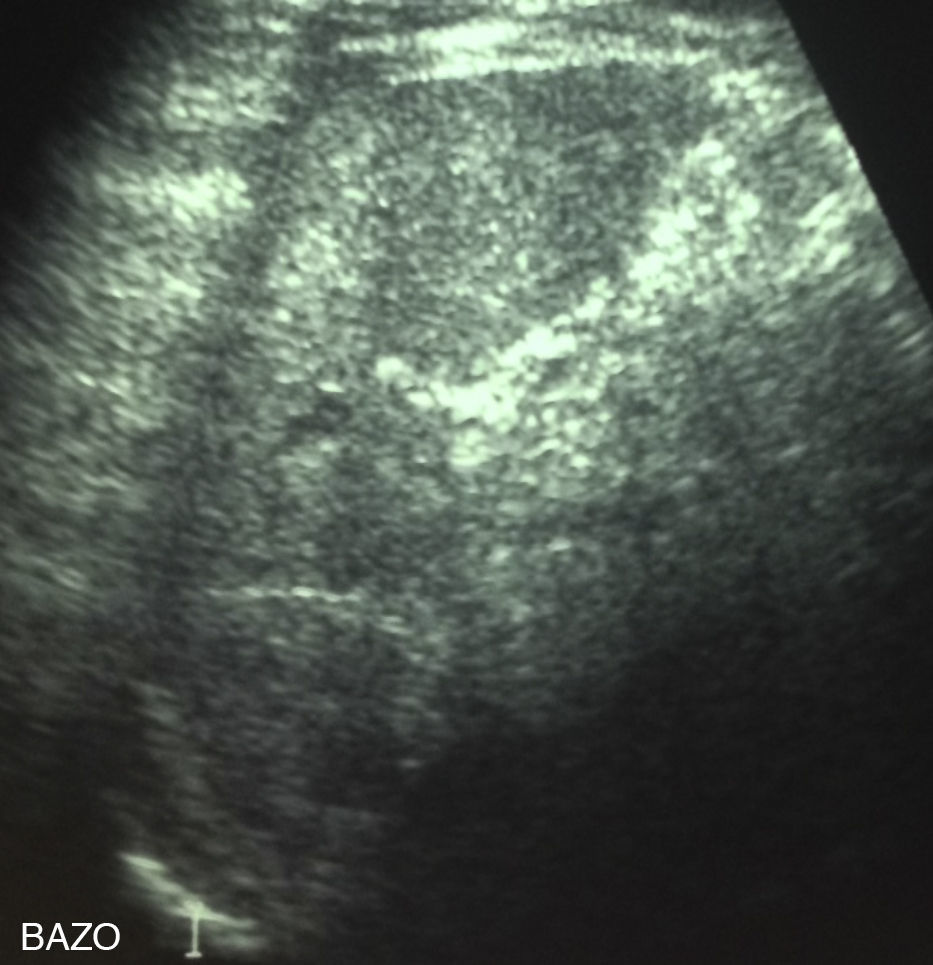
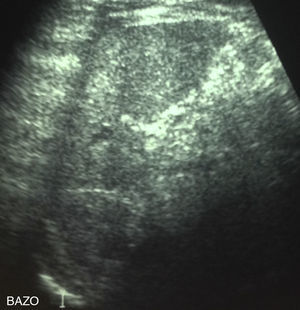
En el estudio de laboratorio inicial presentaba un hemograma con serie roja sin alteraciones, leucocitosis de 14.100 células/mm3 con predominio de polimorfonucleares de 64% y recuento total de eosinófilos de 705 células/mm3, proteína C reactiva de 3,52mg/dl (rango de referencia 0 a 5mg/dl), velocidad de hemosedimentación de 54mm/h, examen de orina completa y urocultivo normales, pruebas de función renal y hepática normales, hemocultivos de sangre periférica negativos. El estudio específico para Bartonella henselae reveló serología positiva, con inmunofluorescencia indirecta en título IgG de 1:256 (laboratorio del Hospital Clínico Universidad Católica). Dentro del estudio de imagen del paciente destacaba una radiografía de tórax sin lesiones, ecotomografía abdominal que evidencia múltiples lesiones hipoecogénicas de aproximadamente 4mm en el bazo, sugerentes de microabscesos (fig. 1) e hígado con ecoestrucutura sin alteraciones. Basándonos en lo anterior se inicia tratamiento con claritromicina oral en dosis de 15mg/kg/peso cada 12h para tratamiento de EAG.
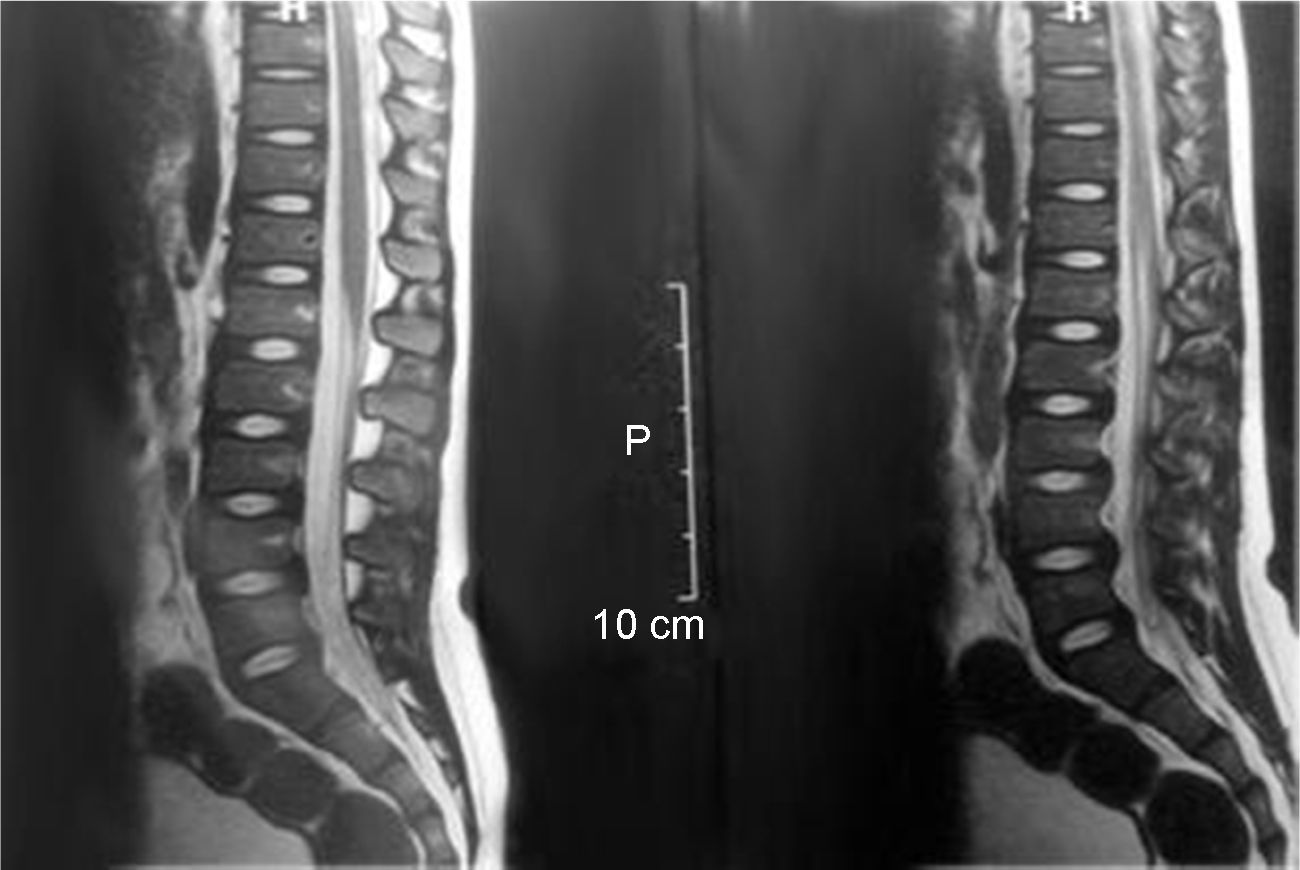
Por sintomatología musculoesquelética se solicita evaluación traumatológica y se efectúa resonancia magnética de columna vertebral total, que muestra múltiples lesiones vertebrales dorsolumbares multisegmentarias con aspecto inflamatorio sugerente de osteomielitis vertebral (fig. 2). Otros diagnósticos diferenciales planteados fueron osteomielitis bacteriana, tuberculosis, histiocitosis, granuloma eosinofílico y neoplasia primaria o metastásica. Estos diagnósticos se desestimaron a la luz de elementos de la anamnesis, clínica, los estudios de imágenes y laboratorio que eran claramente acordes al diagnóstico. Al reevaluar y descartado el riesgo de aplastamiento vertebral en función del estudio anterior, se decide adicionar al tratamiento antimicrobiano ciprofloxacino por vía endovenosa por 14 días y luego completar 6 semanas de tratamiento por vía oral. El paciente presentó una evolución favorable, con mejoría sistémica y musculoesquelética. Egresa con control ambulatorio en policlínicos de infectología y traumatología.
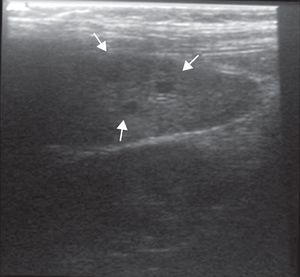
Respecto del seguimiento, en controles posteriores el paciente evolucionó sin sintomatología, con completa resolución de su incapacidad física. El control ecográfico a los 8 meses destaca la desaparición de imágenes hipoecogénicas, incluso con transductor de alta resolución (fig. 3). El equipo de especialistas descarta la necesidad de repetir otra imagen.
DiscusiónLa EAG es una zoonosis producida por la inoculación directa de Bartonella henselae tras la mordedura, arañazo o lamido de gatos, en cuyos glóbulos rojos y saliva aloja esta bacteria4. Tras un periodo de incubación descrito entre 7 a 12 días aparece la primera lesión papular en la piel que tuvo contacto con el felino, con posterior aparición de adenopatías en zonas que reciben el drenaje linfático del sitio de inoculación, en un rango de tiempo que va entre los 5 a 50 días3.
Las manifestaciones de esta enfermedad son variadas, pudiendo presentar un compromiso regional o un amplio espectro sistémico (tabla 1)1. Tradicionalmente se han descrito 2 grandes formas de presentación: una forma típica o síndrome de linfoadenopatía aislada con o sin fiebre, y una forma atípica que abarca manifestaciones extraganglionares en variados sistemas, esperable en el 5% a 25% de los casos de EAG, siendo el compromiso óseo descrito en un 0,3% de los casos5, requiriendo para su diagnóstico un alto índice de sospecha, por lo que muchas veces este se identifica de forma tardía o se confirma luego de múltiples tratamientos sin respuesta. Dentro de estas formas atípicas, una forma frecuente de presentación es como un síndrome febril prolongado, como se presentó nuestro caso clínico, logrando establecerse el diagnóstico final basado en el cuadro clínico, la serología y el estudio imagenológico.
Manifestaciones clínicas de la infección por Bartonella henselae
| EAG típica |
| Linfoadenopatía localizada con síndrome febril prolongado/fiebre de origen desconocido |
| EAG atípica |
| Enfermedad hepatoesplénica |
| Síndrome oculoglandular de Parinaud |
| Neurorretinitis, enfermedad del segmento ocular posterior |
| Encefalopatía, estado espilético |
| Radiculopatía |
| Parálisis facial |
| Síndrome de Guillain Barré |
| Arteritis cerebral |
| Mielitis transversa |
| Epilepsia parcial continua |
| Glomerulonefritis |
| Neumonía, derrame pleural |
| Púrpura trombocitopénica |
| Osteomielitis |
| Artritis/artralgia |
| Endocarditis |
| Angiomatosis bacilar |
Fuente: Florin et al.1.
El paciente reunió 3 de los 4 criterios propuestos por Margileth6 para el diagnóstico de EAG (tabla 2), que si bien no constituyen una regla de oro, orientan hacia el diagnóstico. El cultivo ha sido desplazado debido a su baja sensibilidad, por ser un microorganismo de crecimiento lento y de difícil aislamiento7, dando paso al diagnóstico serológico utilizando inmunofluorescencia indirecta, que muestra una excelente sensibilidad (88-100%) y especificidad (92-98%) para detección de IgG8, y test de ELISA, con sensibilidad (43-95%) y especificidad (77-97%) para la medición de IgM9. Esta última, cuando es positiva apoya el diagnóstico de EAG, pero una negativa no permite descartarlo, por lo que IgG debe considerarse como el estándar de oro para el diagnóstico de EAG9. En nuestro caso el diagnóstico se basó principalmente en el cuadro clínico más la serología positiva con títulos de IgG en punto de corte para Bartonella henselae. Para la interpretación de los títulos IgG se debe considerar la población estudiada, el nivel de los títulos y el momento en que se hace la medición. Según Ferrés2 títulos <1:64 podrían corresponder a una infección antigua debido a que en población pediátrica chilena es posible detectar un elevado porcentaje (13,3%) de niños asintomáticos con este nivel de títulos, contrario a lo que sucede en EE. UU., en donde el diagnóstico serológico se sustenta en títulos mayores a ese nivel en pacientes con una clínica compatible para EAG. Con un nivel de títulos IgG≥1:125 ya se aprecia una buena sensibilidad para el diagnóstico, certificando la enfermedad aguda con títulos≥1:256, en contraposición a lo que ocurre con una IgG entre 1:64 y 1:256, lo que es posible de encontrar en pacientes sanos (4% a 6%) o al inicio o en la convalecencia de la enfermedad, por lo que la recomendación es repetir el test dentro de 10 a 14 días5,10,11. Además, se debe tener presente que durante los primeros 10 a 14 días de la enfermedad los test serológicos pueden resultar negativos. El uso de IgM no está recomendado para el diagnóstico por su corto tiempo de producción, la que se negativiza a los 3 meses11.
Criterios diagnósticos de infección por Bartonella henselae
| Tres de 4 de los siguientes: |
| 1. Contacto con gato o pulga independiente de la presencia de sitio de inoculación |
| 2. Serología negativa para otras acusas de adenopatía, aspiración estéril de ganglio, PCR positiva y/o lesiones en hígado/bazo a la TAC escáner |
| 3. Inmunoanálisis enzimático positivo o IFI con títulos mayor o igual a 1:64a |
| 4. Biopsia que muestre inflamación granulomatosa atribuible a EAG o tinción de Whartin-Starry positiva |
EAG: enfermedad por arañazo de gato; IFI: inmunofluorescencia indirecta; PCR: reacción en cadena de la polimerasa; TAC: tomografía axial computarizada.
Fuente: Margileth et al.6.
Autores nacionales sugieren utilizar títulos de ≥1:256 para el diagnóstico, debido a que estudios locales muestran que niveles entre 1:64 y 1:256 se pueden observar en pacientes asintomáticos2.
El uso de técnicas de biología molecular, como la reacción en cadena de la polimerasa, es la prueba más sensible y específica cuyo fundamento como técnica se basa en la detección de ADN específico para Bartonella henselae presente en muestras estériles o contaminadas (principalmente sanguínea y biopsia de tejido afectado en formas atípicas), pudiendo discriminar entre las distintas especies, subespecies y cepas de Bartonella, siendo de utilidad para el diagnóstico diferencial, y superando por esta característica a la especificidad para el diagnóstico de especies de las técnicas serológicas, debido a las reacciones cruzadas entre antígenos de Bartonella henselae y Bartonella quintana5,12. Se insiste en que un resultado negativo para Bartonella no descarta el diagnóstico13.
En la evolución del paciente destaca preponderantemente la sintomatología musculoesquelética debido a presencia de osteomielitis en la columna vertebral dorsolumbar, siendo esta una complicación poco frecuente, según lo descrito en las primeras grandes series de casos reportados por Carithers14 y por Margileth15. Las manifestaciones clínicas que acompañan a esta presentación incluyen mialgias, dolor óseo y sensibilidad en el hueso afectado, como lo ocurrido al paciente1. En un estudio realizado por Maman16, que presenta una serie de 913 pacientes con EAG, solo 96 (10,5%) presentaron manifestaciones musculoesqueléticas, y la mialgia fue el síntoma más frecuente, reportado en 53 pacientes. En el compromiso óseo predomina la lesión unifocal, pero de ubicación variable, con mayor frecuencia en columna vertebral (de predominio en la columna dorsal lumbar y pélvica) y el cráneo5,17, al contrario de lo que ocurre en otros huesos, en los cuales su compromiso es menos frecuente, siendo raro el compromiso en las articulaciones, y a pesar de que el compromiso vertebral es uno de los más frecuentes, la discitis es rara13.
La patogenia de la osteomelitis vertebral no está del todo dilucidada, pese a ello la ubicación de la linfoadenopatía está frecuentemente distante al sitio de la osteomielitis, lo que sugiere que la infección ósea es producida por diseminación hematógena o linfática, siendo la forma hematógena la más frecuente de los mecanismos fisiopatológicos de osteomielitis vertebral.
Los estudios de imágenes son imprescindibles para certificar las lesiones óseas, y en estas se pueden observar cambios osteolíticos, a menudo múltiples, en la columna o las extremidades. La radiografía simple constituye generalmente el estudio inicial de afecciones osteoarticulares, siendo de baja sensibilidad en etapas precoces, debido a que las lesiones existentes muchas veces no son aparentes, aunque pueden asociarse a cierto grado de actividad osteoblástica perilesional, esclerosis y reacción perióstica del segmento óseo afectado12,17. La TAC puede evidenciar imágenes óseas hiperdensas, cambios líticos y edema paravertebral que acompaña a la osteomielitis. La RNM es la mejor herramienta para detectar osteomielitis, evaluar su extensión y para el diagnóstico de lesiones concomitantes como abscesos paravertebrales. Sin embargo, el estudio de primera línea lo constituye el cintigrama óseo, el cual es muy sensible pero con una especificidad variable que oscila entre el 70% a 95%18, con una tasa relativamente alta de falsos positivos, secundario a ello la dificultad para diferenciar el compromiso infeccioso óseo de los tejidos blandos y articulares, así como para diferenciar la presencia de osteomielitis de otros procesos inflamatorios como los producidos por neoplasias y traumatismos17,18. Es superior a RNM en cuanto a que puede visualizar la totalidad del esqueleto, aspecto importante en niños, en los cuales las lesiones pueden ser multifocales, como el paciente expuesto. La desventaja se relaciona con su limitada resolución espacial, por lo que se plantea el estudio del compromiso óseo con cintigrama y luego con RNM para estudio regional18. En el caso clínico expuesto no se realizó cintigrafía ósea por no contar con el recurso en el centro de salud, y por opinión de especialistas en priorizar la imagen focal con RNM.
Respecto al manejo, este es controvertido debido a que no existe consenso referente a la indicación de algún esquema antimicrobiano para personas inmunocompetentes, en quienes la EAG típica es habitualmente autolimitada y se resuelve en uno o 2 meses sin necesidad de usar estos fármacos19.
Existe una gran variabilidad en la susceptibilidad de diferentes antimicrobianos, como penicilinas, cefalosporinas, aminoglucósidos, cloranfenicol, macrólidos, rifampicina, fluoroquinolonas y cotrimoxazol, tanto in vitro como in vivo. Para los macrólidos, el único ensayo prospectivo, doble ciego controlado con placebo realizado por Bals19, utilizó azitromicina en pacientes con EAG sin complicaciones, e informó una disminución del 80% en el volumen inicial de las adenopatías en 7 de los 14 pacientes tratados con azitromicina versus uno de 15 pacientes con placebo durante los primeros 30 días de observación (p=0,026)19. Solo hubo diferencia en la velocidad y el grado de disminución del volumen total de las adenopatías, demostrando ninguna eficacia de azitromicina en el tratamiento de la EAG diseminada, ni en la prevención de complicaciones tales como encefalitis o endocarditis.
En general, la recomendación en EAG no complicada es un régimen de azitromicina vía oral 10mg/kg/día el primer día, luego 5mg/kg/día del 2.° al 5.° día5,19. Otra alternativa incluye rifampicina (20mg/kg/día divididos en 2 dosis por 2-3 semanas), ciprofloxacino (20-30mg/kg/día divididos en 2 dosis por 2-3 semanas) o trimetoprim-sulfametoxazol (10mg de trimetoprim/kg/día en 2-3 dosis al día por 7-10 días) para pacientes con grandes linfoadenopatías19.
En la mayoría de los casos las adenopatías remiten en 2-4 meses, siendo indicaciones de resección quirúrgica la supuración y la sospecha de malignidad20.
En contraposición, y debido a su baja frecuencia, no se dispone de ensayos clínicos controlados que evalúen la eficacia de algún esquema antimicrobiano para el manejo de EAG atípica, por lo que el conocimiento actual para su tratamiento deriva mayoritariamente de la observación de estudios de casos y no de ensayos aleatorios. La falta de datos es aún mayor en pediatría, por lo que se sugiere analizar de manera individual la terapia antimicrobiana y con ayuda de pediatras infectólogos2.
Distintos autores plantean el uso sistemático de antimicrobianos, recomendándose claritromicina 10-15mg/kg/día, gentamicina 5mg/kg/día, cotrimoxazol 40mg/kg/día de sulfa (o 6-8mg/kg/día de trimetoprim) y ciprofloxacina 20-30mg/kg/día en el niño a partir de los 12 años de edad5. También se menciona rifampicina, fármaco que hoy en día debiera reservarse a otras situaciones clínicas particulares como TBC.
Para el compromiso óseo no existe una recomendación estándar, pero se sabe que tiene un comportamiento benigno, sin necesidad de manejo quirúrgico, y que habitualmente tiende a la resolución espontánea dentro de 4 a 20 meses5. No ha sido claramente demostrado que la terapia con antimicrobianos modifique la evolución natural del cuadro, ni tampoco se ha establecido un consenso en la literatura referente al tiempo total de administración de ellos debido a su escasa penetración ósea secundario al proceso inflamatorio, necrosis y secuestro óseo21.
La mayoría de los estudios y guías de tratamiento recomiendan el uso de ciprofloxacino, doxiciclina o azitromicina en altas dosis y en períodos prolongados, con una duración de 6 a 12 semanas (mínimo 4 semanas, en ausencia de colecciones, pudiendo ser superior en casos con gran destrucción ósea o abscesos)19,22, administrados de forma endovenosa los primeros 10 a 14 días para luego pasar a la vía oral, hasta lograr la resolución microbiológica total del cuadro, con normalización de parámetros inflamatorios23.
El paciente presentó una respuesta favorable al tratamiento antibiótico biasociado, logrando resolución clínica y radiológica del compromiso de la columna y sistémico. Por lo anterior, se propone el uso de antimicrobianos de forma biasoacida como en nuestro caso, claritomicina más ciprofloxacino de uso prolongado (6 semanas). Actualmente, el paciente se encuentra dado de alta en infectología y traumatología.
ConclusiónEn pacientes con EAG y compromiso óseo aún no ha sido claramente demostrado que la terapia con antimicrobianos modifique la evolución natural del cuadro, debido a la falta de evidencia clínica para un manejo más estandarizado. Se recomienda el uso de 2 antimicrobianos con una duración de 6 a 12 semanas hasta lograr una resolución clínica y radiológica del cuadro, constituyendo los lineamientos de manejo terapéutico de osteomielitis vertebral en EAG basado en la experiencia clínica registrada en reporte de casos aislados en el mundo.
Nota: para la presentación clínica de este caso se obtuvo el consentimiento informado y firmado por la madre.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.