Valorar la eficacia de la administración preoperatoria de inmunonutrición oral en pacientes con cáncer colorrectal resecable, en términos de reducción de la incidencia de complicaciones infecciosas posquirúrgicas.
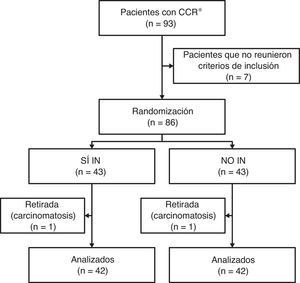
Material y métodosEstudio prospectivo y aleatorizado. Se reclutaron 84 pacientes. En el grupo inmunonutrido (SÍ IN) se administró de forma preoperatoria Impact© Oral durante 8 días (3 envases al día), con respecto del grupo no inmunonutrido (NO IN), que únicamente recibió dieta normal, sin suplementos.
ResultadosDel total de pacientes, el 40,5% (17) de los NO IN presentaron complicaciones infecciosas frente a un 33,3% (14) de los SÍ IN. En los pacientes con cáncer rectal NO IN, un 50% (8) tuvieron complicaciones infecciosas menores frente a un 13,6% (3) de los SÍ IN, (p=0,028).
En la regresión logística, la variable proteínas totales en el quinto día posquirúrgico (OR: 2,8 [IC 95%: 1,3-6,3], p=0,012) fue independiente en relación con la aparición de complicaciones infecciosas. Específicamente, la variable fuga anastomótica se comportó como factor de riesgo en el desarrollo de infección de herida, con una OR de 4,5 (IC 95%: 1,3-16,1) (p=0,033).
DiscusiónLa desnutrición en los pacientes oncológicos susceptibles de cirugía se traduce en un incremento en la morbimortalidad postoperatoria de los mismos. La utilización de fórmulas enterales con inmunonutrientes en estos sujetos puede atenuar dicha morbilidad, a expensas de la disminución de complicaciones infecciosas.
ConclusiónEn nuestro análisis, los pacientes NO IN presentaron con mayor frecuencia complicaciones infecciosas posquirúrgicas, sobre todo el subgrupo de pacientes con cáncer rectal.
Assess the efficacy of preoperative administration of oral immunonutrition in patients with resectable colorectal cancer, in terms of reducing the incidence of postoperative infectious complications.
Material and methodsProspective randomized study. A total of 84 patients were recruited. To the group YES IN, Impact© Oral was preoperatively administered for 8 days (3 bricks a day), whereas the NOT IN group only received normal diet, without supplements.
ResultsOf all patients, 40.5% (17) in the NOT IN group suffered infectious complications against 33.3% (14) in the YES IN group. Among patients with rectal cancer in the NOT IN group, 50% (8) suffered minor infectious complications, compared with 13.6% (3) among those in the YES IN group (P=.028). Using logistic regression, the variable total protein on the fifth postoperative day [OR: 2.8 (95% CI: 1.3 to 6.3) (P=.012)] showed a statistically significant relationship with the occurrence of infectious complications. Specifically, anastomotic leak variable behaved as a risk factor in the development of surgical site infection, with an OR of 4.5 (95% CI: 1.3 to 16.1) (P=.033).
DiscussionMalnutrition in cancer patients suitable for surgery results in an increase in postoperative morbidity and mortality. The use of enteral formulas with immunonutrients in these subjects can attenuate this morbidity, decreasing infectious complications.
ConclusionIn our analysis, the NOT IN group suffered more postoperative infectious complications, particularly the subset of patients with rectal cancer.
La malnutrición hospitalaria, cuya elevada prevalencia se describe en la literatura desde hace más de 40 años, varía de un 19-80%, según la nación y el tipo de enfermos estudiados1-3. Los pacientes desnutridos presentan mayor morbimortalidad posquirúrgica, lo que implica un incremento de la estancia hospitalaria y de los costes sanitarios asociados de hasta el 50%, con respecto de los pacientes no desnutridos4-6.
El manejo perioperatorio actual de los pacientes intervenidos mediante cirugía colorrectal programada incluye, entre las opciones nutricionales actuales, la administración de suplementos orales con inmunonutrientes7. Estos inmunonutrientes: arginina, ácidos grasos ω-3 y nucleótidos, además de regular la respuesta inmunitaria del huésped, mantienen la funcionalidad de la barrera mucosa y ayudan a modular la reacción inflamatoria local o sistémica, el balance nitrogenado y la síntesis proteica8-10. En la literatura, diversos metaanálisis muestran que las fórmulas enterales con dichos inmunonutrientes, utilizadas en pacientes quirúrgicos con neoplasias gastrointestinales, reducen la incidencia de complicaciones infecciosas, acortando la estancia hospitalaria aunque sin modificar la mortalidad, constituyendo, por tanto, una medida coste-efectiva11-19. Sin embargo, estas investigaciones presentan múltiples limitaciones en relación con los pacientes con cáncer colorrectal: la calidad metodológica de los estudios individuales, la heterogeneidad de la patología sufrida por los sujetos y su diverso estado nutricional, la variedad de regímenes nutricionales utilizados y las cantidades y tiempo de administración de los mismos17,19,20. Asimismo, no existen estudios centrados en pacientes con cáncer colorrectal intervenidos mediante cirugía programada en los que se analice la prevalencia de desnutrición antes y después de la administración ambulatoria de inmunonutrientes, donde se objetiven las complicaciones posquirúrgicas tras la aplicación de esta inmunodieta, estratificadas según la localización del tumor; y por todo ello, consideramos justificada la realización de este estudio.
El objetivo principal de nuestro análisis fue valorar la eficacia de la utilización preoperatoria de suplementos orales con inmunonutrientes frente a la preparación prequirúrgica habitual en cirugía colorrectal oncológica programada en el servicio de Cirugía General y del Aparato Digestivo del Hospital General Universitario de Ciudad Real, en términos de reducción de la incidencia de complicaciones infecciosas posquirúrgicas.
Los objetivos secundarios fueron analizar los factores de riesgo y su correlación con la incidencia de complicaciones infecciosas posquirúrgicas, así como determinar la prevalencia de malnutrición antes y después de la administración preoperatoria de suplementos orales con inmunonutrientes.
Material y métodosEstudio prospectivo y aleatorizado, realizado en el Hospital General Universitario de Ciudad Real, durante un periodo de 11 meses (entre el 1 de diciembre del 2010 y el 31 octubre del 2011), en el que se incluyeron 84 pacientes21.
La secuencia de aleatorización se estableció mediante una tabla de números aleatorios. Los sujetos se aleatorizaron en el grupo A (SÍ IN: sí inmunonutrición), que recibió inmunonutrición preoperatoria y dieta normal (n=42), y el grupo B (No IN: no inmunonutrición), que no recibió inmunonutrientes (manejo preoperatorio habitual) y únicamente dieta normal según nuestra práctica habitual (n=42). Al grupo SÍ IN le fue administrado de forma preoperatoria Impact© Oral (Novartis©; Medical Nutrition, España), 3 envases de 237ml al día, durante 8 días. Vía telefónica, se comprobó la adherencia al tratamiento y sus posibles efectos secundarios, el tercer y el sexto día de suplementación oral y personalmente el primer día del ingreso preoperatorio.
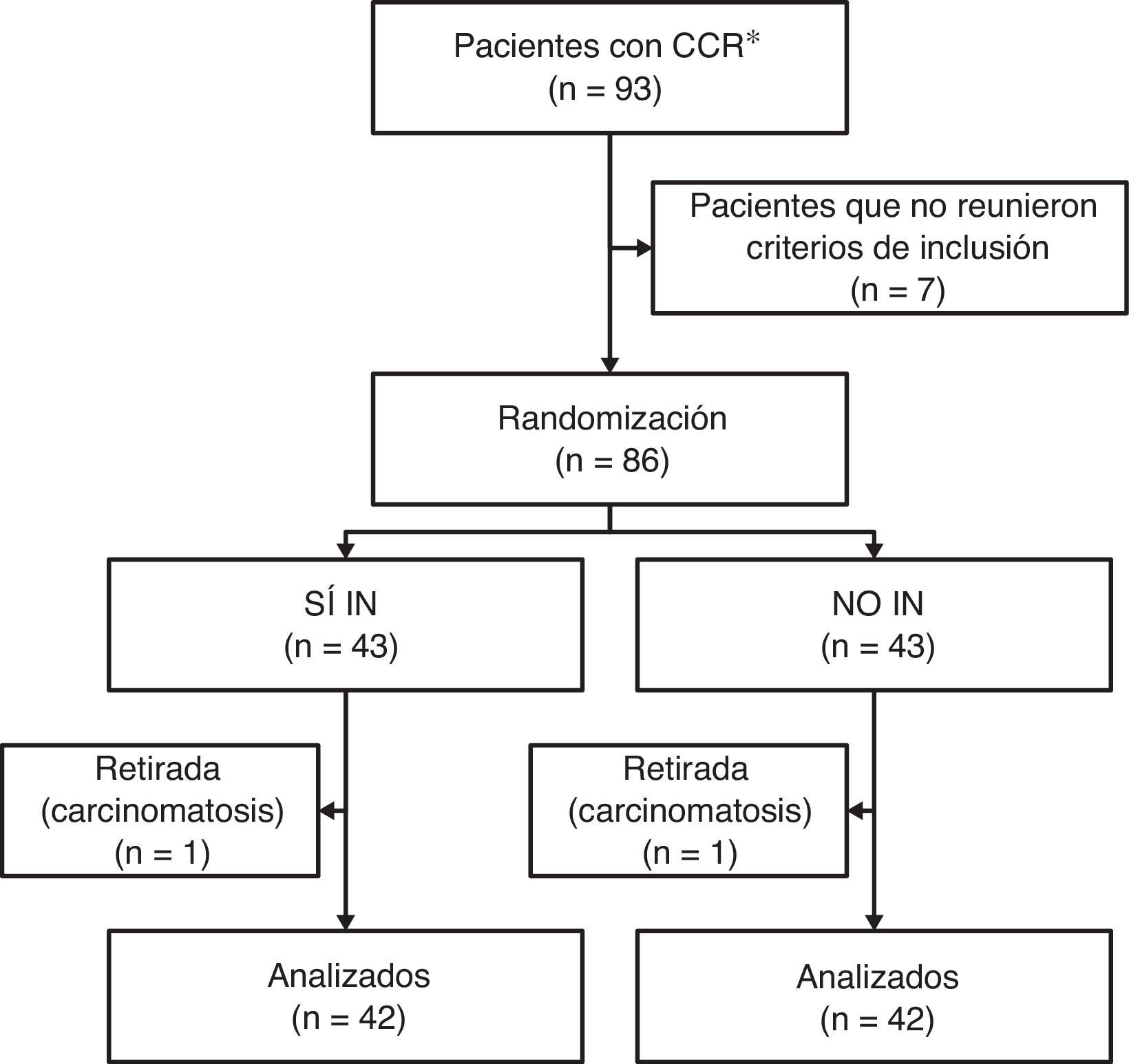
Los criterios de inclusión fueron: pacientes mayores de 18 años diagnosticados de cáncer colorrectal, susceptibles de cirugía programada con intención curativa y en quienes se realizó una técnica quirúrgica con resección intestinal, con o sin anastomosis intestinal primaria (fig. 1).
Se determinaron parámetros proteicos: proteína de fijación del retinol (RBP), transferrina, albúmina, prealbúmina, proteínas totales; calóricos: porcentaje de peso perdido, índice de masa corporal (IMC), colesterol total, e inmunológicos: linfocitos totales, proteína C reactiva (PCR), complementos C3 y C4, inmunoglobulinas G, A y M, linfocitos T CD3 y B CD19, en la primera consulta, el primer día preoperatorio y el quinto día posquirúrgico. Asimismo, se registraron las complicaciones postoperatorias, centrándonos en las complicaciones infecciosas hasta 30 días tras el alta hospitalaria. Los resultados se estratificaron en función del segmento intestinal afecto por el cáncer (colon y recto).
El test t-Student se utilizó para comparar 2 medias independientes, en el estudio de una variable cuantitativa dependiente frente a una cualitativa dicotómica verificando la independencia y la normalidad a través de los test de Rachas y Kolmogorov-Smirnov, respectivamente. Cuando la variable cualitativa tenía más de 2 clases, se utilizó el test de ANOVA, verificando los supuestos necesarios para su utilización.
En el análisis estadístico de la evolución de una variable a lo largo del tiempo se utilizó el ANOVA de medidas repetidas al trabajar con muestras dependientes. Los supuestos necesarios para su utilización también fueron verificados. En los casos en los que alguno de los supuestos no fue verificado se utilizó el test no paramétrico correspondiente. El test de Chi-cuadrado (χ2), con su correspondiente corrección de continuidad, se utilizó para la comparación de variables categóricas, siempre y cuando se cumplieran las condiciones de validez para esta aproximación. En caso contrario, se utilizó el test exacto de Fisher. La eficacia de la inmunonutrición frente a la práctica habitual se expresó mediante la odds ratio (OR) con un intervalo de confianza (IC) del 95%, a través de un modelo multivariante de regresión logística.
El análisis estadístico se realizó utilizando el programa SPSS©, versión 17.0. Valores de p<0,05 fueron considerados estadísticamente significativos.
El estudio se llevó a cabo respetando las normas éticas concordantes con la Declaración de Helsinki y fue aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario de Ciudad Real. Todos los pacientes firmaron el consentimiento informado para su inclusión en el estudio.
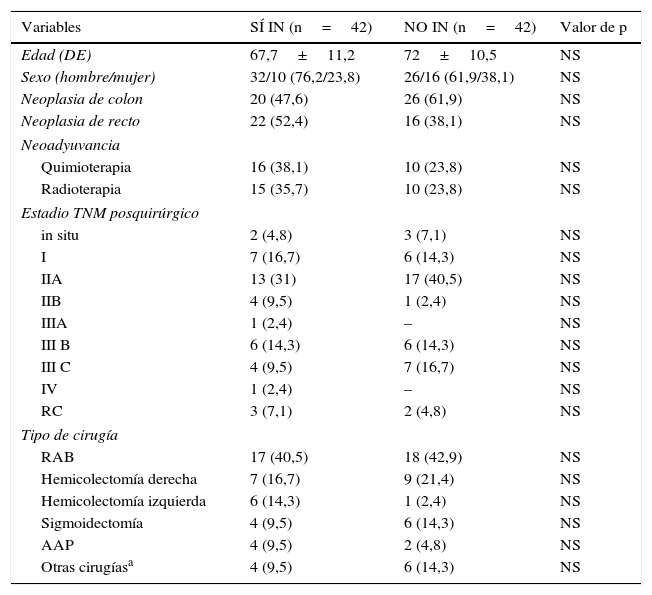
ResultadosLa edad media de los sujetos analizados fue de 69,9±11 años, con predominio de los varones (69,05% [58]). Ambos grupos no mostraron diferencias significativas en sus características basales (tabla 1).
Características basales
| Variables | SÍ IN (n=42) | NO IN (n=42) | Valor de p |
|---|---|---|---|
| Edad (DE) | 67,7±11,2 | 72±10,5 | NS |
| Sexo (hombre/mujer) | 32/10 (76,2/23,8) | 26/16 (61,9/38,1) | NS |
| Neoplasia de colon | 20 (47,6) | 26 (61,9) | NS |
| Neoplasia de recto | 22 (52,4) | 16 (38,1) | NS |
| Neoadyuvancia | |||
| Quimioterapia | 16 (38,1) | 10 (23,8) | NS |
| Radioterapia | 15 (35,7) | 10 (23,8) | NS |
| Estadio TNM posquirúrgico | |||
| in situ | 2 (4,8) | 3 (7,1) | NS |
| I | 7 (16,7) | 6 (14,3) | NS |
| IIA | 13 (31) | 17 (40,5) | NS |
| IIB | 4 (9,5) | 1 (2,4) | NS |
| IIIA | 1 (2,4) | – | NS |
| III B | 6 (14,3) | 6 (14,3) | NS |
| III C | 4 (9,5) | 7 (16,7) | NS |
| IV | 1 (2,4) | – | NS |
| RC | 3 (7,1) | 2 (4,8) | NS |
| Tipo de cirugía | |||
| RAB | 17 (40,5) | 18 (42,9) | NS |
| Hemicolectomía derecha | 7 (16,7) | 9 (21,4) | NS |
| Hemicolectomía izquierda | 6 (14,3) | 1 (2,4) | NS |
| Sigmoidectomía | 4 (9,5) | 6 (14,3) | NS |
| AAP | 4 (9,5) | 2 (4,8) | NS |
| Otras cirugíasa | 4 (9,5) | 6 (14,3) | NS |
Las variables cualitativas están expresadas como número de pacientes y entre paréntesis su porcentaje. Las variables cuantitativas como medias±desviación estándar.
AAP: amputación abdominoperineal; DE: desviación estándar; NO IN: no inmunonutrición; NS: no significativo; RAB: resección anterior baja; RC: remisión completa; SÍ IN: sí inmunonutrición; TNM: tumor, adenopatía, metástasis.
En nuestro estudio administramos Impact® Oral (Novartis©; Medical Nutrition, España), independientemente del estado nutricional del sujeto. Este suplemento hiperproteico con inmunonutrientes (L-arginina, nucleótidos, ácidos grasos ω-3, vitaminas y oligoelementos) fue administrado durante 8 días en el periodo preoperatorio inmediato (media de 7,3±0,8 días), con una pauta de 3 envases (711ml) al día (volumen ingerido medio de 5.180,1±618,4ml). La adhesión al tratamiento fue completa, salvo en un caso (2,4%), en el que se suspendió la inmunodieta el quinto día por diarrea.
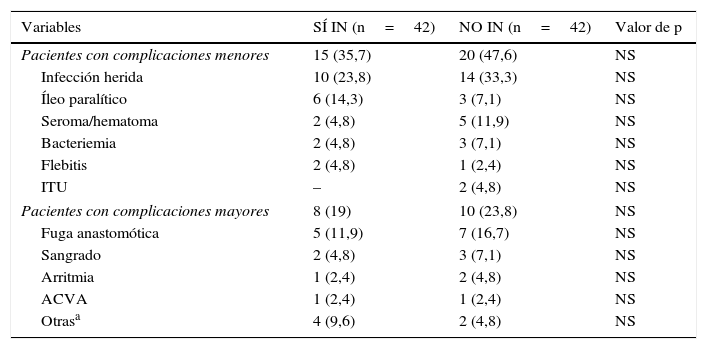
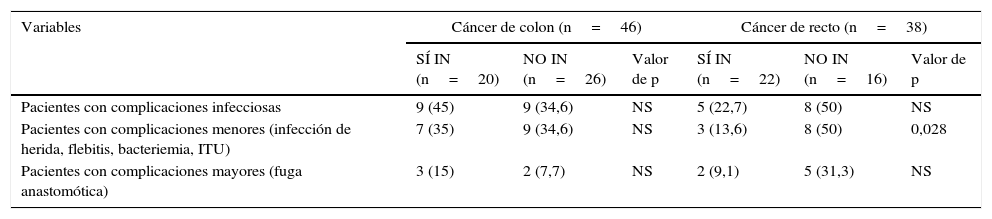
En nuestro análisis, predominaron las complicaciones infecciosas (infección de herida, bacteriemia, fuga anastomótica, etc.) frente a las no infecciosas, y los NO IN desarrollaron dichas complicaciones con mayor frecuencia (40,5% [17]) que los SÍ IN (33,3% [14]), aunque sin resultados significativos (tabla 2). En los intervenidos por cáncer rectal, las complicaciones infecciosas menores (infección de herida, flebitis, bacteriemia e infección urinaria) fueron más frecuentes en NO IN con respecto de SÍ IN, de forma significativa (p=0,028) (tabla 3).
Complicaciones menores y mayores
| Variables | SÍ IN (n=42) | NO IN (n=42) | Valor de p |
|---|---|---|---|
| Pacientes con complicaciones menores | 15 (35,7) | 20 (47,6) | NS |
| Infección herida | 10 (23,8) | 14 (33,3) | NS |
| Íleo paralítico | 6 (14,3) | 3 (7,1) | NS |
| Seroma/hematoma | 2 (4,8) | 5 (11,9) | NS |
| Bacteriemia | 2 (4,8) | 3 (7,1) | NS |
| Flebitis | 2 (4,8) | 1 (2,4) | NS |
| ITU | – | 2 (4,8) | NS |
| Pacientes con complicaciones mayores | 8 (19) | 10 (23,8) | NS |
| Fuga anastomótica | 5 (11,9) | 7 (16,7) | NS |
| Sangrado | 2 (4,8) | 3 (7,1) | NS |
| Arritmia | 1 (2,4) | 2 (4,8) | NS |
| ACVA | 1 (2,4) | 1 (2,4) | NS |
| Otrasa | 4 (9,6) | 2 (4,8) | NS |
Las variables están expresadas como número de pacientes y entre paréntesis su porcentaje.
ACVA: accidente cerebrovascular agudo; ITU: infección del tracto urinario; NO IN: no inmunonutrición; NS: no significativo; SÍ IN: sí inmunonutrición.
Complicaciones infecciosas según localización neoplásica
| Variables | Cáncer de colon (n=46) | Cáncer de recto (n=38) | ||||
|---|---|---|---|---|---|---|
| SÍ IN (n=20) | NO IN (n=26) | Valor de p | SÍ IN (n=22) | NO IN (n=16) | Valor de p | |
| Pacientes con complicaciones infecciosas | 9 (45) | 9 (34,6) | NS | 5 (22,7) | 8 (50) | NS |
| Pacientes con complicaciones menores (infección de herida, flebitis, bacteriemia, ITU) | 7 (35) | 9 (34,6) | NS | 3 (13,6) | 8 (50) | 0,028 |
| Pacientes con complicaciones mayores (fuga anastomótica) | 3 (15) | 2 (7,7) | NS | 2 (9,1) | 5 (31,3) | NS |
Las variables están expresadas como número de pacientes y entre paréntesis su porcentaje.
ITU: infección del tracto urinario; NO IN: no inmunonutrición; NS: no significativo; SÍ IN: sí inmunonutrición.
Centrándonos en la complicación infecciosa más frecuente, observamos una mayor proporción de varones y fuga anastomótica en el grupo NO IN que presentó infección del sitio quirúrgico, con un 78,6% (11) y 42,9% (6), respectivamente, con respecto del grupo SÍ IN, con un 50% (5) y 10% (1), respectivamente. Estos resultados no fueron estadísticamente significativos. Mediante regresión logística analizamos estas variables en relación con la aparición de infección del sitio quirúrgico. Observamos que la variable sexo varón presentó una OR de 1,2 (IC 95%: 0,4-3,2) y la fuga anastomótica una OR de 4,5 (IC 95%: 1,3-16,1). Esta última se comportó como un factor de riesgo, con resultados significativos (p=0,033).
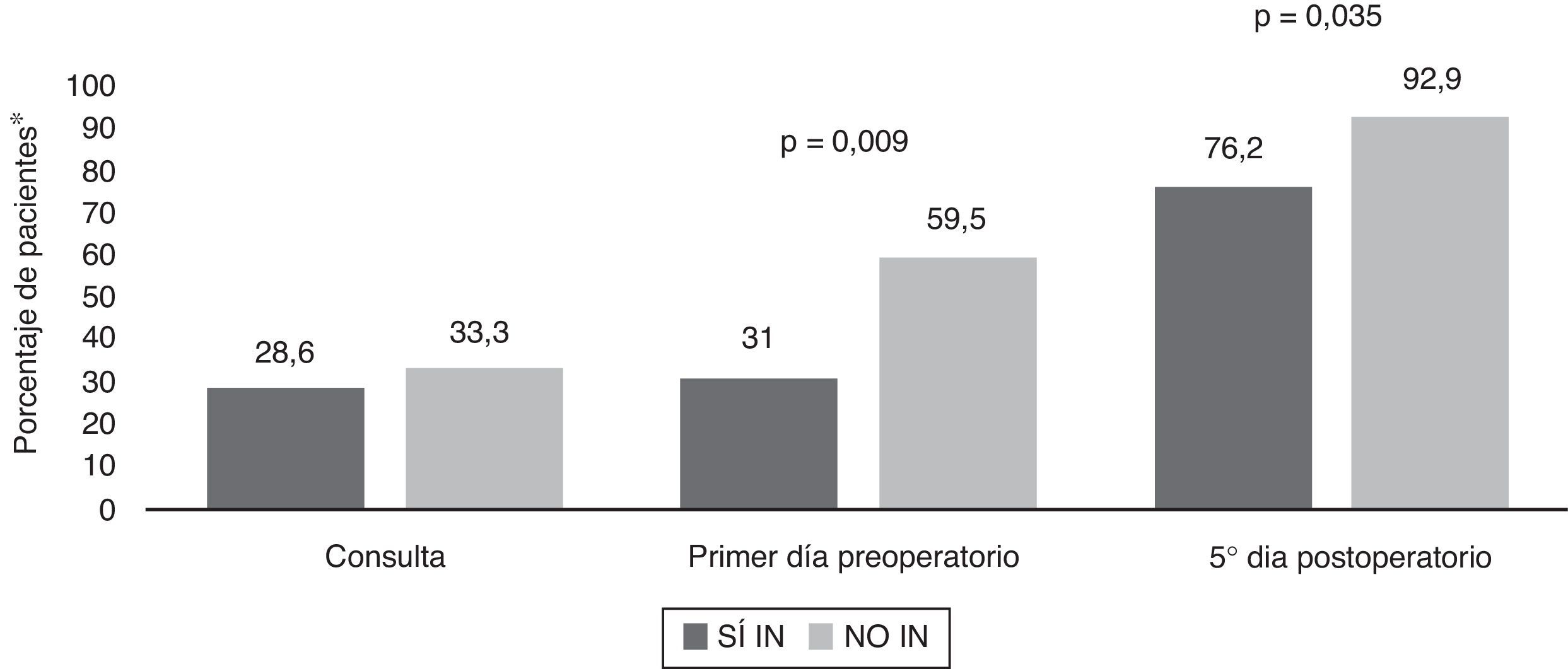
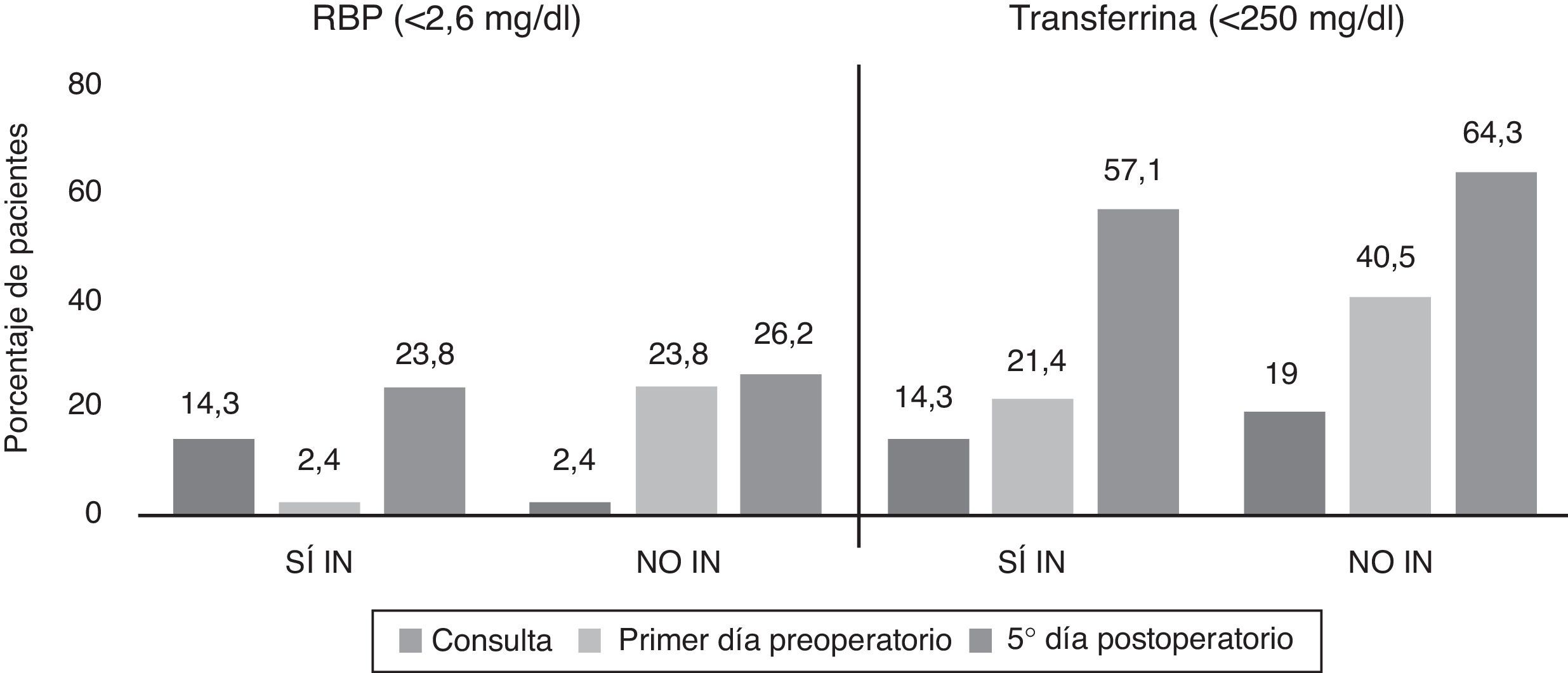
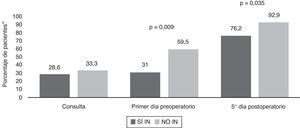
Se determinó la prevalencia de desnutrición proteica (sujetos con al menos un parámetro alterado: RBP, transferrina, albúmina, prealbúmina) y calórica (en función del colesterol total) en la primera consulta, después de la administración de la inmunonutrición, el primer día preoperatorio y el quinto día postoperatorio, en ambos grupos. A nivel proteico se obtuvieron diferencias significativas entre el primer día preoperatorio (p=0,009) y quinto día posquirúrgico (p=0,035) en ambos grupos, con un mayor porcentaje de desnutrición entre los pacientes del grupo NO IN (fig. 2). La evolución específica de estos parámetros en rango de desnutrición la mostramos en las figuras 3 y 4.
Evolución de la prevalencia de desnutrición proteica.
*Porcentaje de pacientes con al menos un parámetro nutricional proteico en rango de desnutrición (RBP, transferrina, albúmina, prealbúmina), determinado en la primera consulta, primer día preoperatorio y quinto día posquirúrgico en ambos grupos (SÍ IN y NO IN).
NO IN: no inmunonutrición; RBP: proteína de fijación del retinol; SÍ IN: sí inmunonutrición.
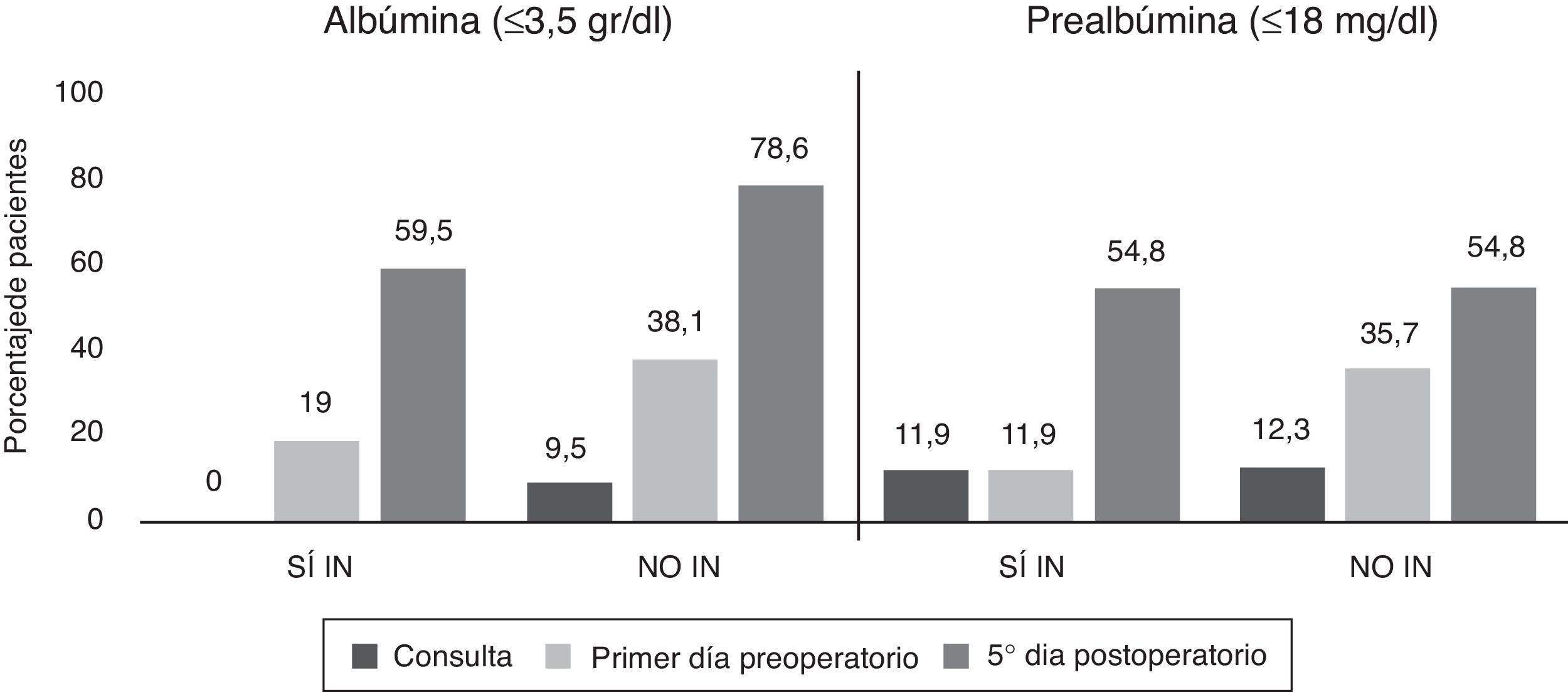
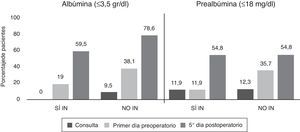
La variable albúmina presentó un descenso de sus niveles en el preoperatorio y en el quinto día postoperatorio con respecto de la consulta en el grupo NO IN, superior a lo observado en el grupo suplementado, siendo estas diferencias estadísticamente significativas (p=0,002) (fig. 3).
Los niveles de proteínas totales en el grupo SÍ IN en el quinto día postoperatorio fueron superiores a los del grupo NO IN, siendo estos resultados significativos (p=0,017). En la regresión logística, únicamente dicha variable fue independiente en relación con la aparición de complicaciones infecciosas posquirúrgicas. Por tanto, los sujetos con niveles bajos de proteínas totales en el quinto día postoperatorio (grupo NO IN) mostraron un riesgo 2,8 veces superior (IC 95%: 1,3-6,3) de presentar estas complicaciones, con resultados significativos (p=0,012).
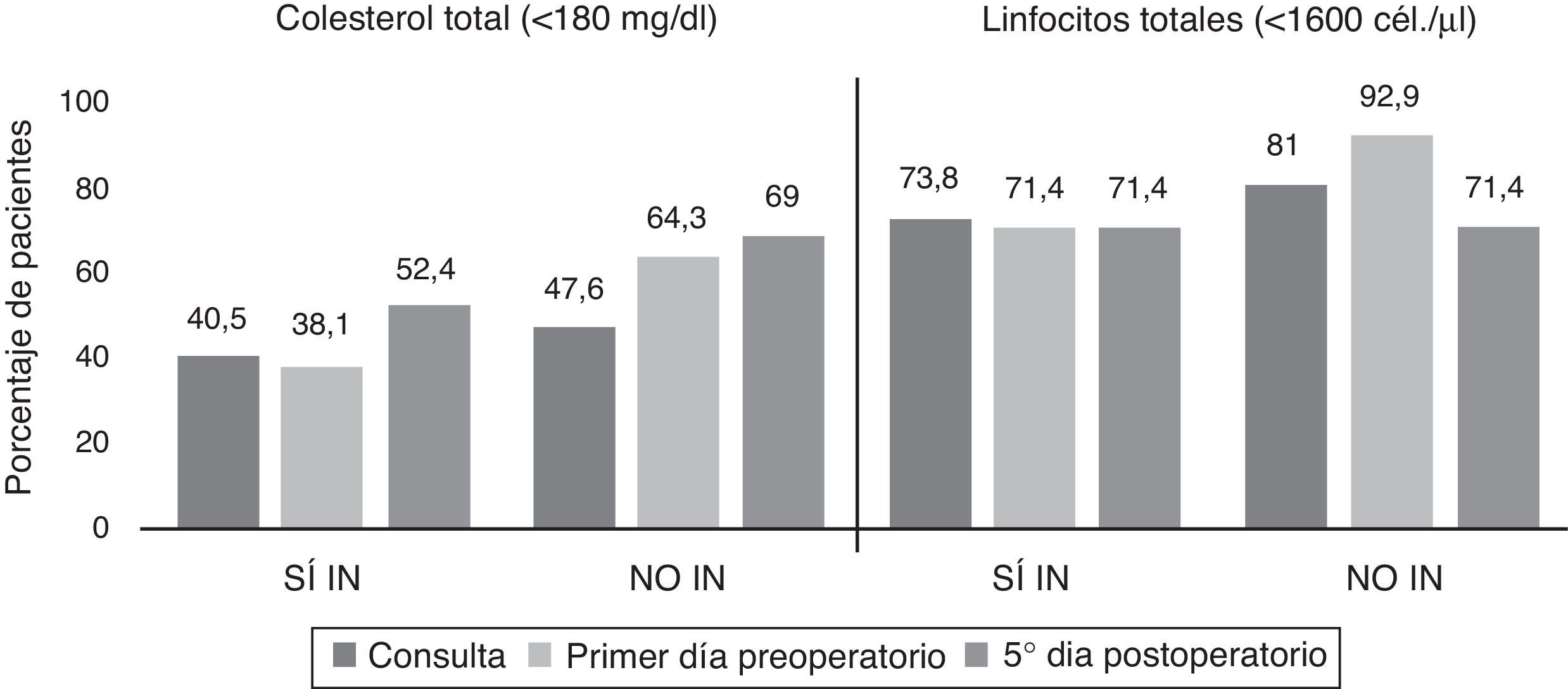
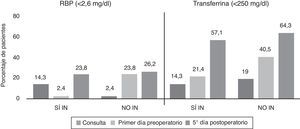
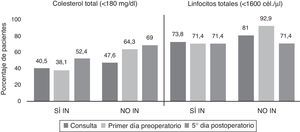
La prevalencia de desnutrición calórica experimentó un incremento el quinto día posquirúrgico (60,7% [51]) y el primer día preoperatorio (51,2% [43]) (p=0,034) con respecto de la consulta (44% [37]), con valores superiores en todas las mediciones en NO IN con respecto de SÍ IN (fig. 5).
Los parámetros inmunológicos analizados en ambos grupos en las diferentes mediciones no mostraron resultados significativos, ni se comportaron como factores de riesgo, mediante regresión logística, en relación con la aparición de complicaciones infecciosas (fig. 5).
DiscusiónEn la literatura existen diferentes estudios en los que se obtiene una disminución significativa de la prevalencia de complicaciones postoperatorias en los pacientes con cáncer gastrointestinal intervenidos mediante cirugía que reciben inmunonutrición, preoperatoria o perioperatoria, en comparación con aquellos que no la reciben. La reducción más importante sucede en el grupo de las complicaciones infecciosas, sobre todo en la infección del sitio quirúrgico, abscesos intraabdominales o neumonía. Este hecho se comprueba en múltiples estudios aleatorizados22-24 así como en los actuales metaanálisis de Zhang et al.25, Marimuthu et al.18 y Osland et al.19.
Los resultados obtenidos por nosotros en pacientes intervenidos con cáncer colorrectal que recibieron inmunonutrición oral preoperatoria son comparables a estos hallazgos. Las complicaciones infecciosas fueron más frecuentes en el grupo NO IN (40,5% [17]) en comparación con SÍ IN (33,3% [14]), aunque sin significación estadística. Sin embargo, el subgrupo de los pacientes con cáncer rectal no inmunonutridos presentó significativamente más complicaciones infecciosas menores (50% [8]; p=0,028) que los pacientes suplementados (13,6% [3]). Hacemos hincapié en la significación estadística de este hallazgo, que no hemos observado en ningún otro estudio en la literatura precedente.
En nuestro análisis la fuga anastomótica se comportó como un factor de riesgo del desarrollo de infección del sitio quirúrgico (p=0,033).
La fuga anastomótica como factor de riesgo de infección queda reflejada en el estudio prospectivo de Poon et al.26 del 2009 sobre 1.011 pacientes intervenidos mediante cirugía colorrectal electiva, donde se erigió como factor de riesgo independiente de infección del sitio quirúrgico (OR: 6,5; IC 95%: 2,3-18,6) (p=0,01). Asimismo, no hemos de olvidar que en el cáncer rectal, cuando se realiza la escisión total del mesorrecto (ETM), y en anastomosis localizadas a menos de 7cm del margen anal, el riesgo de fuga anastomótica observado es mayor27,28.
En nuestro estudio, en la regresión logística, únicamente la variable proteínas totales en el quinto día posquirúrgico fue independiente en relación con la aparición de complicaciones infecciosas posquirúrgicas (p=0,012).
En la literatura, en el estudio prospectivo de Horie et al.29 del 2006 se analizaron 66 pacientes con cáncer colorrectal intervenidos mediante cirugía y se comparó un grupo que recibía nutrición preoperatoria Impact© Oral (Novartis©; Medical Nutrition, España), como suplemento durante 5 días, con respecto del control, que no la recibía. En el grupo inmunonutrido las infecciones de la herida quirúrgica fueron menos frecuentes que en el grupo control (p<0,05). A nivel analítico, observaron una mejoría de los valores de las proteínas totales y de la albúmina a partir del tercer día posquirúrgico, siendo estadísticamente significativa la diferencia entre el grupo inmunonutrido y el no inmunonutrido solo en el último parámetro. A diferencia de nuestro estudio, Horie et al.29 no incluyeron pacientes desnutridos, de ahí que la recuperación de las proteínas totales que nosotros objetivamos sea más tardía (quinto día posquirúrgico) y sí obtengamos diferencias estadísticamente significativas entre ambos grupos de estudio (SÍ IN y NO IN).
La desnutrición hospitalaria no solo constituye un problema de gran relevancia por su elevada prevalencia cercana al 50%, con un rango comprendido entre el 30-70%30-33; también los pacientes desnutridos presentan una mayor morbimortalidad posquirúrgica, por un incremento asociado de complicaciones postoperatorias. En el grupo específico de los pacientes con cáncer colorrectal la tasa de desnutrición puede variar entre el 45 y el 60%34,35.
En nuestro estudio existe una prevalencia global de desnutrición proteica en la determinación de consulta del 31%, inferior a este último rango. Sin embargo, resulta complicado comparar estos datos, pues el rango de desnutrición citado en pacientes con cáncer colorrectal procede de estudios que analizan sujetos con tumores en diferentes estadios no reseñados, localización en colon o recto no descrita y donde la metodología para determinar esta prevalencia no es homogénea y, por tanto, comparable1,34,35. Por tanto, a pesar de los múltiples estudios sobre desnutrición hospitalaria desarrollados desde hace más de 30 años, los datos de prevalencia muestran cifras muy parecidas desde los primeros análisis hasta nuestros días.
La evolución de la prevalencia global de desnutrición proteica en nuestro análisis mostró un incrementó en el primer día preoperatorio (45,2% [38]) y quinto día posquirúrgico (84,5% [72]) en relación con la primera consulta (31% [26]). Esta tasa fue inferior y significativa, en el grupo suplementado, en el primer día preoperatorio (p=0,009) y quinto día posquirúrgico (p=0,035) (fig. 2). Lo mismo observamos a nivel calórico, únicamente con resultados significativos en el primer día preoperatorio (p=0,034).
La tasa de desnutrición en los pacientes hospitalizados, como observamos en nuestro análisis, se incrementa conforme aumentan los días de hospitalización, como se halló en el estudio brasileño IBRANUTRI31, donde esta tasa se duplicó tras más de 15 días de hospitalización (61% frente a 31,8% en las primeras 48h de ingreso). El estudio multicéntrico español PREDYCES36 mostró unos resultados similares, al igual que otros en la literatura internacional37,38.
Las limitaciones de nuestro estudio fueron, en primer lugar, el limitado tamaño muestral. En segundo lugar, la administración de inmunonutrición en nuestro análisis se llevó a cabo independientemente del estado nutricional del sujeto. La baja incidencia de malnutrición en los pacientes con cáncer colorrectal en comparación con otras neoplasias digestivas, junto con la menor morbimortalidad generalmente esperada en cirugía colorrectal, nos invita a considerar, basados en nuestros hallazgos, y centrándonos en futuros estudios, en la necesidad de realizarlos centrándonos en grupos de pacientes de alto riesgo, con moderada y severa malnutrición.
ConclusionesEn conclusión, nuestros hallazgos indican que los pacientes no inmunonutridos intervenidos mediante cirugía programada por cáncer colorrectal, con respecto de los inmunonutridos, presentaron con mayor frecuencia complicaciones infecciosas posquirúrgicas, sobre todo el subgrupo de pacientes con cáncer rectal. Por tanto, dicho subgrupo podría beneficiarse en mayor grado de la utilización de suplementos orales con inmunonutrientes preoperatorios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNinguno.