La tomografía computada por emisión de positrones (PET/TC) con 18F-fluorodesoxiglucosa (FDG) ha demostrado ser una técnica útil en el diagnóstico y la estadificación de diversos tumores. Su efectividad radica en que la mayoría de los tejidos neoplásicos tienen una tasa de metabolismo más alta que la del resto de los tejidos normales del cuerpo, por lo que presentan una mayor captación de glucosa y, por tanto, de la 18F-FDG1. Sin embargo, existen patologías benignas que también presentan una alta captación de 18F-FDG y que pueden ser confundidas con tumores, dando un falso positivo con la técnica (p. ej. algunas enfermedades infecciosas o las vasculitis)2–5.
La granulomatosis de Wegener (GW) es una enfermedad poco frecuente, que afecta principalmente a los vasos de pequeño y mediano calibre1–5. Consiste en una vasculitis necrotizante crónica granulomatosa, cuya etiología es desconocida, aunque parece ser de origen autoinmune, dado que hasta un 90% de los casos con enfermedad activa se asocia con la presencia de anticuerpos autoinmunes ANCA-c3–5. Puede afectar cualquier zona del cuerpo, pero tiene predilección por las vías aéreas superiores, el pulmón y el riñón (tríada clínica clásica)1–5. Si bien la afectación de órganos como la aorta y las meninges es más rara, hay que tenerla en cuenta en pacientes con GW que padecen dolor de espalda2.
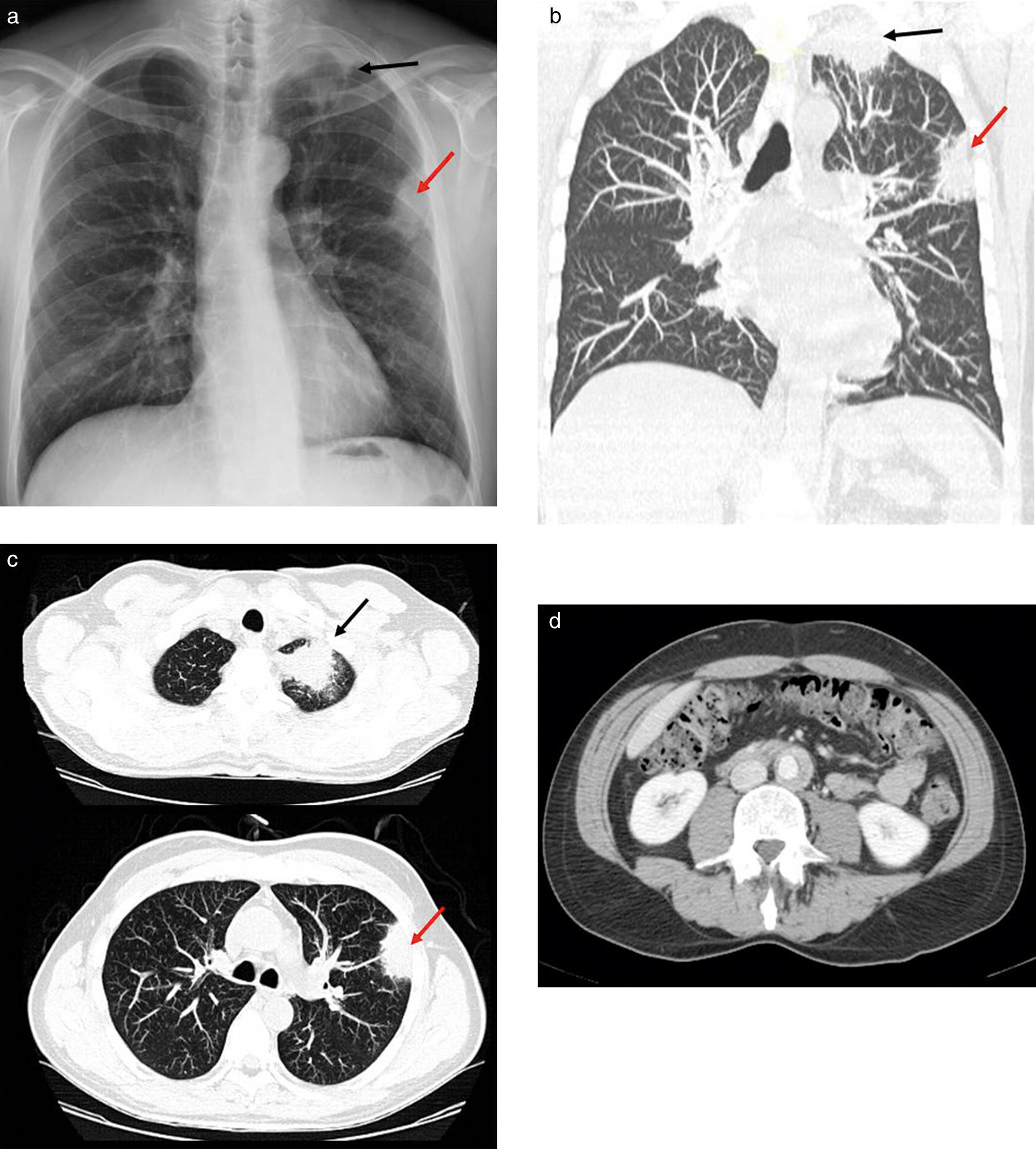
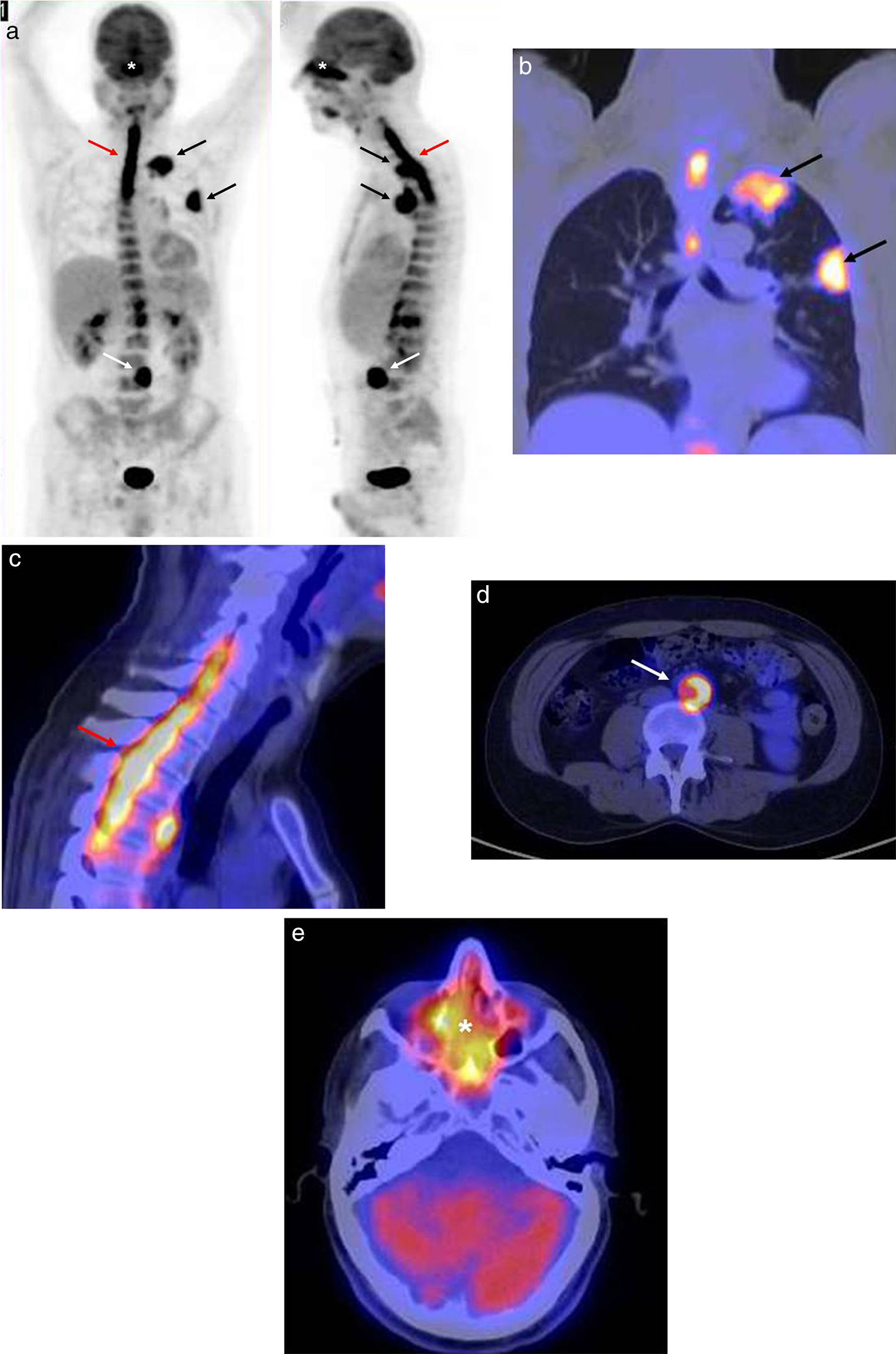
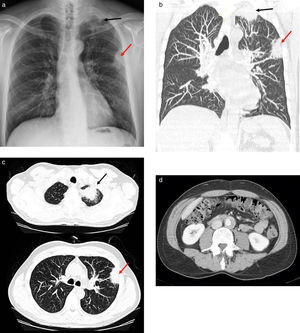
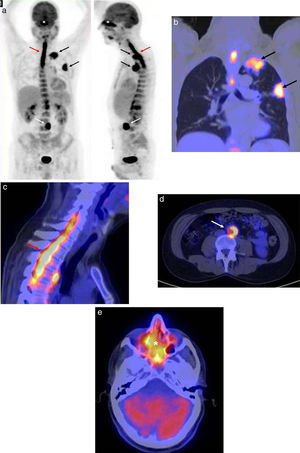
Presentamos el caso de un paciente varón de 53 años que acudió al hospital por dolor cérvico-dorsal y síndrome constitucional severo, con pérdida de 20kg de peso. En la radiografía de tórax se visualizaba un engrosamiento pleural en el vértice del pulmón izquierdo y una masa subpleural en el lóbulo superior izquierdo (fig. 1a). El diagnóstico fue neumonía y se lo trató con antibióticos. Una semana después, el paciente no presentaba mejorías, por lo que se le realizó una tomografía computada (TC) en la que se vio la persistencia de las masas descritas en la radiografía. Estas sugerían un proceso inflamatorio-infeccioso, aunque no se podía descartar completamente el origen oncológico ante la falta de respuesta al tratamiento (figs. 1b y 1c). Además, como hallazgo casual, se encontró un rodete hiperdenso en la aorta abdominal, compatible con fibrosis periaórtica (fig. 1d). Se decidió completar el estudio con un examen 18F-FDG-PET/TC. En este existía un hipermetabolismo en las masas pulmonares descritas, y también se encontraron depósitos patológicos de 18F-FDG sobre el rodete hiperdenso de la aorta, en la médula espinal entre C5-D5 y en los senos paranasales (fig. 2).
(a) Radiografía posteroanterior de tórax: engrosamiento pleural en el vértice pulmonar izquierdo (flecha negra) y condensación subpleural en el lóbulo superior izquierdo (LSI) (flecha roja). Tomografía computada de tórax sin contraste intravenoso, cortes (b) coronal y (c) axial: masa apical izquierda (flecha negra) y masa subpleural en LSI (flecha roja) con características de condensación y presencia de broncograma. No hay signos claros de infiltración de la pared torácica y no existen erosiones costales, por lo que los hallazgos son más compatibles con masas de origen inflamatorio-infeccioso (aunque no se puede descartar completamente una causa neoplásica con esta exploración). (d) Tomografía computada de abdomen en fase portal con contraste intravenoso: rodete periaórtico hiperdenso en la aorta abdominal, a 3,5 cm de la salida de la arteria renal izquierda, compatible con fibrosis periaórtica
(a) Imagen volumétrica de la tomografía con emisión de positrones, en proyecciones anteroposterior y lateral: se aprecian captaciones patológicas de 18F-FDG en las masas pulmonares (flechas negras) sobre el rodete hiperdenso de la aorta (flecha blanca), en la médula espinal entre C5-D5 (flecha roja) y en los senos paranasales (asterisco). (b) 18F-FDG-PET/TC de tórax, corte coronal de imágenes de fusión: hipermetabolismo en las masas apical (SUV 7,82) y subpleural del lóbulo superior (SUV 8,35) del pulmón izquierdo, compatibles en una primera instancia con un proceso oncológico (flechas negras). (c) 18F-FDG-PET/TC de la columna cérvico-dorsal, corte sagital de imágenes de fusión: hipermetabolismo en la médula espinal (SUV 7,7) entre C5-D5 que, en el contexto oncológico, sugería con más probabilidades una infiltración metastásica (flecha roja). (d) 18F-FDG-PET/TC de abdomen, corte axial de imágenes de fusión: hipermetabolismo sobre el rodete periaórtico (SUV 6,5), sospechoso de infiltración metastásica (flecha blanca). (e) 18F-FDG-PET/TC del cráneo, corte axial de imágenes de fusión: captación en los senos paranasales (SUV 9,3), de distribución simétrica y homogénea, sugerente de un proceso inflamatorio-infeccioso (asterisco).
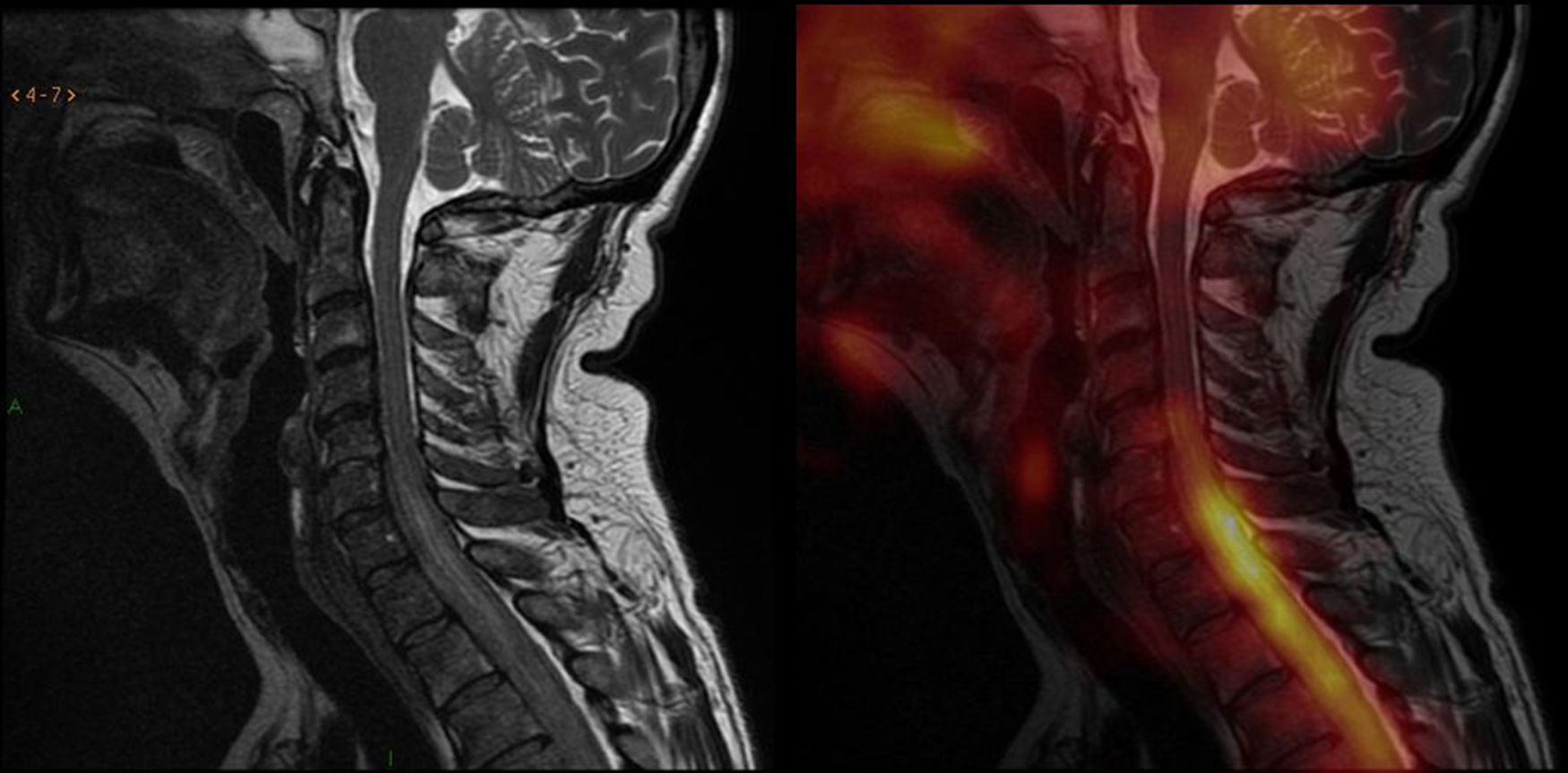
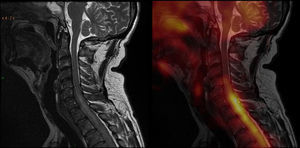
Debido a su alta tasa metabólica, las captaciones en el tórax, la aorta y la médula sugerían, como primera opción, un origen tumoral, probablemente en el pulmón. Por otro lado, la captación en los senos paranasales, por su distribución simétrica y homogénea, apuntaba más a un proceso inflamatorio-infeccioso. Ante los hallazgos por 18F-FDG-PET/TC en la médula, también se llevó a cabo una resonancia magnética (RM) cérvico-dorsal, donde se visualizó un tejido blando epidural que provocaba compresión medular. Esta imagen coincidía con el hipermetabolismo descrito en la médula durante el estudio de 18F-FDG-PET/TC y que el informe había definido como una infiltración tumoral de meninges (fig. 3).
Imágenes de fusión entre la resonancia magnética y la tomografía por emisión de positrones en secuencia sagital ponderada en T2 en la columna cervical: hay alteraciones de intensidad de señal a nivel de la médula, en la transición cérvico-dorsal, a partir de aproximadamente el espacio intervertebral C5-C6; así como también se notan alteraciones en la intensidad de señal del líquido cefalorraquídeo, coincidente con el hipermetabolismo descrito por el estudio PET a nivel de la médula espinal. Inicialmente se creyó que era un componente de tejido blando epidural, fundamentalmente anterior, que generaba evidente compresión medular, provocando cierta hiperintensidad intramedular (sugestiva de edema medular de carácter compresivo). Esta hacía difícil descartar totalmente cierto grado de infiltración de la estructura medular.
Se llevó a cabo una biopsia pulmonar para confirmar la etiología tumoral de los hallazgos, pero el estudio de anatomía patológica estableció alteraciones compatibles con una GW. Se determinaron anticuerpos ANCAs en sangre con un resultado positivo, por lo que el diagnóstico definitivo fue enfermedad de Wegener diseminada grave, con afectación de senos paranasales, pulmón, aorta y meninges.
El paciente inició tratamiento con bolos de metilprednisolona y ciclofosfamida. Su tolerancia a la medicación fue buena y hubo una mejoría clínica evidente con la desaparición del dolor cérvico-dorsal.
A pesar de que la 18F-FDG-PET/TC condujo a un diagnóstico erróneo de enfermedad tumoral por la elevada captación de glucosa en las lesiones inflamatorias de la GW, fue de utilidad en el estudio de extensión de la enfermedad, al identificar la afectación meníngea y de los senos paranasales5.
Saludan atentamente,
Los autores
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.