Desde hace tiempo se ha establecido la relación entre el hábito tabáquico y diferentes enfermedades pulmonares, particularmente el cáncer y el enfisema pulmonar. Sin embargo, es menos conocida la asociación del tabaquismo con otras entidades, como la bronquiolitis respiratoria asociada a la enfermedad intersticial (BREI), la neumonitis descamativa (ND), la histiocitosis de Langerhans (HL), la neumonía eosinofílica aguda (NEA), la fibrosis pulmonar (FP) y la combinación de esta última con el enfisema (FPE).
El objetivo de este trabajo es describir los hallazgos por tomografía computada multidetector (TCMD) de las lesiones pulmonares asociadas al tabaquismo, como así también los principales diagnósticos diferenciales de estas entidades.
The relationship between smoking and various lung diseases, particularly cancer and pulmonary emphysema, is well-known. Nevertheless, what is less known is the relationship between smoking and other conditions, such as respiratory bronchiolitis -associated interstitial disease (RBAID), desquamative pneumonitis (DN), Langerhans histiocytosis (LH), acute eosinophilic pneumonia (AEN), pulmonary fibrosis (PF), and combined pulmonary fibrosis and emphysema (CPFE).
The aim of this article is to describe the findings of smoking-associated lung lesions using multidetector computed tomography (MDCT) images, and their main differential diagnoses.
El hábito tabáquico se asocia a patologías pulmonares intersticiales, como enfermedad intersticial (bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial [BRE-PI]), neumonitis descamativa (ND), histiocitosis de Langerhans (HL), neumonía eosinofílica aguda (NEA) y fibrosis pulmonar (FP), más la combinación de esta última con el enfisema (FPE). Además está vinculado al cáncer, principalmente con los tipos histológicos escamoso y de células pequeñas, y al enfisema.
Estas entidades muchas veces se presentan con solapamiento clínico radiológico y con frecuencia pueden coexistir. La utilización de la tomografía computada multidetector (TCMD) permite una mejor caracterización y discriminación de ellas.
El objetivo de este trabajo es describir los hallazgos por TCMD de las lesiones pulmonares asociadas al tabaquismo, como así también los principales diagnósticos diferenciales de estas entidades.
Cáncer pulmonarCerca del 90% de los cánceres de pulmón están directamente relacionados con el humo del cigarrillo, por lo que la Organización Mundial de la Salud (OMS) considera al tabaco como la principal causa de muerte prevenible1. Según Morabia et al.2 la asociación entre el hábito tabáquico y el tipo histológico del cáncer podría estar relacionado con la localización, ya que se vincula más con los carcinomas de ubicación central (escamoso y de células pequeñas) que con los periféricos (adenocarcinoma y carcinoma de células grandes). Estos últimos se encuentran menos relacionados con el humo del cigarrillo.
El carcinoma de células escamosas frecuentemente se manifiesta como una lesión endobronquial, con o sin obstrucción bronquial, produciendo de esta forma atelectasia o neumonía posobstructiva e invasión rápida del sistema linfático, generalmente con signos de linfangitis al momento del diagnóstico. Las lesiones se ven como masas redondeadas que frecuentemente cavitan con invasión de estructuras hiliares y mediastinales. Generalmente ocasionan metástasis tardías3,4.
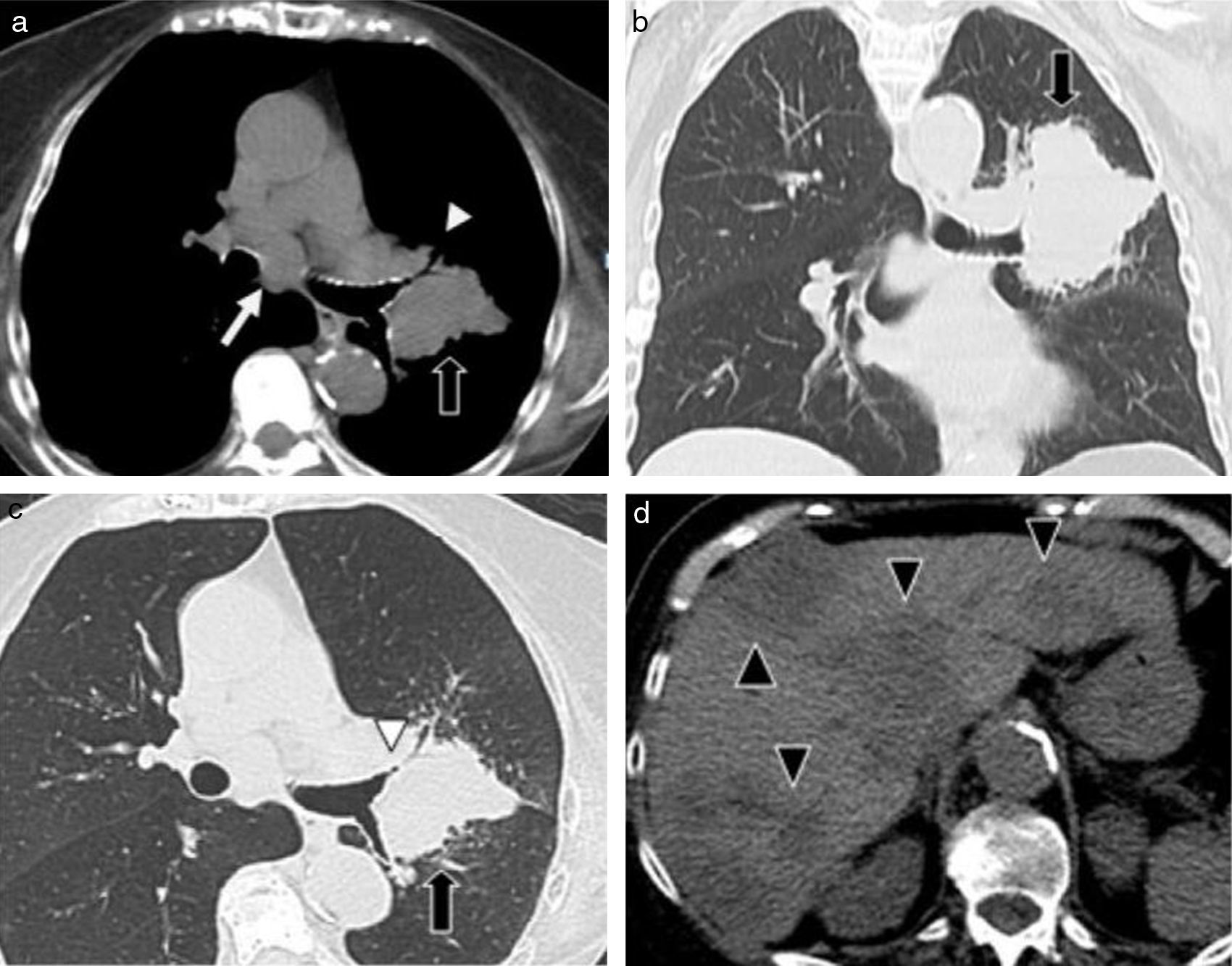
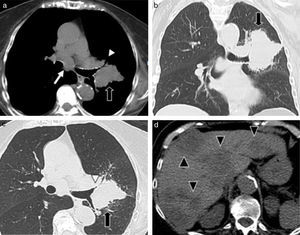
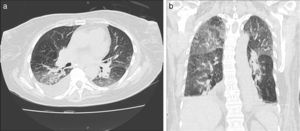
El carcinoma de células pequeñas corresponde al 15% de los tumores pulmonares, es de origen neuroendocrino y presenta muy mal pronóstico3. Posee localización central en el 75-90% de los casos, con origen en los bronquios principales o lobares, produciendo invasión de los mismos y formando masas hiliares/perihiliares de gran tamaño (fig. 1). Producen metástasis ganglionares (mediastinales e hiliares) y a distancia en forma temprana (hígado, hueso, glándulas suprarrenales y cerebro)5,6.
TCMD de una mujer de 83 años de edad con carcinoma de células pequeñas: (a) corte axial de tórax con ventana para mediastino, (b) corte coronal con ventana pulmonar, (c) corte axial con ventana pulmonar y (d) corte axial de abdomen. (a, b y c) Se observa una adenomegalia subcarinal (flecha blanca) y una masa pulmonar de bordes lobulados y espiculados (flechas negras) en la región perihiliar izquierda, que produce compresión bronquial (cabeza de flecha). (d) Se identifican múltiples imágenes hipodensas heterogéneas, compatibles con metástasis hepáticas (cabeza de flecha), primer lugar en frecuencia de secundarismo a distancia.
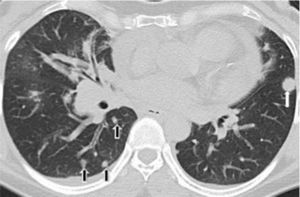
El adenocarcinoma se presenta como un nódulo o masa redondeada u oval solitaria periférica en el 75% de los casos y se encuentra más comúnmente en los lóbulos superiores4 (fig. 2). Algunos distorsionan los vasos periféricos (corona radiata) o causan retracción de la pleura adyacente. Estos hallazgos no son específicos, ya que también pueden verse en patología benigna7,8.
TCMD de tórax en corte axial con ventana pulmonar de una mujer de 53 años de edad con adenocarcinoma pulmonar. Muestra una formación nodular redondeada en el lóbulo inferior del pulmón izquierdo (flecha blanca) y formaciones nodulillares aisladas en ambos pulmones, particularmente en el lóbulo inferior derecho (flechas negras), correspondientes a lesiones metastásicas.
El carcinoma de células grandes se revela como una masa voluminosa periférica de márgenes irregulares en más del 60% de los casos. Son frecuentes las metástasis extrapulmonares en el momento del diagnóstico4.
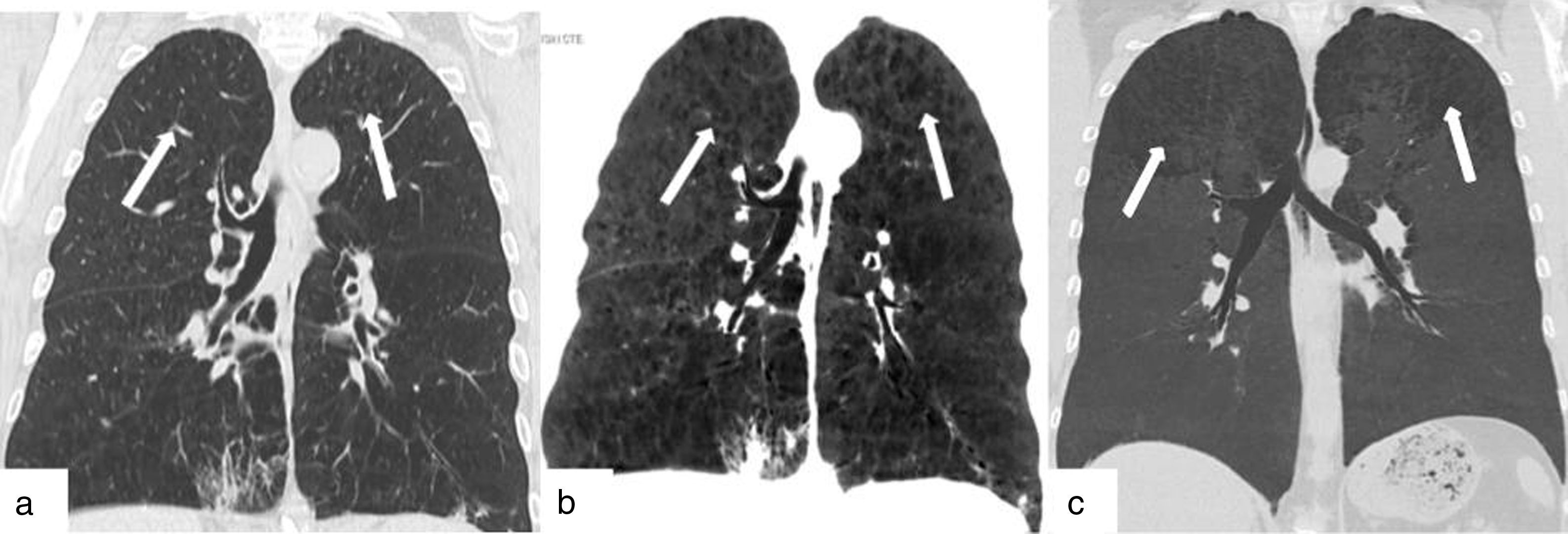
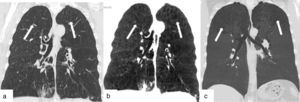
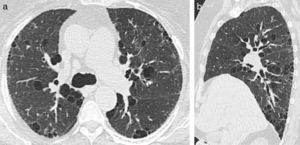
EnfisemaEl enfisema centrolobulillar es la forma de lesión pulmonar más frecuente asociada al tabaquismo. Afecta a más de la mitad de los fumadores9. La disnea sin producción de esputo es la clínica de presentación habitual. Se encuentra predominantemente en las zonas superiores de cada lóbulo (es decir, segmentos apical y posterior de los lóbulos superiores, y el segmento superior de los lóbulos inferiores) y tiene una distribución irregular9. Aparece como radiolucencias focales (espacios enfisematosos) que miden hasta 1cm de diámetro, situadas centralmente dentro del lobulillo pulmonar secundario9,10 (fig. 3).
TCMD de una mujer de 71 años de edad con enfisema pulmonar: (a) corte coronal y (b) su comparativo con reconstrucción de mínima intensidad de proyección, en el que se hace más evidente el enfisema centrolobulillar que afecta ambos pulmones (flechas). (c) La reconstrucción de mínima intensidad de proyección de otro paciente evidencia áreas de enfisema con predominio de ambos lóbulos superiores (flechas).
Afecta usualmente a fumadores activos entre los 30 y 40 años que consumen más de 30 paquetes al año. Se presenta de manera asintomática o con síntomas leves que incluyen disnea y tos, pero también puede observarse disnea severa o hipoxemia. Por lo general no se asocia a hipocratismo.
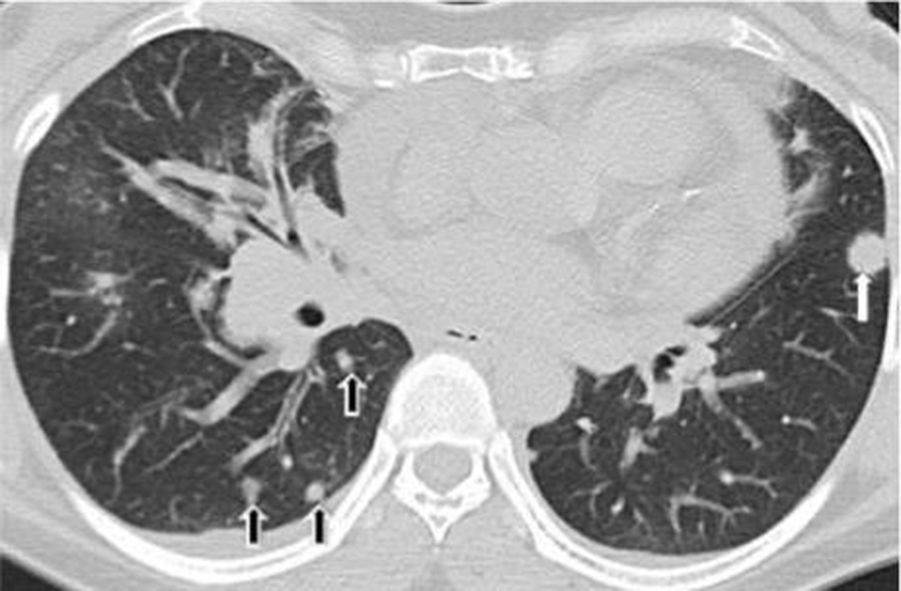
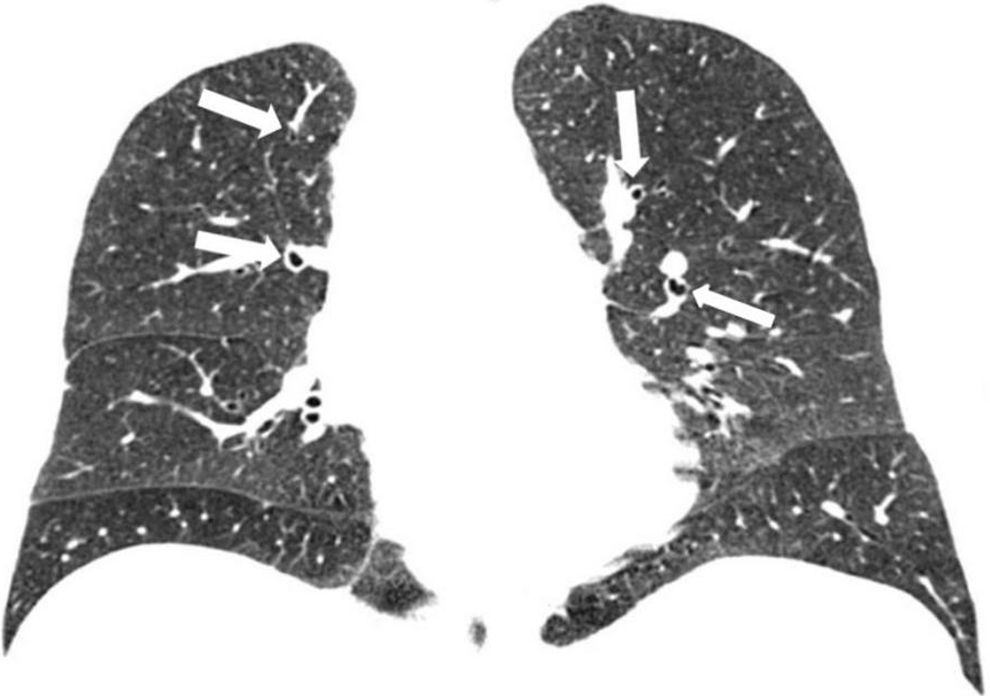
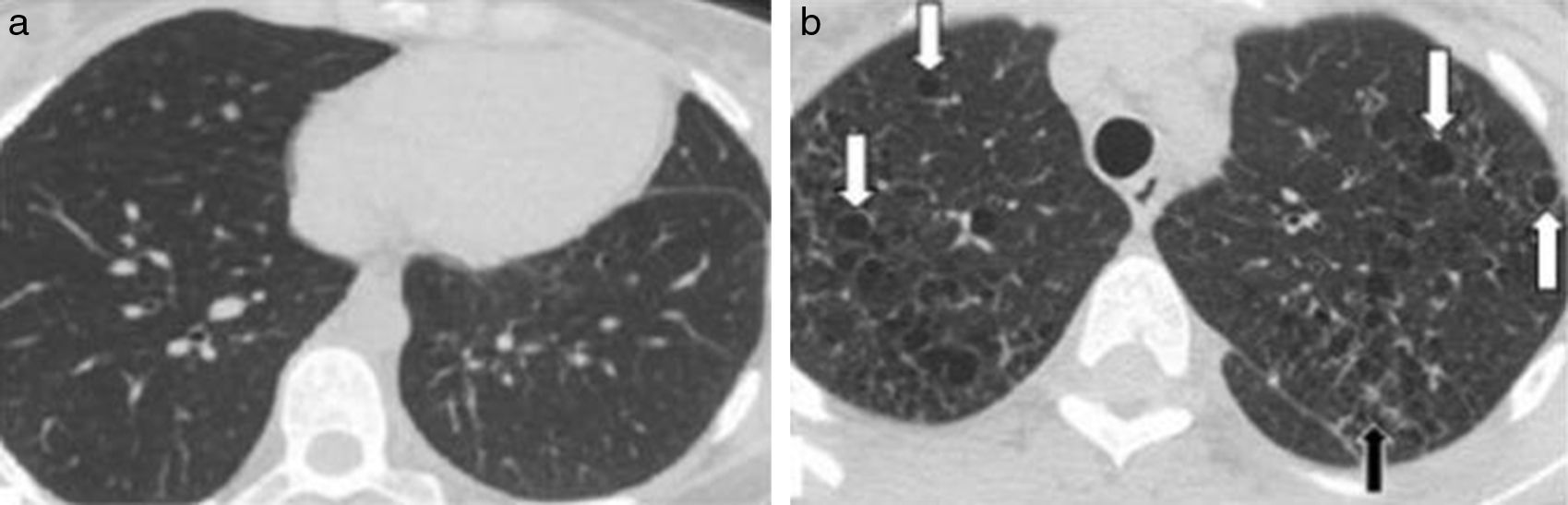
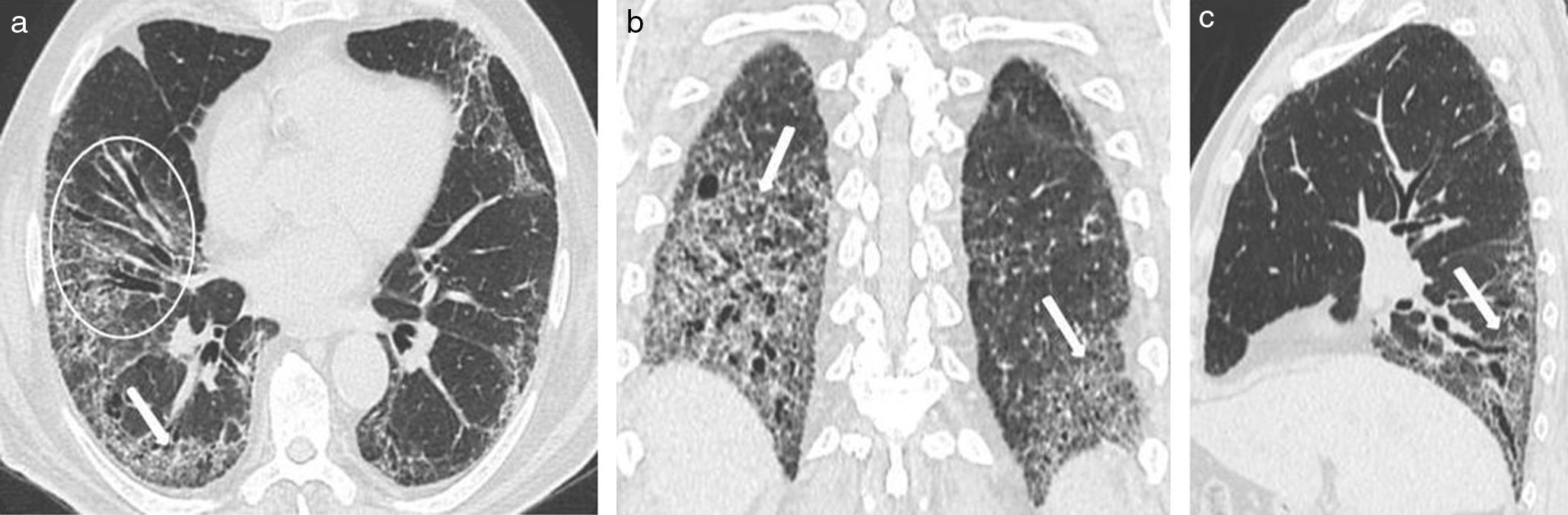
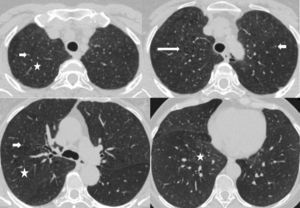
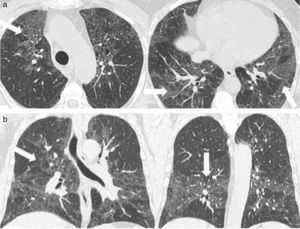
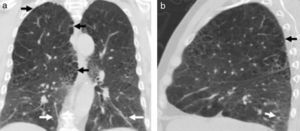
Los hallazgos en la TCMD incluyen opacidades centrolobulillares micronodulares, áreas de aumento de la atenuación en vidrio esmerilado y engrosamiento de las paredes bronquiales que predominan en los lóbulos superiores (figs. 4 y 5). Es común la coexistencia con enfisema centrolobulillar.
TCMD de tórax en cortes axiales con ventana pulmonar de un hombre de 67 años de edad con bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial muestra opacidades centrolobulillares micronodulares (flechas cortas) y áreas de aumento de la atenuación en vidrio esmerilado (estrellas) con áreas de enfisema centrolobulillar a predominio de ambos lóbulos superiores (flecha larga).
Los diagnósticos diferenciales incluyen neumonitis aguda por hipersensibilidad (fig. 6), ND y neumonitis intersticial no específica (NINE).11
TCMD de tórax en corte axial con ventana pulmonar de un paciente con neumonitis aguda por hipersensibilidad evidencia múltiples opacidades nodulillares en vidrio esmerilado y centrolobulillares distribuidas de forma difusa en ambos pulmones (flechas). Se diferencia de la bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial porque esta presenta menos opacidades centrolobulillares, se asocia generalmente a enfisema centrolobulillar y predomina en los lóbulos superiores.
Es considerada por muchos autores como el final del espectro clínico de la BREI debido a su similitud en la histopatología y porque se asocia al tabaquismo12. Se produce por la acumulación intraalveolar de macrófagos, predominando más en hombres que en mujeres con síntomas de disnea y tos13. A veces llega a una falla respiratoria y es posible ver hipocratismo digital en la mitad de los pacientes14.
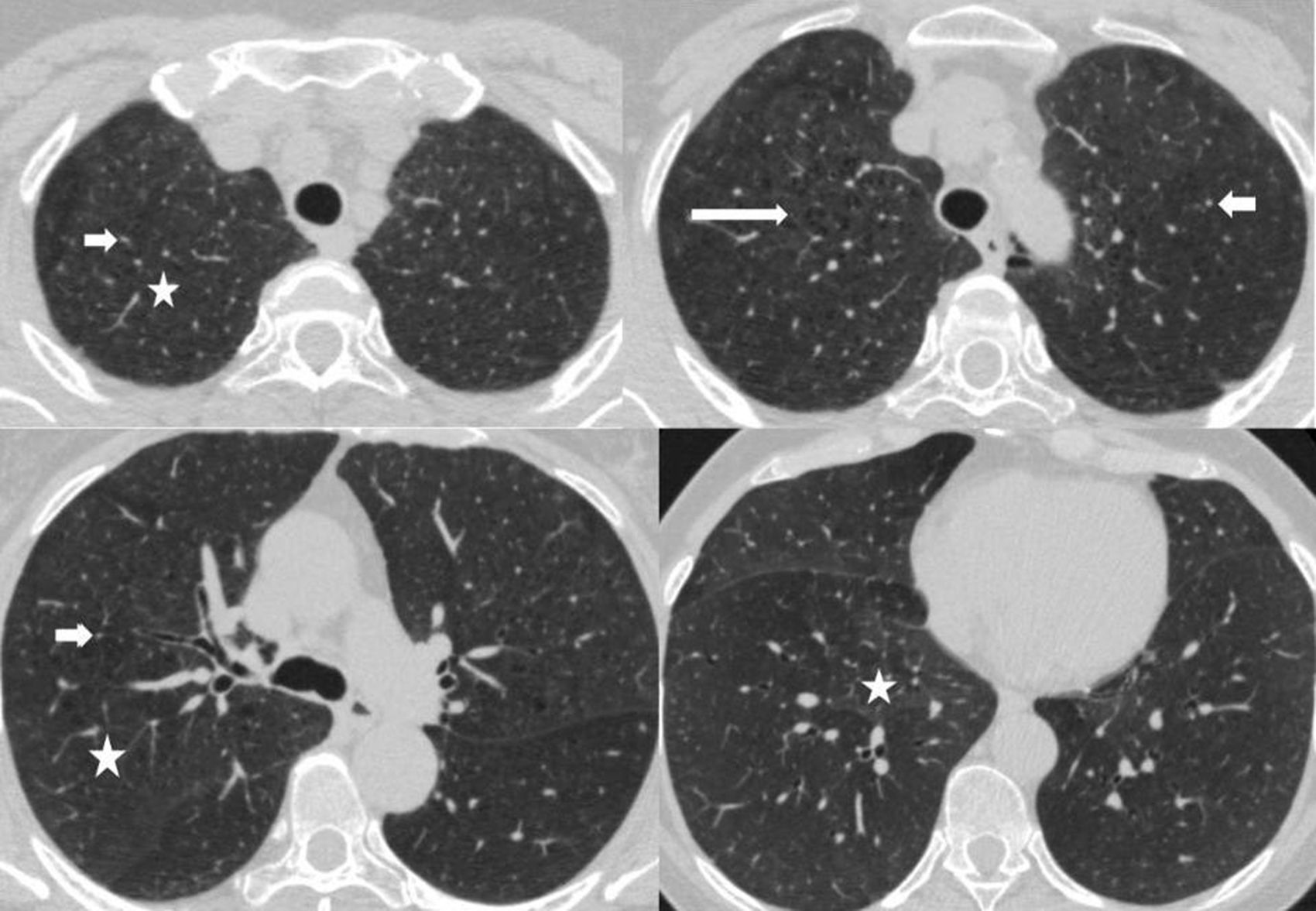
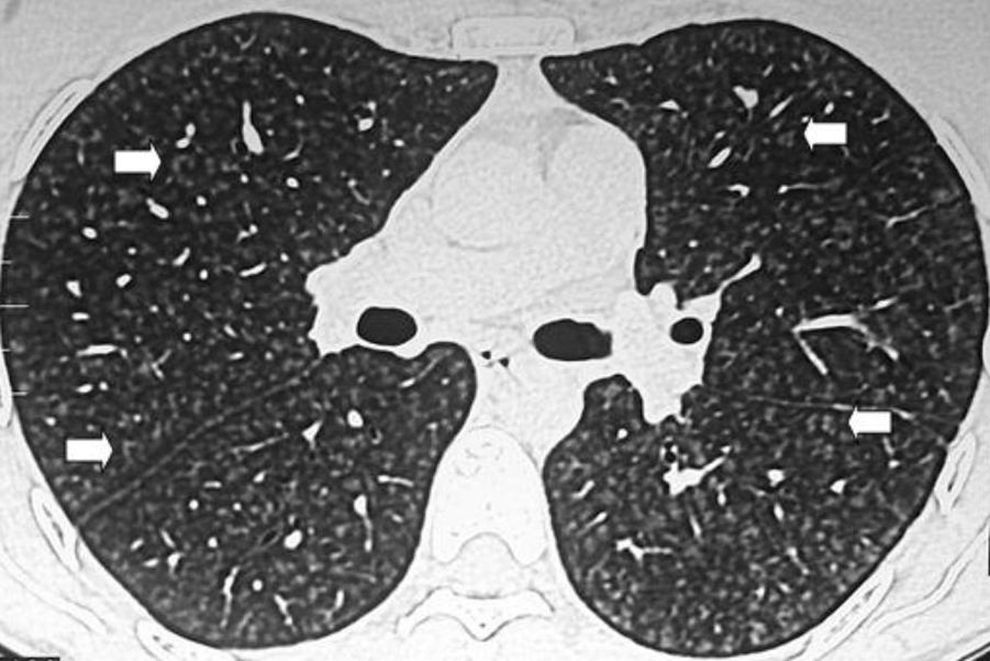
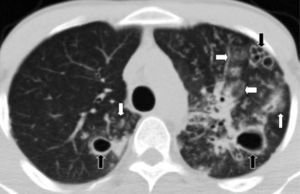
En la TCMD se evidencian opacidades en vidrio esmerilado y puede presentarse con un patrón generalizado con distribución parcheada. Se observa predominio periférico y en los lóbulos inferiores. En el 59% de pacientes se identifican opacidades lineales irregulares y en menos de la tercera parte de los casos un patrón reticular y en panal de abejas15. También es posible detectar pequeños quistes bien definidos de paredes finas de menos de 2cm de diámetro (fig. 7).
El diagnóstico diferencial incluye enfermedad pulmonar intersticial, neumonitis por hipersensibilidad, NINE e infecciones atípicas, como la neumonía por Pneumocystis jirovecii (fig. 8).
Histiocitosis de LangerhansLa HL afecta principalmente a adultos jóvenes fumadores que presentan tos y disnea. Se encuentra exclusivamente en fumadores, lo que apoya la teoría de su vinculación con la exposición al antígeno16.
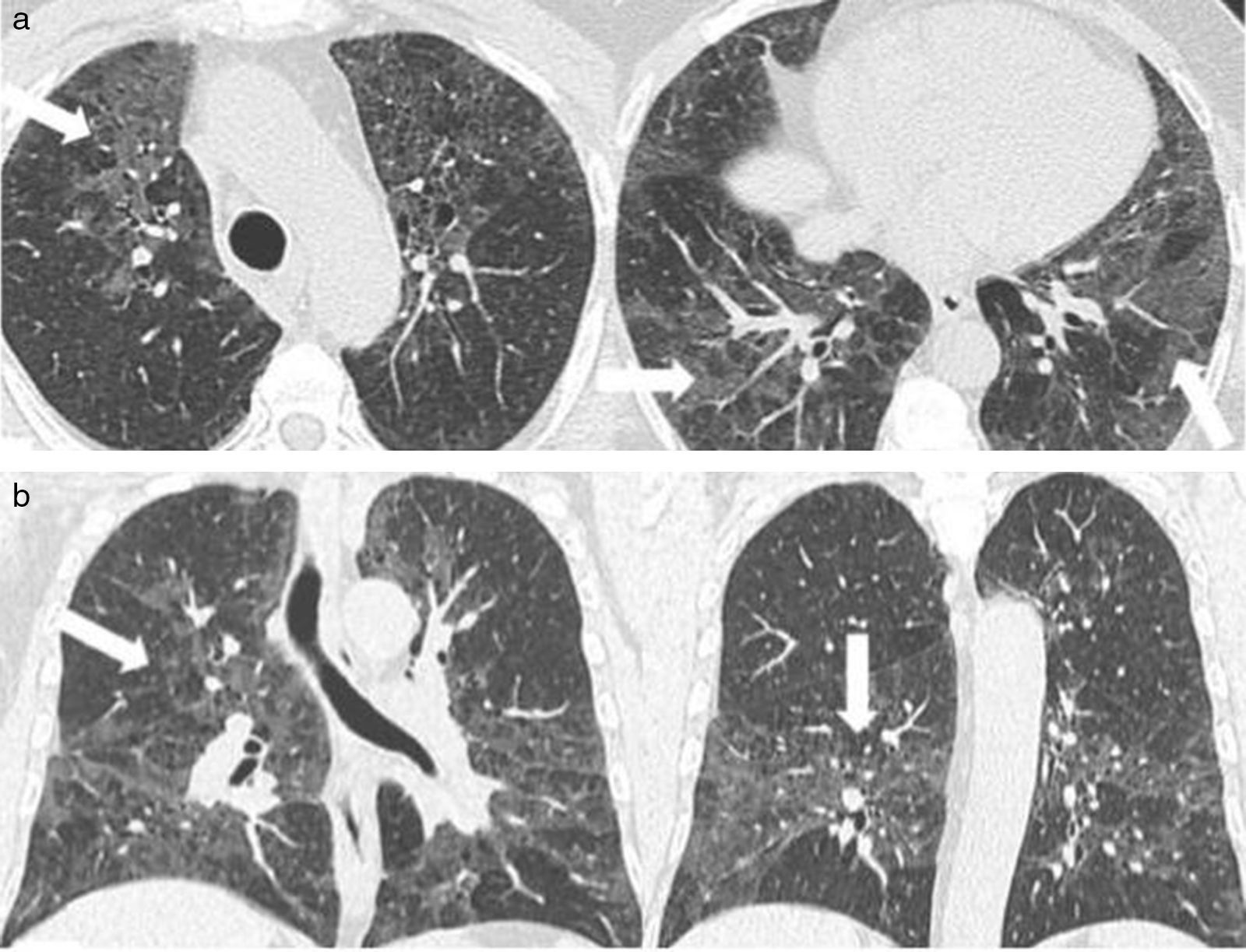
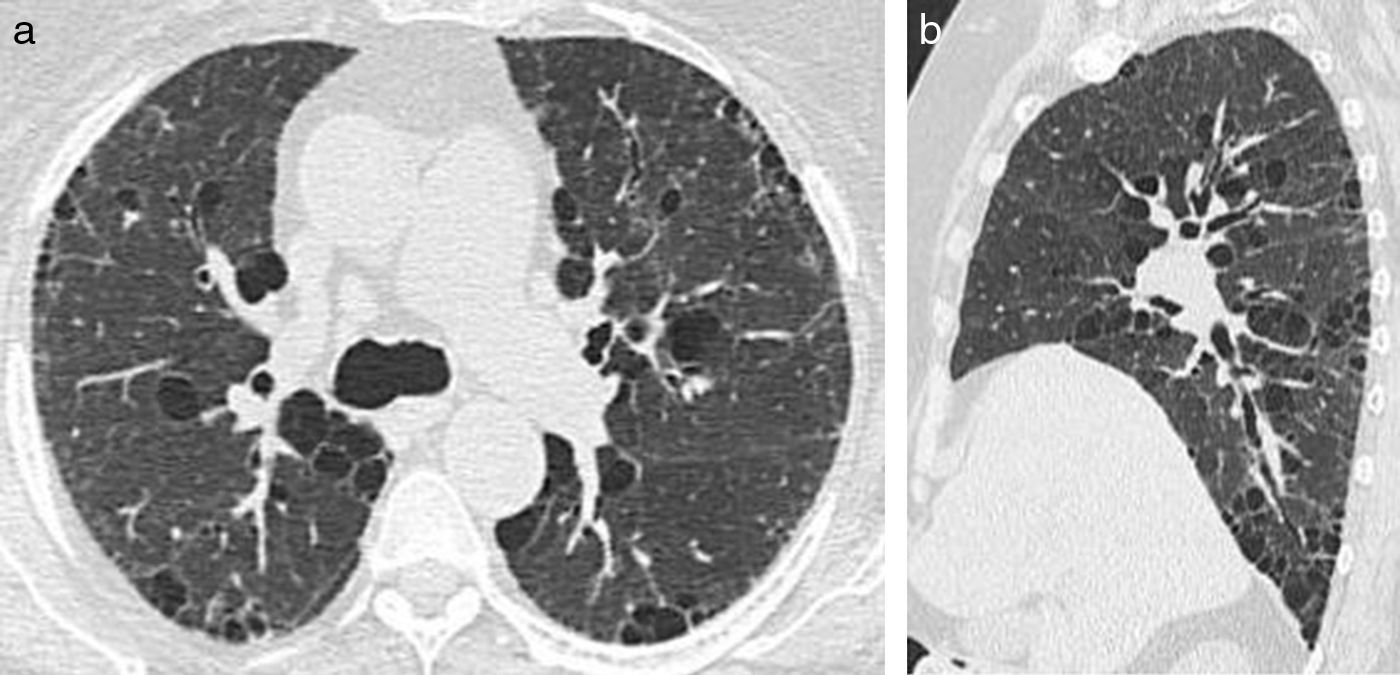
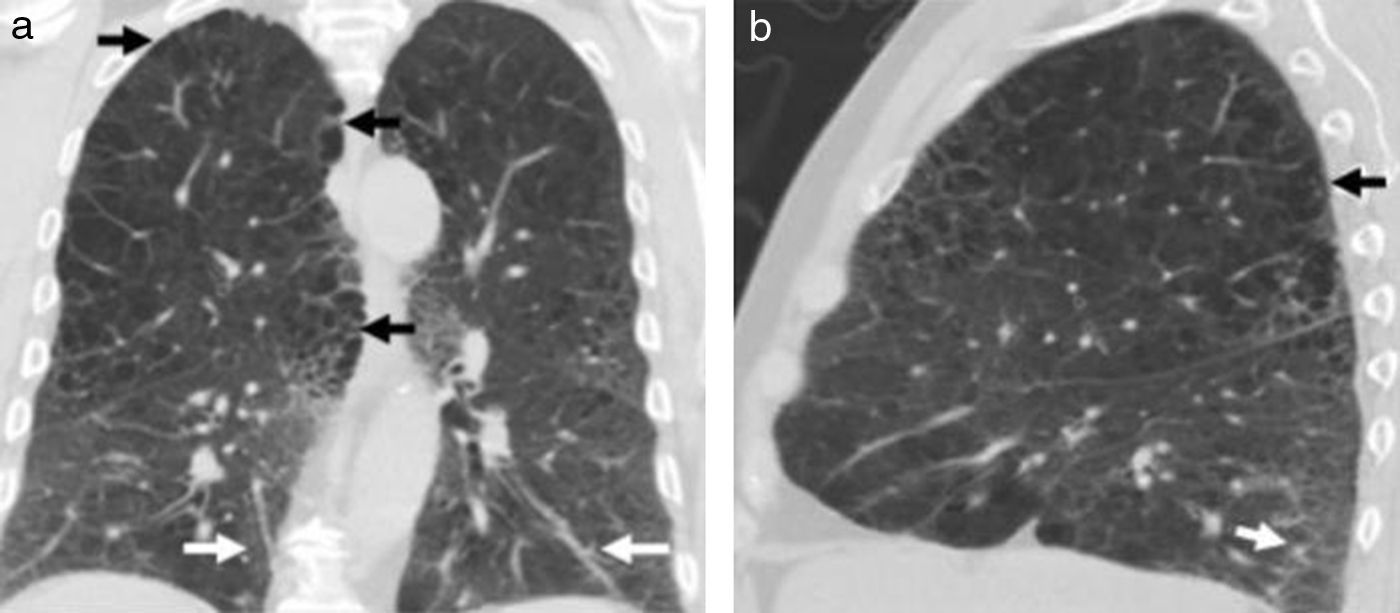
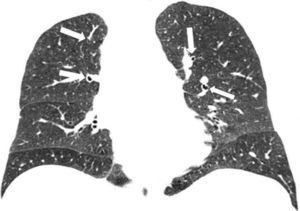
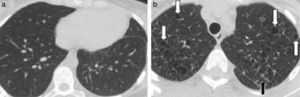
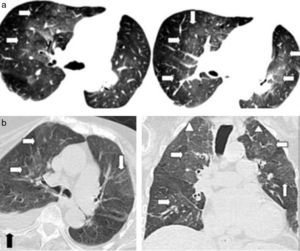
La TCMD muestra pequeños nódulos que pueden variar de 1 a 10mm de diámetro y a medida que la enfermedad progresa es posible encontrar infiltrados reticulonodulares bilaterales, principalmente en las campos pulmonares medios y superiores, respetando las bases pulmonares17. En los casos típicos se evidencia un patrón nodular predominante en las primeras fases de la enfermedad y en fases posteriores predomina un patrón quístico. Este último es el más frecuente y se presenta con quistes menores de 20mm de diámetro y con una pared típicamente fina, de 1mm de grosor o incluso menos, con formas variables irregulares y algunas bizarras18 (fig. 9).
TCMD cortes axiales del tórax con ventana pulmonar de una mujer de 61 años de edad con histiocitosis de Langerhans. Lóbulos inferiores se encuentran respetados (a). Múltiples imágenes reticulonodulares (flecha negra) en lóbulos superiores y medios con formaciones quísticas de formas irregulares y paredes finas (flechas blancas) (b).
Los diagnósticos diferenciales a considerar cuando se presenta con un patrón nodular incluyen sarcoidosis, silicosis, enfermedad metastásica y tuberculosis. La distribución en los campos superiores y medios y la naturaleza centrolobulillar de los nódulos en la HL son características diferenciadoras útiles. Cuando se presenta con patrón quístico, hay que distinguirlo de la linfangioleiomiomatosis (LLMM) (fig. 10), el enfisema y la fibrosis pulmonar idiopática.
TCMD de tórax con ventana pulmonar en corte (a) axial y (b) sagital de una mujer con linfangioleiomiomatosis muestra numerosas formaciones quísticas pequeñas, de paredes finas y distribución bilateral. Se diferencia de la histiocitosis de Langerhans porque sus quistes son de formas regulares y comprometen en forma difusa a ambos campos pulmonares, incluyendo las regiones basales y posteriores.
Se caracteriza por presentar infiltrados pulmonares difusos y eosinofilia pulmonar. La etiología es desconocida, aunque existen varios estudios que constatan una relación con el consumo de cigarrillo19.
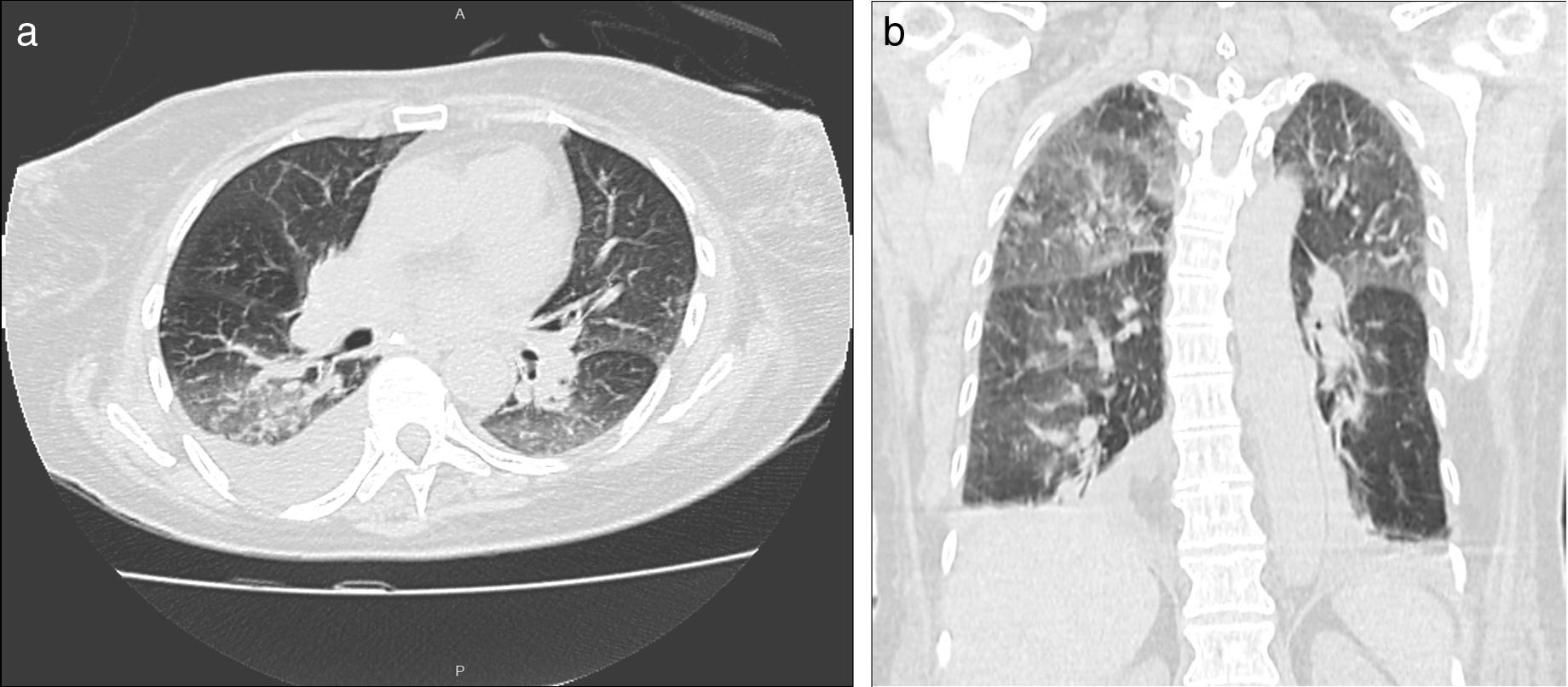
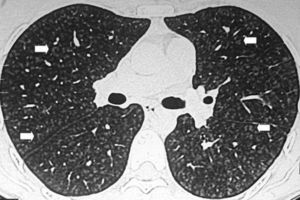
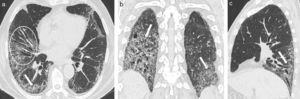
En la TCMD se visualizan áreas de aumento de atenuación, bilaterales, en vidrio esmerilado, generalmente de distribución peribroncovascular y periférica con frecuencia, acompañadas de engrosamiento de los septos interlobulillares, algunas veces con áreas de consolidación y nódulos mal definidos centrolobulillares20. Puede observarse derrame pleural y se presentan generalmente en forma bilateral (fig. 11).
TCMD de tórax con ventana pulmonar en cortes (a) axiales y (b) coronales de un hombre de 52 años de edad con neumonía eosinofílica aguda revela áreas de aumento de la atenuación bilaterales en vidrio esmerilado con tendencia a la consolidación con distribución peribroncovascular y periférica, asociadas a engrosamiento de los septos interlobulillares y derrame pleural bilateral a predomino derecho.
Los diagnósticos diferenciales incluyen edema agudo pulmonar (fig. 12), síndrome de dificultad respiratoria del adulto, neumonía intersticial aguda y neumonía bacteriana o viral atípica21.
(a) TCMD de tórax en cortes axiales con ventana pulmonar de una mujer de 79 años de edad con edema agudo pulmonar evidencia áreas de aumento de la atenuación en vidrio esmerilado en ambos campos pulmonares, con distribución peribroncovascular y central en “alas de mariposa” (flechas), a diferencia de la neumonía eosinofílica aguda que presenta distribución periférica. (b) Otra paciente con edema pulmonar donde se observan áreas con densidad en vidrio esmerilado de distribución central (flechas blancas), asociadas a engrosamiento de septos interlobulillares (cabezas de flecha) y derrame pleural derecho (flecha negra). Nótese la cardiomegalia.
La FP vinculada al hábito tabáquico es la fibrosis pulmonar idiopática (FPI). Esta muestra un patrón histológico de neumonía intersticial usual, distinta de la FP, asociada a enfermedades sistémicas o relacionada a exposiciones ocupacionales con otros patrones histológicos.
La FPI es la forma más común de enfermedad pulmonar intersticial idiopática, manifestándose en la sexta o la séptima década, con predominio en el sexo masculino. Clínicamente se evidencia con disnea progresiva, tos seca y fatiga. Frecuentemente es fatal y los pacientes presentan un promedio de supervivencia de tres a cinco años a partir del diagnóstico22,23.
A pesar de que no se conoce exactamente su etiología, se cree que entre varios factores ambientales implicados, el tabaco es un factor de riesgo importante. Este incrementa el riesgo en 4,6 veces de desarrollar la enfermedad en varones con exposición ocupacional en comparación con las mujeres no expuestas24.
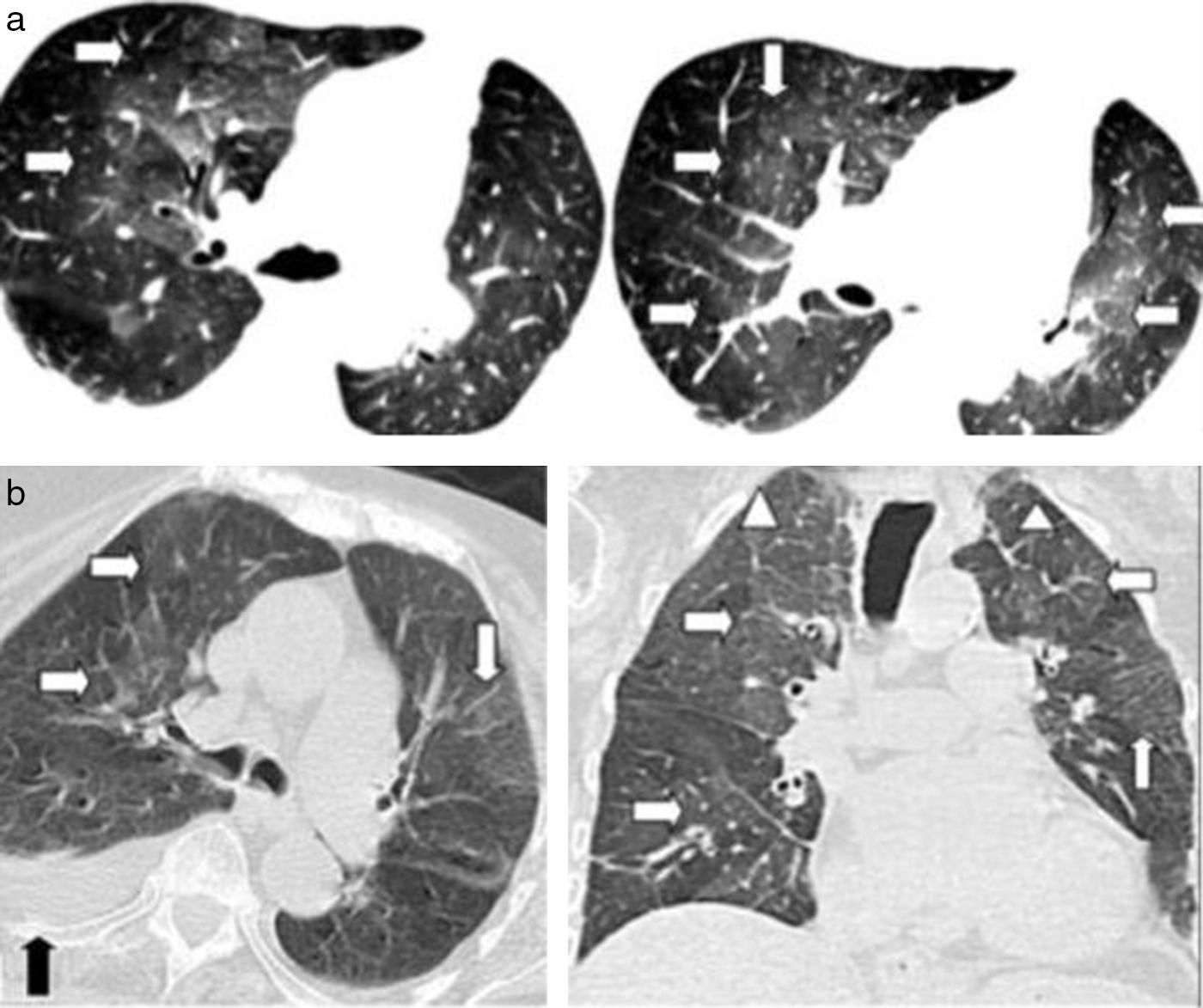
Los hallazgos por TCMD más frecuentes de la fibrosis pulmonar incluyen disminución global del volumen pulmonar, presencia de opacidades pulmonares de tipo reticular/reticulonodular, bronquiectasias por tracción y áreas de panalización, mostrando las lesiones un gradiente ápico-basal y un predominio en los lóbulos inferiores y sectores periféricos25 (fig. 13).
TCMD de tórax con ventana pulmonar en corte (a) axial, (b) coronal y (c) sagital de un hombre de 56 años con fibrosis pulmonar idiopática evidencia engrosamiento intersticio-nodulillar subpleural, en ambos campos pulmonares a predominio bibasal posterior, que conforma un patrón reticular asociando áreas quísticas (panalización) (flechas blancas) y múltiples bronquiectasias por tracción (círculo).
La FPE es un síndrome definido recientemente en el que coexisten, en un mismo individuo, el enfisema en los lóbulos superiores y la FPI en los lóbulos inferiores. El humo del tabaco se ha establecido como el principal agente etiológico, aunque ni los mecanismos fisiopatológicos ni la secuencia de eventos involucrados en este síndrome han sido aún dilucidados26.
La prevalencia de hipertensión pulmonar es elevada y representa la principal condición que determina el pronóstico, puesto que su presencia lo empeora.
En la TCMD se evidencia la presencia de enfisema de predominio en lóbulos superiores, definido por una zona hipodensa bien delimitada, sin pared o con una pared muy fina y/o múltiples bullas, que coexiste con opacidades reticulares, bronquiectasias por tracción, áreas de engrosamiento septal, vidrio esmerilado y panal de abejas en lóbulos inferiores.
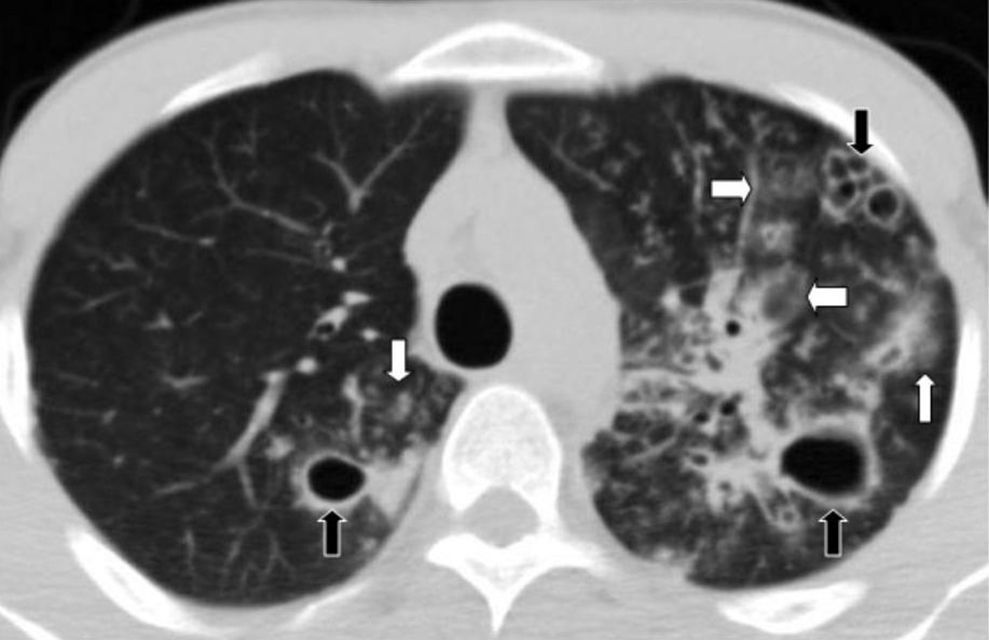
Las lesiones enfisematosas corresponden a enfisema centrolobulillar y paraseptal (bullas subpleurales). El enfisema paraseptal se ha descrito hasta en una 90% de los casos, por lo que algunos autores sugieren que se trata de un rasgo característico de esta entidad11,27 (fig. 14).
TCMD en corte (a) coronal y (b) sagital de un hombre de 48 años de edad con fibrosis pulmonar y enfisema revela enfisema centrolobulillar y paraseptal con predominio en lóbulos superiores (flechas negras), asociado a imágenes reticulares subpleurales posterobasales (flechas blancas), correspondiente a áreas de fibrosis pulmonar idiopática.
Las lesiones pulmonares que se relacionan con el tabaquismo son variadas. La TCMD permite su caracterización de manera no invasiva y, junto con la clínica y los exámenes funcionales complementarios, ayuda a caracterizar las distintas entidades y realizar los diagnósticos diferenciales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.