La embolia grasa (EG) es una obstrucción de los vasos sanguíneos por glóbulos de grasa. Ha sido descrita en la circulación pulmonar con una gran variedad de asociaciones, pero las más comunes e importantes se dan con fracturas de huesos largos y daño de tejido blando debido a traumatismo grave. Por su parte, el síndrome de embolia grasa (SEG) es una manifestación poco frecuente, aunque grave, del fenómeno de embolia grasa, que se caracteriza clínicamente por la tríada disnea, petequias y confusión mental. La razón de la discrepancia entre la presencia de embolia grasa y el desarrollo del síndrome no es clara.
Presentamos el caso de un hombre de 41 años que, inmediatamente después del trauma, presentó en la tomografía computada (TC) inicial defectos de llenado de atenuación grasa dentro de las arterias pulmonares. Estos fueron interpretados como múltiples embolias grasas macroscópicas.
Los valores de atenuación de la tomografía computada multidetector (TCMD) de las embolias pulmonares deben examinarse cuidadosamente en el contexto de un traumatismo agudo o después de procedimientos ortopédicos, debido a la complicación rara pero potencialmente fatal del SEG. En los centros de trauma, la TCMD es una herramienta esencial para hacer el diagnóstico de la embolia grasa macroscópica, así como también para descartar otras causas de hipoxia, como la embolia pulmonar trombótica. La reconstrucción de cortes finos debe utilizarse para la evaluación detallada de la vasculatura pulmonar.
Fat embolism (FE) may be defined as the blockage of blood vessels by fat globules. Pulmonary fat embolisms are reported to be associated with a wide variety of conditions, with the most common and important ones being with long bone fractures and soft tissue damage due to severe trauma. Fat embolism syndrome (FES) is a rare but serious manifestation of the fat embolism phenomenon, characterized clinically by a triad of dyspnea, petechiae, and mental confusion. The discrepancy between the presence of a fat embolism and the development of fat embolism syndrome is unclear.
The case is presented of a 41 year-old male who, on the initial trauma CT scan, presented with filling defects of fat attenuation within the pulmonary arteries. Those were interpreted as multiple macroscopic fat emboli.
The CT attenuation values of pulmonary embolism should be carefully examined in the setting of acute trauma or after orthopedic procedures, as the rare but potentially fatal complication of FES may result. In trauma centers, multidetector computed tomography is an essential tool to make the diagnosis of macroscopic fat embolism, and to exclude other causes of hypoxia, such as thrombotic pulmonary embolism. These reconstructions should be used for detailed evaluation of the pulmonary vasculature.
Un ciclista masculino de 41 años de edad, previamente sano, fue traído en ambulancia al servicio de Emergentología por un politraumatismo. Había sido arrollado por un vehículo.
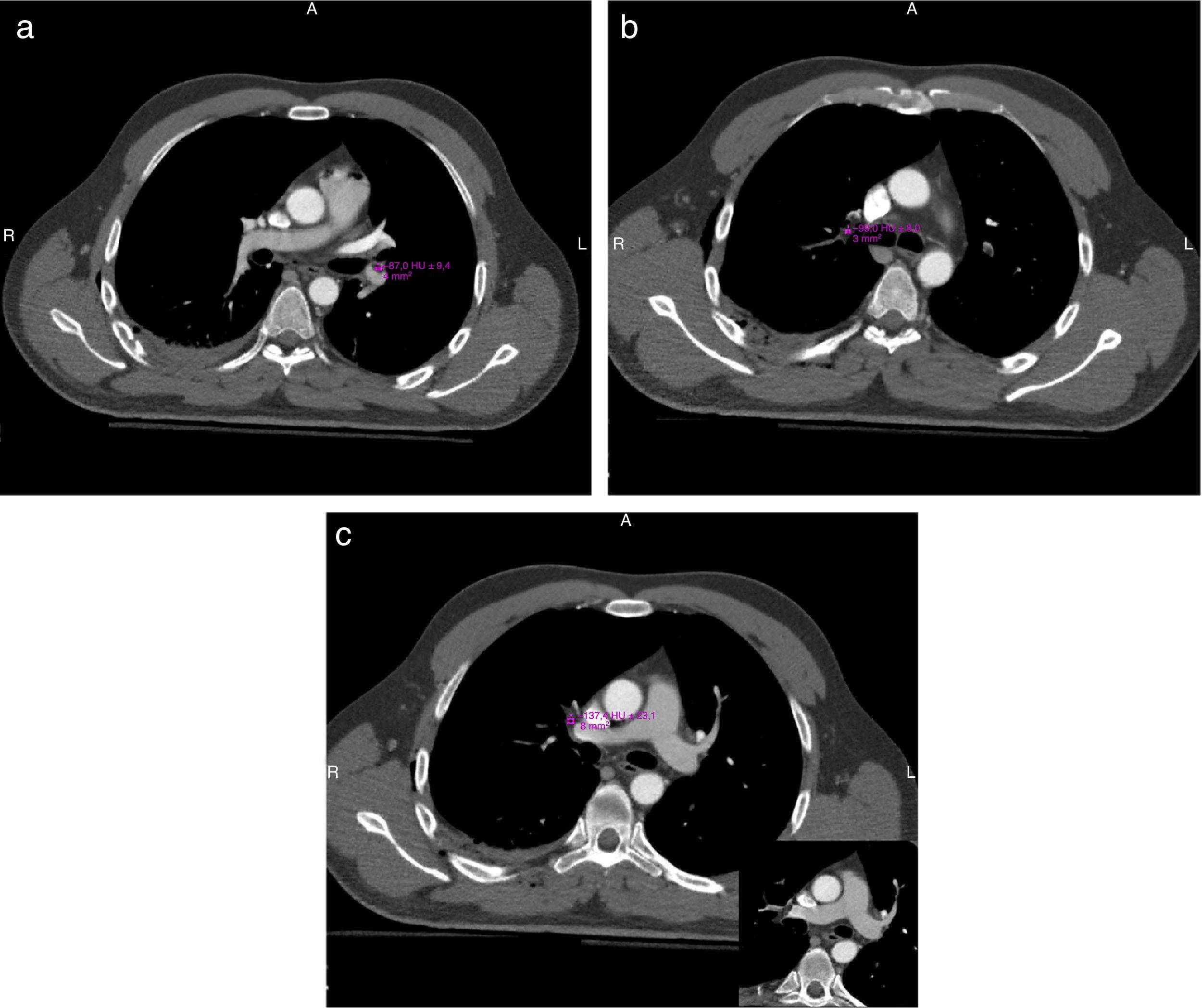
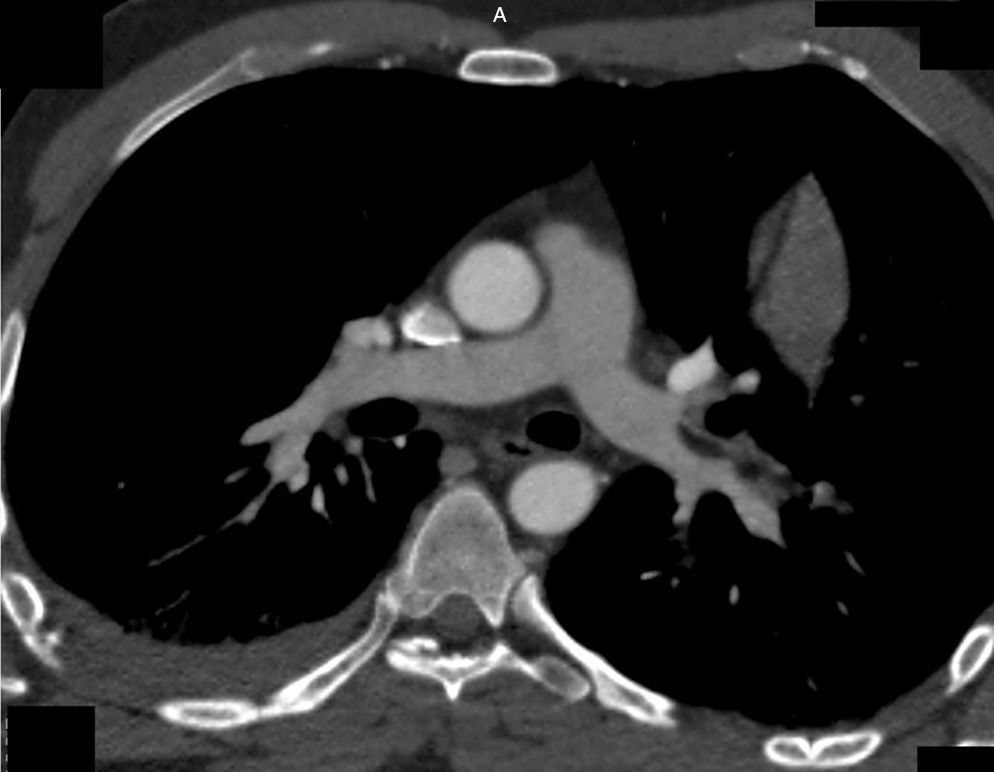
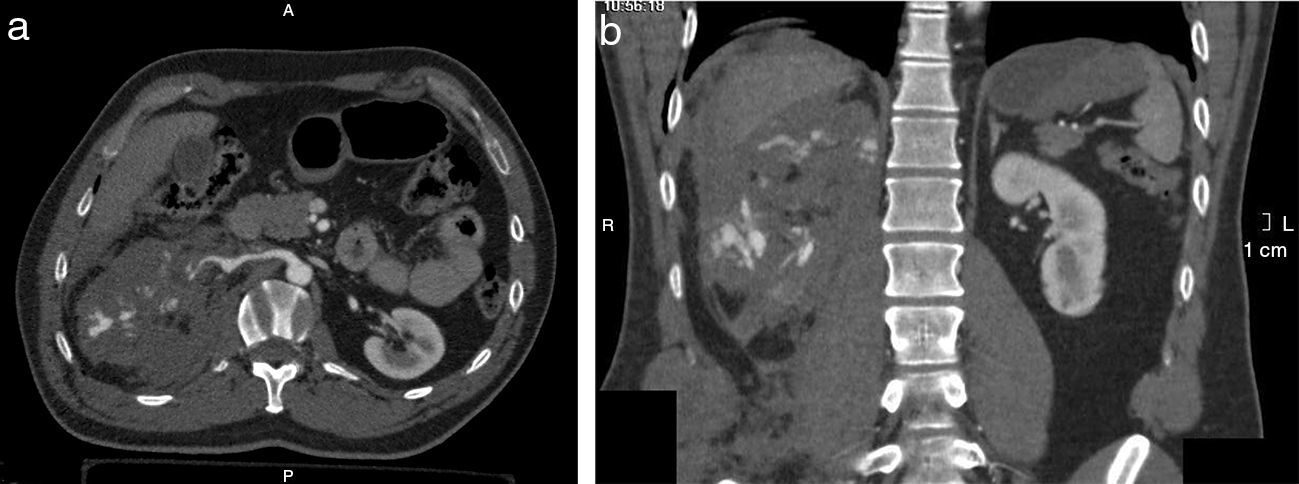
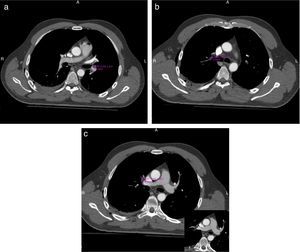
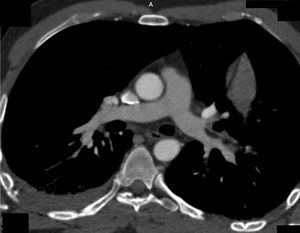
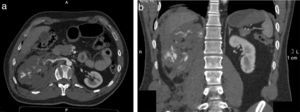
Se solicitó una eco FAST (Focused Assessment Sonography in Trauma) que reveló líquido libre en la cavidad pleural derecha y espacio parietocólico homolateral. Minutos después, luego de la estabilización hemodinámica, se realizó una tomografía computada (TC) de cerebro, tórax, abdomen y pelvis con contraste endovenoso, en la que se evidenció un defecto de relleno con valores tomodensitométricos negativos, ubicado (fig. 1) cabalgando en el ramo arterial interlobar derecho, en los ramos segmentarios para el lóbulo inferior homolateral, a nivel de la primera bifurcación en sus ramos lobares del lado izquierdo, y en los ramos lobares y segmentarios para el lóbulo inferior izquierdo. También se observó: derrame pleural bilateral a predominio derecho; neumotórax grado I; neumomediastino; áreas de aumento de la atenuación en vidrio esmerilado en las convexidades posteriores y bilateral, así como en el lóbulo superior izquierdo; aire en el espesor del tejido graso de la pared posterolateral del tórax a predominio derecho; trazo de fractura del 7.° arco costal posterior izquierdo; y fractura desplazada del 3.° al 10.° arco costal posterior derecho (fig. 2). En el abdomen (fig. 3) se encontró: abundante cantidad de líquido libre; estallido renal derecho con interrupción del hilio renal; hematoma del músculo psoas ilíaco homolateral; vena cava interior (VCI) plana sin delimitación adecuada de todo su trayecto; solución de continuidad en los músculos de la pared lateral derecha del abdomen, asociada a un hematoma de partes blandas a ese mismo nivel; fracturas de las apófisis trasversas izquierdas de L1, L2 y L4; y fractura desplazada de la apófisis trasversa de L5. No se observaron trazos de fractura a nivel de los huesos largos ni de la pelvis.
Las imágenes y el escenario clínico fueron altamente sugestivos, por lo que se realizó el diagnóstico de embolia pulmonar grasa.
DiscusiónLa embolia grasa (EG) es la obstrucción de los vasos sanguíneos por glóbulos de grasa. Ha sido descrita en la circulación pulmonar con una gran variedad de asociaciones, pero las más frecuentes e importantes están relacionadas con fracturas de huesos largos y daño de tejido blando debido a traumatismo grave. Aunque menos comunes, también hay casos de EG de causas no traumáticas.
El síndrome de embolia grasa (SEG) es una consecuencia clínica infrecuente, severa y poco comprendida de la EG, que se presenta como un desorden multisistémico. Se manifiesta mediante un amplio espectro clínico y los órganos más afectados generalmente son el pulmón y el cerebro. Su inicio ocurre luego de un período de latencia de 12 a 72h promedio, aunque en el 60% de los casos aparece dentro de las 24 h1. Cuando hay grandes perjuicios, este tiempo se reduce a unas pocas horas. La tríada clásica está conformada por disnea, exantema petequial y confusión mental, pero esta se presenta solo en el 50% de los casos1.
Las causas no traumáticas pueden estar vinculadas a procedimientos (liposucción, biopsia y trasplante de médula ósea o renal, o transfusión sanguínea), enfermedades (quemaduras, osteomielitis, pancreatitis, cetoacidosis diabética, esteatosis hepática, alcoholismo o hepatitis) y drogas (corticoides, anestésicos inhalados, ciclosporina A o nutrición parenteral total rica en ácidos grasos).
Un trabajo en el que se evaluaron los restos de 53 hombres fallecidos tras haber sido golpeados comunicó que 6 (11,3%) habían muerto por aspiración de sangre o hemorragia intracraneal, 15 (28,3%) por shock hipovolémico y 32 (60,4%) por SEG. Las fracturas de los huesos largos se encontraron solo en 4. El SEG fatal, producido por la desintegración mecánica del tejido adiposo que migra en el torrente sanguíneo, fue un fenómeno común en este estudio2. Sin embargo, no hubo correlación entre la presencia de fracturas de huesos largos y la gravedad del SEG, ni se detectaron en todos los cuerpos émbolos de médula ósea en el examen histológico de los órganos diana2. Todas las víctimas tenían hematomas subcutáneos dispersos. La hipovolemia y el shock neurogénico, así como los efectos sistémicos de las lesiones por aplastamiento, deben considerarse factores que contribuyen a la muerte por SEG. Estos hallazgos contradicen la afirmación de que las personas con fuertes traumatismos sucumben principalmente por hemorragias masivas2.
Los factores de riesgo para el desarrollo de EG son la ausencia de inmovilización de la fractura o inmovilización inadecuada, las fracturas cerradas de huesos largos y las múltiples con inmovilización diferida, la hemorragia y el shock concomitantes.
Su fisiopatogenia se ha intentado explicar mediante distintas hipótesis. Como consecuencia de la fractura o traumatismo, los glóbulos adiposos de la médula ósea tienen acceso a la circulación y producen embolias y obstrucción mecánica de la vasculatura del pulmón y otros sitios (piel, cerebro, riñones). A continuación estos son metabolizados y convertidos en glicerol y ácidos grasos libres, causando una reacción inflamatoria con efectos tóxicos directos sobre el pulmón (células endoteliales y neumonocitos) que se manifiestan como hipoxemia aguda y neumonitis3. El embolismo de material graso a través del foramen oval permeable es un posible mecanismo causal de las manifestaciones sistémicas del SEG.
EpidemiologíaLa embolia grasa es una complicación frecuente de fracturas pelvianas y de huesos largos, así como también de politraumatismos con afectación de tejidos blandos. En la mayor parte de los pacientes es asintomático y solo un 1-5% muestra síntomas y signos de disfunción en múltiples órganos (sobre todo, el cerebro, el pulmón y la piel). Para estos casos, se reserva el término síndrome de embolia grasa (SEG)4.
Si bien la razón de la discrepancia entre la presencia de émbolos de grasa y el desarrollo del SEG aún no es clara, se ha propuesto una vinculación entre el tamaño del émbolo y la presencia de síntomas.
El síndrome suele ser más frecuente en pacientes jóvenes (20-30 años), con una presencia menor en la edad infantil por la diferente composición grasa de la médula ósea. La incidencia de SEG en fracturas únicas de huesos largos oscila entre un 0,5-2%; en cambio, si se asocia a fracturas múltiples de huesos largos y pelvis, esta varía entre un 5 y un 11%. Su mortalidad global es de 5-15%.
La embolia grasa en la circulación arterial sistémica también ha sido reportada, presentándose clínicamente como un stroke con el signo de la arteria hipodensa (objetivación de una señal hipodensa en el trayecto de un territorio vascular cerebral) y valores de atenuación de –25 Unidades Hounsfield (UH) en la TC de cerebro5. Se ha descrito, además, la presencia de émbolos grasos a nivel de la sustancia gris y de hemorragias en el centro semioval y la sustancia blanca, como manifestación del daño a nivel de la microvasculatura6–8.
ClínicaLos síntomas respiratorios aparecen en casi el 100% de los pacientes. Oscilan entre una ligera disnea con una hipoxemia relativa subclínica hasta un cuadro de distrés respiratorio. El 50% de los casos requiere apoyo ventilatorio.
Por su parte, los síntomas neurológicos afectan al 80% de los pacientes. Su presentación varía entre déficits focales, cuadros confusionales y crisis comiciales (en general, transitorios y reversibles). Suelen tener correlación temporal con la clínica respiratoria en cuanto a su presentación.
El exantema petequial se encuentra en un 20-50% de los casos y afecta predominantemente la cabeza, el cuello, el tórax anterior, las axilas y las conjuntivas. Es el signo clínico más específico, pero también uno de los más tardíos. A su vez, puede haber fracaso renal agudo con oliguria, hematuria y lipiduria, alteraciones visuales, anisocoria, fiebre, coagulación intravascular diseminada e ictericia, entre otras afecciones.
Es importante destacar que el diagnóstico de SEG se basa en hallazgos clínicos. Los estudios de laboratorio o de imágenes, en este sentido, solo constituyen un aporte más.
Hallazgos imagenológicosSon inespecíficos y aparecen después de un período variable de retraso en relación con la clínica.
Radiografía de tóraxPuede ser normal o evidenciar opacidades alveolares o intersticiales, difusas o parcheadas, periféricas o basales, sugestivas de edema e injuria pulmonar aguda1. Aparecen a las 12-24h del inicio de los síntomas, a diferencia de la contusión pulmonar. Estos tiempos deben tenerse en cuenta en las imágenes al momento de realizar el diagnóstico diferencial de la hipoxemia en todo paciente politraumatizado.
Tomografía computada/angiografía por TCCuando un paciente ingresa con alguno de los factores descritos, y ante defectos de relleno en la arteria pulmonar, los valores de atenuación deben ser considerados cuidadosamente, ya que el SEG constituye una complicación rara pero posiblemente fatal. En estos casos, la aparición de disnea súbita puede inferir el diagnóstico clínico de SEG; sin embargo, la angio-TC y/o TC helicoidal permiten el diagnóstico diferencial con la tromboembolia pulmonar.
Como hallazgos más frecuentes se comunican: áreas de aumento de atenuación en vidrio esmerilado focal o difusa, áreas de consolidación parcheada o difusa, y nódulos centrolobulillares y subpleurales menores de 10mm, mal definidos y de diferentes tamaños. Estos hallazgos son la representación de la hemorragia intersticial, la hemorragia y el edema alveolar difusos, y la neumonitis producida por isquemia y citotoxicidad de la grasa1,4,9.
En nuestro caso, el paciente presentó defectos de relleno a nivel de los ramos segmentarios de la arteria pulmonar, los cuales eran bilaterales y tenían valores tomodensitométricos negativos a dicho nivel. Dado también el contexto (politraumatismo con lesiones en múltiples órganos, incluyendo fracturas costales y lesión grave en órganos sólidos y partes blandas de la pared abdominal), se infirió el diagnóstico de embolia pulmonar grasa.
Otros hallazgos tomográficos pueden ser los septos interlobares finos y la afectación nodular, con diámetro normal de bronquios y arterias, sin asociación con derrame pleural. La aparición de las imágenes suele suceder en 1-3 días y su resolución entre los 7 y 25 días después del evento traumático. En la etapa tardía de la evolución del SEG se describen calcificaciones difusas ubicadas en las ramas de las arterias pulmonares1.
Huang et al.10 proponen una evaluación cuantitativa de los valores de atenuación para el análisis de los émbolos grasos hallados en la circulación pulmonar y sistémica10.
El incremento en el uso de la TC como método diagnóstico ante la sospecha de embolia pulmonar probablemente aumente la documentación sobre la presencia de émbolos de grasa en la circulación en pacientes con antecedentes de traumatismos o fractura y síntomas respiratorios de aparición súbita11.
Otros métodosEl lavado broncoalveolar puede evidenciar inclusiones grasas en la inspección microscópica en más del 70% de los macrófagos alveolares. También se mencionan: lipiduria, hipocalcemia por saponificación de ácidos grasos libres y plaquetopenia, pero todas estas determinaciones son inespecíficas.
Diagnósticos diferencialesSe realizan con contusión pulmonar, broncoaspiración, edema agudo de pulmón, tromboembolismo pulmonar y distrés respiratorio asociado a transfusión.
PronósticoLa duración de SEG es difícil de predecir. El pronóstico es bueno, excepto en casos fulminantes. El déficit neurológico y de la capacidad de difusión puede persistir.
Se estima que su mortalidad es del 5-15% en general, pero la mayoría de los pacientes se recupera totalmente12.
ConclusiónLos valores de atenuación de TC de las embolias pulmonares deben examinarse cuidadosamente en el contexto de un traumatismo agudo o después de procedimientos ortopédicos, debido a la complicación rara pero potencialmente fatal del SEG. En los centros de trauma, la TC es una herramienta fundamental para hacer el diagnóstico de la embolia grasa macroscópica, así como también para descartar otras causas de hipoxia, como la embolia pulmonar trombótica. La reconstrucción de cortes finos debe utilizarse para la evaluación detallada de la vasculatura pulmonar.
La detección de defectos de relleno dentro de las arterias pulmonares con valores tomodensitométricos negativos asociados a áreas de consolidación, disminución de la atenuación en vidrio esmerilado o nódulos menores de 10mm de diferentes tamaños, permite el diagnóstico de embolia pulmonar grasa.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.