El uso indiscriminado de fertilizantes químicos ha contribuido al deterioro de las propiedades biológicas, físicas y químicas del suelo, lo que derivó en la pérdida de su capacidad productiva. Por esta razón, se ha planteado como alternativa tecnológica el uso de biofertilizantes. El objetivo de esta investigación fue desarrollar un sistema de fermentación líquida y de enquistamiento adecuado para la multiplicación de Azotobacter chroococcum cepa AC1, una bacteria utilizada en la formulación de un biofertilizante actualmente producido por CORPOICA, Colombia. Se emplearon diseños estadísticos secuenciales para determinar las condiciones del sistema de fermentación. Se evaluaron la interacción entre la agitación, la aireación y el pH sobre la biomasa viable obtenida de AC1 (UFC/ml), que se tomó como variable de respuesta. Además, se evaluó la capacidad de enquistamiento de esta bacteria empleando 2 agentes de enquistamiento, AE01 y AE02. La actividad potencial promotora del crecimiento vegetal fue evaluada por medio del ensayo de ARA (fijación biológica de nitrógeno), la técnica de azul de fosfomolibdeno (solubilización de fosfato) y la reacción colorimétrica empleando el reactivo de Salkowski (producción de compuestos indólicos). Se evidenciaron efectos significativos (p<0,05) sobre la producción de biomasa de los 3 factores evaluados (pH, aireación y agitación) individualmente, de una interacción dual y en la interacción tripartita, teniendo un efecto positivo sobre la variable de respuesta la aireación y agitación. La adición de los inductores de enquistamiento AE01 y AE02 demostró la capacidad de la cepa AC1 para formar quistes en condiciones de estrés. Asimismo, las condiciones de fermentación y el enquistamiento no afectaron las actividades biológicas evaluadas.
The indiscriminate use of chemical fertilizers has contributed to the deterioration of the biological, physical and chemical properties of the soil, resulting in the loss of its productive capacity. For this reason, the use of biofertilizers has emerged as a technological alternative. The objective of this research was to develop a suitable liquid fermentation system and encystment for the multiplication of Azotobacter chroococcum AC1 strain, a bacterium employed in a biofertilizer formulation produced at present by CARPOICA, Colombia. Sequential statistical designs were used to determine the conditions in the fermentation system. The interaction between agitation, aeration and pH was evaluated on the viable biomass (CFU/ml) of AC1. In addition, the encystment ability of the strain was evaluated using two encystment agents and the potential plant growth-promoting rhizobacteria (PGPR) activity was assessed by different techniques, such as nitrogen fixation by ARA, phosphate solubilization by the phospho-molybdenum-blue reaction and indolic compound production by colorimetric reaction using the Salkowski reagent. Results showed significant effects (p<0.05) on the viable biomass in the three conditions (pH, aeration and agitation) tested individually, in one dual interaction and one tripartite interaction, were demonstrated to have a positive effect on the response variable aeration and agitation. The addition of the two encystment agents evaluated, AE01 and AE02, demonstrated the ability of AC1 to form cysts under stress conditions. Likewise, fermentation and encystment conditions did not affect the biological activities tested.
La degradación de las propiedades biológicas, físicas y químicas del suelo son consecuencia del uso indiscriminado de fertilizantes químicos y de prácticas agrícolas incorrectas31. El uso de biofertilizantes ha tomado cada vez más fuerza, ya que estos intervienen directamente sobre los ciclos biogeoquímicos por medio de la fijación biológica de nitrógeno atmosférico y la solubilización de fósforo inorgánico2.
El uso de biofertilizantes ha demostrado generar un aumento en la productividad en cultivos de gramíneas de hasta 50% en condiciones de invernadero4 y del 30% en parcelas experimentales30. Por esta razón, el empleo de biofertilizantes representa una alternativa económicamente rentable para los agricultores y ganaderos del Caribe seco colombiano, debido a que su uso puede reducir hasta un 50% la aplicación de fertilizantes nitrogenados de síntesis química.
La Corporación Colombiana de Investigación Agropecuaria (CORPOICA) ha desarrollado un biofertilizante con base en una bacteria diazotrófica, Azotobacter chroococcum10,11, denominado Monibac® (biofertilizante en formulación sólida, presentación de 500g, para el cultivo de algodón, fabricado pro Corpoica en Centro de Investigacion Tibaitatá), nativa del Valle del Cásar, Colombia6, la cual ha demostrado su eficacia en el cultivo de Panicum maximum4 y Gossypium sp. Sin embargo, este biofertilizante se encuentra en presentación sólida y posee varios limitantes, tales como la concentración final de biomasa y el tiempo necesario para su producción. Para este caso puntual de A. chroococcum cepa AC110, el proceso de fermentación empleado tiene un rendimiento de 1×108UFC/ml de células vegetativas en 48 h de crecimiento.
El objetivo del presente estudio fue desarrollar un sistema de fermentación líquida y de enquistamiento de A. chroococcum cepa AC1 (en adelante, AC1), con el fin de maximizar la obtención de biomasa que sea capaz de tener una mayor vida útil, debido a la presencia de células enquistadas. Además, este sistema es la etapa preliminar para el desarrollo de una nueva formulación líquida del biofertilizante, que pueda mantener las actividades para la promoción de crecimiento vegetal características de A. chroococcum.
Materiales y métodosCepa de estudio y medios de cultivoSe evaluó las cepa fijadora de nitrógeno de vida libre A. chroococcum AC1 perteneciente al banco de microorganismos del Laboratorio de Microbiología de Suelos de CORPOICA. La cepa fue reactivada en el medio Ashby pH 7,2, con la siguiente composición (g/l): manitol (10,0); K2HPO4 (0,2); MgSO4 (0,2); NaCl (0,2); CaSO4 (0,1); CaCO3 (5,0) y agar-agar (15,0). Todos los reactivos empleados fueron de marca Merck, Millipore, EE. UU. Las fermentaciones fueron llevadas a cabo en el medio de cultivo MBR20 con una temperatura de incubación de 28±2°C.
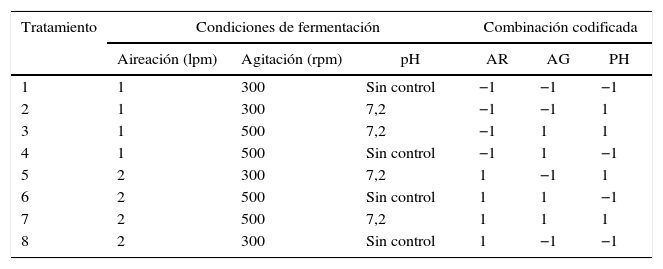
Determinación de las condiciones para el sistema de fermentaciónLas fermentaciones discontinuas se llevaron a cabo en un biorreactor de tanque agitado, con volumen efectivo de trabajo (VET) de 3,5 l, con una configuración tipo Rushton (MINIFORS modelo INF-30174, Suiza), empleando el medio de cultivo MBR12. Todos los tratamientos fueron inoculados con un preinóculo obtenido a partir de una suspensión bacteriana de la cepa AC1 de 35ml, correspondiente al 1% del VET, el cual tuvo una concentración celular ajustada a una DO540nm=0,20. Se empleó un diseño factorial completamente aleatorizado compuesto por 8 tratamientos con 24 ejecuciones sin puntos centrales, donde se determinaron 3 factores como limitantes en el proceso de fermentación, aireación, velocidad de agitación y pH (tabla 1), de acuerdo con condiciones previas descritas22. Se generó una matriz experimental (tabla 1) y se empleó como variable de respuesta el conteo de células viables (UFC/ml), mientras la temperatura se mantuvo constante a 30°C.
Factores de estudio y matriz experimental
| Tratamiento | Condiciones de fermentación | Combinación codificada | ||||
|---|---|---|---|---|---|---|
| Aireación (lpm) | Agitación (rpm) | pH | AR | AG | PH | |
| 1 | 1 | 300 | Sin control | −1 | −1 | −1 |
| 2 | 1 | 300 | 7,2 | −1 | −1 | 1 |
| 3 | 1 | 500 | 7,2 | −1 | 1 | 1 |
| 4 | 1 | 500 | Sin control | −1 | 1 | −1 |
| 5 | 2 | 300 | 7,2 | 1 | −1 | 1 |
| 6 | 2 | 500 | Sin control | 1 | 1 | −1 |
| 7 | 2 | 500 | 7,2 | 1 | 1 | 1 |
| 8 | 2 | 300 | Sin control | 1 | −1 | −1 |
AR: aireación; AG: agitación; PH: pH; lpm: litros por minuto; rpm: revoluciones por minuto.
El conteo de células viables fue realizado mediante la técnica de microgota modificada por Rojas-Tapias et al.24 empleando 4 diluciones decimales seriadas con 4 repeticiones por placa en alícuotas de 20μl por gota; las placas de agar Ashby fueron incubadas durante 24h a 28±2°C8.
Enquistamiento de la cepa AC1Se realizó una fermentación discontinua de AC1 empleando 125ml de medio MBR a 120rpm y 30°C hasta alcanzar su fase estacionaria (24h), en la cual se indujo el enquistamiento. Para esto se evaluaron 2 agentes de enquistamiento codificados como AE01 (Etanol absoluto marca Merck Millipore CAS 64-17-5) y AE02 (Glicerol marca Merck Calbiochem CAS 56-81-5), cada uno evaluado en 3 diferentes concentraciones (0,4; 0,7 y 1,0% v/v)3. Los agentes de enquistamiento tuvieron un tiempo de contacto con el microorganismo de 5 días en las mismas condiciones de fermentación previamente descritas. Este procedimiento se realizó por triplicado, empleando un diseño experimental completamente aleatorio.
Conteo de quistesEl número de quistes en la fermentación fue estimado por medio de conteo del número de células resistentes a la desecación, siguiendo la metodología planteada por Campos et al.3. Para esto fue necesario utilizar el medio MBR suplementado con sacarosa (1% p/v). Las células resistentes a la desecación fueron obtenidas a partir de la fase estacionaria del cultivo bacteriano (5 días) derivado de las fermentaciones suplementadas con los inductores de enquistamiento. Para contar el número de quistes, se tomó una alícuota de 2ml de la fermentación obtenida y se filtró al vacío a través de una membrana de nitrocelulosa (estéril) con un tamaño de poro de 0,45μm. Este número se consideró directamente proporcional al número de células resistentes a la desecación (quistes) provenientes del proceso fermentativo.
Evaluación de actividad biológicaTodos los ensayos de actividad biológica se llevaron a cabo durante un periodo de 105 días (3,5 meses) con muestreos cada 15 días. Para la evaluación de la fijación biológica de nitrógeno se realizaron 2 muestreos, uno inicial y uno final. Para las evaluaciones de las diferentes actividades biológicas se realizó una fermentación con las condiciones óptimas y la biomasa resultante fue distribuida en frascos de muestra (100ml de capacidad) para ser almacenada en 3 temperaturas diferentes (4, 20 y 32°C).
Fijación biológica de nitrógenoSe hizo el ensayo de reducción del acetileno (ARA, por sus siglas en inglés) mediante cromatografía de gases10, empleando el medio de cultivo MBR libre de nitrógeno. Los resultados de actividad enzimática de la nitrogenasa se calcularon por interpolación a partir de una curva de calibración con diluciones conocidas de etileno, relacionando la cantidad de nanomoles de etileno (concentración conocida) con el área del pico de etileno detectada por el cromatógrafo de gases para dicha dilución9,15.
Producción de compuestos indólicosSe realizó la técnica colorimétrica que utiliza el reactivo de Salkowski para determinar la producción de indoles totales a partir del precursor triptófano. Se tomó 1ml del sobrenadante y se llevó a reacción con 1ml del reactivo de Salkowski modificado, con incubación durante 30min en completa oscuridad; este procedimiento se realizó por triplicado. Se determinó la absorbancia de cada tubo en un espectrofotómetro a 540nm en un espectrofotómetro GENESYS TM 10 Series (Thermo Electron Scientific Instruments LLC, Madison, WI, EE. UU.) y utilizando la curva patrón se obtuvo la producción de indoles totales en mg/ml5,27.
Solubilización de fosfato in vitroSe inoculó con la cepa AC1 el medio SRS líquido con fosfato tricálcico y sin indicador de pH. El contenido de fósforo soluble se determinó a través del método de azul de fosfomolibdeno18. El ensayo tuvo una duración de 12 días, al cabo de los cuales se realizó la lectura de fósforo disponible en el medio de cultivo. Las muestras fueron centrifugadas a 14.000rpm por 10 min para tomar el sobrenadante. Se realizó la lectura de la reacción a 712nm en el espectrofotómetro y se reportó en partes por millón de fosfato soluble, interpolando las absorbancias a través de la curva patrón.
Análisis estadísticoTodos los experimentos fueron analizados con el paquete estadístico STATGRAPHICS CENTURION XV, con un intervalo de confianza del 95% para las comparaciones de medias y pruebas de correlación entre los factores evaluados.
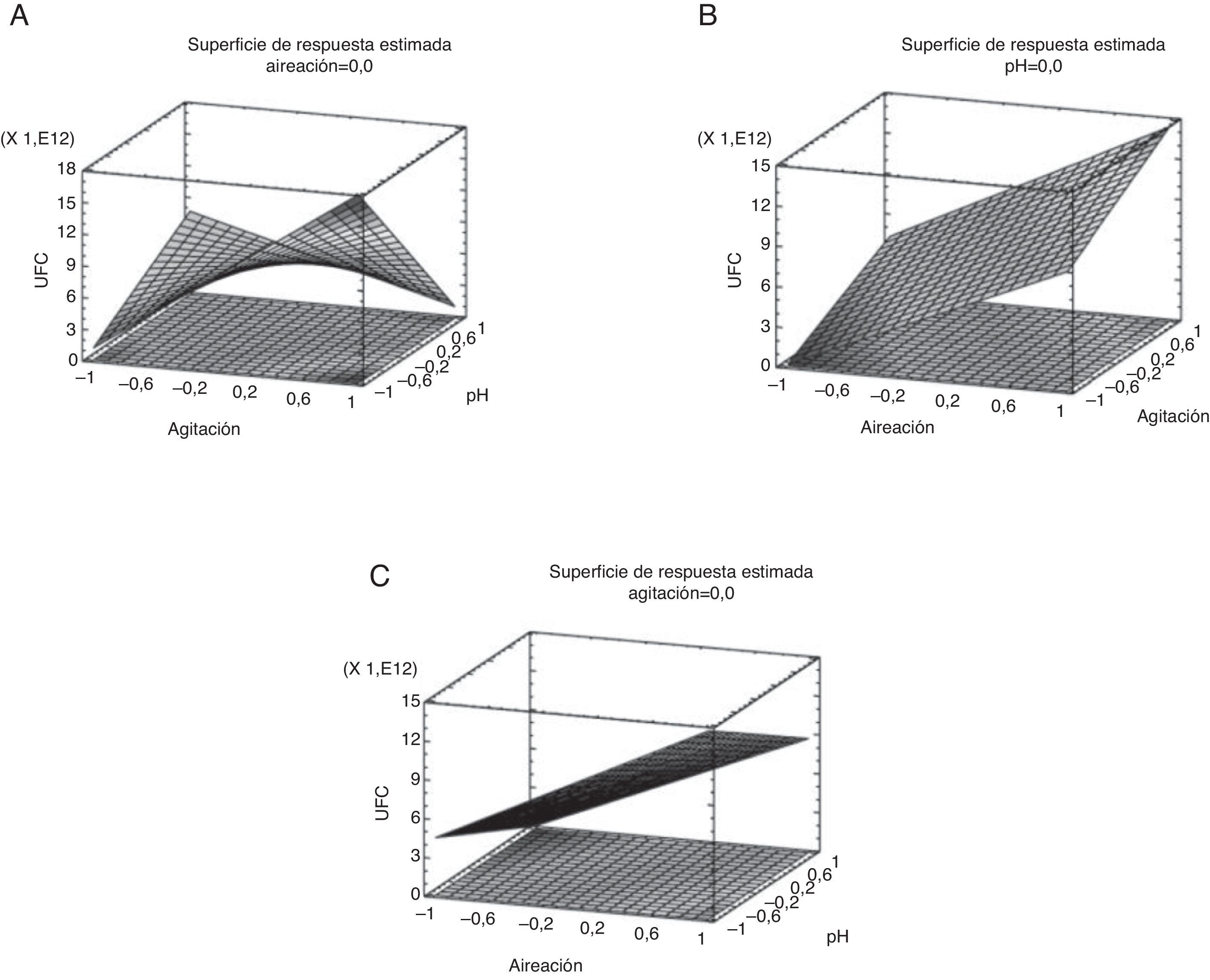
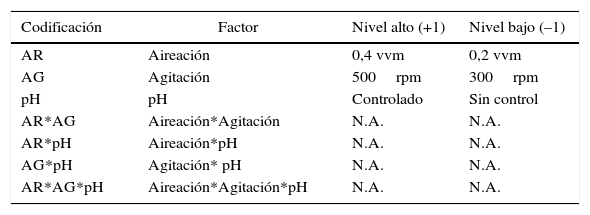
ResultadosDeterminación de las condiciones para el sistema de fermentaciónEl diseño factorial demostró una distribución normal con un intervalo de confianza del 95%, con un coeficiente de correlación del 95,85% y un valor ajustado del 94,05%. El diseño evaluó 3 factores principales, 3 interacciones duales y una interacción tripartita. Se evidenciaron efectos significativos (p<0,05) por los 3 factores principales evaluados individualmente, en una interacción dual y en la interacción tripartita, en donde la aireación y la agitación presentaron un efecto positivo sobre la variable de respuesta (tabla 2).
Análisis de varianza para UFC/ml de Azotobacter chroococcum AC1 en relación con factores fisicoquímicos
| Codificación | Factor | Nivel alto (+1) | Nivel bajo (–1) |
|---|---|---|---|
| AR | Aireación | 0,4 vvm | 0,2 vvm |
| AG | Agitación | 500rpm | 300rpm |
| pH | pH | Controlado | Sin control |
| AR*AG | Aireación*Agitación | N.A. | N.A. |
| AR*pH | Aireación*pH | N.A. | N.A. |
| AG*pH | Agitación* pH | N.A. | N.A. |
| AR*AG*pH | Aireación*Agitación*pH | N.A. | N.A. |
R2=95,85% y R2 ajustado=94,05%. Valor de p =0,05.
N.A.: no aplica; AR: aireación; AG: agitación; rpm: revoluciones por minuto; vvm: volumen de medio por minuto.
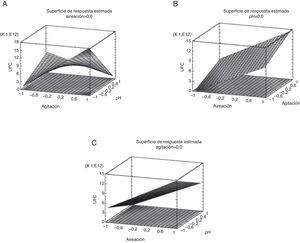
Las interacciones entre la agitación y el pH pueden ser observadas en la figura 1A, así como, la aireación y el pH (fig. 1C). En estos resultados se observa una relación inversa entre la velocidad de agitación y el pH del medio de cultivo. Este comportamiento se presentó de igual forma al evaluar la aireación suministrada al sistema y el pH del medio de cultivo. El pH no controlado en el medio permitió una mayor producción de biomasa expresada en UFC/ml. La fermentación con pH libre alcanzó valores entre 7,81 y 8,22.
Los contornos bajo la superficie de respuesta determinaron las concentraciones de los factores que maximizaron la respuesta en UFC/ml en relación con la interacción de las variables. En la figura 1B es posible observar que el efecto combinado de la aireación y la agitación en sus niveles más altos promueven mayores producciones de biomasa en las condiciones establecidas en el ensayo. En la figura 1C nuevamente se observa el efecto positivo sobre la producción de biomasa cuando el pH se encuentra sin controlar en el sistema de fermentación.
Asimismo, mediante la aplicación de la herramienta de optimización empleada sobre la variable de respuesta (UFC/ml), se pudieron determinar los niveles de los factores que según el diseño experimental optimizan la variable respuesta del estudio; de esta forma se plantea un valor teórico con base en resultados obtenidos (2,69×1013UFC/ml).
Se realizó una fermentación por triplicado en las condiciones determinadas por la herramienta y se obtuvo un rendimiento promedio de 1,06×1010UFC/ml. Los resultados obtenidos evidenciaron que las condiciones ideales para obtener concentraciones iguales o superiores a la mencionada (1×1010UFC/ml) fueron las siguientes: agitación, 500rpm; aireación, 3,5 litros por minuto (l.p.m.), equivalentes a 1 volumen de aire por volumen de medio por minuto (v.v.m.), pH no controlado, tiempo de fermentación 24h y temperatura 30°C.
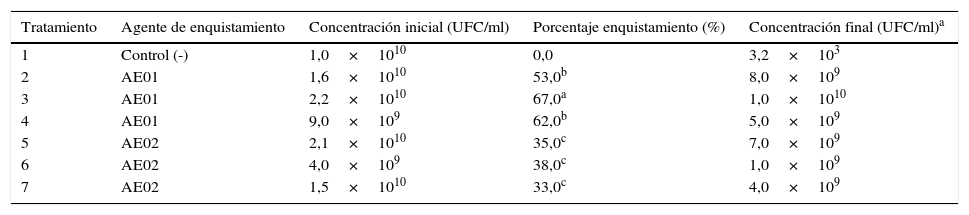
Enquistamiento de la cepa AC1La adición de los inductores de enquistamiento evaluados, AE01 y AE02, demostró la capacidad de la cepa AC1 para formar quistes en condiciones de estrés. En la tabla 3 se pueden observar los distintos porcentajes de enquistamiento obtenidos. Ambos inductores fueron capaces de disparar el proceso de enquistamiento de las células de AC1 en condiciones de fermentación sumergida en medio MBR.
Porcentajes de enquistamiento
| Tratamiento | Agente de enquistamiento | Concentración inicial (UFC/ml) | Porcentaje enquistamiento (%) | Concentración final (UFC/ml)a |
|---|---|---|---|---|
| 1 | Control (-) | 1,0×1010 | 0,0 | 3,2×103 |
| 2 | AE01 | 1,6×1010 | 53,0b | 8,0×109 |
| 3 | AE01 | 2,2×1010 | 67,0a | 1,0×1010 |
| 4 | AE01 | 9,0×109 | 62,0b | 5,0×109 |
| 5 | AE02 | 2,1×1010 | 35,0c | 7,0×109 |
| 6 | AE02 | 4,0×109 | 38,0c | 1,0×109 |
| 7 | AE02 | 1,5×1010 | 33,0c | 4,0×109 |
AE: agente de enquistamiento.
Representa la media de 3 repeticiones. abc Las letras diferentes representan diferencias significativas con p = 0,05. La concentración inicial hace referencia al tiempo inicial de muestreo y la concentración final al último muestreo después de 105 días. Letras minúsculas indican diferencias significativas (p<0,05).
El tratamiento que presentó el mayor porcentaje de enquistamiento fue el número 3, con un 67% de células enquistadas. Este tratamiento correspondió al agente AE01 adicionado en una concentración del 0,7%. También se puede observar que el agente AE02 (tabla 3, tratamientos 5 al 7) fue capaz de inducir la formación de quistes de las células vegetativas de la cepa AC1; sin embargo, los porcentajes de enquistamiento obtenidos corresponden a la mitad de los obtenidos por el agente AE01. Con este agente solamente fueron capaces de formar quistes alrededor de un 35,3% de las células presentes.
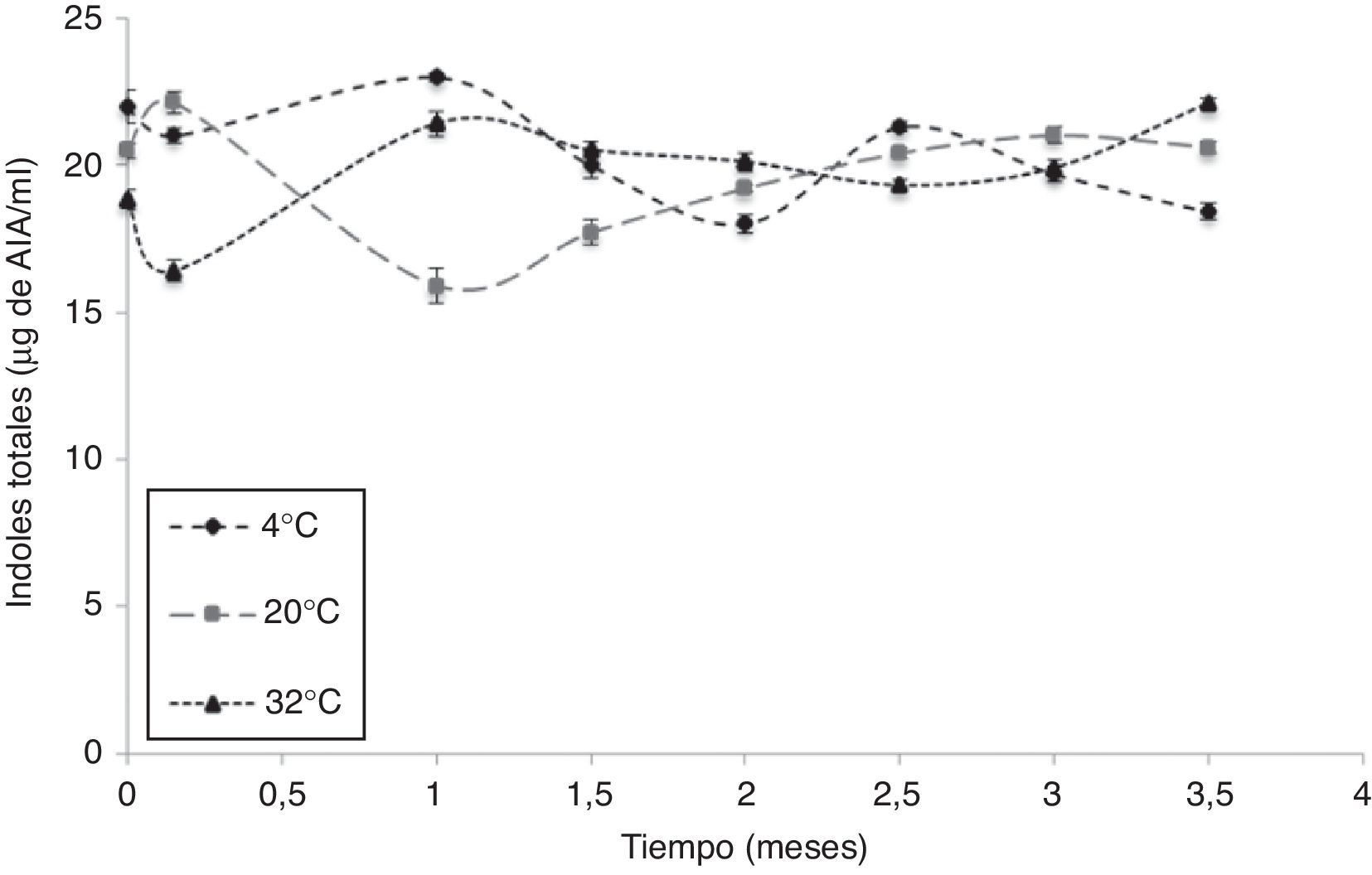
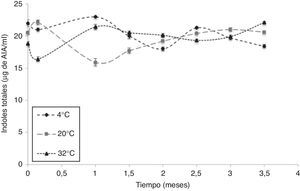
Evaluación de actividad biológicaUna vez optimizados todos los parámetros para la fermentación de AC1 en el medio de cultivo MBR, se evaluaron la viabilidad y la actividad biológica de la biomasa de dicha cepa obtenida como producto de la fermentación. Los resultados demostraron que la concentración celular después de 24 h de fermentación estuvo en el rango de 1×1010UFC/ml y no se evidenció presencia de microorganismos contaminantes de ningún tipo. Además, la actividad biológica no se vio disminuida por las condiciones de crecimiento y enquistamiento suministradas (fig. 2).
La síntesis de indoles se presentó en todos los tratamientos durante los 105 días de evaluación, en un rango que varió entre 16 y 23μg de ácido indolacético (AIA)/ml (fig. 2).
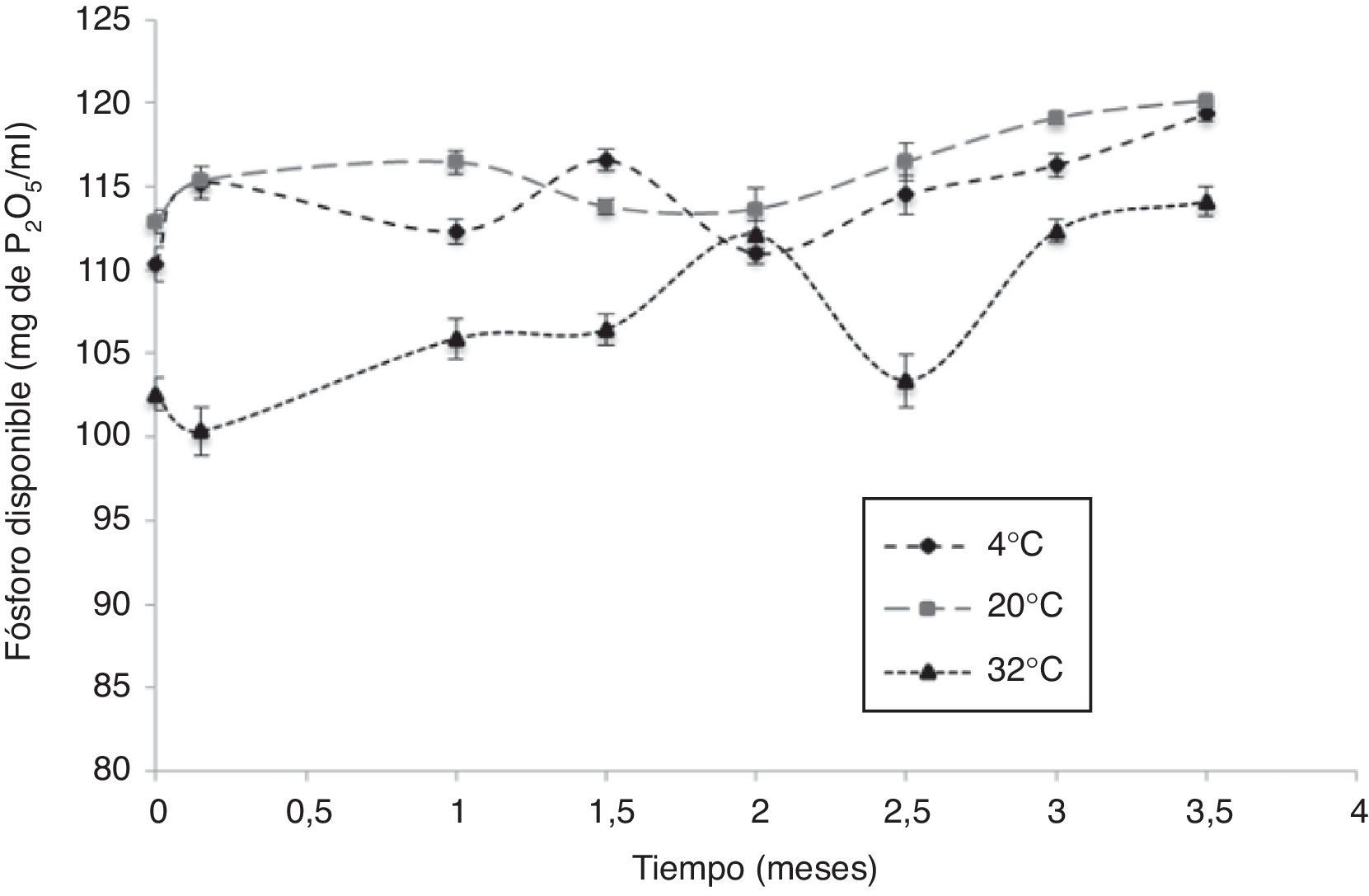
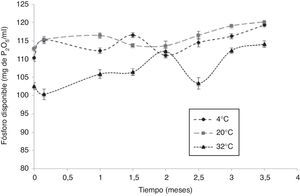
La cantidad de fósforo disponible producido por la cepa AC1 en estado de enquistamiento se muestra en la figura 3. El comportamiento general de esta actividad en todos los tratamientos fue en aumento a través del tiempo, obteniéndose un máximo de fósforo disponible de 120mg de P2O5/ml.
En cuanto a la fijación biológica de nitrógeno, al comparar el muestreo inicial con el muestreo final, después de 105 días de evaluación, no se presentaron diferencias significativas en los tratamientos evaluados. En promedio la actividad de la nitrogenasa registró un valor de 70 nmol C2H4/ml/h (datos no mostrados).
DiscusiónAl igual que lo hallado por otros autores, este estudio demostró que la aireación y la agitación son parámetros que influencian positivamente la producción de biomasa en sistemas de fermentación líquida en tanque agitado19,29. Condiciones de pH controlado en fermentaciones con similares características generan un detrimento en la producción de biomasa por parte del microorganismo7. Más aún, se demostró que al someter a A. chroococcum a rangos de pH más alcalinos (7,2-8,0) se favorece la multiplicación del microorganismo, mientras que a pH neutros (6,0-7,0) se limita su crecimiento. La observación de una interacción entre agitación y pH, y la combinación tripartita de los factores en evaluación, demostraron efectos negativos sobre el crecimiento de la cepa, debido principalmente a la interacción negativa que produce el pH controlado cerca de la neutralidad.
La aireación y la agitación fueron factores vitales para el desarrollo celular (fig. 1B), esto se debe a las necesidades metabólicas de A. chroococcum, el cual requiere una gran cantidad de oxígeno para su óptimo crecimiento21.
La significativa y positiva correlación entre la aireación y la agitación (fig. 1B) está ligada directamente a la disponibilidad de aire y al tamaño de burbuja que se genera a consecuencia de la relación entre estos 2 factores, donde cuanto mayor es el flujo de aire, mayor debe ser la velocidad de agitación para permitir la dispersión del aire de entrada en burbujas más pequeñas que posibilitan una distribución más homogénea del oxígeno dentro del medio de cultivo. Este fenómeno beneficia directamente al microorganismo, ya que permite un aprovechamiento total de los nutrientes presentes y favorece el intercambio gaseoso.
La correlación positiva puede ser comparada con los resultados reportados por Peña et al.21, quienes informan que la aireación necesaria para asegurar el crecimiento de bacterias pertenecientes al género Azotobacter en sistemas de fermentación de tanque agitado es de 1 vvm. Los resultados mencionados pueden ser comparados con los obtenidos en este estudio, en donde se puede asegurar que 0,4 vvm de aireación son suficientes para obtener rendimientos iguales a 1×1010UFC/ml en 20h de fermentación.
Los lípidos poli-β-hidroxibutirato (PHB) y los alquil-resorcinoles son los principales productos metabólicos de los quistes en las especies del género Azotobacter. Los quistes se forman cuando las células vegetativas están en contacto con agentes de enquistamiento, como los aquí evaluados. Por lo general, estas formas de resistencia aparecen en la fase estacionaria de crecimiento cuando son adicionadas sustancias como las anteriormente nombradas1,16,17,32.
Lin y Sadoff16, quienes utilizaron sacarosa al 0,01% adicionada en la fase estacionaria de un cultivo de Azotobacter vinelandii, demostraron que después de la inducción del enquistamiento, se produce una rápida formación de gránulos de PHB, y posteriormente las células comienzan la síntesis de alquil-resorcinoles que sustituyen a los fosfolípidos en las membranas y son componentes de la exina. La exina es la capa externa que se encuentra sobre el quiste23. Este fenómeno posiblemente fue replicado en las condiciones establecidas en este experimento. Las células vegetativas no son capaces de sintetizar alquil-resorcinoles, razón por la cual no pueden producir formas enquistadas. Sin embargo, Lin y Sadoff16 determinaron que al quitar la glucosa o la sacarosa de la fase exponencial de los cultivos y sustituirlas por n-butanol o β-hidroxibutirato, se puede inducir el enquistamiento. Esto da lugar a la acumulación de PHB y la síntesis o alquil-resorcinoles. Los gránulos de PHB pueden ser utilizados como fuente de carbono y energía en virtud de la limitación de carbono, para que las células puedan formar los quistes16,28,32,33.
Los agentes de enquistamiento aquí evaluados inducen la formación de polimorfos de la cepa AC1. García-Esquivel et al.13 reportaron que las poblaciones que crecieron sin la influencia de los agentes de enquistamiento presentaron una morfología típica de la especie: células ovoides (1μm de diámetro) de forma bacilar (1μm de ancho×4,5μm de largo), sin gránulos de PHB, con reacción negativa a la coloración de Gram14. Estas características coinciden con la morfología de la cepa AC1, objeto de este estudio. Con la adición de sacarosa como inductor de enquistamiento, García-Esquivel et al.13 obtuvieron un 64,7% de quistes maduros resistentes a la desecación; estos resultados son comparables con los obtenidos en este estudio, en donde el mayor porcentaje de enquistamiento fue obtenido por el inductor AE01, el cual condujo a un 67% de quistes maduros resistentes al fenómeno de la desecación.
Esta proporción de quistes maduros es similar a la obtenida por Reusch y Sadoff23, quienes también adicionaron inductores para generar el «shifting» metabólico en las células vegetativas de Azotobacter spp. Varias investigaciones han establecido que sustancias como los alcoholes pueden inducir procesos de enquistamiento en varias especies del género Azotobacter, debido a que los alcoholes son intermediarios en el catabolismo de hidrocarburos26,30. Las características de las células vegetativas y quísticas obtenidas en este estudio corresponden a lo enunciado por otros autores que indujeron el enquistamiento de células de Azotobacter spp.25,26.
Los quistes maduros se componen de un cuerpo central, que consiste en el protoplasma, una membrana celular, una pared celular delgada y el centro de los gránulos de PHB, rodeado por una capa con la típica estructura capsular que poseen las células quísticas del género Azotobacter28.
Los resultados de este trabajo demostraron que A. chroococcum es capaz de ser enquistado en el medio de cultivo MBR en condiciones de biorreactor. Después de 105 días de evaluación se demostró que la cepa AC1 es capaz de mantener su viabilidad y actividad biológica, sin importar la temperatura de almacenamiento. En nuestro conocimiento, este es el primer trabajo en demostrar el enquistamiento de A. chroococcum en condiciones óptimas de fermentación obtenidas mediante modelos factoriales en biorreactor.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores del manuscrito «Desarrollo de un sistema de fermentación líquida y de enquistamiento para una bacteria fijadora de nitrógeno con potencial como biofertilizante» declaramos que no poseemos conflicto de intereses con la sumisión de esta investigación en la Revista Argentina de Microbiología.
Los autores agradecen al Ministerio de Agricultura y Desarrollo Rural por el financiamiento de esta investigación. Además, expresan sus agradecimientos a los técnicos del Laboratorio de Microbiología de Suelos Inés Roldan y Mauricio Barón por su apoyo a esta investigación.