El síndrome de ovario poliquístico (SOP) es una endocrinopatía que afecta a mujeres en edad reproductiva, frecuentemente asociado a insulinorresistencia (IR) y riesgo cardiovascular (RCV). El criterio de Rotterdam distingue 4 fenotipos: 3 presentan hiperandrogenismo clínico y/o bioquímico (HA) y uno es normo-androgénico (NHA). Por ser un síndrome heterogéneo, es necesario identificar a las pacientes con mayor RCV. Dos nuevos marcadores han sido propuestos para evaluarlo: el índice de adiposidad abdominal (VAI) y el producto de acumulación lipídica (LAP).
ObjetivoEvaluar los marcadores LAP y VAI como predictores de IR y su correlación con los parámetros de RCV en relación con los fenotipos SOP.
MetodologíaSe estudió a 130 pacientes con SOP entre 18 y 36 años, clasificadas en 2 grupos: HA y NHA según la presencia de hiperandrogenismo clínico y/o bioquímico. Se evaluaron parámetros de RCV según ATP III: circunferencia de cintura (CC), glucemia, HDL, triglicéridos (TG) y presión arterial. Se calcularon: LAP=(CC [cm] – 58) * TG (mmol/l) y VAI=(CC [cm]/[36,58+(1,89 * IMC [kg/m2]] * [TG [mg/dl]/0,81] * [1,52/HDL-c [mg/dl]]). Se realizaron curvas ROC/área bajo la curva para establecer valores de corte de LAP y VAI para la identificación de IR, análisis de correlación con parámetros de RCV y de las diferencias entre fenotipos, tomando como significativo p<0,05.
ResultadosLos valores de corte establecidos para definir IR fueron de 14,02 para LAP (especificidad: 93,22%; sensibilidad: 93,94%) y de 2,17 para VAI (especificidad: 91,38%; sensibilidad: 87,88). Dichos marcadores correlacionaron con marcadores de IR (HOMA-IR, QUICKI e índice glucosa/insulina) y presentaron una correlación positiva con TG, CC y negativa con HDL. El análisis entre fenotipos no reveló diferencias en la presencia de SM, IR o factores de RCV.
ConclusiónLAP y VAI serían buenos predictores de IR y RCV asociado en pacientes jóvenes con SOP. El análisis de los parámetros entre fenotipos HA y NHA indica que ambos presentan similar riesgo metabólico y de desarrollar enfermedad cardiovascular.
Polycystic ovary syndrome (PCOS) is the most common endocrine disorder affecting women of reproductive age. It is associated with insulin resistance (IR) and high cardiovascular risk (CVR). According to the Rotterdam consensus, four PCOS phenotypes could be established: three with clinical and/or biochemical hyperandrogenism (HA), and one non-hyperandrogenic (NHA). It is necessary to identify which of these patients are at risk of metabolic disturbances and CVR. Two indexes: lipid accumulation product (LAP) and visceral adiposity index (VAI) have been suggested as reliable markers of IR and CVR in PCOS.
ObjectiveThe present study aims to assess the reliability of LAP and VAI as IR markers in a young local population of PCOS patients. Their association with CVR parameters is also evaluated.
MethodologyLAP and VAI were calculated in 130 PCOS patients. The PCOS patients were divided in two groups as HA and NHA, taking into account the signs of hyperandrogenism (clinical or biochemical). An evaluation was also made of the metabolic and anthropometric characteristics of the population and their association with CVR and IR.
ResultsBoth LAP and VAI showed to be effective markers to asses CVR and IR in these PCOS women (cutoff values: LAP: 14.02 (sensitivity: 93.94% specificity: 93.22%) VAI: 2.17 (sensitivity: 87.88% specificity: 91.38%). There was a positive correlation of both markers with abdominal circumference and triglycerides (TG), and negative with HDL-cholesterol. The risk of IR and metabolic disturbances was similar in both phenotypes (NHA versus HA).
ConclusionOur data show that both LAP and VAI are representative markers for assessing IR and associated CVR in PCOS patients. These results also suggest that the NHA phenotype in the population studied shows the same risk of metabolic disturbances and cardiovascular disease when compared to HA phenotypes.
El síndrome de ovario poliquístico (SOP) es la endocrinopatía más frecuente en la mujer en edad reproductiva, de etiología incierta y presentación clínica heterogénea1. El SOP es una de las principales causas de infertilidad ovárica femenina y asimismo se encuentra asociado a distintos desórdenes metabólicos como el síndrome metabólico (SM), obesidad, dislipidemia, insulinorresistencia (IR) y riesgo cardiovascular (RCV) aumentado2-5. Por lo tanto, las pacientes con SOP tienen mayor riesgo de desarrollar diabetes tipo 2 y enfermedades cardiovasculares (ECV), entre otras patologías endócrino-metabólicas6.
Debido a su heterogeneidad fenotípica, el diagnóstico de SOP es complejo. Según el consenso de Rotterdam1 (2003), el SOP puede ser diagnosticado en pacientes que presentan al menos 2 de los siguientes criterios: hiperandrogenismo clínico o bioquímico, oligo o amenorrea (OA) y morfología de ovarios poliquísticos (MOP), dando origen a 4 fenotipos. Fenotipo A: OA, hiperandrogenismo y MOP; fenotipo B: OA e hiperandrogenismo; fenotipo C: hiperandrogenismo y MOP, y fenotipo D: OA y MOP. Este último fenotipo es normo-androgénico (fenotipo no hiperandrogénico o NHA) y no ha sido considerado en los otros 2 consensos descriptos para el diagnóstico de SOP (NIH 1990 y AES 2006)7. Aun es controvertido si dicho fenotipo presenta la misma etiopatogenia que los otros fenotipos y, por lo tanto, si debería formar parte del SOP8,9.
Debido a su alta incidencia en la población femenina y su asociación con desórdenes metabólicos, el SOP es de gran interés en la clínica. En Latinoamérica, la ECV es una de las principales causas de muerte10,11. En nuestro país, la Organización Mundial de la Salud ha relevado que la ECV representa un 35% de las causas de muerte, siendo la principal causa al compararse con muertes por cáncer, enfermedades respiratorias e infecciosas, entre otras (informe Ministerio de Salud de la Nación, Instituto Nacional de Estadísticas y Censos, 2015)12. Debido a que el SOP se encuentra asociado a factores de RCV y, dado que la heterogeneidad del síndrome representa un motivo de controversia a la hora de establecer si todas las pacientes presentan igual riesgo, es de particular interés detectar qué fenotipos se encuentran más afectados.
Actualmente, se reconoce la IR como un factor independiente de riesgo para desarrollar ECV. Por lo tanto, investigar su presencia en una población de mujeres que habitualmente consulta a edades tempranas puede facilitar la aplicación de terapias preventivas que disminuyan en el futuro el desarrollo de patologías cardiovasculares13.
El método de mayor exactitud para evaluar IR es el clamp euglucémico-hiperinsulinémico desarrollado por DeFronzo et al. en 197914, pero no se lo utiliza en la práctica clínica cotidiana por su elevado costo y lo engorroso de su realización. Recientemente, han surgido índices alternativos para identificar IR como herramientas de gran interés, eficientes y de bajo costo para el sistema de salud. Entre ellas, el producto de acumulación lipídica, lipid accumulation product (LAP)15, y el índice de adiposidad visceral, visceral adiposity index (VAI)16,17, según sus siglas en inglés, surgieron como marcadores confiables de IR y RCV en la población general y también en distintas poblaciones de pacientes SOP, pese a que los valores de corte dependían de la población evaluada13,18-25. Tanto LAP como VAI son modelos matemáticos que involucran parámetros antropométricos y metabólicos: circunferencia de cintura (CC) y triglicéridos (TG) en el caso de LAP e índice de masa corporal (IMC), CC, TG y HDL en el caso de VAI, resultando en marcadores sensibles de la cantidad de grasa visceral y del estado de la función adipocitaria15-18. La grasa de distribución central se encuentra ligada a IR, como también a otras anormalidades metabólicas, desempeñando un papel importante en la modulación del RCV. Las pacientes con SOP suelen presentar patrones de distribución de grasa alterados, siendo prevalente la grasa de distribución central con un patrón androgénico18, por lo que el uso de marcadores que contemplen dichas perturbaciones del sistema adipocitario sería de gran interés.
El objetivo del presente estudio fue evaluar, en una población local de pacientes con SOP, los marcadores LAP y VAI como predictores de IR y correlacionarlos con los parámetros de RCV en relación con la presencia de fenotipos hiperandrogénicos.
Materiales y métodosPacientes y criterios diagnósticos de síndrome de ovario poliquísticoUn total de 130 pacientes con SOP entre 18 y 36 años de edad fueron atendidas en la División Endocrinología del Hospital Durand (Ciudad Autónoma de Buenos Aires) y de la División Ginecología del Hospital Posadas (El Palomar, provincia de Buenos Aires) y reclutadas para el estudio entre los años 2012 y 2014. El diagnóstico de SOP fue establecido sobre la base de los criterios de Rotterdam1, que incluyen al menos 2 de los siguientes componentes: a) hiperandrogenismo clínico o bioquímico; b) MOP en ecografía transvaginal: al menos un ovario con 12 o más folículos de 2-9mm y/o volumen ovárico mayor a 10cm3, y c) disfunción ovulatoria definida por la presencia de OA. Se excluyó a pacientes portadoras de enfermedades hipofisarias, adrenales y ováricas, incluyendo hiperplasia suprarrenal congénita, tumores productores de andrógenos y síndrome de Cushing, así como también pacientes con historia de diabetes gestacional, enfermedades hepáticas e hiperprolactinemia. Las pacientes con SOP no estaban recibiendo, al menos hasta 2 meses antes de la extracción de sangre, terapia hormonal, fármacos que modifiquen la insulina u otros tratamientos que pudieran afectar al metabolismo o el eje gonadal. El exceso de andrógenos fue determinado por la presencia de hiperandrogenemia, midiendo la testosterona total, DHEA-S y/o Δ4 androstenediona o por la evidencia de clínica de hiperandrogenismo, determinada por la presencia de hirsutismo de acuerdo con el puntaje de Ferriman-Gallway modificado (FGm) > 8 o por la presencia de acné y/o alopecia androgénica. Las pacientes fueron clasificadas en fenotipo hiperandrogénico (HA), si presentaban signos de hiperandrogenismo, o en caso contrario, en fenotipo NHA. Las pacientes firmaron un consentimiento informado escrito que fue conducido de acuerdo con la declaración de Helsinki y el estudio fue aprobado por el comité local de revisión.
Procedimiento analíticoSe determinaron las medidas antropométricas de las pacientes. El IMC y el índice FGm fueron establecidos. La CC fue medida como la menor circunferencia del tronco. Las muestras fueron tomadas en ayunas a las 8 de la mañana, en fase folicular temprana, días 1-5 del ciclo menstrual en pacientes eumenorreicas u oligomenorreicas o en cualquier momento en pacientes amenorreicas. Se determinaron glucosa, insulina, TG, CT, HDL, LDL, perfil androgénico (incluyendo testosterona total, Δ4 androstenediona, DHEA-S, 17-hidroxiprogesterona, globulina ligadora de hormonas sexuales para diferenciar pacientes con HA y con NHA. Las determinaciones de glucosa, TG, CT, HDL y LDL fueron realizadas en un autoanalizador Cobas 8000 (Roche) y la insulina se determinó por quimioluminiscencia (Liaison, Diasorin), con coeficientes de variación intra e interensayo del 4,3 y el 11,6%, respectivamente. El perfil androgénico se determinó por inmunoensayos comerciales: testosterona total por quimioluminiscencia en (Access 2, Beckman-Coulter), androstenediona y 17-hidroxiprogesterona por radioinmunoensayo (RIA-CT, DIA Source), DHEA-S por (DPC) Immulite 1000, Siemens. Los coeficientes de variación intra e interensayo fueron del 3,93 y el 7,08% para testosterona total, el 9,5 y el 15% para DHEAS, el 4,5 y el 9,0% para androstenediona, y el 8,8% y el 19.2% para 17 hidroxiprogesterona.
Parámetros de riesgo cardiovascular e insulino-resistenciaSe calcularon VAI=CC/36,58+(1,89×IMC)×TG/0,81×1,52/HDL16,17 y LAP=(CC [cm] – 58)×TG (nmol/l)15 como marcadores tanto de IR como de RCV. La IR fue estimada en forma indirecta utilizando valores de glucemia e insulinemia en ayuno para calcular el modelo homeostático de IR (HOMA-IR: glucemia [mg/dl]×insulinemia [μUI/ml]/450)26, el índice de insulinosensibilidad QUICKI (1/[log insulinemia basal IU/ml+log glucemia basal mg/dl])27 y el índice glucemia/insulinemia (GLC/INS)28. El índice HOMA-IR se utilizó como herramienta para evaluar el IR por su buena correlación con el clamp euglucémico29 y se utilizó para calcular el mejor valor de corte para VAI y LAP. Se estudió la asociación entre estos índices y los diferentes parámetros de RCV descriptos por el ATP III para la evaluación de la presencia de SM30: CC > 88cm, glucemia>110mg/dl, HDL < 50mg/dl, TG>150mg/dl, presión arterial sistólica/presión arterial diastólica>130/85mmHg30.
Análisis estadísticoLos datos se presentan como media±desviación estándar (DE) o mediana y rango intercuartílico, según sea distribución normal o asimétrica, respectivamente. Se realizaron análisis de correlación para evaluar los parámetros de RCV con los marcadores LAP y VAI. El test de la chi al cuadrado y el estadístico de Fisher se utilizaron para ver la asociación entre variables categóricas. Los test de t de Student y Mann-Whitney se realizaron para evaluar diferencias entre fenotipos SOP. En los casos en que las variables no cumplían con los criterios de normalidad y homocedasticidad, se aplicó la transformación logarítmica con el fin de aplicar el test t de Student. En los casos en que esta transformación no logró el cumplimiento de los supuestos para la aplicación de la estadística paramétrica, se aplicó un tratamiento no paramétrico de los datos. Las variables son presentadas como valores medidos, sin transformación. El análisis de regresión múltiple se utilizó para ajustar las variables por edad e IMC debido a que ambos son parámetros conocidos como factores contribuyentes a RCV. Para evaluar la habilidad de VAI y LAP para estimar la presencia de IR en nuestra población, se construyeron curvas ROC y se determinó el área bajo la curva (AUC). Para la construcción de las curvas se utilizó una población control normal (n=88) de entre 18 y 36 años que no presentara ningún criterio diagnóstico de SOP y ninguno de los criterios de exclusión previamente descriptos. Se usó como referencia un valor de HOMA>2,3 como corte para definir IR, que fue establecido en trabajos previos realizados con población argentina sana31. Se eligieron como valores de corte para LAP y VAI los que presentaban valores óptimos de sensibilidad y especificidad identificados como los que mantienen (1-sensibilidad)2+(1-especificidad)2 al mínimo32. Los análisis fueron realizados usando el programa SPSS versión 14.0 Chicago, IL, EE. UU. Las curvas ROC/AUC fueron construidas con el programa Instat (GraphPad software, San Diego, CA, EE. UU.). Se tomaron como diferencias significativas p<0,05.
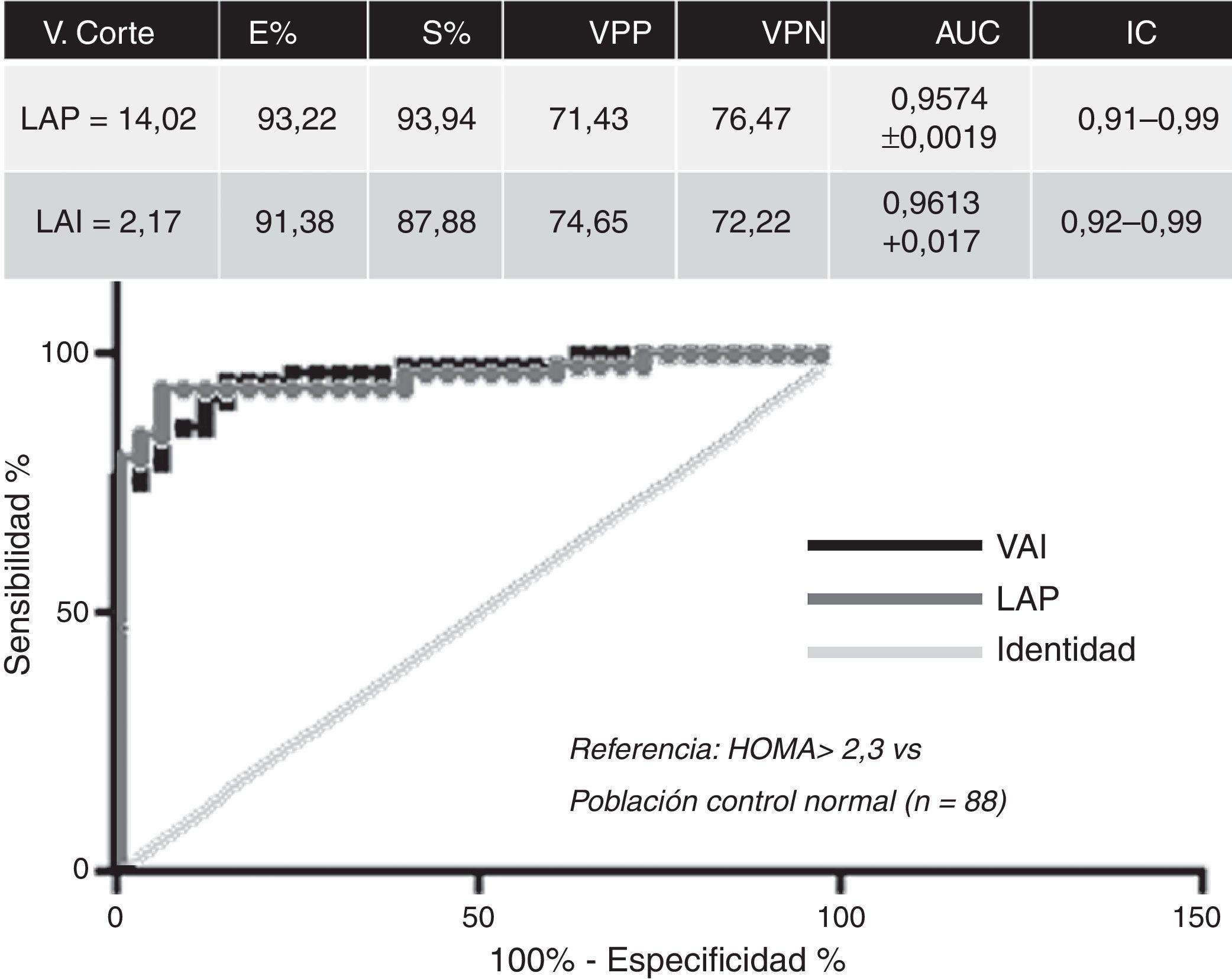
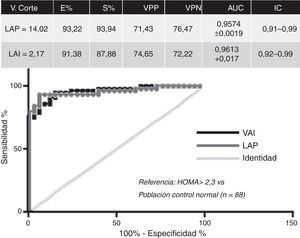
ResultadosLos valores de corte establecidos para definir IR en pacientes con SOP utilizando curvas ROC fueron de 14,02 para LAP (especificidad: 93,22%, sensibilidad: 93,94%, valor predictivo positivo 71,43%, valor predictivo negativo: 76,47%, AUC: 0,9574+0,0019, IC: 0,91-0,99) y de 2,17 para VAI (especificidad: 91,38%, sensibilidad: 87,88%, valor predictivo positivo: 74,65%, valor predictivo negativo 72,22%, AUC: 0,9613+0,017 IC: 0,92-0,99) (fig. 1).
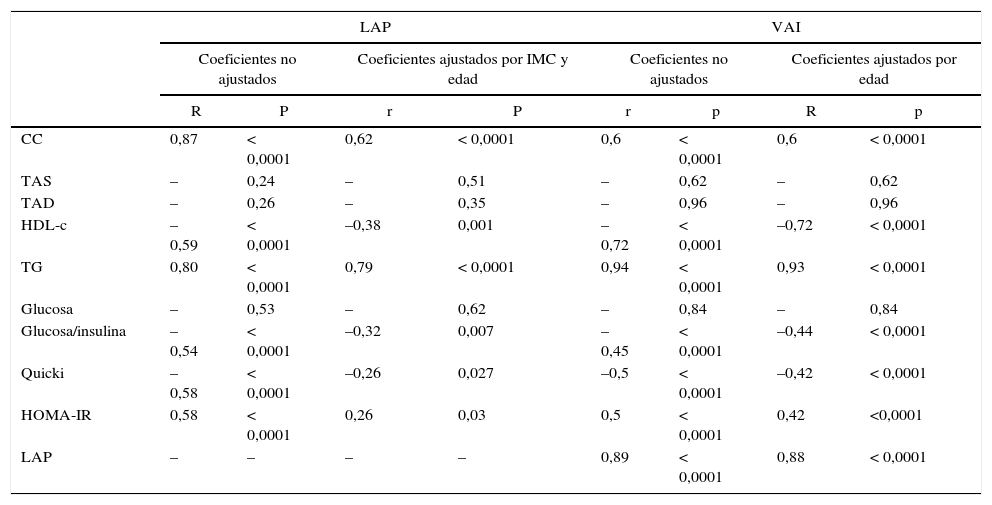
El análisis de correlación mostró que los marcadores propuestos correlacionan en forma positiva con el marcador de IR HOMA-IR (LAP: r=0,58; VAI: r=0,5) y en forma negativa con los marcadores de insulinosensibilidad: QUICKI (LAP: r=–0,58; VAI: r=–0,5) y GLU/INS (LAP: r=–0,54; VAI: r=–0,45), p<0,0001 (tabla 1).
Correlación entre LAP y VAI y marcadores de SM, IR y RCV
| LAP | VAI | |||||||
|---|---|---|---|---|---|---|---|---|
| Coeficientes no ajustados | Coeficientes ajustados por IMC y edad | Coeficientes no ajustados | Coeficientes ajustados por edad | |||||
| R | P | r | P | r | p | R | p | |
| CC | 0,87 | < 0,0001 | 0,62 | < 0,0001 | 0,6 | < 0,0001 | 0,6 | < 0,0001 |
| TAS | – | 0,24 | – | 0,51 | – | 0,62 | – | 0,62 |
| TAD | – | 0,26 | – | 0,35 | – | 0,96 | – | 0,96 |
| HDL-c | –0,59 | < 0,0001 | –0,38 | 0,001 | –0,72 | < 0,0001 | –0,72 | < 0,0001 |
| TG | 0,80 | < 0,0001 | 0,79 | < 0,0001 | 0,94 | < 0,0001 | 0,93 | < 0,0001 |
| Glucosa | – | 0,53 | – | 0,62 | – | 0,84 | – | 0,84 |
| Glucosa/insulina | –0,54 | < 0,0001 | –0,32 | 0,007 | –0,45 | < 0,0001 | –0,44 | < 0,0001 |
| Quicki | –0,58 | < 0,0001 | –0,26 | 0,027 | –0,5 | < 0,0001 | –0,42 | < 0,0001 |
| HOMA-IR | 0,58 | < 0,0001 | 0,26 | 0,03 | 0,5 | < 0,0001 | 0,42 | <0,0001 |
| LAP | – | – | – | – | 0,89 | < 0,0001 | 0,88 | < 0,0001 |
LAP y VAI como marcadores asociados a riesgo cardiovascular e índices de homeostasis de glucosa e insulina. Coeficiente de correlación de Spearman (r) y p valor para modelos ajustados y no ajustados.
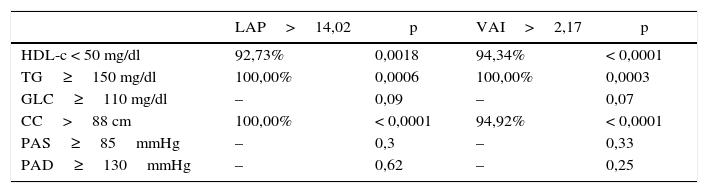
En cuanto a la correlación de VAI y LAP con los marcadores de RCV propuestos por el ATP III para evaluación del SM, fue positiva con TG y CC y negativa con HDL, p<0,05 (tabla 1). El test de la chi al cuadrado reveló una asociación significativa entre la presencia de valores de LAP y VAI por encima de los valores de corte establecidos y la presencia de cada uno de los parámetros de RCV propuestos por el ATP III (tabla 2).
Análisis de la chi al cuadrado, medido por estadístico de Fisher, entre la presencia de valores de LAP y VAI por encima de los valores de corte establecidos y la presencia de cada uno de los parámetros de RCV propuestos por ATP III
| LAP>14,02 | p | VAI>2,17 | p | |
|---|---|---|---|---|
| HDL-c < 50 mg/dl | 92,73% | 0,0018 | 94,34% | < 0,0001 |
| TG≥150 mg/dl | 100,00% | 0,0006 | 100,00% | 0,0003 |
| GLC≥110 mg/dl | – | 0,09 | – | 0,07 |
| CC>88 cm | 100,00% | < 0,0001 | 94,92% | < 0,0001 |
| PAS≥85mmHg | – | 0,3 | – | 0,33 |
| PAD≥130mmHg | – | 0,62 | – | 0,25 |
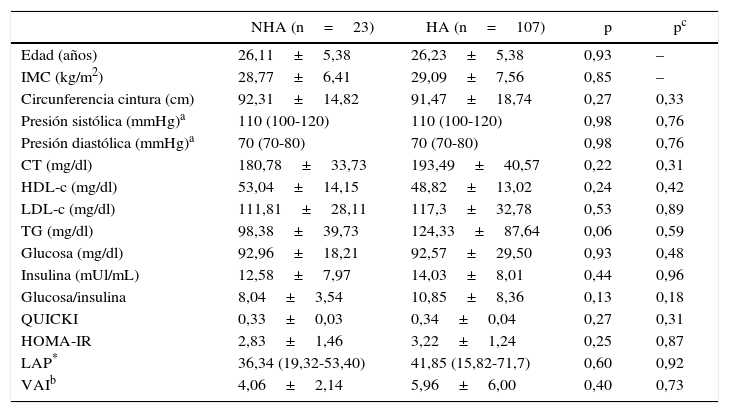
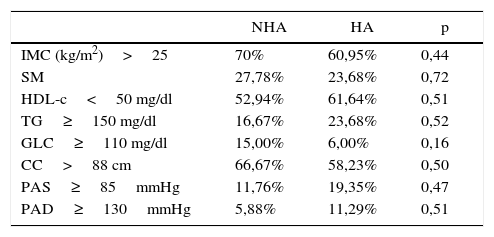
El análisis entre fenotipos HA y NHA no reveló diferencias significativas para la presencia de cada uno de los componentes del SM, IR o factores de RCV entre los mismos (tablas 3 y 4), incluso luego de ajustar por edad e IMC mediante análisis de regresión lineal múltiple.
Características clínicas y bioquímicas de las pacientes SOP analizadas según su fenotipo NHA o HA
| NHA (n=23) | HA (n=107) | p | pc | |
|---|---|---|---|---|
| Edad (años) | 26,11±5,38 | 26,23±5,38 | 0,93 | – |
| IMC (kg/m2) | 28,77±6,41 | 29,09±7,56 | 0,85 | – |
| Circunferencia cintura (cm) | 92,31±14,82 | 91,47±18,74 | 0,27 | 0,33 |
| Presión sistólica (mmHg)a | 110 (100-120) | 110 (100-120) | 0,98 | 0,76 |
| Presión diastólica (mmHg)a | 70 (70-80) | 70 (70-80) | 0,98 | 0,76 |
| CT (mg/dl) | 180,78±33,73 | 193,49±40,57 | 0,22 | 0,31 |
| HDL-c (mg/dl) | 53,04±14,15 | 48,82±13,02 | 0,24 | 0,42 |
| LDL-c (mg/dl) | 111,81±28,11 | 117,3±32,78 | 0,53 | 0,89 |
| TG (mg/dl) | 98,38±39,73 | 124,33±87,64 | 0,06 | 0,59 |
| Glucosa (mg/dl) | 92,96±18,21 | 92,57±29,50 | 0,93 | 0,48 |
| Insulina (mUl/mL) | 12,58±7,97 | 14,03±8,01 | 0,44 | 0,96 |
| Glucosa/insulina | 8,04±3,54 | 10,85±8,36 | 0,13 | 0,18 |
| QUICKI | 0,33±0,03 | 0,34±0,04 | 0,27 | 0,31 |
| HOMA-IR | 2,83±1,46 | 3,22±1,24 | 0,25 | 0,87 |
| LAP* | 36,34 (19,32-53,40) | 41,85 (15,82-71,7) | 0,60 | 0,92 |
| VAIb | 4,06±2,14 | 5,96±6,00 | 0,40 | 0,73 |
Los valores están expresados como media+DE (test t de Student).
Análisis de la chi al cuadrado. IMC, porcentaje de síndrome metabólico y presencia de factores contribuyentes a RCV según ATP III en los fenotipos SOP (NHA vs. HA)
| NHA | HA | p | |
|---|---|---|---|
| IMC (kg/m2)>25 | 70% | 60,95% | 0,44 |
| SM | 27,78% | 23,68% | 0,72 |
| HDL-c<50 mg/dl | 52,94% | 61,64% | 0,51 |
| TG≥150 mg/dl | 16,67% | 23,68% | 0,52 |
| GLC≥110 mg/dl | 15,00% | 6,00% | 0,16 |
| CC>88 cm | 66,67% | 58,23% | 0,50 |
| PAS≥85mmHg | 11,76% | 19,35% | 0,47 |
| PAD≥130mmHg | 5,88% | 11,29% | 0,51 |
Análisis de la chi al cuadrado. Valores expresados en porcentajes referidos a cada fenotipo.
El SOP es una patología que afecta a la salud de la mujer, tanto desde el punto de vista reproductivo como metabólico. Debido al carácter multifactorial de su patogenia33,34, es importante considerar en la clínica el agregado familiar, tanto de antecedentes de esta como de otras patologías asociadas. Asimismo, varios estudios han demostrado que las condiciones ambientales durante el desarrollo embrionario, tanto como el estilo de vida postnatal, sobre todo aquel de los primeros años de vida, predisponen al desarrollo de fenotipos SOP35,36. Debido a todo lo mencionado, es dificultoso el estudio del SOP y las comorbilidades asociadas, por lo que son necesarios estudios locales que permitan conocer la epidemiología y el estado actual particular de SOP en las poblaciones locales.
En Latinoamérica, y principalmente en Sudamérica, los principales factores contribuyentes a la ECV son: bajo HDL, presión arterial elevada y obesidad10,11. Estos factores están presentes frecuentemente en mujeres con SOP37-39. Existe evidencia de que las pacientes con SOP jóvenes presentan aterosclerosis38 y que la ECV se incrementa con la edad, independientemente de la presencia de otras patologías40. En nuestro estudio, nos concentramos en mujeres en periodo reproductivo temprano (18 y 36 años) para poder identificar a mujeres jóvenes con SOP que presentan alto riesgo metabólico y CV. Nuestros resultados muestran que, independientemente del estado androgénico, las pacientes SOP locales presentan un alto porcentaje de sobrepeso y obesidad como así también de bajos niveles de HDL, junto con otras alteraciones predisponentes a ECV según el panel ATP III.
Existen pocos trabajos sobre desórdenes metabólicos en pacientes SOP latinoamericanas, siendo la mayoría realizados en pacientes caucásicas europeas o estadounidenses. Debido a que el origen étnico ha sido considerado como un factor contribuyente tanto para SOP como para RCV11,41, hay que tener especial cuidado al comparar los resultados de poblaciones caucásicas con las locales. Asimismo, entre poblaciones latinoamericanas se presenta una gran diversidad en sus composiciones étnicas. Un estudio reciente que compara una población de mujeres con SOP de Argentina con una de Chile muestra que las alteraciones metabólicas son diferentes entre ambas, siendo más frecuentes los trastornos asociados a presión arterial en las pacientes argentinas respecto de las chilenas. Por otro lado, las pacientes chilenas presentaron mayor prevalencia de alteraciones metabólicas, dislipidemia y SM. Esto pone de relevancia la influencia de la constitución étnica pero también del estilo de vida incluyendo la situación económica y el estatus nutricional de las diferentes poblaciones42. De esta forma, al estudiar la predisposición a ECV se deben tener en cuenta las problemáticas y factores de riesgo locales.
En nuestra población de pacientes con SOP, el fenotipo NHA presentó, aun en el análisis ajustado por edad e IMC, el mismo riesgo metabólico que el fenotipo HA. Estos datos revelan la importancia de utilizar los criterios de Rotterdam para el diagnóstico de SOP porque los mismos incluyen a este fenotipo. Como las mujeres NHA presentan el mismo RCV y los mismos desórdenes metabólicos que el fenotipo HA, la aplicación de otros criterios diagnósticos, como NIH (1990) y AES (2006)7-9, hubiera dejado de lado a estas pacientes para la prevención de RCV, como refirieran Amato et al.43. Si bien una limitación de nuestro estudio es la falta de comparación con una población control, estos datos están en concordancia con lo que fue descripto para otra población argentina de la provincia de Córdoba donde el fenotipo NHA mostró una prevalencia de SM similar a los fenotipos HA42; sin embargo, se están llevando a cabo más estudios. Estos resultados, en conjunto, resaltan la importancia de que el SOP debe ser considerado más allá de una condición hiperandrogénica e involucra a varios desórdenes metabólicos34.
En este trabajo reportamos que tanto LAP como VAI serían buenos marcadores de RCV e IR en una población SOP de etnicidad mixta. Es interesante mencionar que las diferencias entre los valores de cortes comparado con otros estudios13,19,21,23 pueden deberse no solo a la diversidad étnica presente en nuestra población de estudio, sino también a la edad de las mujeres consideradas, ya que otros estudios contemplan una rango más amplio (hasta 45 años, lo que incluye mujeres en etapa perimenopáusica)13,19,21,23.
En conclusión, nuestros datos muestran que en la población SOP joven, en edad reproductiva temprana, tanto VAI como LAP, son buenos marcadores que permiten evaluar IR y RCV asociado. El análisis de los parámetros metabólicos entre los fenotipos SOP (HA y NHA) indica que en nuestra población el RCV se presenta de forma independiente de la condición androgénica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaJuan Manuel Gamez y Giselle Abruzzese contribuyeron de igual manera al desarrollo del trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.