Los niños con restricción del crecimiento intrauterino (RCIU) presentan en la vida posnatal una serie de alteraciones metabólicas y hormonales, y tienen predisposición al desarrollo de obesidad, hipertensión arterial, enfermedad cardiovascular, resistencia a la insulina y diabetes tipo2. La exposición a un ambiente intrauterino desfavorable en fases críticas del desarrollo puede tener un efecto deletéreo sobre la gónada en formación.
Se realizó una revisión bibliográfica y puesta al día sobre la posible asociación entre RCIU y alteraciones de la función gonadal en niños y adolescentes de ambos sexos. Para facilitar la actualización, se dividió por etapas en: 1, prenatal; 2, posnatal y prepuberal; 3, puberal, y 4, adulta.
La mayoría de los niños que nacen muy prematuros o con muy bajo peso al nacer hacen una transición sin obstáculos desde la infancia a la edad adulta con respecto a la salud reproductiva. Sin embargo, en los varones se puede observar criptorquidia, hipospadias, cáncer testicular y menor fertilidad, y en las niñas, pubertad y menarca temprana, hiperandrogenismo y síndrome de ovario poliquístico. Existen datos controvertidos y se necesitan más estudios para aclarar la relación entre el RCIU y la función hipotálamo-hipófiso-gonadal.
Low birth weight due to intrauterine growth restriction (IUGR) is associated with an increased risk of obesity, hypertension, cardiovascular disease, insulin resistance, and type2 diabetes during postnatal life. Exposure to an unfavourable intrauterine environment in critical phases of development may have a deleterious effect on the forming gonad.
The objective was to carry out a bibliographic review and update on the possible association between IUGR and alterations of gonadal function in children and adolescents of both sexes. To facilitate the update, this was divided into stages: 1, prenatal; 2, postnatal and pre-pubertal; 3, puberal, and 4, adult.
Most children born preterm or with low birth weight make a normal transition from childhood to adulthood with respect to reproductive health. However, cryptorchidism, hypospadias, testicular cancer and lower fertility could be observed in boys, and early puberty and menarche, hyperandrogenism and polycystic ovarian syndrome in girls. However, the data are controversial, and further studies are needed to clarify the relationship between IUGR and pituitary gonadal function.
Se define a un niño con restricción del crecimiento intrauterino (RCIU), o pequeño para la edad gestacional, como aquel que nace con un peso y/o una longitud corporal igual o menor a 2 desvíos estándar (DE) por debajo de la media, de acuerdo a la edad gestacional. Algunos autores definen RCIU como aquellos niños que nacen con un peso menor al percentil 10 corregido para la edad gestacional o con menos de 2.500g para los nacidos a término. Otros sugieren restringir el uso del término RCIU, aplicándolo solamente si en el curso de la gestación se ha verificado un retardo de crecimiento de los distintos parámetros utilizados por medio de un seguimiento ecográfico longitudinal1,2. En esta revisión los términos se aceptan como similares.
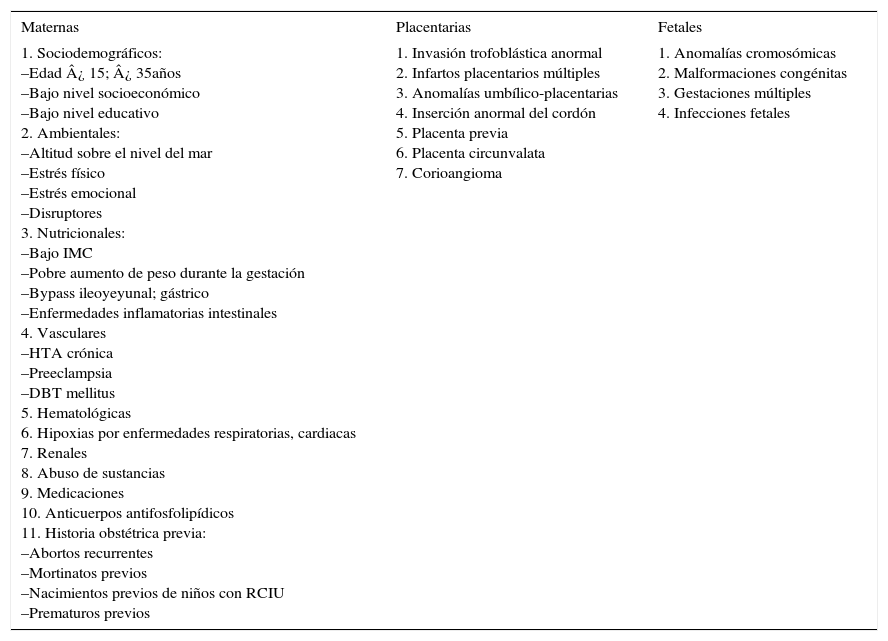
La RCIU se debe a múltiples etiologías, desde anomalías cromosómicas a alteraciones causadas por factores maternos, placentarios, ambientales o genéticos, por lo que este grupo de pacientes es muy heterogéneo, siendo una de las causas más frecuentes de patología del crecimiento posnatal3 (tabla 1).
Causas de restricción del crecimiento intrauterino (RCIU)
| Maternas | Placentarias | Fetales |
|---|---|---|
| 1. Sociodemográficos: –Edad ¿ 15; ¿ 35años –Bajo nivel socioeconómico –Bajo nivel educativo 2. Ambientales: –Altitud sobre el nivel del mar –Estrés físico –Estrés emocional –Disruptores 3. Nutricionales: –Bajo IMC –Pobre aumento de peso durante la gestación –Bypass ileoyeyunal; gástrico –Enfermedades inflamatorias intestinales 4. Vasculares –HTA crónica –Preeclampsia –DBT mellitus 5. Hematológicas 6. Hipoxias por enfermedades respiratorias, cardiacas 7. Renales 8. Abuso de sustancias 9. Medicaciones 10. Anticuerpos antifosfolipídicos 11. Historia obstétrica previa: –Abortos recurrentes –Mortinatos previos –Nacimientos previos de niños con RCIU –Prematuros previos | 1. Invasión trofoblástica anormal 2. Infartos placentarios múltiples 3. Anomalías umbílico-placentarias 4. Inserción anormal del cordón 5. Placenta previa 6. Placenta circunvalata 7. Corioangioma | 1. Anomalías cromosómicas 2. Malformaciones congénitas 3. Gestaciones múltiples 4. Infecciones fetales |
La incidencia global de esta patología, según la OMS, es del 17%4, y según la UNICEF, del 14%5 de todos los nacimientos, siendo mayor en los países en desarrollo; en la Argentina está alrededor del 9%6.
Aproximadamente el 87% de los niños nacidos con RCIU recuperan su peso/estatura antes de los dos años de edad, y un menor porcentaje lo hace hasta los 5años. Alrededor del 13% no desarrollan este crecimiento compensador7 y un 7% quedan con una estatura adulta definitiva por debajo de 2DE de la media poblacional. Entre un 20 y un 25% de las personas adultas con talla menor a 2DE nacieron con RCIU8.
Los niños con este antecedente presentan en la vida posnatal una serie de alteraciones metabólicas y hormonales, teniendo predisposición al desarrollo de obesidad, hipertensión arterial, enfermedad cardiovascular, resistencia a la insulina y diabetes tipo2. La programación de los ejes endocrinos tiene lugar durante fases críticas del desarrollo fetal, por lo que puede ser afectado por la RCIU. El efecto deletéreo sobre la gónada en formación puede producir criptorquidia, hipospadias, cáncer testicular y menor fertilidad en los varones e hiperandrogenismo y síndrome de ovario poliquístico en las niñas. Aunque la mayoría de los individuos que nacen muy prematuros o con muy bajo peso hacen una transición sin obstáculos desde la infancia a la edad adulta con respecto a la salud reproductiva9, se observa en ambos sexos que la prematuridad y la RCIU pueden afectar la probabilidad de reproducción.
Se sugiere que en la malnutrición generalizada del feto hay un desarrollo anormal de los órganos abdominales causado, al menos en parte, por un mayor flujo sanguíneo preferencial hacia el cerebro y el corazón, deprivando a otros órganos como el hígado, el páncreas y el riñón, resultando así en un pobre desarrollo de ellos10. Anatómicamente las gónadas se originan cercanas al riñón y su desarrollo, por lo tanto, puede ser afectado negativamente por la RCIU. Hay poca evidencia bibliográfica sobre RCIU y afectación de la función reproductiva en el sexo masculino, y algunos autores sugieren falla testicular primaria11. Con respecto al sexo femenino, hay publicaciones que refieren menor volumen ovárico, mayor número de ciclos anovulatorios y niveles hormonales disminuidos con menor reserva folicular12, mientras otros concluyen que esta última no está comprometida13.
ObjetivoRealizar una revisión bibliográfica y puesta al día sobre la posible asociación entre RCIU y alteraciones de la función gonadal en niños y adolescentes de ambos sexos.
MetodologíaSe efectuó una búsqueda con las siguientes palabras clave: retardo/restricción de crecimiento intrauterino, bajo peso para edad gestacional, función gonadal, ovárica y testicular, en las bases de datos bibliográficos PUBMED, LILACS, SCIELO, incluyendo los trabajos publicados entre los años 2000-2016.
Se seleccionaron las publicaciones que trataban sobre función gonadal en niños y adultos jóvenes de ambos sexos con el antecedente de RCIU.
Se excluyeron las publicaciones de pacientes con anomalías cromosómicas o genéticas o con genitales ambiguos de etiología no atribuible a la RCIU.
Para facilitar la actualización, se dividió por etapas en: 1, prenatal; 2, posnatal y prepuberal; 3, puberal, y 4, adulta.
Etapa prenatalLa diferenciación de las estructuras fetales precursoras de los órganos genitales internos y externos en sentido masculino o femenino depende de la presencia o ausencia de las hormonas secretadas por el testículo fetal. Alrededor de la semana 8 de gestación, las células del intersticio testicular se diferencian en células de Leydig que tienen capacidad esteroidogénica. Su actividad depende del estímulo gonadotrófico proporcionado por la gonadotrofina coriónica humana (hCG) en los primeros seis meses de vida intrauterina y de la hormona luteinizante (LH) de la hipófisis fetal en el último trimestre. La testosterona secretada por estas células produce la estabilización del conducto de Wolff y la diferenciación del epidídimo, del deferente y de parte de las vesículas seminales. A su vez, la dihidrotestosterona (DHT), principal metabolito de la testosterona, es sintetizada por acción de la enzima 5-alfa-reductasa en los tejidos blanco14. La DHT es la responsable de la virilización del seno urogenital y de los genitales externos. Estos procesos se dan en forma secuencial y en un tiempo preciso del desarrollo llamado ventana biológica que ocurre entre las 8 y las 14semanas de gestación. Cualquier disrupción en este periodo, por factores hormonales o ambientales, incluyendo cualquier etiología de la RCIU subyacente, puede ser causa de hipospadias15. Luego de la semana 16 se completa el descenso testicular y el agrandamiento del pene14.
Nemec et al.16 analizaron la asociación entre RCIU y anormalidades genitales, particularmente micropene y criptorquidia, mediante resonancia magnética nuclear (RMN) en fetos entre 20 y 35semanas, hallando una relación entre la severidad de la RCIU y la presencia de aquellas.
En el sexo femenino la falta de andrógenos resulta en regresión de los conductos de Wolff y en feminización de los genitales externos14. Durante este período, en las niñas con RCIU no se encontraron alteraciones en el desarrollo ovárico en relación con su volumen, el tamaño y la distribución de folículos y ovogonias. Este hallazgo podría explicarse por un flujo preferencial hacia el ovario para mantener la capacidad reproductiva, o porque el gasto energético necesario para su desarrollo es relativamente bajo10.
Etapa posnatal y prepuberalEn la población masculina en general, la prevalencia de anomalías genitales, excluyendo la criptorquidia, es de 4,6/1.000recién nacidos (RN), siendo la más frecuente el hipospadias (73% de las anomalías)17,18, con una incidencia de 3/1.000RN19. La forma más severa es la proximal y representa el 20% de todos los hipospadias.
Un estudio de cohorte retrospectivo encontró una mayor tasa de hipospadias en niños RCIU, con peso, longitud y circunferencia craneana igualmente afectados al nacimiento. La alteración combinada de las tres mediciones es sugestiva de restricción del crecimiento en la gestación temprana20. En un estudio danés se halló asociación entre RCIU, criptorquidia e hipospadias, con fuerte interacción con el grado de premadurez21. Contrariamente a informes anteriores, el peso al nacer fue el único que se asoció con anomalías urogenitales. Estudios en gemelos monocigóticos discordantes para el hipospadias mostraron que el gemelo con menor peso es el más frecuentemente afectado22-24. Como etiología se propuso la hipótesis de que los factores que causan RCIU son los mismos que determinan la presencia de anomalías urogenitales en estos19, postulándose que la insuficiencia placentaria en el primer trimestre de embarazo puede causar una entrega deficiente de hCG, con la resultante producción inadecuada de testosterona y DHT necesaria para inducir la virilización completa22-24. Otros autores hipotetizan que podría ser consecuencia de un retraso o una alteración en la cronología de la maduración global que incluiría el desarrollo genital25.
Un análisis reciente del registro International Disorders of Sex Development (IDSD) mostró que el 23% de pacientes con trastornos del desarrollo sexual (disorders of sex development [DSD]) masculino eran RCIU26. La prematuridad y la RCIU fueron más frecuentes en niños con hipospadias proximal acompañado de criptorquidia comparado con aquellos con hipospadias aislado27. Por otro lado, se ha hallado que aquellos DSD de causa idiopática presentaban peso y longitud al nacer más bajos comparados con los DSD de causa conocida, y que el peso era menor en los niños menos virilizados28,29. Se desconoce el mecanismo por el cual la incidencia de hipospadias es mayor en estos niños, y algunos autores proponen la asignación de una categoría específica al hipospadias asociado con RCIU25. La evidencia actual recomienda que los pacientes con hipospadias sean evaluados de acuerdo a los protocolos establecidos para el estudio de DSD, independientemente del peso al nacer19.
Durante la etapa posnatal temprana Ibáñez et al.30 observaron niveles de la hormona foliculoestimulante (FSH) mayores en niñas y varones con RCIU, evaluados a una edad media de 4 meses, con respecto a controles con peso adecuado para la edad gestacional (PAEG). El mecanismo no se conoce, pero podría estar relacionado con subsecuente infertilidad30. Sir-Petermann et al.31 encontraron niveles aumentados de hormona anti-müleriana (AMH) y una mayor respuesta del estradiol a la prueba de estímulo con leuprolide en niñas con RCIU, lo que podría sugerir una alteración del desarrollo folicular. Contrariamente, en 119niñas prepuberales nacidas con RCIU, Kerkhof et al.13 encontraron niveles de AMH semejantes a los controles de la misma edad, concluyendo que la reserva folicular no estaba comprometida.
AdrenarcaEl desarrollo de pubarca precoz y la secreción exagerada de andrógenos adrenales han sido asociados a la historia de RCIU. Se define pubarca a la aparición de vello pubiano considerada normal cuando ocurre después de los 8años en las niñas y de los 9años en los varones. Se debe a la maduración de la zona reticulada de la glándula adrenal que produce incremento de la secreción de esteroides sexuales con aparición de sudoración, vello pubiano y axilar.
El bajo peso de nacimiento, la ganancia rápida de peso posnatal y el mayor tamaño corporal a los 8años, independientemente, predicen niveles más altos de andrógenos adrenales en ambos sexos12,32-35, que pueden asociarse a pubarca precoz en individuos susceptibles11. Neville y Walker36 encontraron que ser RCIU es un factor independiente de riesgo de presentar pubarca precoz, como lo son la prematurez, el sobrepeso y la obesidad.
A pesar de algunos datos contradictorios, la mayoría de los autores concuerdan como causas posibles de pubarca precoz o exagerada, la adiposidad central, la disminución de la sensibilidad a la insulina y el aumento del insulin growth factor-I (IGF-I)37,38. Tanto la insulina como el IGF-I estimulan la producción de andrógenos por las células teca intersticiales e incrementan la esteroidogénesis y la respuesta de adenocorticotrofina (ACTH) en células de la corteza adrenal39. Además, la insulina y el IGF-I aumentan la fosforilación del citocromo P450 ligado a la 17-hidroxilasa (P450c17) y elevan, por lo tanto, la actividad 17,20-liasa estimulando la síntesis de andrógenos adrenales40.
Algunos autores sugieren que el aumento prepuberal de los andrógenos adrenales desaparecería en la adultez temprana (20años)41.
Etapa puberalEn la RCIU los datos actuales acerca del inicio y la duración de la pubertad son limitados y difíciles de comparar.
Diferentes estudios epidemiológicos en Europa han demostrado que la pubertad se produce en los límites de las edades habituales para la población de referencia, pero relativamente temprano y con una talla algo menor42,43.
En un grupo de 76 niños con peso de nacimiento menor a 2DE (RCIU) y 52 con peso adecuado (PAEG) controlados hasta que completaron la pubertad, Lazar et al.44 observaron que, aunque la edad de inicio puberal era normal, el 20% de las niñas RCIU iniciaron pubertad entre los 8-9,5años y el 13% de los varones entre los 9 y 10,5años, en contraste con solo el 3% de las niñas y el 5% de los varones con PAEG. El único predictor prepuberal de la edad de inicio puberal fue el DE de peso al nacer; otros, como la edad gestacional, el índice de masa corporal (IMC) y la edad ósea retrasada con respecto a la cronológica, no correlacionaron con la edad de inicio puberal.
Otros estudios refieren un adelanto en la edad de menarca43, hecho que es más frecuente si se asocia a un elevado ritmo de crecimiento entre los 0-6meses de vida45.
Por otra parte, al comparar niveles de estradiol, AMH, LH, FSH y su respuesta a la hormona liberadora de gonadotrofinas (GnRH) entre adolescentes RCIU y PAEG no se encontraron diferencias significativas; por lo tanto, no hay una base para sospechar una reserva ovárica limitada en este grupo de pacientes32,46.
Evaluaciones longitudinales mediante ecografías ginecológicas revelaron un incremento del tamaño uterino en la adolescencia tardía, que era menos evidente en RCIU que en las niñas PAEG. La recopilación longitudinal y los resultados transversales a los 18años de edad corroboraron la persistente reducción en el tamaño del útero de las niñas RCIU (aproximadamente en un 20%) y de su volumen ovárico (aproximadamente en un 40%)47.
En un estudio poblacional chino48, el bajo peso para gestación no se asoció con la edad del inicio puberal tanto en varones como en niñas, no pudiendo determinarse su influencia sobre el timing de progresión de la misma.
Según Van Weissenbruch y Delemarre-van de Waal49, la RCIU suele asociarse a un riesgo aumentado de adrenarca prematura, pubertad temprana, poliquistosis ovárica y trastornos en la fertilidad. Basados en que la pubertad, definida como el inicio de interacción entre la unidad neuroendocrina y las gónadas49, tiene su origen en el período fetal cuando el sistema endocrino ya está activo, se postula que el proceso de maduración de este sistema podría estar influido por la programación fetal. El concepto de programación fetal se basa en la presencia de cambios ejercidos en un sistema dado, cuando este se encuentra en un período crítico del desarrollo50. Es decir, el sistema regulatorio implicado en la fisiología sexual es plástico y puede ser permanentemente cambiado durante un período crítico de ventana. Luego de este período crítico, los cambios inducidos persisten debido a la pérdida de esta plasticidad.
En un estudio con animales se observó que los nacidos RCIU con ganancia acelerada de peso y mayor exposición a la insulina pueden asociarse con secreción precoz y exagerada de LH, que conlleva un desarrollo puberal temprano51. Por otro lado, estudios en humanos39 marcan diferencias significativas entre niñas RCIU según hayan presentado o no catch-up en su crecimiento lineal, concluyendo que el inicio y la progresión de la pubertad son complejos y muchos factores, aun posnatales, han sido identificados como responsables directos o indirectos de la producción o secreción del GnRH39.
Al evaluar el empuje puberal en niños pequeños para la edad gestacional, Verkauskiene et al.40 observaron un modesto retardo de la edad ósea con respecto a la cronológica al comienzo puberal y un avance más rápido de la maduración ósea durante la pubertad comparado con los controles; el pico de la velocidad de crecimiento se alcanza en un estadio puberal más temprano y es de menor duración, estas diferencias podrían contribuir a una menor talla adulta. No se conoce el mecanismo fisiopatológico que causa estos hallazgos, y no parece estar relacionados solamente con el peso de nacimiento, edad de gestación, adiposidad u obesidad, sino más bien con una ganancia rápida de peso en la infancia temprana y el inicio puberal7,40. Por lo tanto, aunque el crecimiento puberal total es similar en niños PAEG y RCIU, indicando una etapa de crecimiento suficiente en estos últimos52, hay evidencia de que la ganancia de talla en la pubertad puede ser menor que la esperada, debido a un inicio temprano de la pubertad y a una maduración ósea acelerada con fusión de los cartílagos de crecimiento32.
Etapa adultaMientras la mayoría de los estudios no hallaron disfunción testicular en adolescentes y adultos jóvenes en relación con el peso al nacer33,34, otros encontraron alteraciones del eje hipófiso-gonadal con reducción del volumen testicular, menores niveles de testosterona e inhibinaB y mayor nivel de LH, especialmente en los niños sin catch up completo11. Dado que el volumen testicular refleja la función de los túbulos seminíferos/Sértoli y los niveles de inhibinaB reflejan la actividad espermatogénica, estos hallazgos sugerirían una reducida espermatogénesis que podría ser responsable de la subfertilidad en varones adultos. En este sentido, fue descripta menor tasa de reproducción en varones RCIU que empeora a medida que envejecen53. Por otro lado, Allvin et al.54 hallaron que los RCIU con talla normal presentaban mayores niveles de estradiol, DHT e inhibinaB que los controles, sugiriendo que la actividad aromatasa, calculada en base a la relación estradiol/testosterona, y la actividad 5-alfa-reductasa, calculada por la relación DHT/testosterona, se correlacionan negativamente con el peso al nacer.
Con respecto a las mujeres, las niñas que tuvieron pubarca precoz12,51 tendieron a presentar un índice de ovulación reducido en la adolescencia55. Durante la tercera década de la vida el riesgo de desarrollar ovario poliquístico fue dos veces más alto, aun cuando fue ajustado por IMC, resistencia a la insulina, paridad y antecedentes de tabaquismo materno, demostrando que el bajo peso es un factor independiente para el síndrome de ovario poliquístico en la vida adulta. Las niñas RCIU con adrenarca precoz tuvieron diez veces más posibilidades de tener ovarios poliquísticos. En este grupo de pacientes se observó una respuesta exagerada de 17-hidroxiprogesterona (17-OHP) al estímulo con ACTH39.
Otros estudios56,57 no encontraron asociación significativa entre el bajo peso al nacer y las anormalidades reproductivas y metabólicas de mujeres con ovario poliquístico. Un factor crítico de los trabajos es la inclusión de recién nacidos pretérmino57,58, ya que la maduración funcional de los órganos y tejidos del recién nacido prematuro puede ser completada durante la vida posnatal y, por lo tanto, ser influenciada por el medio ambiente extrauterino59. Otro factor es que ciertos estudios han evaluado síntomas como hiperandrogenismo clínico o irregularidad menstrual solamente no incluyendo todos los posibles fenotipos del síndrome de ovario poliquístico57, hecho que puede llevar a la exclusión de algunos de ellos y a una posible subestimación de su real prevalencia.
En relación con la reproducción esto es más problemático de evaluar, por los múltiples factores involucrados; hasta el momento no hay datos suficientes como para confirmar la presencia de alteración ovárica que se evidencie en una menor fertilidad o una menopausia precoz13. Kerkhof et al.13 analizaron los datos de 279 mujeres jóvenes entre 18-24años buscando la posible relación entre edad gestacional, talla y peso de nacimiento y los niveles de AMH, concluyendo que tanto las nacidas pretérmino como las RCIU no tenían una reducción de la reserva folicular. Otro estudio realizado en Suecia, con una importante población de ambos sexos, encontró asociación entre bajo peso al nacer y prematuridad, con probabilidad de una menor tasa de reproducción53.
Mishra et al.60 estudiaron las consecuencias de algunos eventos vitales tempranos y su impacto sobre la menarca y la menopausia, encontrando que la malnutrición pre o posnatal temprana puede jugar un rol en determinar una menopausia temprana, pero la relación estricta con la RCIU no está claramente establecida.
Conclusiones- •
En varones se encontró una relación entre la severidad de la RCIU y la presencia de anomalías genitales, particularmente hipospadias y criptorquidia.
- •
Algunos estudios refieren niveles elevados de FSH en varones y mujeres.
- •
La mayoría de los autores concuerdan en la relación entre RCIU, pubarca o adrenarca precoz, con la ganancia de peso excesiva en la infancia que se asocia a adiposidad central y disminución de la sensibilidad a la insulina.
- •
Se refiere adelanto en la edad de comienzo puberal, con aceleración temprana de la edad ósea.
- •
Algunos estudios sugieren que la edad de menarca es similar a los controles, otros refieren edad de menarca más temprana.
- •
El riesgo de desarrollar ovario poliquístico es mayor.
- •
Estudios en adolescentes varones han descripto alteración del eje hipotálamo-hipófiso-gonadal con volumen testicular disminuido sobre todo en aquellos que no realizaron crecimiento compensador, mientras que otros estudios no han apoyado estos hallazgos.
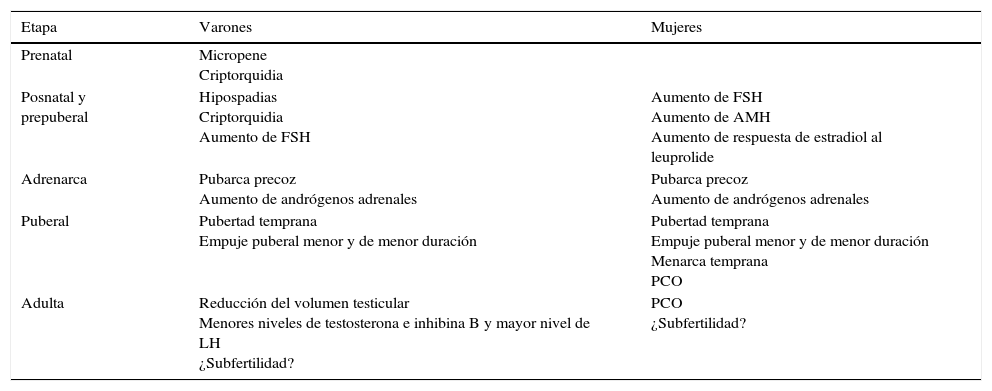
Existen datos controvertidos y se necesitan más estudios para aclarar la relación entre la RCIU y la función hipófiso-gonadal (tabla 2).
Hallazgos relacionados con la presencia de restricción del crecimiento intrauterino (RCIU)
| Etapa | Varones | Mujeres |
|---|---|---|
| Prenatal | Micropene Criptorquidia | |
| Posnatal y prepuberal | Hipospadias Criptorquidia Aumento de FSH | Aumento de FSH Aumento de AMH Aumento de respuesta de estradiol al leuprolide |
| Adrenarca | Pubarca precoz Aumento de andrógenos adrenales | Pubarca precoz Aumento de andrógenos adrenales |
| Puberal | Pubertad temprana Empuje puberal menor y de menor duración | Pubertad temprana Empuje puberal menor y de menor duración Menarca temprana PCO |
| Adulta | Reducción del volumen testicular Menores niveles de testosterona e inhibina B y mayor nivel de LH ¿Subfertilidad? | PCO ¿Subfertilidad? |
AMH: hormona anti-müleriana; FSH: hormona foliculoestimulante; LH: hormona luteinizante; PCO ovario poliquístico.
Descripto por algunos estudios11,12,16,20,24,30,31,36,38-40,53.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.