Estrés oxidativo y sus repercusiones orgánicas
La presencia del oxígeno como molécula central y diferencial de la composición de nuestra atmósfera, junto con otros factores como la presencia de radiaciones solares, etc., promueven efectos oxidativos en los seres vivos, circunstancia que ha determinado el desarrollo de mecanismos antioxidantes que contrarresten los potenciales efectos deletéreos promovidos por las condiciones ambientales en que nos desenvolvemos.
Las reacciones de óxido-reducción tienen una amplia distribución en el metabolismo celular. La transformación de los nutrientes orgánicos y la obtención de la energía química almacenada en sus enlaces involucra reacciones químicas de óxido-reducción que suceden en el proceso de respiración celular que acontece en las mitocondrias durante el cual se consume oxígeno. Sin embargo, en este proceso también se produce la oxidación de moléculas orgánicas a través de reacciones secuenciales que no implican la adición directa del oxígeno. La oxidación hace referencia a la eliminación de electrones, no sólo a la adición de átomos de oxígeno, y la reducción implica adición de electrones. En las células, los átomos de carbono y de hidrógeno de las moléculas orgánicas, que inicialmente se encuentran en un estado reducido (rico en electrones), se metabolizan hasta transformarse en CO2 y H2O, moléculas que han cedido electrones y, por tanto, están muy oxidadas. Ésta es su forma más estable y, por ello, la transformación es energéticamente favorable.
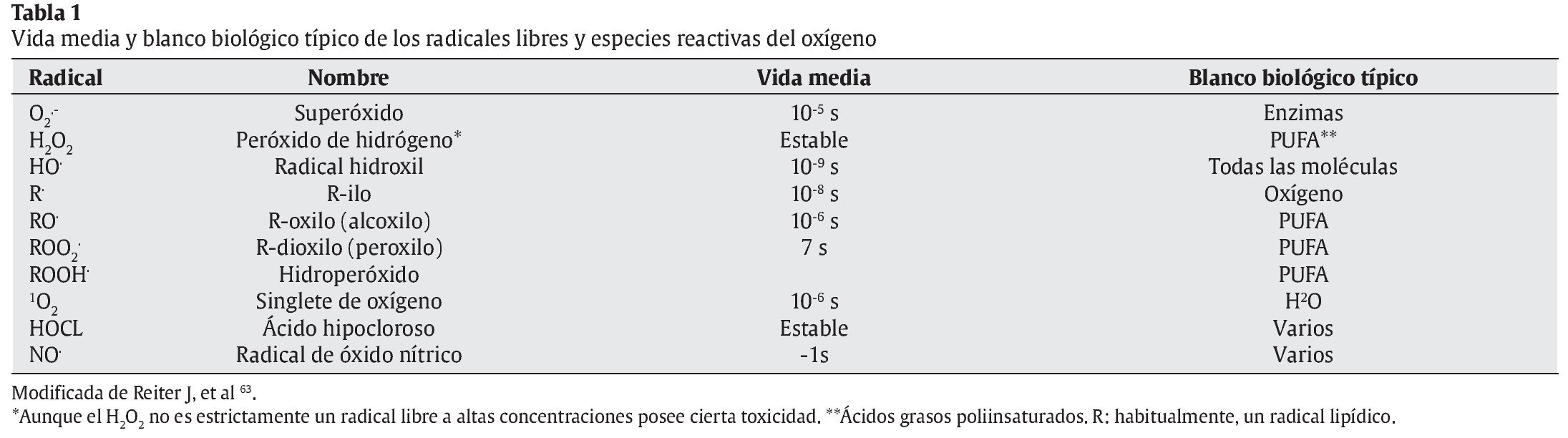
Sin embargo, durante la respiración celular, además de consumirse oxígeno y de obtenerse energía generándose ATP, quedando como subproductos CO2 y H2O, también se producen otras moléculas residuales: las especies reactivas del oxígeno (ERO) y otros radicales libres (RL). En la tabla 1 se nos muestran distintos tipos de RL, su vida media y los principales blancos biológicos.
El estrés oxidativo es un estado de la célula en el cual se altera la homeostasis de la óxido-reducción intracelular, evidenciada por el equilibrio entre respuestas prooxidantes y antioxidantes. Por tanto, esta situación podría venir definida o bien por una excesiva producción de ERO, o bien por deficiencia en los mecanismos antioxidantes1.
Radicales libres
En el organismo se forman continuamente moléculas o átomos con electrones no apareados en su último orbital electrónico, denominados "radicales libres" según la denominación propuesta por Halliwell et al. Estas moléculas o átomos muestran en general una gran agresividad oxidativa celular. La inestabilidad de su estado energético los hace muy reactivos y de vida media corta. Su presencia genera una cadena de reacciones de transferencia de electrones con las moléculas vecinas, que a su vez se convierten también en RL, y tan sólo desaparece su actividad en el caso de que reaccionen dos RL entre sí mismos2.
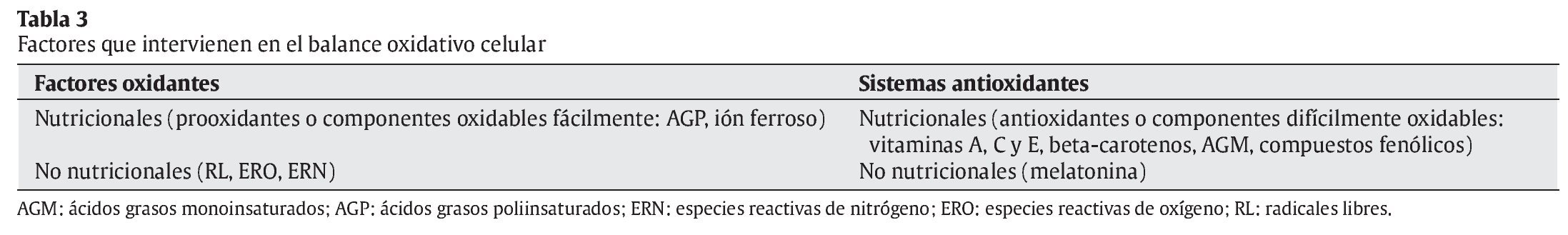
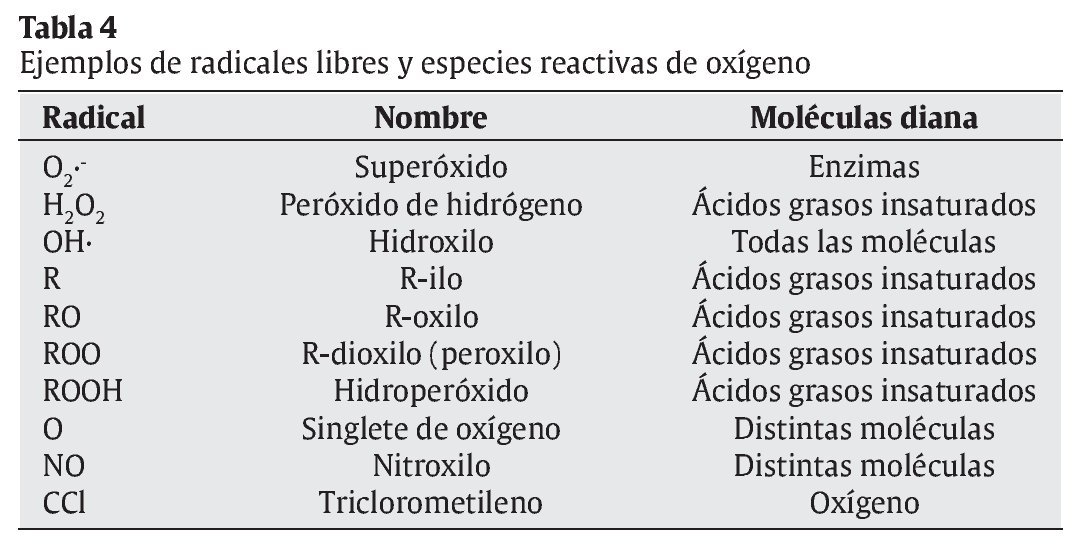
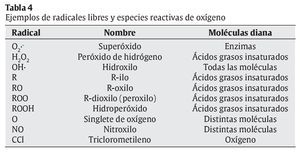
La interrelación de los RL con las moléculas de su entorno produce un daño oxidativo, con repercusiones sobre el desarrollo de diversas patologías en el ser humano, en campos tan dispares como la Neurología, la Cardiología, la Oftalmología, la Dermatología, la Gastroenterología, la Nefrología, o la Gerontología3, 4 (tabla 2). La reactividad y toxicidad de los RL y ERO también se ha relacionado con el proceso de envejecimiento y con la patogénesis de muchas de las enfermedades crónicas degenerativas asociadas a este proceso. Las respuestas orgánicas de defensa ante estas agresiones tóxicas se centran inicialmente en el desarrollo de los sistemas de defensa antioxidante. En la tabla 3 se muestran los factores nutricionales y no nutricionales que intervienen en los procesos tanto de oxidación como de defensa antioxidante. Los principales tipos de RL que actúan en los procesos de oxidación celular se muestran en la tabla 4.
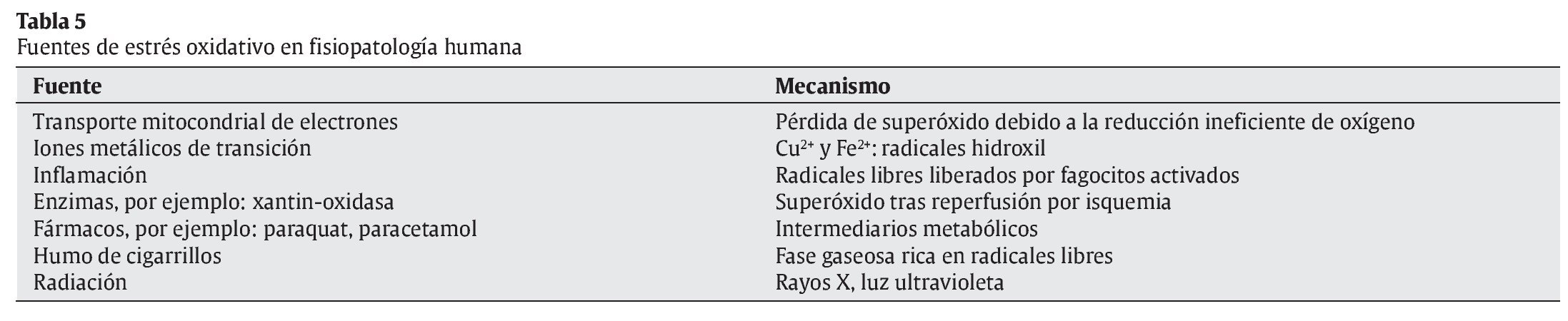
Mecanismos celulares de producción de radicales libres (tabla 5)
Cadena respiratoria mitocondrial
La cadena respiratoria mitocondrial permite gracias al transporte de electrones, que provienen del catabolismo de los nutrientes energéticos, la liberación de energía de esos nutrientes que es transferida a los enlaces energéticos del ATP, en la fosforilación oxidativa acoplada a la misma. Esta cadena requiere oxígeno molecular como aceptor final de electrones, que procede del oxígeno atmosférico, pero una parte del mismo (2-5%) se convierte en radical superóxido, debido a que un pequeño porcentaje de electrones "escapa" de la cadena respiratoria, conduciendo a la formación del citado RL. Cualquier situación en la que se produzca un aumento del consumo de oxígeno tendrá como consecuencia una mayor formación de radical superóxido. Esto puede ocurrir fundamentalmente en dos situaciones: cuando la concentración o el consumo de oxígeno aumenta, por ejemplo, durante el ejercicio físico5, 6, y en casos en que la cadena mitocondrial de transporte de electrones se encuentra completamente reducida, como ocurre en los períodos de isquemia y reperfusión7, 8.
En condiciones normales ésta es la mayor fuente formadora de RL debido a la formación de radical hidroxilo secundaria a la transformación del anión superóxido a peróxido de hidrógeno, que posteriormente se transforma en el citado radical hidroxilo mediante la reacción de Fenton o de Haber-Weiss9, 10.
Posteriormente, a través de la superóxido dismutasa (SOD), se forma otra ERO, el peróxido de hidrógeno11. Dado que la formación del radical superóxido es dependiente del flujo de electrones en la cadena, cualquier situación que aumente el consumo de oxígeno, como ocurre por ejemplo con la actividad física, incrementará proporcionalmente la producción del radical superóxido. En general, la producción de estos RL es proporcional a la tasa metabólica. Hay que resaltar que la formación de RL a través de la cadena respiratoria, es el sistema cuantitativamente más importante de producción de éstos.
Xantina oxidasa
La alteración de los mecanismos homeostáticos celulares, como puede suceder en la hipoxia o la isquemia, puede conducir a un aumento del calcio citosólico y a la activación de enzimas dependientes del calcio, entre las que se encuentra una proteasa que modifica covalentemente la enzima xantina-deshidrogenasa, convirtiéndola en xantina-oxidasa, que a su vez cataliza la transformación de hipoxan-tina a xantina y ésta a ácido úrico, que es clave en la degradación permanente de los ácidos nucleicos. En esta reacción se produce anión superóxido y quizá también singletes de oxígeno5. Esta alteración se ha descrito en procesos de isquemia/reperfusión de oxígeno12.
Metabolismo del ácido araquidónico
La estimulación de la fosfolipasa A2, como sucede en la reperfusión tras isquemia, en presencia de iones calcio, conduce a la liberación de ácido araquidónico a partir de las membranas celulares. Mediante la acción catalítica de dos enzimas distintas, la ciclooxigenasa y la hidroperoxidasa, el ácido araquidónico se oxigena en primer lugar a prostaglandina G2 y posteriormente a prostaglandina H2. Durante este último paso se produce el radical superóxido, cuando están disponibles el NADH o el NADPH. La actividad hidroperoxidasa conduce asimismo a la producción de singlete de oxígeno13. Por tanto, la formación de prostaglandinas y leucotrienos a partir del ácido araquidónico (C20:4n6) puede ser fuente de producción de RL, fundamentalmente en el endotelio vascular. A través de la vía de la ciclooxigenasa se pueden generar radicales superóxido13; y a través de la vía lipooxigenasa parece haber una mayor producción de singlete de oxígeno14.
Fagocitos y otras fuentes de radicales
Tanto los fagocitos como los leucocitos polimorfonucleares (PMN) constituyen una fuente biológica importante de aniones superóxido y de otros tipos derivados reactivos del oxígeno. Estos tipos celulares de glóbulos blancos poseen diversos mecanismos microbicidas, el más importante de los cuales depende del oxígeno.
Metales en la producción de radicales
El hierro y el cobre son los que participan en la producción de los derivados oxigénicos más agresivos. En algunas circunstancias estos procesos precisan la presencia de agentes reductores, como el ácido ascórbico. El hierro en su forma ferrosa participa en la generación de radical hidroxilo mediante la clásica reacción de Fenton15, 16.
Fe2+ + H2O2 →OH• + OH• + Fe3+
El cobre es el metal iónico con mayor capacidad de formación de ERO, incluso más que el hierro, ocasionando como resultado un mayor daño a las bases de ADN17.
Uno de los mecanismos de defensa frente a los efectos prooxidantes de estos metales es reducir su libre disponibilidad mediante la unión a proteínas de transporte y a su posterior almacenamiento. Sin embargo, los efectos directos del propio estrés oxidativo pueden movilizar el hierro desde las moléculas con las que se encuentra ligado, como son citocromos de la cadena respiratoria18.
Activación de xenobióticos
Durante la activación metabólica de los xenobióticos se produce a nivel del retículo endoplásmico de los hepatocitos un transporte continuo de electrones a partir del citocromo P450, con la consiguiente formación del radical superóxido y el aumento del estrés oxidativo19.
Radiaciones ionizantes
En la composición del aire atmosférico encontramos compuestos químicos como el dióxido de nitrógeno, el ozono y el óxido nítrico. El humo del tabaco tiene altas concentraciones de óxido nítrico, radicales peroxilo y radicales centrados en el carbono, entre otros, por lo que supone una fuente importante de producción de RL, cuyo efecto lesivo se ve aumentado por la importante acumulación de hierro que existe en el tejido pulmonar de los fumadores. Los efectos nocivos de estas sustancias se encuentran potenciados además por la acumulación de macrófagos en el aparato respiratorio20.
Por otro lado, la acción directa de las radiaciones ionizantes como la luz solar potencian la activación de un gran número de átomos y moléculas, entre ellas el propio oxígeno, promoviendo la producción de tripletes excitados a través del cambio de órbita de los electrones21.
En resumen, son muchas las causas que inducen y desencadenan un estrés oxidativo, proceso relacionado con la patogénesis de un gran número de patologías crónicas degenerativas, incluyendo las más prevalentes en nuestro medio (enfermedades pulmonares, cardiovasculares, inmunológicas y neurodegenerativas).
Mecanismos antioxidantes
Un antioxidante es cualquier sustancia que a bajas concentraciones y en presencia de un sustrato oxidable, retrasa o previene la oxidación del mismo, inhibiendo la tasa de oxidación. La preservación de la salud del organismo depende en gran medida de la existencia de eficaces sistemas de defensa antioxidantes que actúen contra el daño producido por RL y ERO19.
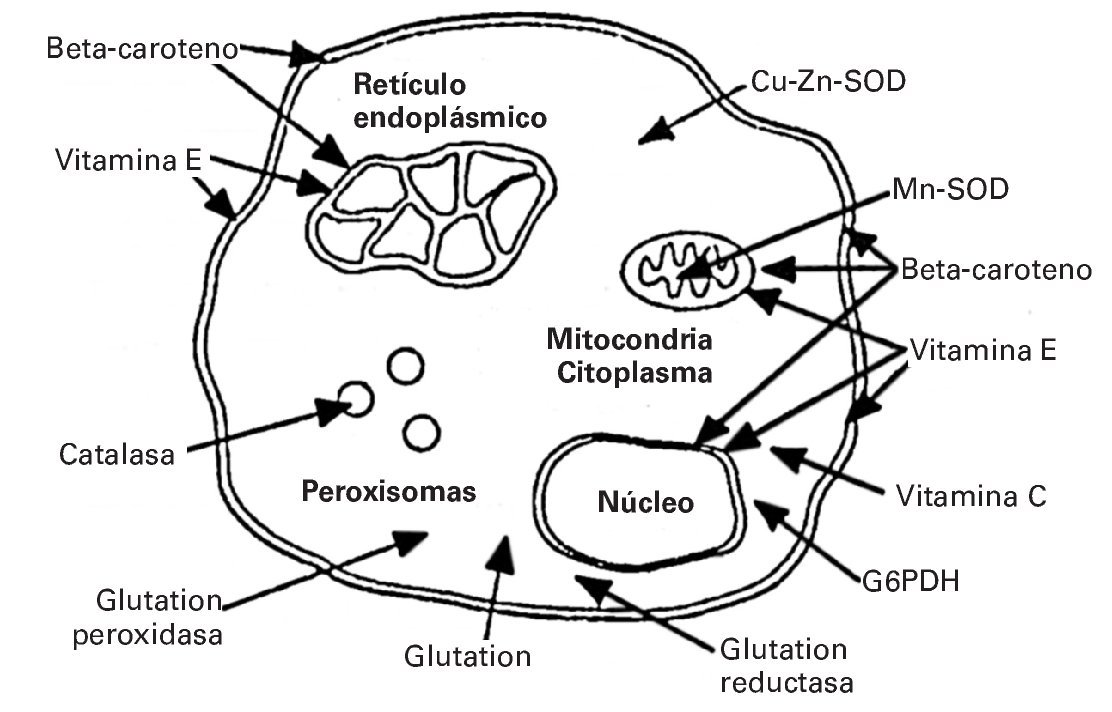
Dado que los RL desempeñan un papel importante como estimulantes de distintas funciones fisiológicas, por ejemplo en el proceso de hipertrofia muscular22, los antioxidantes actúan evitando aquellos aumentos excesivos de RL que podrían desencadenar efectos nocivos sobre el organismo. En este sentido, la acción complementaria de las enzimas antioxidantes se realiza catalizando la ruptura de RL pero a nivel intracelular. Cada antioxidante ejerce su función en una localización determinada. Así, por ejemplo la catalasa (CAT) la ejerce en los peroxisomas celulares; el beta caroteno actúa tanto en el núcleo como en la membrana celular; la vitamina E en el retículo endoplásmico23 (fig. 1).
Fig. 1. Lugar específico de acción de cada antioxidante. Tomada de Fardy H, Silverman F23.
Defensas antioxidantes primarias y secundarias
Los sistemas antioxidantes se pueden diferenciar en primarios (constituidos por enzimas como la SOD y la CAT, así como otras del ciclo redox del glutation) y en secundarios (moléculas antioxidantes)23. La funcionalidad de estos sistemas, mostrada en las tablas 6 y 7, sigue el siguiente esquema:
Tabla 7 Antioxidantes naturales y sintéticos de uso terapéutico (Maxwell)
- Los sistemas antioxidantes primarios previenen el fenómeno oxidativo impidiendo la formación de los RL o directamente eliminando a los agentes oxidantes. Aquí se incluyen moléculas como la vitamina E, el ácido ascórbico, los beta-carotenos, el ácido úrico y algunas enzimas como SOD, glutation peroxidasa, CAT y DT-diaforasa.
- Los sistemas antioxidantes secundarios actúan de forma complementaria a los primarios, eliminando los productos nocivos formados durante la oxidación, impidiendo su acumulación. En este grupo encontramos a las enzimas de reparación del ADN, exonucleasas y endonucleasas, enzimas proteolíticas (proteasas y peptidasas), enzimas lipolíticas (fosfolipasa A2) y transferasas. Con la salvedad de los sistemas de reparación del ADN, las restantes enzimas metabolizan los ácidos nucleicos, proteínas y lípidos que han sido dañados por los RL/ERO, ya que dichas moléculas una vez dañadas dejan de cumplir sus funciones biológicas, y su permanencia las convertiría con toda probabilidad en agentes nocivos.
Defensas antioxidantes en función de su mecanismo de acción
Los mecanismos de acción de las distintas defensas antioxidantes las podemos centrar en tres campos: mecanismos de prevención (sistemas primarios), mecanismos eliminadores de RL y sistemas enzimáticos de reparación o síntesis de novo. Entre los sistemas enzimáticos relevantes19, 24 cabe citar los siguientes:
Mecanismos enzimáticos o de producción endógena
Son enzimas con capacidad antioxidante que no se consumen al reaccionar con los RL, y son dependientes de ciertos cofactores generalmente oligoelementos metálicos tales como cobre, hierro, magnesio, zinc o selenio.
Superóxido dismutasa. Es un grupo de metaloproteínas, caracterizadas por la presencia de manganeso en las mitocondrias o de zinc-cobre en el citosol, que cataliza la reacción de formación de peróxido de hidrógeno a partir del oxígeno y el hidrógeno como se representa en la siguiente ecuación química:
O2·- + O2·- + 2H+ →O2 + H2O2
Las concentraciones en plasma son muy bajas o nulas. Su concentración mayor parece encontrarse en los sitios donde puede producirse oxígeno. La familia de las SOD ha ido en aumento y ya se han descubierto al menos tres miembros además de las dos proteínas inicialmente detectadas (la Mn-SOD mitocondrial y la Zn/Cu-SOD citoplasmática, que dan cuenta del 100% de la actividad SOD intracelular), la Esc-SOD es de localización extracelular. La distribución de la SOD es muy amplia a nivel tisular, con excepción de la Mn-SOD, que no se localiza a nivel eritrocitario; todas ellas ejercen un importante papel en el control de los niveles de radical superóxido a nivel celular25.
Catalasa. Se trata de una enzima ferroporfirínica intracelular, cuya localización principal son los peroxisomas (80%) y el citosol de las células, aunque también está presente en las mitocondrias y otros orgánulos26.
La concentración de CAT varía en las diferentes localizaciones celulares, y entre los distintos tejidos del organismo, siendo su concentración baja o ausente en plasma27, en tanto que abunda y es muy activa tanto en hígado como a nivel eritrocitario26.
Sin embargo, puede ser el antioxidante celular más importante cuando se libera al dañarse la célula por necrosis, ya que limita la extensión del daño por RL. Ejerce su acción sobre el peróxido de hidrógeno de forma muy eficaz. La función de la CAT es doble: por un lado cataliza la descomposición de peróxidos de hidrógeno en agua y oxígeno, en tanto que también ejerce una función peroxídica, produciendo la oxidación de donadores de hidrógeno como el metano, los fenoles o el etanol con consumo de peróxidos como el H2O228.
H2O2 → 2H2O + O2
ROOH + AH2 → ROH + H2O + A
El predominio de la reacción catalítica o peroxídica depende tanto de la concentración de peróxido de hidrógeno en el sistema como de la concentración de donadores de hidrógeno. La descomposición de H2O2 por parte de la CAT es bastante rápida, sin embargo, su afinidad por el mismo es baja, por lo que se requieren altas concentraciones para su descomposición24, 29.
Glutation peroxidasa. Cataliza la reacción de los hidroperóxidos con el glutation reducido (GSH) para formar glutation disulfuro oxidado (GSSG) y el producto de la reducción del hidroperóxido:
ROOH + 2 GSH → ROH + GSSG + + H2O
La enzima contiene selenio, probablemente en el centro activo. Es específica para GSH y no para el hidroperóxido. Esta clara falta de especificidad de sustrato aumenta su capacidad de acción. En el estado estable se requiere la regeneración del GSH por la reducción del GSSG. La GSSG reductasa, dependiente del NADPH, tiene una distribución subcelular similar a la de la glutation peroxidasa. La oxidación del NADPH une la acción de la glutation peroxidasa con los sustratos unidos a NADPH. En situaciones de estrés oxidativo la actividad peroxidasa la realizan las glutation transferasas, con aumento de la actividad peroxidasa y disminución de la actividad transferasa30, 31.
Glutation reductasa. Es una flavoproteína que cataliza la reducción de NADPH que depende del GSSG a GSH. La reacción es esencial para el mantenimiento de los niveles de glutation. Esta molécula tiene un importante papel como reductor de los procesos de óxido-reducción, actuando también en los procesos de detoxicación y en otras funciones celulares de gran importancia. La actividad de esta enzima permite mantener los niveles de GSH para la acción de la glutation peroxidasa. Es beneficioso, por tanto, un elevado balance GSH/GSSG para el mantenimiento de la salud, ya que así se promueve la detoxicación del peróxido de hidrógeno y de otros agentes tóxicos externos. La N-acetilcisteína (NAC) y otros compuestos con puentes sulfhidrilos (penicilina, captopril, etc.) pueden actuar como antioxidantes al contribuir a la síntesis de glutation y aumentar la eliminación de los RL.
Mecanismos no enzimáticos
Los mecanismos antioxidantes no enzimáticos comprenden una serie de compuestos principalmente exógenos, caracterizados por ser consumidos durante su actuación como moléculas antioxidantes, por lo que deben ser reemplazados. Su aporte proviene fundamentalmente a través de la dieta. Son ejemplos de este tipo de antioxidantes no enzimáticos y de bajo peso molecular las vitaminas E y C, el beta-caroteno, el ácido úrico, la ceruloplasmina, la transferrina, la taurina, el dimetilsulfóxido (DMSO), la dimetilformamida (DMPO), quelantes de metales pesados, taninos, alcaloides del Gingko biloba, selenio, lactoferrina, tioxantina, hidroxantina (atrapador del radical OH), los ácidos nordidroguayarético y tiazolidincarboxilo, etc.
Vitamina E (alfa-tocoferol). Está presente en el aceite de oliva virgen y es el antioxidante de membrana más eficaz que se conoce, protegiendo a la misma del daño peroxidativo. La vitamina E, una vez oxidada y antes de descomponerse, puede ser reducida de nuevo por el ácido ascórbico y el glutation, entre otros. La función fisiológica más aceptada de la vitamina E es su papel como detoxicador o scavenger de los RL, pues previene la lesión oxidativa de los ácidos grasos poliinsaturados (AGP) y de las proteínas ricas en grupos tiol de las membranas celulares, preservando así la integridad estructural y funcional de los orgánulos. Se considera el antioxidante natural más efectivo32, cuya función se ha demostrado tanto in vivo como in vitro33. En los años sesenta se planteó la hipótesis de que el ácido ascórbico podría reducir los RL tocoferoxilo formados durante la detoxicación de los RL formados in vivo durante el metabolismo, lo que permitiría a una molécula de tocoferol limpiar muchos radicales y unirse a la vitamina C para la protección de las membranas contra el daño producido por los RL.
La vitamina E activa la reducción del citocromo C y reduce el NADH, aunque no se ha evidenciado totalmente su metabolización en la cadena respiratoria. De igual forma, la vitamina E disminuye la fluidez de la membrana y altera la permeabilidad al fosfato, y adicionalmente puede afectar la síntesis de prostaglandinas y leucotrienos y por tanto el metabolismo de AMPc, previniendo la peroxidación del ácido araquidónico a prostaglandinas.
En células aisladas la vitamina E aumenta el número de divisiones celulares de los fibroblastos en cultivo. Cuando las células aisladas se someten de forma adicional a un estrés ambiental o a concentraciones más elevadas de oxígeno, el alfa-tocoferol disminuye el depósito de lipopigmentos, así como la producción de malondialdehido (MDA).
La vitamina C ayuda a mantener los niveles de vitamina E, ya que prevendría la pérdida oxidativa de los alfa-tocoferoles durante el proceso de la digestión de los alimentos. El ascorbato también podría actuar positivamente sobre la distribución del tocoferol disponible en el organismo.
Ubiquinona (coenzima Q). La ubiquinona, una de las moléculas centrales en la funcionalidad de la cadena de transporte de electrones en la membrana mitocondrial, también tiene una función muy importante como antioxidante, actuando como agente bloqueador de RL. Los mecanismos más aceptados por los que la coenzima Q (CoQ) puede actuar como antioxidante son previniendo o la peroxidación lipídica o la propagación de la reacción en cadena.
Beta-carotenos. Actúan como agentes fotoprotectores frente a los efectos deletéreos de las radiaciones solares, del propio oxígeno y de los pigmentos fotosensibilizadores. La actividad antioxidante de estos compuestos se basa en su capacidad para reaccionar con determinados RL, como el peróxilo, el hidroxilo, el singlete de oxígeno, el anión superóxido, el ácido hipocloroso y otras especies reactivas34.
Ácido ascórbico. Actúa como un potente agente reductor, ya que reduce RL derivados del oxígeno, del nitrógeno y del sulfuro. Es un antioxidante soluble en agua que reacciona directamente con el radical superóxido, hidroxilo y con el singlete de oxígeno. En combinación con hierro o cobre puede acelerar la formación de RL a través de la reacción de Fenton, resultando paradójico que en ciertas condiciones pueda actuar como agente prooxidante.
El ácido ascórbico puede sufrir de manera rápida y consecutiva dos procesos oxidativos monovalentes, con formación de radical semidihidroascorbato como intermediario, que no es muy reactivo y puede interaccionar de forma directa con radicales superóxido, hidroxilo y singlete de oxígeno, así como radicales lipídicos y otros centrados en el nitrógeno y el sulfuro35. Por otro lado, también es capaz de ejercer un papel antioxidante de manera indirecta, mediante la regeneración del alfa-tocoferol.
Otros antioxidantes. En los últimos años se están descubriendo numerosos compuestos antioxidantes de interés biológico, como el glutation (tripéptido formado por cisteína, glicina y glutamina). La acción antioxidante de la mayoría de éstos se conoce in vitro, quedando por determinar su acción real in vivo. Entre las moléculas proteicas no enzimáticas de localización plasmática se conocen las siguientes: ceruloplasmina, transferrina, albúmina, haptoglobina y hemopexina. Existe un grupo de pequeñas moléculas no enzimáticas y de pequeño peso molecular también con acción antioxidante, como el ácido úrico, bilirrubina, licopeno, luteína, zeoxantina, polifenoles, vitamina K, etc.
Daños moleculares y celulares del estrés oxidativo
Los RL son átomos o moléculas inestables, altamente reactivas que atacan los enlaces de proteínas de los tejidos, los fosfolípidos poliinsaturados de las membranas celulares, los hidratos de carbono y los ácidos nucleicos de las células. Su presencia genera una cadena de reacciones de transferencia de electrones con las moléculas vecinas, que a su vez también se convierten en RL.
Al ejercer su acción los RL sobre las biomoléculas orgánicas se activan reacciones en cadena que podrían incluso llevar a la apoptosis celular (muerte celular programada). La existencia del electrón desapareado es lo que confiere al RL su altísima reactividad con gran cantidad de moléculas biológicas (lípidos, proteínas, ácidos nucleicos, etc), ya que tiende rápidamente a ganar o ceder un electrón para conseguir así una conformación estable. Esta misma rapidez hace que su vida media sea muy corta, lo cual hace enormemente difícil su estudio2.
Los RL pueden causar las siguientes alteraciones patológicas:
1) Desnaturalización de las cadenas de ADN.
2) Liberación de factores quimiotácticos que provocan la llegada de leucocitos activados que a su vez generan más RL.
3) Inicio de la peroxidación lipídica (con la subsiguiente alteración de membranas), que a su vez genera hidroperóxidos, aldehidos y endoperóxidos, con daño en las proteínas y ADN.
4) Desnaturalización de las proteínas presentes en el citosol y las enzimas de membrana, incluyendo el inhibidor de alfa 1-antitripsina.
En síntesis, los RL producen daño sobre todo a cuatro sistemas celulares básicos: la respiración aeróbica, la síntesis de proteínas, la membrana celular y el ADN celular36.
Ácidos nucleicos y activación génica
El estrés oxidativo actúa sobre el ADN, provocando un incremento del número de mutaciones, entrecruzamientos, roturas en las cromátidas o pérdida de fragmentos cromosómicos, siendo más frecuentes las alteraciones del tipo de fragmentación y de modificaciones oxidativas en las bases púricas y pirimídicas37. Los RL de oxígeno, y en particular el hidroxilo, presentan una gran afinidad para la fijación a estas bases, modificando la estructura del ADN. Por ello, los puntos más vulnerables para el ataque de RL/ERO son tanto las bases como las pentosas de los ácidos nucleicos. Estas alteraciones pueden ser evidenciadas por la presencia en orina de bases oxidadas e hidroxiladas del ADN, fundamentalmente timina37.
La interacción de los RL del oxígeno con el ADN se puede producir de manera directa (por ejemplo, radical hidroxilo) o indirecta (por ejemplo, H2O2, O2·-) en presencia de metales de transición y con la posterior formación de radicales hidroxilo. El radical H2O2 es tóxico debido a su capacidad de atravesar membranas y producir radicales hidroxilo38,39. La lesión producida por los RL en el ADN mitocondrial se ha relacionado directamente con los procesos de envejecimiento40. Según los estudios realizados por el Prof. Jaime Mikel "el daño del ADN nuclear produciría cáncer, y el de las mitocondrias, envejecimiento"41.
Por lo tanto, el ARN como el ADN son objetivos para la acción de los RL/ERO. Los daños producidos a ambas moléculas pueden ser cuantificados in vivo, midiendo las bases púricas y pirimidínicas modificadas, como resultado de las escisiones y reparaciones del ADN. Estas modificaciones pueden ascender a cerca de 10.000 bases por célula al día. Es evidente, por lo tanto, que a pesar de la existencia de sofisticados y eficaces mecanismos de control celular una fracción de tales alteraciones puede escapar a los mecanismos de reparación, lo que sugiere que el daño potencial de carácter mutagénico y cancerígeno provocado por RL/ERO es importante42, así como que dichos procesos contribuyen de forma muy importante a la aceleración del envejecimiento.
Proteínas
Los RL al interactuar con las proteínas van a ocasionar cambios en su estructura, con pérdida de su capacidad funcional y entrecruzamientos catalíticos43. Se pueden distinguir dos tipos de efectos nocivos de los RL sobre las proteínas: a) ataques difusos, que originan modificaciones generalizadas, y b) ataques selectivos, que dan lugar a modificaciones en puntos concretos de la proteína. Se producen alteraciones en diversas regiones de la proteína, lo que conlleva modificaciones en su estructura, agregaciones intra e intercatenarias y fragmentación proteica. Las modificaciones específicas se caracterizan por su gran selectividad. Los aminoácidos más frecuentemente atacados son la histidina, la prolina, la lisina y la arginina5. Estos daños proteicos provocan alteraciones en las estructuras de las que éstas forman parte, por lo que se producen anomalías en la permeabilidad celular, y daños en el citoesqueleto, con pérdida de la funcionalidad en el primer caso y alteraciones graves en la estructura celular en el segundo44.
La vulnerabilidad de las proteínas ante la acción de los RL depende de su composición aminoacídica y de la accesibilidad de la especie oxidante a los aminoácidos más reactivos, como son histidina, metionina, cisteína, triptófano y tirosina. El inicio de una reacción en cadena se ve favorecido por la presencia de iones metálicos, como los de transición formando complejos en el interior del ambiente proteico. Dichos iones son capaces de catalizar la descomposición del peróxido de hidrógeno, provocando un efecto sitio-específico. El resultado es la conversión de algunos residuos aminoácidos en derivados carbonilo que pueden ser utilizados como marcadores del daño producido.
Los RL/ERO también facilitan la formación de enlaces cruzados proteína-proteína, así como la fragmentación de las cadenas proteicas. Por otra parte, las proteínas pueden ser objeto de ataque por radicales secundarios, como los que derivan de la peroxidación lipídica. Este es el caso del malondialdehido (MDA), que puede dar lugar a productos estables de enlaces cruzados con aminoácidos específicos. En conjunto, el daño oxidativo a las proteínas celulares incluye cambios conformacionales, pérdida de actividad enzimática, aumento de la susceptibilidad a las proteasas y disfunciones inmunológicas45.
Ácidos grasos insaturados. La peroxidación lipídica
La peroxidación lipídica es el daño oxidativo que se produce en los AGP a causa de un proceso autocatalítico incontrolable. El hecho de que los fosfolípidos sean componentes básicos de todas las membranas celulares evidencia más claramente la repercusión funcional y estructural que estos procesos pueden desencadenar en la funcionalidad celular.
El proceso de la peroxidación lipídica se inicia con la acción de distintos RL y ERO sobre los lípidos de las membranas, que desencadenan una auténtica cascada de reacciones que producen nuevos RL, con la formación finalmente de peróxidos orgánicos y otros productos a partir de ácidos grasos insaturados46. Los ácidos grasos más susceptibles de sufrir este proceso son los que presentan mayor número de dobles enlaces, como el C20:4n6, el docosahexaenoico (C22:6n3) y el linoleico (C18:2n6). Este fenómeno oxidativo es la forma más conocida de la toxicidad de RL/ERO.
En la cadena de reacciones de los RL se pueden distinguir tres etapas esenciales: inicio, propagación y terminación. Una vez iniciado el proceso oxidativo, éste se propaga hasta que dos RL reaccionan entre sí, con lo que finaliza el proceso. Por tanto, un único evento de iniciación puede provocar la conversión de numerosas cadenas de AGP en hidroperóxidos lipídicos, lo que significa que la peroxidación lipídica puede ser amplificada hasta que se agote la disponibilidad de oxígeno y de cadenas de AGP no oxidadas47.
Por otra parte, la duración y la velocidad de la cadena de peroxidación dependen directamente del grado de insaturación lipídica. Para una serie de ácidos grasos insaturados de uno a seis dobles enlaces, como oleico, linoleico, esta velocidad aumenta según la relación 0,025:1:2:4:6:8. El ácido oleico del aceite de oliva es más resistente al ataque oxidativo que otros ácidos grasos insaturados, y comparativamente al ácido linoleico presente en aceites de semillas la velocidad de la cadena de peroxidación es 80 veces menor. La peroxidación lipídica da origen a numerosos productos (muchos de ellos biológicamente activos y citotóxicos), que pueden dividirse en tres categorías principales48:
1) Productos de rotura de la cadena. Se encuentran sustancias que se obtienen de la rotura de dobles enlaces C-C adyacentes a un grupo hidroperóxido, por lo que es posible identificar tres clases de moléculas importantes:
-Alcanales, como el MDA, que a través de la reacción con tioles proteicos y/o enlaces con grupos amino de las proteínas, pueden causar un importante daño celular.
-Alquenales. Son productos con una vida media más bien larga. Pueden difundir del lugar de origen a la membrana, modificando su integridad estructural y funcional, su fluidez y su permeabilidad. Puesto que estos sucesos tienen lugar en la zona interna de la membrana biológica, se pueden ver afectados todos los fenómenos de la señal celular y el flujo iónico. También se pueden alterar propiedades apolipoproteicas, modificando las características inmunológicas. En el caso de que estos productos se formen junto a los ácidos nucleicos, se podrían alterar la secuencia del mensaje de determinados genes y/o la estructura molecular del ADN/ARN, provocando así un daño todavía mayor en los mecanismos genéticos y/o en la biosíntesis proteica.
-Alcanos, como el pentano y el etano que son productos terminales de la oxidación de los PUFAS (ácidos grasos polisaturados). Estos compuestos se emplean en el laboratorio para cuantificar el grado de daño de esos ácidos grasos.
2). Productos formados de la reordenación del LOOH (hiperóxidos), o reordenación y sucesivas oxidaciones (hidroperóxidos, epidióxidos, dihidroperóxidos, endoperóxidos bicíclicos y compuestos mono, di-, tri-, ceto- y epoxi-hidróxidos).
3) Productos de oxidación de alto peso molecular por reacciones de polimerización.
En resumen, lo más destacable de la peroxidación lipídica es que es más acusada cuanto mayor es el grado de insaturación de la membrana celular, y esto está condicionado, en mayor o menor medida, por el grado de insaturación de los ácidos grasos aportados por la dieta, los cuales determinan realmente la composición de ácidos grasos de la membrana. El producto final de la peroxidación lipídica es la formación de hidroperóxidos de ácidos grasos y metabolitos derivados, algunos de ellos altamente tóxicos, como los aldehídos MDA y 4-hidroxinonenal. Se forman también dihidrocarburos como el pentano o el etano, cuya eliminación por la respiración los hace útiles como marcadores del proceso49.
Biomoléculas de bajo peso molecular
Los RL también interactúan con moléculas de bajo peso molecular como las vitaminas (ácido ascórbico, carotenoides, alfa-tocoferol, ubiquinonas), hidratos de carbono (glucosa, ribosa), aminoácidos (histidina, trip-tófano, cisteína, metionina), ácido úrico, colesterol y pequeños péptidos solubles como el glutation19. Las reacciones de RL con las vitaminas A, C, E y ubiquinonas, glutation y ácido úrico, conducen habitualmente a la finalización de la cadena de reacción de estos radicales.
El caso concreto de la oxidación del colesterol tiene un particular interés biológico, puesto que se producen hidroperóxidos de colesterol y otros compuestos de familia de los oxisteroles, en los que la oxidación se produce sobre el anillo beta del esterol. Éstos derivados del colesterol están implicados directamente en la patogénesis de la aterosclerosis y de sus distintas formas de presentación clínica. Se ha postulado que la presencia de oxisteroles en la sangre puede ser el resultado de un ineficaz mecanismo antioxidante in vivo19.
La reacción de los RL, como el radical hidroxilo, con la glucosa y el manitol genera una reacción en cadena de nuevos radicales, siendo imprescindible la presencia de metales de transición (cobre o hierro) con fines catalizadores para el desarrollo de este proceso36. El ácido hialurónico puede ser degradado en el transcurso del daño articular también debido a la acción de RL50.
La interacción entre los glúcidos y los derivados oxigénicos está en la base de muchos procesos patológicos metabólicos como la diabetes mellitus51 y algunas enfermedades reumatoideas y oftalmológicas, como las cataratas.
Estrés oxidativo y ejercicio físico
Las respuestas fisiológicas de los distintos sistemas y órganos durante el ejercicio físico dependen de las diferentes variables que lo definen: intensidad, frecuencia, duración, tipo de ejercicio, etc.
Desde el año 1982, Davies et al52 evidenciaron el aumento en la producción de RL durante el ejercicio físico. El aumento del consumo de oxígeno cuando se incrementan las cargas de trabajo, determina una mayor actividad oxidativa sobre los componentes del ciclo de Krebs y de la cadena de transporte de electrones, provocando un aumento de la producción de RL, que se estima entre un 1-5% del oxígeno consumido22.
Las respuestas oxidativas provocadas por el ejercicio aumentan, por tanto, de forma directamente proporcional al aumento de la intensidad del mismo. Las reacciones en las que se produce una mayor formación de RL es a nivel de los complejos I y III de la cadena de transporte de electrones22.
Los ejercicios anaeróbicos, o de intensidad elevada, son los que ocasionan una mayor producción de RL. Son ejemplos de este tipo de ejercicios los supramáximos realizados durante las series de spints, o de multisaltos, así como los ejercicios en los que predominan las contracciones excéntricas que provocan una gran respuesta inflamatoria.
Los mecanismos por los que se produce el aumento de RL durante el ejercicio anaeróbico están relacionados con la producción de xantinooxidasa, con los mecanismos de isquemia-reperfusión, con el aumento de la actividad fagocítica desencadenada durante los procesos inflamatorios provocados por el ejercicio intenso, así como con la autooxidación de las catecolaminas. La liberación adicional de hierro proveniente de la hemoglobina o la ferritina podría ampliar las respuestas inflamatorias y por ende el estrés oxidativo.
Por otro lado, dado que durante el ejercicio de baja intensidad (inferior al 50% del consumo máximo de oxígeno) la producción de RL es muy reducida, la actividad de estas moléculas no supera las defensas antioxidantes del deportista, por lo que no se evidencian daños oxidativos cuando el ejercicio físico se practica a estas intensidades. Dichos resultados responden a que el ejercicio aeróbico estimula el aumento de antioxidantes intracelulares así como la capacidad enzimática antioxidante, especialmente en las células inmunitarias, reduciendo por tanto la vulnerabilidad de estos sujetos frente al estrés oxidativo53-55.
Sobre la base de estas evidencias se concluye que para que el entrenamiento físico consiga mejorar las variables que determinan el rendimiento deportivo, como la fuerza y la velocidad, es necesario planificar la estimulación de aquellos procesos bioquímicos, como los oxidativos, que pueden contribuir a mejorar la asimilación de las cargas de entrenamiento, o por el contrario, cuando no se controlan adecuadamente, pueden incrementar los riesgos asociados a la fatiga. En este sentido, la estimulación del equilibrio entre procesos oxidativos y capacidad antioxidante mediante el manejo de las cargas de trabajo, provocando distintas respuestas oxidativas, y del ajuste de la dieta y los suplementos nutricionales, son un claro ejemplo de la necesidad de profundizar en las respuestas bioquímicas al ejercicio como medio ideal para mejorar el rendimiento deportivo a la vez que se promueve la salud de los deportistas.
Aunque existe escasa evidencia de que los antioxidantes aumenten el rendimiento en los deportistas, un número extenso de trabajos han mostrado que aquellos pueden disminuir el estrés oxidativo. Esto sugiere que el beneficio secundario a la administración de antioxidantes debe ser esperado a largo plazo.
Antioxidantes y ejercicio físico
La relación entre defensas antioxidantes y ejercicio físico es doble. Por un lado, el ejercicio físico aumenta los procesos oxidativos, lo que precisa de unas defensas antioxidantes que protejan frente a los potenciales daños del aumento del estrés oxidativo. Por otro lado, el ejercicio aeróbico por sí mismo induce una activación de la funcionalidad enzimática oxidativa, potenciando las defensas antioxidantes.
Uno de los factores que más incide en el rendimiento deportivo es la capacidad ergogénica del deportista, es decir, la capacidad de generar energía y, por tanto, retrasar la aparición de la fatiga. Estos procesos están íntimamente ligados a la funcionalidad energética mitocondrial, y por tanto al mantenimiento estructural de sus membranas, especialmente sensibles a los efectos de los RL sobre sus componentes lipídicos. Las respuestas oxidativas que se producen durante el ejercicio intenso y prolongado, como sucede en la mayoría de las competiciones deportivas, tienen un efecto deletéreo sobre la capacidad ergogénica, acelerando los procesos metabólicos que conducen a la fatiga muscular. Por esta razón, uno de los puntos clave en el manejo de la alimentación del deportista es el control de la ingesta de antioxidantes, para preservar la funcionalidad metabólica y energética, especialmente en aquellas circunstancias que conlleven un mayor riesgo oxidativo, como sucede en situaciones de estrés emocional o térmico, o en aquellas competiciones que debido a su larga duración (por etapas, o partidos consecutivos en cortos periodos de tiempo) requieran un control alimentario más exhaustivo.
Aunque hipotéticamente las necesidades alimentarias de los deportistas podrían cubrirse con dietas individualizadas y bien equilibrada, las distintas vicisitudes que se producen durante los periodos de entrenamientos intensivos y de competición, suelen dificultar la exacta valoración de las necesidades de determinados nutrientes, como puede ser el caso de los antioxidantes. Por ello, durante las dos últimas décadas se han realizado múltiples estudios para evidenciar los efectos de distintas sustancias y moléculas antioxidantes sobre los daños funcionales y estructurales de diferentes modalidades deportivas. Una de las moléculas que ha mostrado efectos protectores más favorables para los deportistas, debido a sus acciones antioxidantes y sobre otros muchos órganos y funciones, es la melatonina, cuya potencial utilización en los deportistas a pesar de la escasa difusión de los resultados de los estudios sobre sus efectos en el ejercicio físico, merece en este artículo una atención más detenida.
Melatonina y ejercicio
El filósofo francés René Descartes describió hace tres siglos la glándula pineal como el "asiento del alma". Sin embargo, la principal hormona producida por esta glándula, la melatonina, no se describió hasta los años cincuenta del pasado siglo. El dermatólogo Aaron Lemer (1958)56 describió por primera vez una hormona proveniente de la glándula pineal que "aclaraba los melanocitos". A la molécula, por derivarse de la serotonina y por referencia a la melanina, la denominó melatonina.
La melatonina (5-metoxi-N-acetil-triptamina) es una hormona que desde el punto de vista filogenético ha estado ligada a la protección antioxidante frente a las radiaciones ionizantes y a una atmósfera muy rica en oxígeno. Para ello, la función de la melatonina era ralentizar las funciones celulares durante las horas de mayor exposición a dichas radiaciones durante el día, para activarlas durante las horas de oscuridad durante las cuales existía un menor riesgo. Por ello, desde un punto de vista filogenético, la melatonina cumplía una doble función de control de los ciclos circadianos, así como de molécula antioxidante. Posiblemente esta dualidad es la que ha hecho que la melatonina no sólo se encuentre en la glándula pineal, desde donde pasa al líquido cefalorraquídeo y a la circulación cerebral y sistémica, sino que sus concentraciones sean mucho mayores (en miligramos y no en picogramos) en otros órganos como la retina, las células inmunes, el intestino, la bilis, en donde ejerce una función puramente antioxidante frente al estrés oxidativo sufrido en estos órganos.
La distribución orgánica de la melatonina se corresponde con la localización de las células argentafines productoras de serotonina. La melatonina de origen extrapineal pasa a la circulación, aunque la sintetizada en la retina y en el tracto gastrointestinal puede actuar directamente in situ. El 95% de la melatonina liberada a la sangre es metabolizada por el hígado. En el sistema nervioso central la melatonina es rápidamente oxidada hacia N-acetil-5-metoxi-kinurenamina, sustancia que supone un 15% del total de los metabolitos urinarios de la hormona. La vida media de la melatonina tiene unos valores que fluctúan entre los 20 minutos y los 45-60 minutos.
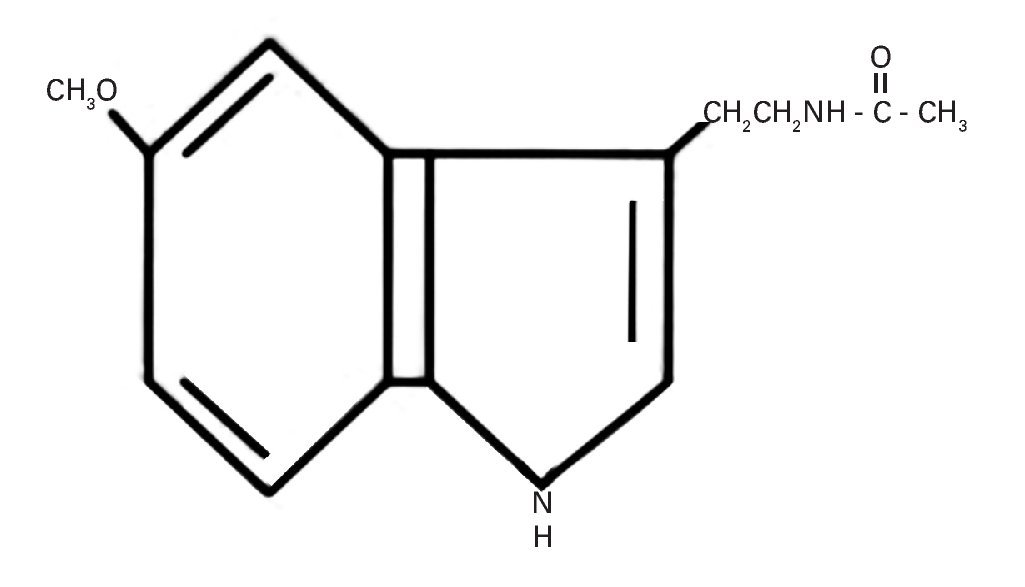
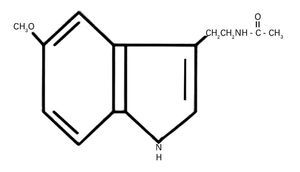
La producción de esta hormona muestra variaciones a lo largo del día vinculadas al ciclo circadiano generado por un "reloj" o marcapasos interno situado en el hipotálamo, que es el núcleo supraquiasmático (NSQ), el cual está sincronizado con el ciclo luz-oscuridad durante las 24 horas del día57. Su estructura química indólica derivada de la serotonina a partir del triptófano se muestra en la figura 2.
Fig. 2. Estructura química de la 5-metoxi-N-acetil-triptamina o melatonina.
Biosíntesis de la melatonina
La biosíntesis de la melatonina se rige por una vía multisináptica cuyo origen está en la retina, y por medio del tracto retino-hipotalámico accede al NSQ del hipotálamo, para posteriormente alcanzar la epífisis. La actividad secretora de la glándula pineal y su relación con el fotoperiodo requieren la integridad de esta inervación. A medida que se sintetiza es liberada a la circulación, por lo que sus niveles plasmáticos son un buen indicador de su producción. La mayor parte de la melatonina circulante es excretada por la orina en forma de compuestos sulfatados como el catabolito 6-sulfatoximelatonina (6-SMT) que resulta de su catabolización en el hígado. Sólo una pequeña porción será eliminada de forma libre. La producción de melatonina es inhibida por la luz. Su biosíntesis sufre variaciones por la acción de distintas enzimas circulantes58,59 que regulan la producción de melatonina, como la N-acetil-transferasa, cuya acción regula la secreción de N-acetil serotonina60, así como por la hidroxiindol-O-metiltransferasa, que influye en la velocidad de síntesis de la monoaminooxidasa (MAO)61.
La liposolubilidad de la melatonina le permite una rápida absorción cuando se administra por cualquier vía, pudiendo atravesar todas las barreras biológicas y llegar hasta cualquier compartimiento celular para prevenir el daño oxidativo.
Mecanismos de acción de la melatonina
Los mecanismos de acción mejor descritos de la melatonina son los que se producen a través de sus receptores. Existen dos tipos de receptores para la melatonina: los ML1, o receptor de alta afinidad (picomolar), y los ML2 o receptor de baja afinidad (nanogramos). La activación de los ML1, que pertenecen a la familia de las proteínas unidas a la guanosina trifosfato, provoca la inhibición de la actividad de la adenilato-ciclasa en las células diana. Estos receptores probablemente estén implicados en la regulación de la función retiniana, los ritmos circadianos y la reproducción. Los receptores ML2 se encuentran acoplados a la estimulación de los compuestos fosfoinositoides, aunque su distribución no está suficientemente documentada62.
Actividad antioxidante. La actividad antioxidante de la melatonina se realiza a nivel de todos los compartimientos celulares (membrana, citosol, mitocondria y núcleo). La melatonina, al ser muy lipofílica, atraviesa todas las membranas celulares, además de las barreras hematoencefálica y placentaria. Las funciones de la melatonina como un antioxidante incluyen:
1) Tiene una función neutralizante directa de RL.
2) Estimula la actividad de enzimas antioxidantes mediante la regulación de la expresión génica de determinadas enzimas de óxido-reducción.
3) Incrementa la eficiencia de la fosforilación oxidativa mitocondrial y reduce el escape de electrones.
4) Aumenta la eficiencia de otros antioxidantes.
Numerosos estudios han evidenciado tanto in vitro como in vivo que concentraciones tanto fisiológicas como farmacológicas de melatonina protegen contra el daño oxidativo de los RL63. Los estudios in vitro64 e in vivo65 han basado sus resultados antioxidantes en una potente actividad neutralizante de RL de la melatonina, actividad que se dirige específicamente contra los radicales hidroxilo y peroxilo64, 66. La capacidad de eliminación de radicales hidroxilo se debe a su estructura química; concretamente, estriba en el grupo metilo en posición 5 -OH del anillo indol, mientras que el grupo N-acetil ejerce una acción sinérgica65 con las vitaminas C y E. También se ha podido evidenciar una acción antioxidante de la melatonina frente a otros radicales, concretamente los radicales peróxido66, 67 y el singlete de oxígeno68, 69. Estas acciones sugieren que la melatonina ejerce su función antioxidante de forma distinta a la mediada por sus receptores ML1 y ML2. Su potencia neutralizante de los radicales hidroxilo es 5 veces superior a la del glutation y 15 veces superior a la del manitol. Además probablemente exista un mecanismo indirecto relacionado con la restauración de los niveles de antioxidantes. Reiter70 evidenció que la melatonina presentaba un efecto protector antioxidante frente al daño oxidativo superior al del manitol, glutation y vitamina E. Sin embargo, para algunos autores62 estos efectos antioxidantes requieren concentraciones superiores a las que se producen fisiológicamente durante el sueño.
Por su parte, Kumar et al71 comparando los efectos del ejercicio intenso sobre dos grupos (uno con melatonina y otro con placebo) evidenciaron una reducción de la peroxidación lipídica, un aumento de la capacidad antioxidante total, y un mantenimiento de la actividad de la SOD, GPX (enzima glutatión peroxidasa) y CAT estadísticamente significativo en el grupo experimental que tomaba melatonina, frente al grupo control. Estos resultados concuerdan con otros que también han evidenciado efectos semejantes de la melatonina sobre el estrés oxidativo producido por el ejercicio físico intenso.
En todos los modelos experimentales conocidos la melatonina mostró capacidad como agente antioxidante72 con los siguientes resultados sobre procesos degenerativos crónicos relacionados con el estrés y daño oxidativo:
- Prevención de la lesión oxidativa mitocondrial causada por la proteína beta-amieloide, marcador neuropatológico del Alzheimer.
- Disminución de la peroxidación lipídica de corteza cerebral y diencéfalo así como la ulcerogénesis de mucosa gástrica desencadenada por MDA.
- Prevención de la necrosis tubular con su poder antioxidante y restauración de la actividad enzimática antioxidante en riñón de rata, tras el tratamiento con gentamicina, la cual aumenta la lipoperoxidación.
- Reducción de la peroxidación lipídica de hígado, pulmón, íleon y riñón de rata, tras la exposición a zimosano, agente no bacteriano que produce inflamación a través de las especies reactivas de oxígeno73.
- Disminución del daño en la zona piramidal del hipocampo de rata, tras la exposición al ácido quinolénico que desencadena daño neuronal.
- Disminución significativa de la peroxidación lipídica en bazo y plasma de rata tras una sobredosis de hierro o fosfina, desencadenadores de la peroxidación lipídica.
- Protección pulmonar y renal en rata contra el efecto carcinógeno potencial, desencadenado por el ácido D-aminolevulínico.
Secreción de la melatonina a lo largo de la vida
La secreción de melatonina varía a lo largo de la vida según el siguiente modelo:
Durante los primeros seis meses de vida, los niveles nocturnos de melatonina son bajos, siendo entre los 1 a 3 años cuando se alcanzan los picos nocturnos más elevados y con ritmicidad circadiana. Entre los 15 y 20 años ocurre una caída en los niveles del 80 % debida probablemente al incremento de la talla del cuerpo, a pesar de la producción constante de melatonina después de la infancia. Durante las décadas siguientes disminuyen moderada y progresivamente hasta los 70-90 años74, en que sus niveles son los más bajos.
Capacidad antioxidante de la melatonina
La melatonina es liposoluble, por lo que cuando se administra por cualquier vía es absorbida rápidamente pudiendo atravesar todas las barreras biológicas; parece que puede llegar hasta cualquier parte de la célula previniendo el daño oxidativo.
Consumo de melatonina
En la actualidad la melatonina es consumida en algunos países para los problemas de insomnio, para el jet-lag y en ocasiones para ralentizar el envejecimiento. En España, la melatonina es un producto de investigación clínica, sin embargo en otros países se puede adquirir como suplemento en tiendas de dietética. La dosis de administración de melatonina oscila desde 0,5 a 3 mg, debiendo ingerirse normalmente una hora antes de acostarse. Tiene una vida media corta, en torno a los 40-50 minutos. Las concentraciones en suero alcanzan el pico a los 20 minutos y después caen rápidamente. Serán necesarios más estudios científicos para poder tener la seguridad de poder utilizar la melatonina con el fin de paliar los efectos del envejecimiento.
Conclusiones
La práctica regular de ejercicio físico es una de las recomendaciones más difundidas como medio de promocionar la salud y prevenir muchas de las patologías más prevalentes en nuestro entorno. Sin embargo, dadas las distintas respuestas oxidativas que se producen durante dicha práctica dependiendo de la modificación de las diferentes variables que definen el ejercicio físico, se hace necesario conocer los principales mecanismos de oxidación así como las manipulaciones alimentarias y de entrenamiento físico que puedan evitar las repercusiones negativas que el estrés oxidativo pueda desencadenar sobre las estructuras celulares implicadas en estos procesos. En este sentido, la melatonina presenta un perfil funcional protector frente a potenciales riesgos oxidativos ligados al ejercicio intenso que puede hacer atractiva su utilización en el deporte, teniendo en cuenta la ausencia de efectos secundarios negativos de esta sustancia.
Correspondencia:
C. de Teresa Galván .
CAMD Granada. Hospital San Juan de Dios 18001 Granada .
Correo electrónico: cdeteresa@ejerciciosaludable.com
Historia del artículo:
Recibido el 27 de junio de 2008
Aceptado el 25 de julio de 2008