Analizar la eficacia y la seguridad de golimumab en los 140 pacientes incluidos en España en la parte 1 del estudio GO-MORE, un estudio multinacional en artritis reumatoide (AR) activa a pesar del tratamiento con distintos fármacos antirreumáticos modificadores de la enfermedad (FAME).
Pacientes y métodosLos pacientes recibieron golimumab 50mg subcutáneo una vez al mes durante 6 meses. El criterio de valoración principal fue el porcentaje con respuesta DAS28-VSG EULAR buena o moderada tras 6 meses de tratamiento.
ResultadosSe incluyó a 140 pacientes. El 76,4% tenía enfermedad muy activa (DAS28-VSG>5,1). El 76,4% estaba tomando metotrexato, el 40,0% otros FAME en monoterapia o combinación, y el 65,0% esteroides. Al mes 6, el 82,9% de los pacientes logró una respuesta EULAR buena o moderada, el 41,4% alcanzó baja actividad y el 30,7% remisión. El porcentaje de pacientes con respuesta al mes de la primera dosis administrada fue del 69,3%. La eficacia fue similar en pacientes tratados con metotrexato u otro FAME, distintas dosis de metotrexato, con/sin esteroides o que habían fallado a uno o más FAME. El golimumab fue bien tolerado y el perfil de seguridad fue coherente con estudios previos. Se comunicaron acontecimientos adversos graves en 11 pacientes (7,9%).
ConclusiónLa adición de golimumab 50mg subcutáneo mensual a distintos FAME en pacientes con AR activa deparó una respuesta moderada o buena a los 6 meses en el 82,9%. La respuesta comenzó a observarse tempranamente, ya al inicio del mes 2, tras una única dosis de golimumab.
To assess the efficacy and safety of golimumab in the 140 patients included in Spain as the first part of the GO-MORE trial, a multinational study involving patients with active rheumatoid arthritis (RA) despite treatment with different disease-modifying antirheumatic drugs (DMARDs).
Patients and methodsThe patients received subcutaneous golimumab 50mg once a month during 6 months. The primary endpoint was the percentage of individuals with a good or moderate EULAR DAS28-ESR response after 6 months of treatment.
ResultsA total of 140 patients were included. Of these, 76.4% had very active disease (DAS28-ESR>5.1). 76.4% were taking methotrexate, 40.0% other DMARDs in monotherapy or combined, and 65.0% received corticosteroids. After 6 months, 82.9% of the patients showed a good or moderate EULAR response, 41.4% had low disease activity, and 30.7% were in remission. The percentage of responders one month after the first dose was 69.3%. The efficacy was similar in patients treated with methotrexate or other DMARDs, with different methotrexate doses, with or without corticosteroids, or in subjects who had failed one or more DMARDs. The response to golimumab was observed from the first dose. Golimumab was well tolerated and its safety profile was consistent with the findings of previous studies. Serious adverse events were reported in 11 patients (7.9%).
ConclusionThe addition of subcutaneous golimumab 50mg once a month to different DMARDs in patients with active RA yielded a moderate or good response after 6 months in 82.9% of the cases. The response was observed early, from the start of the second month, after a single dose of golimumab.
El objetivo del tratamiento de la artritis reumatoide (AR) es conseguir alcanzar un estado de remisión clínica o al menos de baja actividad de la enfermedad1–3 y prevenir la progresión de las lesiones articulares. El papel de los fármacos antagonistas del TNF-alfa en este aspecto está bien establecido en aquellos pacientes en los que el tratamiento con fármacos antirreumáticos modificadores de la enfermedad (FAME), incluido metotrexato (MTX), han fallado previamente2,4. No obstante, la mayoría de los ensayos clínicos con anti-TNF-alfa se han realizado en pacientes en los que se observó fallo a MTX y en combinación con este fármaco, y la experiencia en combinación con otros FAME es limitada.
Dado que en práctica clínica un porcentaje de pacientes no utiliza MTX como FAME, o lo utiliza a dosis distintas de las exigidas en ensayos clínicos, resulta de interés obtener información sobre la eficacia de los anti-TNF-alfa en poblaciones de pacientes más parecidas a la práctica clínica, y evaluar a los pacientes con medidas de eficacia más próximas a las habitualmente utilizadas. En España, la mayoría de los pacientes utiliza MTX, aunque en torno al 40% pueden estar siendo tratados con otro FAME, con o sin MTX concomitante5,6.
Golimumab es un anticuerpo monoclonal anti-TNF-alfa de administración subcutánea mensual que ha demostrado eficacia clínica en un amplio rango de pacientes con AR (naïve a MTX, tras fallo de MTX o tras fallo a al menos un anti-TNF-alfa7–9) e inhibir la progresión de la lesión articular en la radiología convencional10. En el estudio GO-MORE se evaluaron la eficacia y la seguridad de golimumab en pacientes que presentaban AR activa a pesar del tratamiento con diferentes FAME en 3.280 pacientes de 40 países11 con un perfil más parecido a los pacientes de práctica clínica habitual. El estudio tuvo 2 partes: en la parte 1, se evaluó la eficacia de la adición de golimumab subcutáneo en práctica clínica, y en la parte 2 se evaluó si una combinación de golimumab por vía intravenosa y subcutánea podría mejorar la respuesta inicial a golimumab subcutáneo11. Los resultados principales de la parte 1 mostraron que, tras 6 meses de tratamiento, golimumab 50mg fue eficaz y bien tolerado: el 82% de los pacientes alcanzaron una respuesta buena o moderada en la escala European League Against Rheumatism (EULAR), y el 24% remisión clínica. En este estudio participaron países de distintas áreas geográficas. En estos casos, es posible que los distintos estándares de tratamiento puedan influir en determinados resultados y que difieran según las áreas geográficas, por lo que creemos de interés el análisis de los resultados específicos de los países cuando los tamaños maestrales lo permiten. Por ello, en este trabajo presentamos los resultados de eficacia y seguridad de golimumab 50mg subcutáneo administrado una vez al mes en los 140 pacientes incluidos en España en la parte 1 del estudio.
Pacientes y métodosEl estudio GO-MORE fue un estudio abierto, multicéntrico, internacional y prospectivo (Protocolo P06129; NCT00975130), en pacientes con AR activa a pesar de tratamiento con FAME y que no habían recibido tratamiento con fármacos biológicos previamente11. El estudio recibió el aprobado de los Comités Éticos de los hospitales participantes y se realizó siguiendo las normas de Buena Práctica Clínica y la Declaración de Helsinki.
En la parte 1 del estudio se incluyó a pacientes de edad igual o mayor de 18 años con diagnóstico de AR (de acuerdo con los criterios revisados del American College of Rheumatology 1987) con enfermedad activa (DAS28-VSG ≥3.2) a pesar de tratamiento con al menos un FAME de los siguientes a dosis estables durante al menos un mes: MTX, sulfasalazina, fosfato de cloroquina, hidroxicloroquina, leflunomida, sales de oro, azatioprina o ciclosporina. Se excluyó a pacientes con tuberculosis activa, tuberculosis latente no tratada, insuficiencia cardiaca moderada a severa o cualquier otra contraindicación para tratamiento con anti-TNF-alfa.
Los pacientes candidatos que aceptaron participar en el estudio fueron tratados con golimumab subcutáneo, 50mg, una vez al mes, durante 6 meses. La dosis de FAME se mantuvo estable durante todo el estudio. El criterio de valoración principal de la parte 1 fue el porcentaje de pacientes con respuesta buena o moderada en la escala EULAR al cabo de 6 meses de tratamiento (definida como mejoría del DAS28-VSG>1,2 desde la puntuación basal, o de 0,6 a 1,2 en aquellos con puntuación basal ≤ 5,1). Las evaluaciones se realizaron al comienzo del mes 2 (tras una dosis de golimumab), comienzo del mes 4 (tras 3 dosis de golimumab) y final del mes 6 (tras 6 dosis de golimumab). Otras variables secundarias de eficacia incluyeron el porcentaje de pacientes con baja actividad (DAS28-VSG<3,2), el porcentaje que alcanzó remisión clínica de la enfermedad (DAS28-VSG<2,6) y la eficacia según el índice simplificado de actividad de la enfermedad (Simplified Disease Activity Index [SDAI]). También se evaluó el porcentaje de pacientes que lograron deterioro funcional mínimo o nulo (Health Assessment Questionnaire Disability Index [HAQ-DI] ≤ 0,5), la calidad de vida mediante el cuestionario Euro-Quality of Life 5 Dimensions (EQ-5D) y el porcentaje de pacientes que consideró la sintomatología como aceptable, sobre la base de la pregunta: «Considerando cómo la enfermedad le afecta en sus distintas vertientes, si siguiese en este estado en los próximos meses, ¿lo consideraría un estado satisfactorio?». En esta primera parte, participaron 3.280 pacientes de 40 países, de los cuales 140 pacientes fueron reclutados en España.
En la parte 2 del estudio se incluyó a aquellos pacientes que habían alcanzado una respuesta DAS28-VSG EULAR buena o moderada pero que no habían alcanzado remisión al final del mes 6. Estos pacientes fueron aleatorizados a continuar golimumab 50 mg subcutáneo una vez al mes o una combinación de golimumab subcutáneo y por vía intravenosa durante 6 meses más, con el objetivo de evaluar la eficacia de ambas pautas en el porcentaje de pacientes que alcanzaba remisión al inicio del mes 11 y al final del mes 12. En esta segunda parte, se incluyó a muy pocos pacientes en España, por lo que no se presentan resultados.
Análisis estadísticoEl tamaño muestral calculado para la primera parte del estudio fue de 3.150 pacientes, tamaño que permitió la detección de pequeñas diferencias en la eficacia entre los distintos subgrupos11. El análisis que presentamos de la muestra española (n=140) no tiene potencia suficiente para mostrar diferencias entre los distintos subgrupos y se presenta con fines más descriptivos. Los pacientes evaluables para eficacia fueron los que recibieron una dosis del fármaco y al menos una visita de seguimiento y los pacientes perdidos o en los que no se obtuvo evaluación fueron catalogados como no respondedores.
La respuesta EULAR se evaluó en la población global y posteriormente estratificada por diferentes variables: FAME utilizado como tratamiento de base, dosis de MTX (baja [< 10mg/semana], media [≥ 10-< 15mg/semana], alta [≥ 15mg/semana]), tratamiento concomitante con glucocorticoides (sí/no) y número de FAME a los que el paciente había fallado.
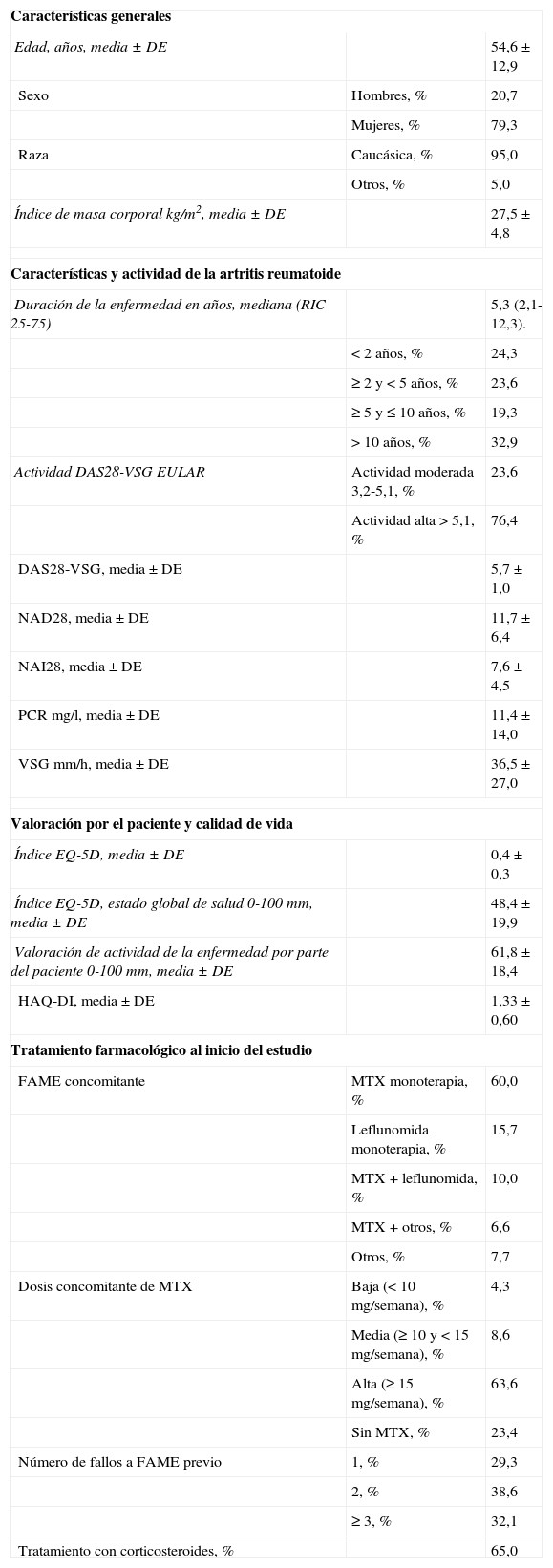
ResultadosDescripción de la muestraEn España, se incluyó a 140 pacientes, 111 mujeres (79,3%) y 29 hombres (20,7%). La mediana de duración de la enfermedad fue de 5,3 años (RIC: 2,1-12,3). El 76,4% de los pacientes presentaba actividad alta (DAS28-VSG >5,1). El 76,4% se encontraba tomando MTX como FAME (en monoterapia en el 60,0% y en combinación con otros en el 16,4%) y el 40,0% estaba recibiendo un FAME distinto de MTX (principalmente leflunomida). La mayoría de los pacientes estaban tomando dosis altas de MTX (≥ 15mg/semana) y el 65% recibía glucocorticoides. El 70,7% había experimentado fracaso con más de un FAME. Las características basales se describen en la tabla 1. Las características de la muestra española fueron similares a las de la muestra global11, excepto por una mayor prevalencia de raza caucásica (95% en nuestra muestra, 70% en la muestra global) y un porcentaje discretamente superior de uso de MTX en monoterapia (60% vs. 51%). Las características de la enfermedad (duración, actividad al inicio, tratamiento con esteroides, dosis de MTX o número de fallos a FAME) fueron similares también a la muestra global.
Características basales de los sujetos incluidos en el estudio (n=140)
| Características generales | ||
| Edad, años, media ± DE | 54,6 ± 12,9 | |
| Sexo | Hombres, % | 20,7 |
| Mujeres, % | 79,3 | |
| Raza | Caucásica, % | 95,0 |
| Otros, % | 5,0 | |
| Índice de masa corporal kg/m2, media ± DE | 27,5 ± 4,8 | |
| Características y actividad de la artritis reumatoide | ||
| Duración de la enfermedad en años, mediana (RIC 25-75) | 5,3 (2,1-12,3). | |
| < 2 años, % | 24,3 | |
| ≥ 2 y < 5 años, % | 23,6 | |
| ≥ 5 y ≤ 10 años, % | 19,3 | |
| > 10 años, % | 32,9 | |
| Actividad DAS28-VSG EULAR | Actividad moderada 3,2-5,1, % | 23,6 |
| Actividad alta > 5,1, % | 76,4 | |
| DAS28-VSG, media ± DE | 5,7 ± 1,0 | |
| NAD28, media ± DE | 11,7 ± 6,4 | |
| NAI28, media ± DE | 7,6 ± 4,5 | |
| PCR mg/l, media ± DE | 11,4 ± 14,0 | |
| VSG mm/h, media ± DE | 36,5 ± 27,0 | |
| Valoración por el paciente y calidad de vida | ||
| Índice EQ-5D, media ± DE | 0,4 ± 0,3 | |
| Índice EQ-5D, estado global de salud 0-100mm, media ± DE | 48,4 ± 19,9 | |
| Valoración de actividad de la enfermedad por parte del paciente 0-100mm, media ± DE | 61,8 ± 18,4 | |
| HAQ-DI, media ± DE | 1,33 ± 0,60 | |
| Tratamiento farmacológico al inicio del estudio | ||
| FAME concomitante | MTX monoterapia, % | 60,0 |
| Leflunomida monoterapia, % | 15,7 | |
| MTX + leflunomida, % | 10,0 | |
| MTX + otros, % | 6,6 | |
| Otros, % | 7,7 | |
| Dosis concomitante de MTX | Baja (< 10 mg/semana), % | 4,3 |
| Media (≥ 10 y < 15 mg/semana), % | 8,6 | |
| Alta (≥ 15 mg/semana), % | 63,6 | |
| Sin MTX, % | 23,4 | |
| Número de fallos a FAME previo | 1, % | 29,3 |
| 2, % | 38,6 | |
| ≥ 3, % | 32,1 | |
| Tratamiento con corticosteroides, % | 65,0 | |
DAS28: 28-Joint Disease Activity Score; DE: desviación estándar; EQ-5D: Euro-Quality of Life 5 Dimensions; EULAR: European League Against Rheumatism; FAME: fármaco antirreumático modificador de la enfermedad; HAQ-DI: Health Assessment Questionnaire Disability Index; MTX: metotrexato; NAD: número de articulaciones dolorosas; NAI: número de articulaciones inflamadas; PCR: proteína c reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular.
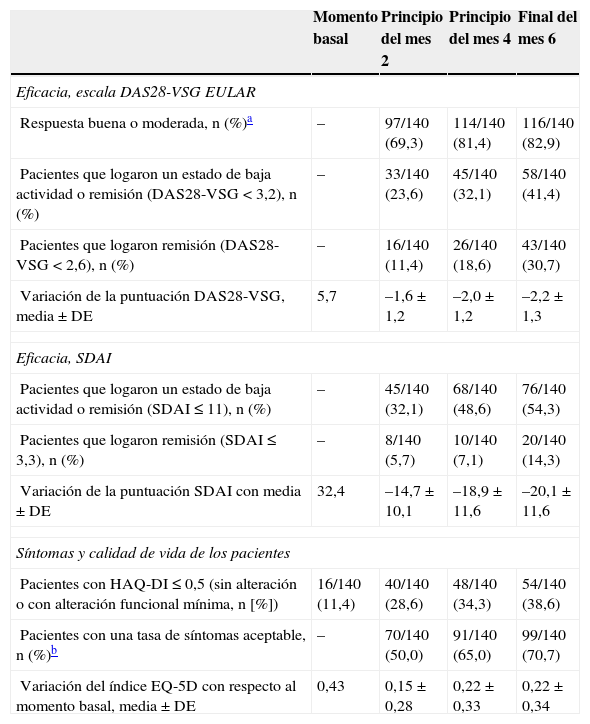
Se observó una respuesta EULAR buena o moderada en el 82,9% de los pacientes (116 de los 140 pacientes de la población por intención de tratar, que recibieron al menos una dosis de medicación de estudio, intervalo de confianza del 95%, 75,8-88,2%). La respuesta fue rápida. El 69,3% de los pacientes había alcanzado respuesta al mes del inicio del tratamiento, tras una única dosis de golimumab; la respuesta se incrementó hasta el 81,4% al inicio del mes 4 (tras 3 dosis de golimumab) y se mantuvo similar en la evaluación de final del mes 6.
Al final del sexto mes, el 41,4% de los pacientes había alcanzado un estado de baja actividad de la enfermedad (DAS28-VSG <3,2) y el 30,7% había logrado remisión (DAS28-VSG <2,6). El porcentaje de pacientes que alcanzó estos objetivos en cada evaluación se describe en la tabla 2. A diferencia de la respuesta clínica, que al comienzo del mes 4 ya era próxima a la máxima, el porcentaje que alcanzó baja actividad o remisión aumentó con el tiempo. La actividad medida por el índice SDAI también disminuyó, y al sexto mes el porcentaje que alcanzó baja actividad o remisión fue del 54,5%, mientras que el 14,3% alcanzó remisión (tabla 2).
Porcentaje de respondedores y evolución de los parámetros de actividad
| Momento basal | Principio del mes 2 | Principio del mes 4 | Final del mes 6 | |
|---|---|---|---|---|
| Eficacia, escala DAS28-VSG EULAR | ||||
| Respuesta buena o moderada, n (%)a | – | 97/140 (69,3) | 114/140 (81,4) | 116/140 (82,9) |
| Pacientes que logaron un estado de baja actividad o remisión (DAS28-VSG < 3,2), n (%) | – | 33/140 (23,6) | 45/140 (32,1) | 58/140 (41,4) |
| Pacientes que logaron remisión (DAS28-VSG < 2,6), n (%) | – | 16/140 (11,4) | 26/140 (18,6) | 43/140 (30,7) |
| Variación de la puntuación DAS28-VSG, media ± DE | 5,7 | –1,6 ± 1,2 | –2,0 ± 1,2 | –2,2 ± 1,3 |
| Eficacia, SDAI | ||||
| Pacientes que logaron un estado de baja actividad o remisión (SDAI ≤ 11), n (%) | – | 45/140 (32,1) | 68/140 (48,6) | 76/140 (54,3) |
| Pacientes que logaron remisión (SDAI ≤ 3,3), n (%) | – | 8/140 (5,7) | 10/140 (7,1) | 20/140 (14,3) |
| Variación de la puntuación SDAI con media ± DE | 32,4 | –14,7 ± 10,1 | –18,9 ± 11,6 | –20,1 ± 11,6 |
| Síntomas y calidad de vida de los pacientes | ||||
| Pacientes con HAQ-DI ≤ 0,5 (sin alteración o con alteración funcional mínima, n [%]) | 16/140 (11,4) | 40/140 (28,6) | 48/140 (34,3) | 54/140 (38,6) |
| Pacientes con una tasa de síntomas aceptable, n (%)b | – | 70/140 (50,0) | 91/140 (65,0) | 99/140 (70,7) |
| Variación del índice EQ-5D con respecto al momento basal, media ± DE | 0,43 | 0,15 ± 0,28 | 0,22 ± 0,33 | 0,22 ± 0,34 |
DAS28: 28-Joint Disease Activity Score; EQ-5D: Euro-Quality of Life 5 Dimensions; EULAR: European League Against Rheumatism; HAQ-DI: Health Assessment Questionnaire Disability Index; SDAI: Simplified Disease Activity Index; VSG: velocidad de sedimentación globular.
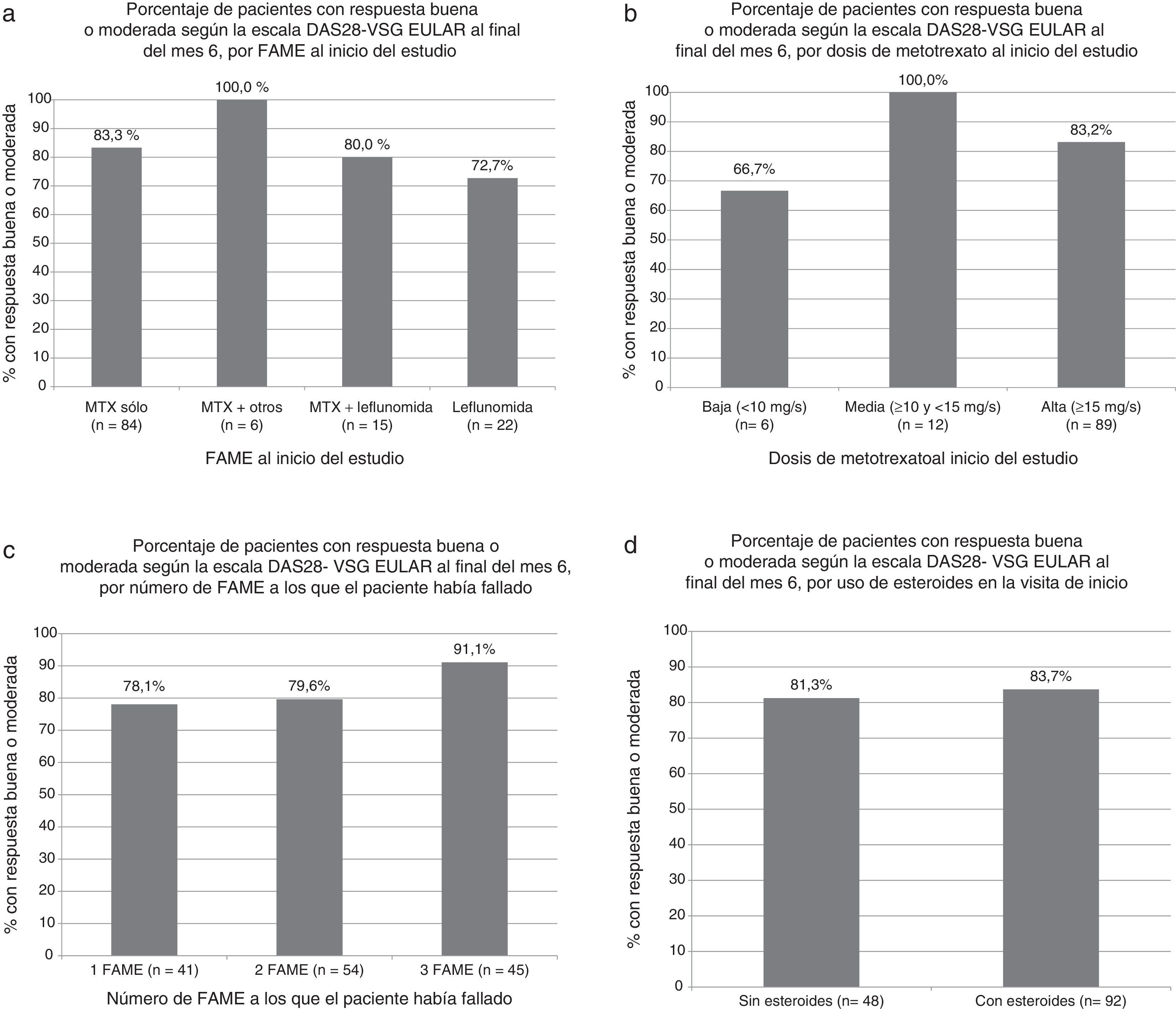
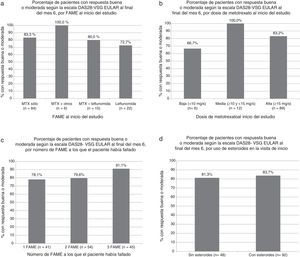
El porcentaje de pacientes que alcanzó respuesta EULAR buena o moderada fue similar en pacientes que se encontraban en tratamiento con MTX, con otro FAME, o con combinación de MTX y otro FAME. Tampoco se observaron diferencias en la respuesta dependiendo de la dosis de MTX, del número de FAME a los que el paciente había fallado previamente, o del tratamiento o no con esteroides (fig. 1 a-d).
Porcentaje de pacientes con respuesta buena o moderada según la escala DAS28-VSG EULAR al final del mes 6. a) Según el FAME al inicio del estudio (p=NS en todas las comparaciones respecto al grupo con metotrexato sólo, test exacto de Fisher). b) Según la dosis de metotrexato al inicio del estudio (p=NS para todas las comparaciones, test exacto de Fisher). c) Según el número de FAME a los que el paciente había fallado (p=NS en todas las comparaciones, test exacto de Fisher). d) Según el uso de esteroides en la visita de inicio (p=NS, test exacto de Fisher).
FAME: fármaco antirreumático modificador de la enfermedad.
La tabla 2 muestra la evolución de los síntomas y la calidad de vida reportados por los pacientes. La calidad de vida, el deterioro funcional y el estado sintomático de los pacientes mejoraron con el tiempo en paralelo a la mejoría del DAS28-VSG. El porcentaje de pacientes que consideraron su sintomatología como aceptable tras 6 meses de tratamiento fue del 70,7%, y el porcentaje con HAQ-DI ≤ 0,5 (situación sin alteración o con alteración funcional mínima) fue del 38,6%. También se observó una mejoría en la calidad de vida medida por el índice EQ-5D (tabla 2). La mejoría de estos índices se observó ya en la evaluación al mes de recibir la primera dosis de golimumab.
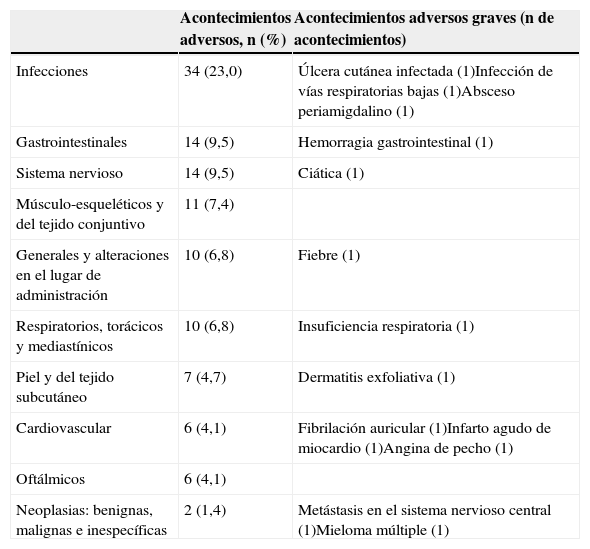
Tolerabilidad y seguridadEl golimumab fue bien tolerado. Se notificaron reacciones en el lugar de inyección en únicamente 2 pacientes (1,4%), fueron leves y no obligaron a suspender la medicación. El perfil de seguridad fue coherente con los estudios previos de golimumab. Se observaron acontecimientos adversos en el 50,0% de los pacientes y en 34 pacientes (23,0%) fueron considerados potencialmente relacionados con el fármaco. En 11 pacientes (7,9%) se observaron acontecimientos adversos descritos como graves (tabla 3). La medicación tuvo que ser suspendida en 6 pacientes (4,1%) debido a reacciones adversas. Se observó elevación de las transaminasas en un paciente (0,7%). Se reportaron 2 fallecimientos, uno debido a un mieloma múltiple con insuficiencia renal aguda (el paciente había recibido 3 dosis de golimumab y el fallecimiento se produjo 48 días después de la tercera dosis) y otro a una insuficiencia respiratoria en el contexto de una infección respiratoria en la que no se cultivó ningún germen específico y fibrilación auricular (también después de 3 dosis y 71 días después de la tercera dosis). Estos fallecimientos fueron considerados por los investigadores como posible y probablemente relacionados con el fármaco, respectivamente.
Número y porcentaje de pacientes con acontecimientos adversos durante los 6 meses de estudio
| Acontecimientos adversos, n (%) | Acontecimientos adversos graves (n de acontecimientos) | |
|---|---|---|
| Infecciones | 34 (23,0) | Úlcera cutánea infectada (1)Infección de vías respiratorias bajas (1)Absceso periamigdalino (1) |
| Gastrointestinales | 14 (9,5) | Hemorragia gastrointestinal (1) |
| Sistema nervioso | 14 (9,5) | Ciática (1) |
| Músculo-esqueléticos y del tejido conjuntivo | 11 (7,4) | |
| Generales y alteraciones en el lugar de administración | 10 (6,8) | Fiebre (1) |
| Respiratorios, torácicos y mediastínicos | 10 (6,8) | Insuficiencia respiratoria (1) |
| Piel y del tejido subcutáneo | 7 (4,7) | Dermatitis exfoliativa (1) |
| Cardiovascular | 6 (4,1) | Fibrilación auricular (1)Infarto agudo de miocardio (1)Angina de pecho (1) |
| Oftálmicos | 6 (4,1) | |
| Neoplasias: benignas, malignas e inespecíficas | 2 (1,4) | Metástasis en el sistema nervioso central (1)Mieloma múltiple (1) |
El análisis de los pacientes reclutados en España en el estudio GO-MORE muestra que el tratamiento con golimumab 50mg subcutáneo una vez al mes añadido a distintos FAME consigue una respuesta EULAR al sexto mes buena o moderada en la mayoría de los pacientes (82,9%), y que esta respuesta se observa ya precozmente. Un mes después de la primera dosis, el 69% de los pacientes había alcanzado respuesta. La mayoría de los pacientes que respondieron lo habían hecho ya al principio del mes 4, tras 3 dosis de fármaco, donde el porcentaje de respuesta fue del 81,4%. Los datos son similares a los encontrados en la muestra global (76,9% al inicio del mes 4 y 82,1% al final del mes 611). En la muestra de España, además, en torno al 40% alcanzaron estado de baja actividad (DAS28-VSG<3,2) y casi un tercio remisión (DAS28-VSG<2,6) al sexto mes, porcentaje que fue aumentando desde el mes 2 en sucesivas evaluaciones (tabla 2). Este aspecto es interesante, ya que sugiere que, si bien la respuesta clínica se alcanza generalmente dentro de las 12 a 14 semanas de tratamiento12, objetivos terapéuticos concretos, como la remisión o la baja actividad pueden tardar más en alcanzarse. El porcentaje de pacientes que alcanzó baja actividad con SDAI (54,3%) fue mayor que con DAS-28, mientras que el porcentaje en remisión con SDAI (14,3%) fue menor. Esta discordancia puede deberse a la inclusión de la valoración del estado general por el médico en el índice SDAI pero no en el DAS-28, que puede ser más estricta que la valoración realizada por los pacientes acostumbrados a los síntomas de la enfermedad pero que han percibido mejoría con el tratamiento, como en general sucedió en el presente estudio.
En general, los estudios multinacionales como el presente suelen incluir un porcentaje elevado de pacientes procedentes de áreas geográficas fuera de Europa o América del Norte. En la muestra española, los porcentajes de pacientes que alcanzaron baja actividad (41,4%) y de remisión (30,7%) fueron mayores a los observados en países de otras áreas geográficas como Asia y América Latina13. Esto puede ser debido a que el acceso a la medicación y los estándares de tratamiento son distintos y los pacientes pueden entrar en los ensayos clínicos con enfermedades en situación más avanzada o con mayor actividad. Cuando se mide un cambio cuantitativo (como es la respuesta clínica en términos de cambio del DAS28-VSG), los porcentajes de éxito pueden ser similares entre países, mientras que cuando se evalúa un objetivo concreto a alcanzar, como un DAS28-VSG<3,2 o DAS28-VSG<2,6, la calidad del tratamiento de base y de los cuidados estándares recibidos, así como la situación de la que parten los sujetos cuando entran en el estudio, condicionan distintos porcentajes de éxito. Así, los porcentajes de pacientes que alcanzaron remisión en GO-MORE en países de Asia y América Latina fueron menores del 20%, en parte, probablemente, a que los pacientes en estas regiones entraron en el estudio con mayor actividad13. Dado que estas diferencias tienen impacto en los porcentajes globales de éxito en los ensayos clínicos, consideramos que es importante realizar análisis específicos de cada país o región, siempre que el tamaño muestral lo permita y aún con las limitaciones que conlleva, y el análisis realizado de los datos de España cumple este objetivo.
En línea con lo anterior, nuestros datos añaden valor por mostrar, además, la eficacia de golimumab en práctica clínica habitual en la que, si bien el MTX es el FAME utilizado con más frecuencia, también se utilizan otros FAME. En nuestra muestra, el 40,0% estaba recibiendo un FAME distinto de MTX (de los cuales el 16,4% lo estaba tomando asociado a MTX y el 23,6% en monoterapia). Después del MTX, el FAME utilizado con más frecuencia fue la leflunomida. El porcentaje de pacientes con cada FAME fue similar al descrito en el estudio EMAR II, donde el MTX fue el FAME más usado (59,6%) en el grupo de pacientes con AR5, seguido por la leflunomida (22,1%), los antipalúdicos (12,2%) y la sulfasalazina (3,1%), y además, el 20,7% de los pacientes recibieron 2 o más FAME de forma simultánea. En otro estudio en el que se incluyó a pacientes que recibían un primer FAME6, el más frecuentemente utilizado en monoterapia fue el MTX (81,3%), seguido de la leflunomida (4,1%) y la hidroxicloroquina (3,2%). Consideramos, por tanto, que la muestra española del estudio GO-MORE es representativa de la práctica clínica española en AR y, por tanto, los resultados obtenidos son aplicables a una amplia población de pacientes con AR, aquellos en los que los FAME (uno o varios) han fallado y precisan un anti-TNF-alfa. Como hallazgos adicionales, la eficacia de golimumab fue similar en pacientes con distintas dosis de MTX, con fallo a uno o más FAME o en tratamiento o no con esteroides, lo que fortalece los resultados de cara a su aplicación práctica.
Golimumab fue bien tolerado. Es de destacar la baja incidencia de reacciones en el punto de inyección (1,4% en los 6 primeros meses). En este análisis y en la muestra global11, el perfil de acontecimientos adversos comunicados fue congruente con los descritos para golimumab en los ensayos clínicos pivotales y en la ficha técnica del producto7–9,12. La incidencia de los acontecimientos adversos graves individuales también fue similar a la encontrada en dichos estudios de golimumab y en uno similar de adalimumab14. En nuestra muestra, se produjeron 2 muertes (una por un mieloma múltiple con insuficiencia renal aguda y otra por insuficiencia respiratoria en el contexto de una infección de vías respiratorias bajas en la que no se cultivó ningún germen y fibrilación auricular). En la muestra global incluida en el análisis de seguridad (n=3.357) se reportaron únicamente 10 fallecimientos (6 en la parte 1 y 4 adicionales más de 30 días después de la última dosis) sin ninguna causa predominante, de los cuales en 5 casos fueron clasificados por los investigadores como potencialmente relacionados y 5 como no relacionados11.
La principal limitación del estudio es que se trata de un grupo reducido de pacientes (los reclutados en España), y por tanto, la potencia estadística es insuficiente para encontrar diferencias, en el caso de que existiesen, en la eficacia de golimumab entre los distintos grupos analizados. En la muestra global del estudio GO-MORE (n=3.280) no se encontraron diferencias significativas en la eficacia entre los mismos grupos analizados11, por lo que no es de esperar que existan en nuestros pacientes. Hay que tener en cuenta también que la primera parte del estudio GO-MORE, la presentada en el presente trabajo, fue abierta y no controlada, por lo que el estudio está sujeto a los sesgos inherentes a los estudios abiertos sin brazo control. Sin embargo, este análisis es de interés, en primer lugar, por mostrar el efecto de golimumab en una población de pacientes que ha fallado a uno o más FAME, incluidos FAME distintos de MTX, y que representa la población con AR que habitualmente precisa tratamiento con anti-TNF-alfa en práctica clínica habitual en España. En segundo lugar, por mostrar ciertas diferencias en la eficacia de golimumab para alcanzar algunos objetivos (baja actividad o remisión) cuando se compara los resultados de España con la muestra global o con los resultados en otros países. Creemos que si el tamaño muestral lo permite, y asumiendo las limitaciones en la interpretación de los resultados, los análisis de los pacientes incluidos en España en los grandes ensayos clínicos, especialmente si se aproximan a práctica clínica como el presente estudio, son necesarios para definir mejor la eficacia y la seguridad de los fármacos en el perfil de pacientes que habitualmente se ven en nuestras consultas.
En conclusión, los resultados del estudio GO-MORE en España muestran que golimumab es eficaz como tratamiento añadido a distintos FAME, con o sin esteroides, en pacientes con AR que han fallado a uno o más FAME, alcanzándose respuesta DAS28-VSG al sexto mes buena o moderada en un porcentaje muy elevado de pacientes (82,9%), y baja actividad o remisión en un porcentaje significativo de pacientes (41,4% y 30,7%, respectivamente). El inicio de acción fue rápido, el perfil de tolerabilidad bueno y el de seguridad congruente con lo descrito en otros ensayos clínicos y en la ficha técnica del producto.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos siguientes autores declaran conflictos de intereses: María J. Arteaga y Luis Cea-Calvo (empleados a tiempo completo en Merck Sharp & Dohme de España); Carlos M. Gonzalez (asesoría a Merck Sharp & Dohme); María L. García Vivar (asesoría a Roche y Janssen, actividades educativas para Abbie, Pfizer, UCB, Roche, Merck Sharp & Dohme y Bristol-Myers Squibb); Raimon Sanmartí (grant de Merck Sharp & Dohme). El resto de los autores declara no tener conflictos de intereses.
El estudio GO-MORE fue financiado por Schering-Plough (en la actualidad Merck & Co, Whitehouse Station, New Jersey, EE. UU.). En el estudio participaron investigadores de 40 países. Agradecemos a los investigadores su colaboración en la inclusión y el seguimiento de los pacientes del estudio.