INTRODUCCIÓN
Los tumores óseos de células gigantes son infrecuentes1,2. Su principal localización es en extremidades inferiores, con una mayor incidencia en el extremo distal del fémur y proximal de la tibia3-5, siendo otros sitios más infrecuentes en cuanto a su presentación6-8. En el estudio de Goldenberg et al5 139/222 (63%) de las lesiones tumorales óseas se localizaron en las extremidades inferiores; de éstas el 41% fueron en el tercio distal del fémur y el 28% en el tercio proximal de la tibia. Los tumores de células gigantes se presentan principalmente en pacientes jóvenes, entre 20-40 años5-10, por lo que el objetivo principal del tratamiento radical no es sólo lograr la curación del paciente, sino que esta meta se obtenga con la menor toxicidad posible, aguda y a largo plazo, preservando en lo posible la funcionalidad.
El tratamiento de elección es la cirugía11,12. El papel de la radioterapia (RT) en los tumores de células gigantes es incierto, debido a que existen pocos estudios y con escaso número de pacientes que hayan sido tratados con RT, tanto de forma exclusiva como adyuvante3,13, siendo utilizada por la mayoría de las instituciones como medida paliativa en los pacientes con recidivas locales o metástasis a distancia. Otra de las razones por las que se intenta evitar el uso de radiación es el riesgo de inducción de sarcomas5,14, a pesar de que estudios actuales muestran que las transformaciones sarcomatosas son infrecuentes15, por lo que con la baja tasa de recidivas locales alcanzada con las técnicas quirúrgicas actuales el uso de la RT debería evitarse. Su indicación de manera exclusiva, sin embargo, puede realizarse en pacientes con tumores con difícil abordaje quirúrgico, o en aquellos pacientes en los que la cirugía produzca una iatrogenia importante, por lo que la evaluación individualizada de cada caso debe realizarse en un marco multidisciplinario, conformado por oncólogos radioterapeutas, traumatólogos, radiólogos, etc.
Con motivo de la presentación de un caso clínico reciente diagnosticado en el Hospital General Universitario Gregorio Marañón, analizamos los casos documentados en este Hospital y realizamos una revisión sobre el papel de la RT en esta patología.
MATERIALES Y MÉTODOS
Se analiza en primera instancia el caso 12 que llevó al análisis y discusión del tema.
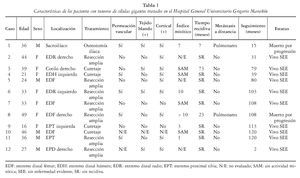
Se realizó una revisión retrospectiva de historias clínicas de pacientes del Hospital General Universitario Gregorio Marañón, buscando en el sistema por diagnóstico de tumor de células gigantes desde el año 1998 hasta 2009, encontrando 12 pacientes. Los datos con respecto a edad, sexo, localización, tratamiento, compromiso de partes blandas, compromiso de la cortical, recidiva y evolución se presentan en la tabla 1.
CASO CLÍNICO
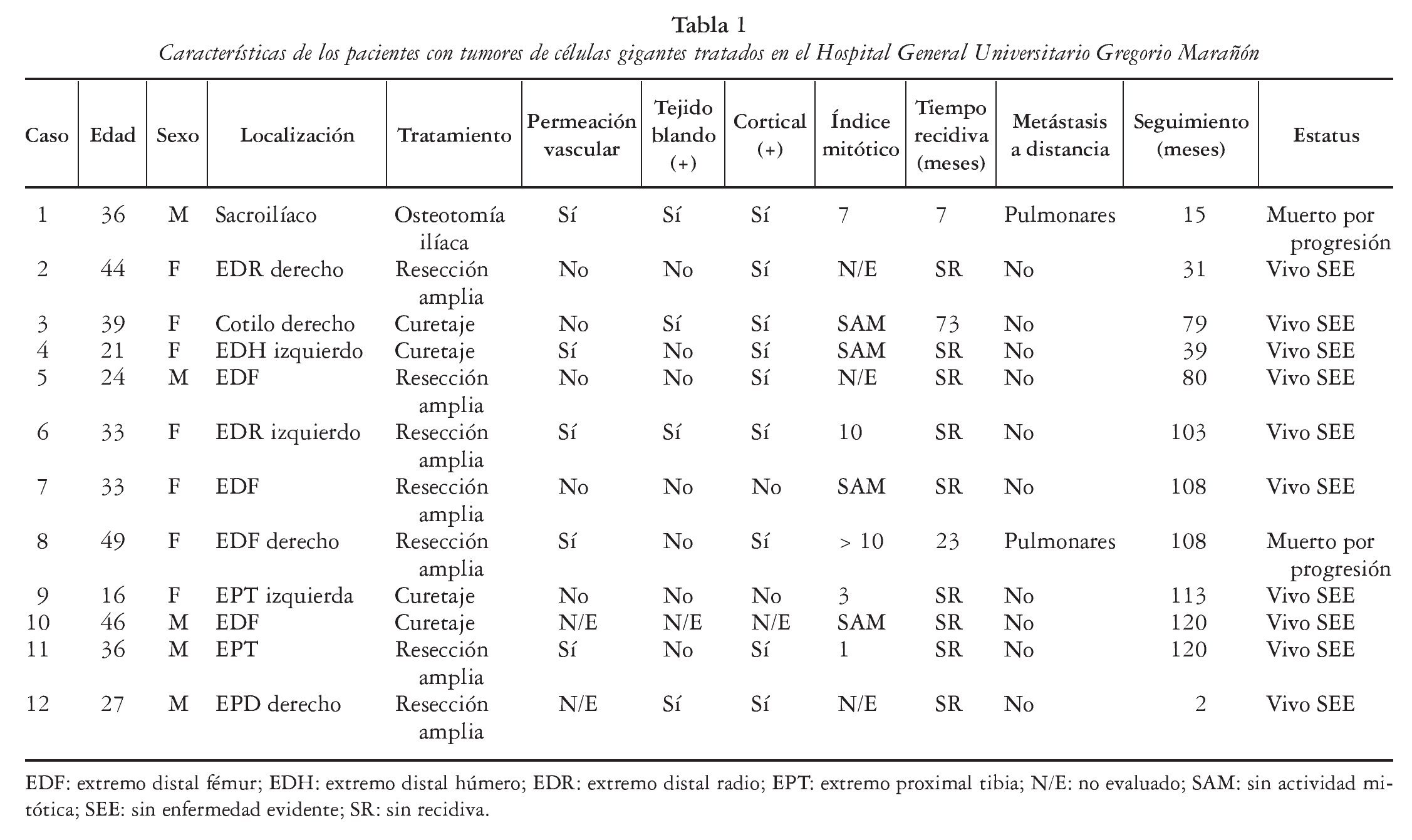
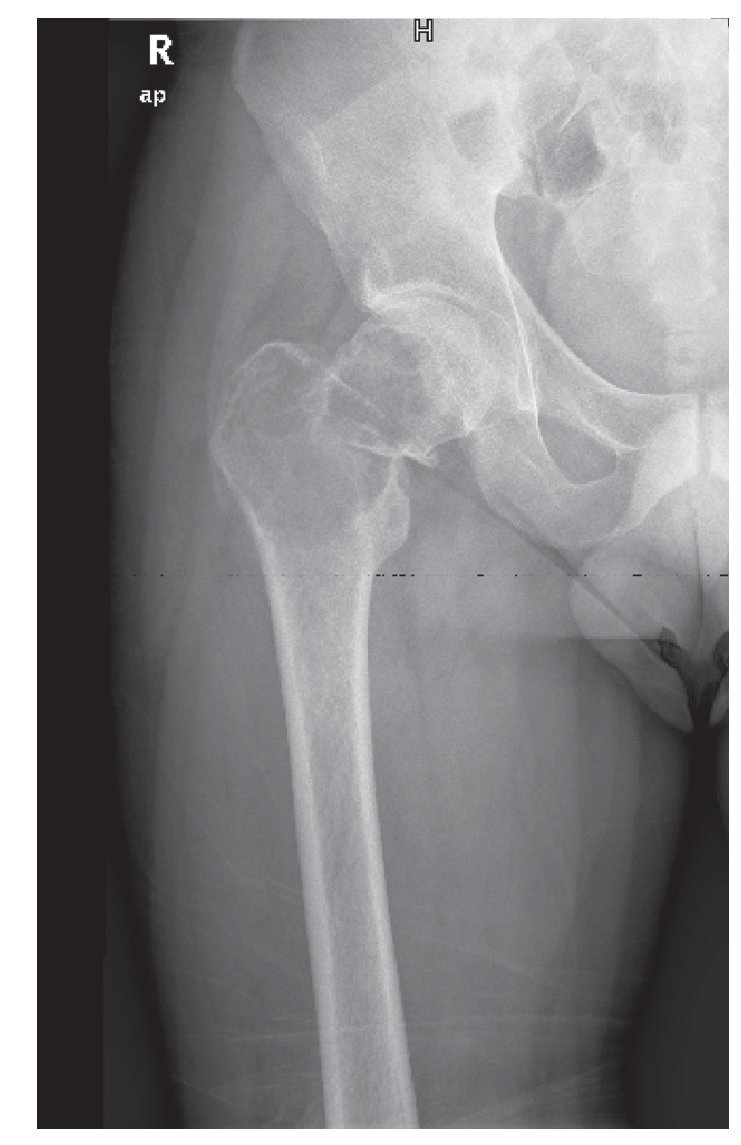
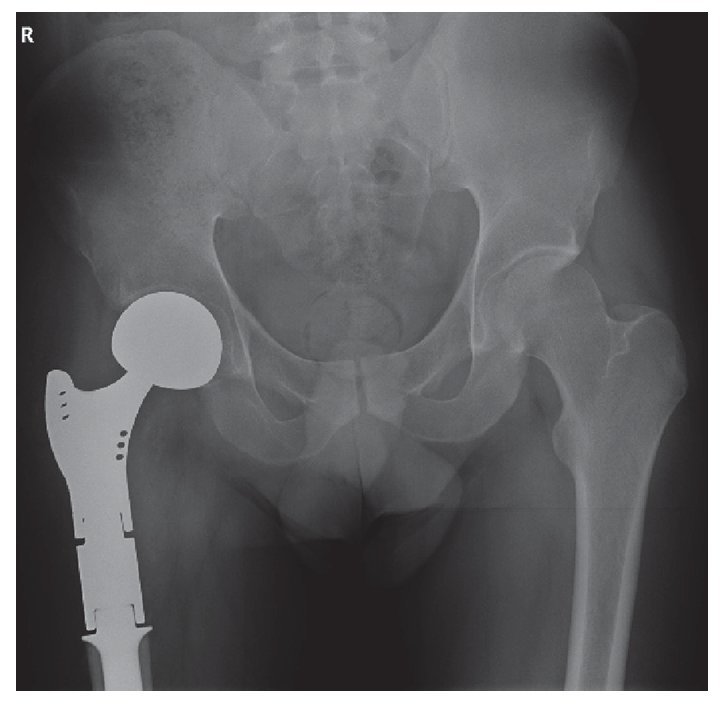
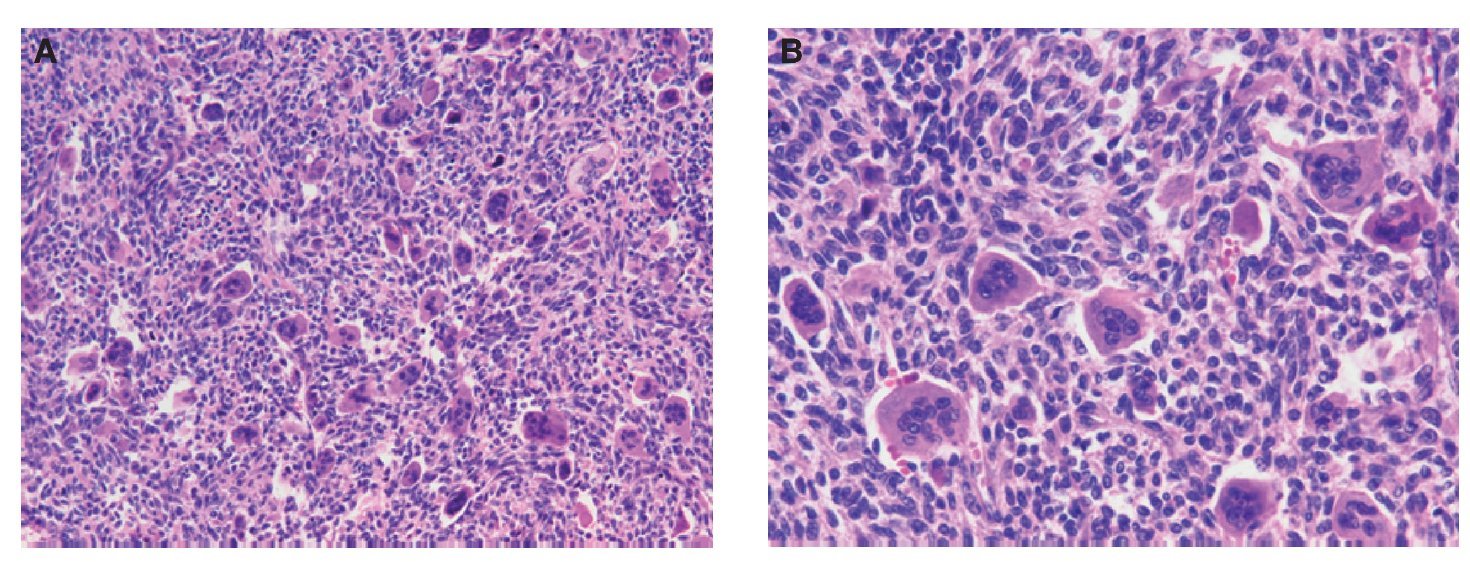
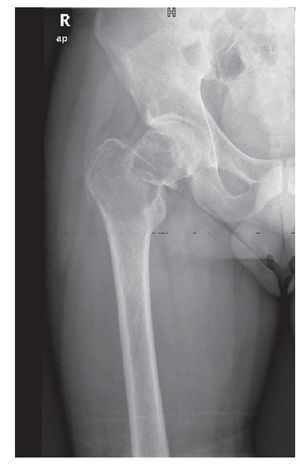
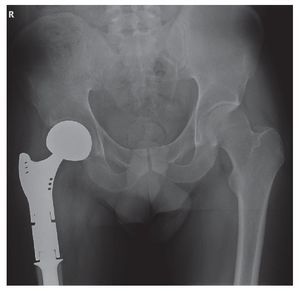
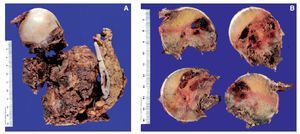
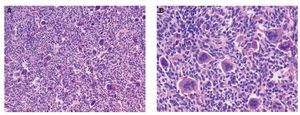
Se trata de un paciente de 27 años, sin antecedentes mórbidos de importancia, que ingresó en Urgencias por cuadro de dolor agudo de reciente comienzo e impotencia funcional. El estudio radiográfico mostró una tumoración osteolítica expansiva con fractura patológica en la región trocantérea femoral derecha (fig. 1). Se referenciaron dos cirugías previas sobre tumoración lítica sin anatomía patológica hace 1 año. Se realizó una biopsia de la tumoración, informándose como tumor de células gigantes. Dada la evolución agresiva de la tumoración, la presencia de fractura patológica y las cirugías previas se decidió realizar cirugía de resección amplia y reconstrucción con prótesis de fémur proximal con un sistema global de sustitución modular (GMRS) (fig. 2). La anatomía patológica reveló en la macroscopía un tumor de 4,5 x 5 cm de contorno lobulado con una superficie de corte homogénea blanco-grisácea (fig. 3A y B). Histológicamente, el estudio de la masa tumoral reveló una neoformación compuesta por células de morfología fusiforme y escasa actividad mitótica, que se ordenaron formando masas amorfas con algunas zonas necróticas y de fibrosis centrales. En la zona central de la tumoración se observaron abundantes células gigantes multinucleadas de aspecto osteoclástico, y en la periferia se identificó osteoide de carácter reactivo (fig. 4A y B). El diagnóstico fue tumor de células gigantes con infiltración de la cabeza femoral y partes blandas que afectaba al margen etiquetado como herida quirúrgica, a las partes blandas y que respetaba el margen de resección distal.
Fig. 1. Radiografía anteroposterior de cadera y fémur derechos. Se aprecia tumoración osteolítica expansiva con fractura patológica en región trocantérea femoral derecha, que invade el cuello y la cabeza femoral.
Fig. 2. Radiografía anteroposterior. Se aprecia prótesis en fémur derecho. Sin otras alteraciones.
Fig. 3. Imagen macroscópica de la pieza tumoral. A. Pieza de resección quirúrgica de 6 x 7 x 3 cm de ejes mayores, que incluye cabeza femoral. Se observa una tumoración localizada en el cuello del fémur que se extiende hasta la cortical, afectando a partes blandas adyacentes, con áreas de crecimiento superficial que se extienden a las regiones lateral y posterior. La tumoración mide 5 cm de eje mayor y muestra una superficie de corte blanquecina-grisácea. Se identifican nódulos satélites en partes blandas. B. Superficie de corte de la tumoración con áreas de aspecto necrótico y hemorrágico.
Fig. 4. Imagen microscópica. Tumor de células gigantes con moderada atipia del componente mononuclear y presencia de abundantes células gigantes tumorales de tipo osteoclasto (A, x10; B, x20).
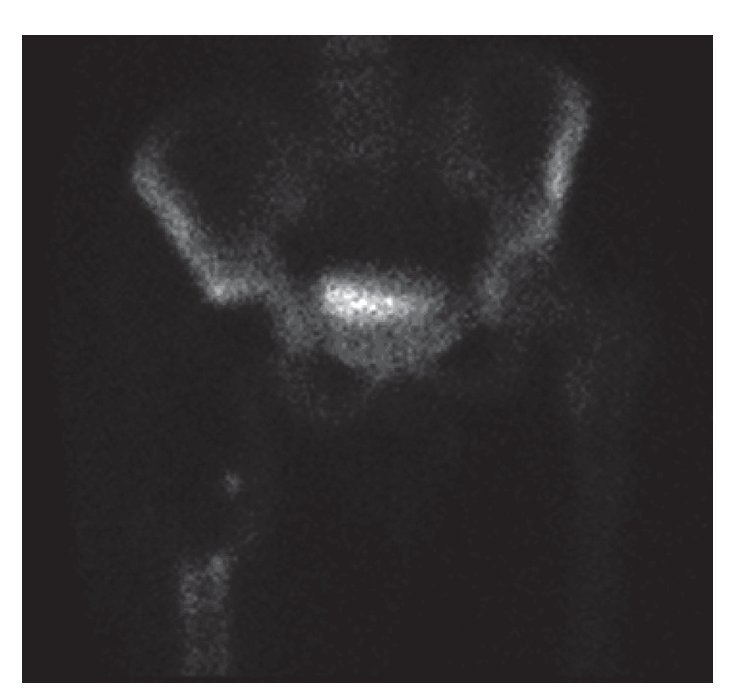
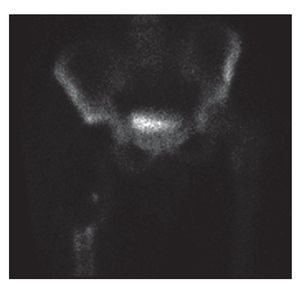
Se realizó un rastreo óseo de extensión que no mostró evidencia de enfermedad residual ni metastásica (fig. 5). Valorado el caso en el comité de tumores se planteó la indicación de adyuvancia con RT, desestimándose su realización en base a la revisión de la literatura.
Fig. 5. Gammagrafía ósea en la que no se visualiza el tercio proximal del fémur derecho en correspondencia con la colocación de prótesis femoral. Se aprecia un aumento difuso de captación a lo largo de los 2/3 distales del fémur derecho, en el reborde acetabular y huesos ilíacos, en relación a la cirugía previa reciente.
RESULTADOS
Se encontraron 12 pacientes, uno de diagnóstico reciente (paciente 12). La mediana de edad fue de 34,5 años (rango 16-49). De los 12 pacientes 5 fueron hombres y 7 mujeres. La distribución por localización tumoral se describe en la tabla 1.
Fueron lesiones tumorales en huesos largos 10/12 (83%), de las cuales 4/12 (33%) se localizaron en el extremo distal del fémur, 2/12 (17%) en el extremo proximal de la tibia, 2/12 (17%) en el extremo distal del radio, 1/12 (8%) en el extremo proximal del fémur y 1/12 (8%) en el extremo distal del húmero; y 2/12 (17%) en los huesos pélvicos.
El tratamiento recibido en todos los pacientes fue quirúrgico, preferentemente resección amplia del tumor en 8/12 casos (67%) y sólo curetaje en 4/12 (33%) pacientes. En los casos en que se analizó la permeación vascular, la infiltración de partes blandas y/o de la cortical se encontró presente en el 50, el 45 y el 82%, respectivamente. Al analizar el índice mitótico de las piezas extraídas se informó en 9/12 (75%) de los casos, señalándose como sin actividad mitótica en 4/9 (44%) pacientes, en 1/9 (11%) una actividad mitótica, en 3 pacientes con tres actividades mitóticas por campo y en un paciente, superior a 10 actividades mitóticas por campo.
Al revisar a los pacientes que tuvieron un seguimiento mayor de 12 meses, 3/11 (27%) recidivaron (casos 1, 3 y 8), dos de ellos muy tempranamente (< 2 años). El paciente 1 recidivó 7 meses después del tratamiento inicial, evidenciándose una extensa recidiva pélvica que producía uropatía obstructiva y dolor. Además, se evidenciaron nódulos pulmonares bilaterales, por lo que se decidió iniciar tratamiento con quimioterapia (cisplatino más adriamicina) y RT paliativa para el manejo de la sintomatología dolorosa. Recibió 30 Gy en 10 sesiones sobre la recidiva pélvica, con una buena respuesta sintomática al tratamiento. El paciente falleció por progresión tumoral. El segundo paciente (8) recidivó a los 23 meses del tratamiento inicial. Se trató con una nueva resección amplia más injerto de prótesis. Sin embargo, a los 11 meses de la recidiva se evidenciaron metástasis pulmonares, que fueron tratadas con 3 líneas de quimioterapia y RT paliativa sobre el hemitórax derecho con 20 Gy en 5 sesiones. Finalmente, el paciente falleció por progresión tumoral. El tercer paciente (3) recidivó a los 73 meses, en el mismo sitio del primario (cotilo derecho), realizándose una resección amplia e injerto de prótesis y recibiendo posteriormente RT adyuvante (46 Gy/23 fracciones). Seis meses después de la recidiva se encuentra vivo sin evidencia de enfermedad.
DISCUSIÓN
El tratamiento estándar de los tumores óseos de células gigantes es la cirugía. El papel de la RT como tratamiento exclusivo, adyuvante o paliativo es tema de debate. La tasa elevada de recidiva tras el tratamiento estándar ha planteado la conveniencia de asociar tratamientos adyuvantes a la cirugía. En nuestra serie, 11 de los 12 pacientes tuvieron un seguimiento superior a 6 meses, con una tasa de recidiva del 27% (3/11). Sung et al11 analizaron 111 pacientes con tumor de células gigantes que tuvieron un seguimiento mayor de 2 años, encontrando una tasa de recidiva local del 26% (29/111). La tasa de recidiva local fue mayor en los que sólo recibieron curetaje (41,2%) frente a los de resección amplia (7,1%). Fraquet et al16, en un análisis con una mediana de seguimiento de 6 años, presentaron 30 pacientes tratados con curetaje y cementación, con o sin fijación interna; la tasa de recidiva fue de 30% (9/30). Campanacci et al10 publicaron en su serie una tasa de recidiva tras una escisión intralesional del 34%, del 7% tras una escisión marginal y del 0% después de una resección amplia. Esto se correlaciona con diversos estudios13 que demuestran que sólo con curetaje el control local es de aproximadamente el 61%, y que este control local aumenta si se realizan resecciones más amplias (91% de control local).
Una serie publicada con la experiencia de diversos hospitales españoles revisó 140 pacientes con tumor de células gigantes de los cuales sólo en 68 pacientes se logró realizar un seguimiento, encontrándose un 29% de recidivas. Los pacientes tratados con resección amplia tenían menos recidivas que aquéllos tratados con curetaje, evidenciándose que los pacientes con resecciones incompletas (curetaje) tenían mayor riesgo de presentar metástasis pulmonares en la evolución17. Este hecho también se reflejó en nuestra serie, donde 2 de los 3 pacientes que recidivaron desarrollaron metástasis pulmonares.
Otros factores que se han asociado a mal control local, como la extensión hacia el tejido blando19,20 y la presencia de un elevado número de mitosis en el tumor17, también estaban presentes en los dos casos de nuestra serie.
El problema, por tanto, es que el curetaje solo no obtiene un buen control local, por lo que se requieren cirugías más amplias que en ciertas localizaciones anatómicas son muy difíciles de realizar por el posible impacto en la funcionalidad y morbilidad del acto quirúrgico. En localizaciones como la columna vertebral, donde la cirugía amplia podría inducir un déficit funcional importante, algunos autores proponen como tratamiento alternativo asociar RT a los pacientes con escisión incompleta (biopsia)20. En el caso 1 el tumor inicial se localizaba a nivel sacroilíaco. La realización de una resección completa en esta localización, sin afectar a la funcionalidad, era difícil. Probablemente, el uso de RT en estas localizaciones como tratamiento adyuvante podría disminuir el riesgo de recidiva local, como lo demuestran otros estudios13,20,21. Sin embargo, no existen estudios aleatorizados que puedan avalar esta afirmación. Micke et al22 analizaron 26 pacientes con tumor de células gigantes, 15 de ellos (58%) con enfermedad primaria o recurrente recibieron RT y el 42% RT tras una resección incompleta o intralesional. La dosis media total de RT fue de 42 Gy (rango 35-60) en fracciones medias de 2 Gy (1,6-3). El control local en todo el grupo fue del 81%. Todas las recidivas ocurrieron fuera del campo de irradiación. Cuando se dieron dosis totales ≥ 42 Gy se obtuvieron mejores resultados. El 11,5% de los pacientes desarrolló metástasis a distancia. La supervivencia global a 5 años fue del 88%. No hubo efectos agudos o tardíos superiores a 2 (escala de la Radiation Therapy Oncology Group/European Organization for Research and Treatment of Cancer [RTOG/EORTC]). Los autores concluyeron que la RT es efectiva como tratamiento adyuvante, e incluso proporciona resultados satisfactorios en tumores irresecables. Krishnan et al23 analizaron 20 pacientes con tumor de células gigantes irradiados, 14 pacientes con RT como tratamiento inicial (10 pacientes con biopsia y 4 con cirugía parcial) y 6 pacientes con RT en el momento de la recidiva. El rango de RT fue de 40-60 Gy, en 15-30 fracciones. Con una mediana de seguimiento de 48 meses, el control local fue del 90%. No hubo toxicidad tardía importante ni transformación sarcomatosa, concluyendo que la RT puede considerarse como tratamiento de primera línea en pacientes en los que la cirugía produciría un importante deterioro funcional. Miszczyk et al3 presentaron 37 pacientes tratados con RT, 23 de ellos con RT posterior a una resección incompleta y 14 con RT como tratamiento exclusivo. La dosis total fue entre 36-64 Gy. El control local a 5 años con resección incompleta más RT adyuvante fue del 83% y con RT exclusiva del 69% (p = no significativa). Nueve pacientes presentaban infiltración de tejidos blandos. El control local a 5 años en los pacientes con infiltración de tejidos blandos fue del 57% frente al 86% en pacientes que no la presentaban, no encontrándose significación estadística. En tumores ≤ 4 cm de diámetro el control local a 5 años fue del 90%, disminuyendo un 8% a medida que el tamaño aumentaba 1 cm de diámetro, encontrándose como única variable significativa el tamaño tumoral. En los tumores ≤ 4 cm de diámetro no hubo diferencias significativas en el control local entre los que recibieron RT postoperatoria y los que la recibieron de forma exclusiva. Concluyendo que la RT con dosis entre 40-45 Gy parece ser altamente efectiva como único tratamiento en tumores ≤ 4 cm de diámetro. Caudell et al13 publicaron 25 casos de tumor de células gigantes que recibieron RT, 13 tumores primarios y 12 recidivas. Diez pacientes fueron catalogados como enfermedad irresecable, y de los resecados sólo 1 presentaba márgenes negativos. La dosis media de RT fue de 46 Gy (rango 25-65). Con una mediana de seguimiento de 8,8 años, la supervivencia global y el control local a 5 años fue del 91% y el 62%, respectivamente. En el grupo de tumores primarios el control local a 5 años fue del 83%. Los autores concluyeron que la RT debía considerarse como tratamiento adyuvante a la cirugía, o como tratamiento exclusivo en aquellos pacientes con tumores de células gigantes irresecables o en que los que la resección produjese un déficit funcional importante. Malone et al24 analizaron 21 pacientes con tumor de células gigantes que recibieron RT, 13 como tratamiento primario y en 8 casos de recidivas. De los 13 pacientes con tumores primarios, 11 recibieron cirugía previa (3 pacientes con enfermedad macroscópica postoperatoria y 8 con enfermedad microscópica). De los 8 casos de recidivas sólo 3 recibieron cirugía previa a la RT. La dosis más frecuentemente utilizada fue 35 Gy/15 fracciones. Con una mediana de seguimiento de 15,4 años se logró el control local en 19/21 pacientes. La RT fue bien tolerada sin evidenciarse secuelas tardías ni transformación sarcomatosa. Los autores concluyeron que estos resultados a largo plazo indicaban que la RT era una opción segura y eficaz como tratamiento en tumores primarios o recurrentes. En un estudio multinacional de 6 centros europeos y de Norteamérica, Bhatia et al25 analizaron 39 pacientes con tumor de células gigantes marginalmente resecados, irresecables o recidivados, todos confirmados por biopsia. El 18% de ellos eran recidivas. Del total, el 36% eran irresecables, el 61% con resección marginal y el 3% R0. La dosis media de RT fue de 50 Gy (20-64,8), con una mediana de 25 fracciones. El tratamiento con RT fue definido como radical en 37 pacientes y paliativo en 2. Con una mediana de seguimiento de 8 años, la recidiva local a 5 años fue del 21%, con una supervivencia global a 5 años del 94%, concluyendo que la RT puede proveer excelentes resultados en control local a largo plazo en tumores irresecables, con resección incompleta o recidivados, con una aceptable morbilidad.
Tras el análisis de la literatura y a la vista de los excelentes resultados de control local en los casos de recidiva local tratados con RT exclusiva como rescate, en el caso 12 de nuestra serie se decidió la no realización de ésta. Se planteó seguimiento activo y demorar la indicación de la RT a la presencia de recidiva local. Finalmente, el uso de RT como medida paliativa en tumores de células gigantes es una excelente alternativa de tratamiento cuando hay compresión medular, destrucción ósea extensa, o metástasis óseas dolorosas. En nuestra serie se utilizó RT de manera paliativa en un paciente con extensa recidiva sacroilíaca dolorosa, logrando un alivio del dolor y una reducción de la masa tumoral, confirmando así que como medida paliativa es una terapia eficaz. De manera paliativa es posible también irradiar lesiones pulmonares metastásicas. En nuestra experiencia se utilizó RT pulmonar, tras la progresión a 3 líneas de quimioterapia, en una paciente con mucha sintomatología pulmonar, principalmente disnea, obteniendo una mejoría clínica importante. Feigenberg et al26 analizaron en 3 pacientes el uso de RT paliativa sobre metástasis pulmonares, con dosis de 16 Gy en 10 sesiones y una sobreimpresión de 35-45 Gy a la enfermedad macroscópica. Un paciente progresó y 2 se encuentran vivos sin enfermedad evidente.
CONCLUSIÓN
La RT en tumores óseos de células gigantes confiere un mejor control local al añadirla posteriormente a un curetaje. En aquellos pacientes con resecciones amplias, que presentan una baja tasa de recidivas, el uso de terapias adyuvantes no se justifica. En aquellos pacientes en los que el tumor se encuentra en sitios difíciles de realizar una resección amplia, como columna cervical, dorsal, lumbar, pelvis, la RT debe ser el tratamiento estándar posterior a la biopsia, alcanzando excelentes tasas de respuesta local. La RT de rescate, tras una recidiva, proporciona una alta tasa de control local sin añadir una morbilidad importante. Por último, la RT como terapia paliativa es una excelente herramienta terapéutica para el alivio sintomático.
Correspondencia: M.E. González Domingo. Instituto Oncológico.
Clínica Reñaca.
Anabaena 363.
Viña del Mar. Chile.
Correo electrónico: mgonzalez@institutooncologico.cl