INTRODUCCION
Diversos estudios sugieren que existe una relación entre la osteoporosis y la arteriosclerosis, debido al aumento de mortalidad global, y específicamente por esta enfermedad, en personas con fracturas o con simple disminución de la masa ósea1-12. También la masa ósea se ha relacionado con el grado de calcificación aórtica o el riesgo de ictus. La posible asociación entre ambas enfermedades podría explicarse, al menos en parte, por la presencia de factores de riesgo en común como el envejecimiento, la depleción de estrógenos o el consumo de tabaco. Pero, además, recientemente se han implicado otros factores como la vitamina D, la osteoprotegerina o la leptina.
Con esta revisión queremos profundizar en el conocimiento de la posible asociación entre ambas enfermedades.
ESTUDIOS EPIDEMIOLÓGICOS
MORTALIDAD Y OSTEOPOROSIS
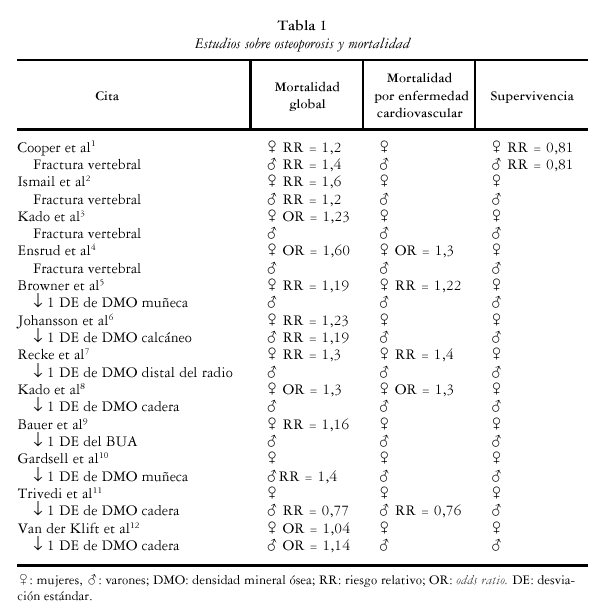
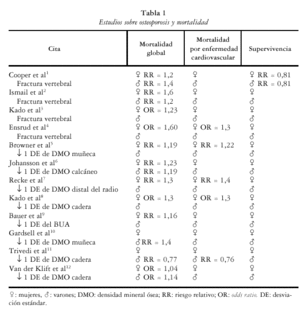
Numerosos estudios describen un aumento de la mortalidad global, y específicamente por causa cardiovascular en personas con fractura vertebral. Un trabajo publicado por Cooper et al1 en individuos de ambos sexos encuentra en pacientes con fractura vertebral una reducción de la supervivencia a los 5 años del 0,81 (OR), y en concreto por causas cardiovasculares, del 0,30 (OR). Más recientemente, un trabajo cooperativo europeo2 sigue una cohorte de personas con el diagnóstico radiológico de fracturas vertebrales y encuentra un riesgo de mortalidad para la población femenina con deformidades vertebrales de 1,9, y para la masculina del 1,3. Otro trabajo similar realizado por Kado et al3 en 9.575 mujeres mayores de 65 años, encuentra un aumento de la mortalidad por todas las causas de 1,23 veces en las que tienen fractura vertebral frente a las no fracturadas, incrementándose el riesgo con el número de fracturas. En este trabajo la fractura vertebral se asoció con mortalidad por cáncer y enfermedad pulmonar, pero no con mortalidad por infarto cerebral o enfermedad coronaria.
Un año más tarde Ensrud et al4 analizan la mortalidad y la hospitalización en 6.459 mujeres del estudio FIT (Fracture Intervention Trial), encontrando una odds ratio (OR) de 1,60 para mortalidad en las que tenían al menos una fractura vertebral (2.027) frente a las no fracturadas (4.432) y de 1,18 para hospitalización. El riesgo de muerte se incrementó con el número de fracturas vertebrales.
También la mortalidad está incrementada en personas con simple disminución de la masa ósea, sin la presencia de fractura. El primer trabajo sobre mortalidad de causa no traumática en mujeres con baja densidad mineral ósea (DMO), se realizó en el año 1991 por Browner et al5 en 9.704 mujeres mayores de 65 años de edad. En él se observó que por cada DE que disminuía la DMO en el radio proximal, se incrementaba la mortalidad por todas las causas en 1,19 veces, y específicamente, la mortalidad por enfermedad cardiovascular en 1,22.
Johansson et al6, en estudios realizados en calcáneo, encuentran un aumento de mortalidad de 1,49 veces con el descenso en 1 DE en la DMO, que tras ajustar por diversas variables se mantenía en 1,23 veces en los varones y 1,19 veces en las mujeres. También von der Recke et al7 estudian la causa de muerte en 1.000 mujeres a las que se les había determinado el contenido mineral óseo (CMO) en el tercio distal del antebrazo, encontrando que las mujeres con menopausia inmediata (309) tenían un riesgo relativo (RR) de muerte por cualquier causa de 1,4 y de 2,3 por causas cardiovasculares, mientras que las mujeres con menopausia tardía (754) sólo tenían incrementada la mortalidad por enfermedad cardiovascular (RR 1,8).
En esta misma línea de trabajos Kado et al8 encuentran en 6.046 mujeres que la pérdida de 1 DE en la DMO de caderas, se asocia a un incremento de la mortalidad por enfermedad coronaria en torno a 1,3 veces, mientras que Bauer et al9, en 5.816 mujeres mayores de 70 años, describen un incremento del 16% en la mortalidad por todas las causas con el descenso de 1DE en el parámetro atenuación ultrasónica de banda ancha (BUA) de los ultrasonidos.
La mayoría de estos trabajos han sido realizados en mujeres, siendo los estudios en varones más escasos. El trabajo de Gardsell et al10 señala un aumento de mortalidad global en varones, con una OR de 1,4 por cada DE de descenso en la DMO de muñeca. Trivedi et al11 encuentran una reducción en la mortalidad global del 23% y en la cardiovascular del 24%, con el incremento de 1 DE en la DMO de cadera, tras estudiar a 1.002 varones mayores de 65 años durante 6,7 años. La reducción de la mortalidad fue aún mayor (30%) tras ajustar en el análisis multivariante por diferentes factores de riesgo cardiovascular (edad, índice de masa corporal, hábito tabáquico, niveles de colesterol, etc.), por lo que los autores concluyen que la DMO de cadera puede ser un predictor independiente de mortalidad por enfermedad cardiovascular en varones de esta edad. En este mismo año van der Klift et al12 llegan a resultados similares al describir en varones una OR para mortalidad por todas las causas de 1,14 por descenso en 1 DE de la DMO en el cuello de fémur.
Parece, pues, poder concluirse que la osteoporosis con o sin desarrollo de fractura es un marcador de riesgo de mortalidad. En concreto, además, la osteoporosis podría ser un marcador de mortalidad por enfermedad cardiovascular arteriosclerosa. En la tabla 1 hacemos un resumen de los trabajos comentados. Como se observa, la presencia de fractura vertebral aumenta el riesgo de mortalidad por un factor que parece situarse en torno a 1,3. También la mortalidad cardiovascular aumenta en torno a 1,3 veces. Análogamente, la simple presencia de masa ósea baja incrementa la mortalidad, y curiosamente, lo hace por un factor similar (1,3), tanto en lo que se refiere a la mortalidad global como a la cardiovascular.
ENFERMEDAD VASCULAR Y MASA ÓSEA
Desde el año 1968 se conoce la asociación entre calcificación de la aorta y fracturas vertebrales13. Son también numerosos los trabajos que relacionan la calcificación vascular con la masa ósea. Frye et al14 estudiaron en 200 mujeres mayores de 50 años el grado de calcificación de la aorta mediante RX y la masa ósea mediante densitometría (DXA), encontrando, tras ajustar por la edad, una asociación negativa entre ambas. Otro trabajo realizado en 115 mujeres postmenopáusicas describe, en las que tienen calcificación aórtica, menor DMO a nivel de fémur proximal15. También se ha relacionado directamente la progresión de la calcificación de aorta con la pérdida de masa ósea16. De hecho, el estudio Framingham17 pone de manifiesto una relación entre el porcentaje de cambio en el grado de calcificación de la aorta abdominal (valorado mediante RX en un período de 25 años) y el porcentaje de cambio en la masa ósea cortical. La progresión de la calcificación se asoció con el descenso de la masa ósea en el grupo de mujeres, pero no en los varones. Un estudio18 más reciente valora la asociación entre osteoporosis y arteriosclerosis coronaria en 45 mujeres postmenopáusicas, a las que se les mide el calcio coronario por tomografía cardíaca con emisión de electrones (EBT), y la DMO mediante DXA. En este trabajo las mujeres con osteoporosis en columna lumbar (T < 2,5) presentan mayores depósitos de calcio coronario que las mujeres del grupo control. Además, se establece una relación inversa entre dichos depósitos y la masa ósea en cadera total (r = 0,34) y columna lumbar (r = 0,28).
Por otra parte, en un grupo de mujeres se ha relacionado la gravedad de la placa arteriosclerosa carotídea (valorada mediante ultrasonografía), con la DMO total (g/cm2) determinada por DXA (r = 0,54)19, lo que plantea la asociación entre aterosclerosis carotídea y osteoporosis. Un trabajo20, cuyos resultados apuntan en la misma dirección, analiza las muertes por accidente cerebrovascular (ACVA) durante un 1,9 años en 4.024 mujeres mayores de 65 años, de las cuales 83 sufrieron un primer ACVA. El descenso de 1 DE en la DMO (0,09 g/cm2) de calcáneo incrementó el riesgo de ACVA en 1,3 veces, tras ajustar por la edad y diferentes factores de confusión como el tabaco, grado de actividad, etc. Jorgensen et al21 también concluyen que la DMO baja puede predecir la aparición de infarto cerebral en las mujeres, con una OR de 1,9 por descenso de 1 DE en la DMO de cuello de fémur.
Sin embargo, no todos los autores encuentran resultados similares. Por ejemplo, un trabajo sobre calcificación aórtica y DMO lumbar medida por densitometría en 130 mujeres postmenopáusicas no muestra una asociación significativa22. Otro trabajo realizado por Vogt et al23, en 2.051 mujeres mayores de 65 años tampoco muestra asociación entre DMO y el grado de calcificación de la aorta, por lo que estos autores proponen que simplemente ambos procesos, osteoporosis y calcificación aórtica, son independientes y acompañan al envejecimiento sin relación causal. De esta misma opinión son Aoyagi et al24, que no encuentran asociación entre la calcificación de aorta y la DMO (índice Z) en 524 mujeres japonesas tras ajustar por la edad, tensión arterial sistólica, actividad física y tabaco, o Vogt et al25 que en 1997 tampoco describen una mayor prevalencia de fracturas vertebrales en 1.500 mujeres postmenopáusicas con enfermedades vasculares.
Sin embargo, frente a estos últimos trabajos, un elevado número de estudios parece indicar que la DMO baja se asocia con calcificación vascular y arteriosclerosis más allá de la simple relación casual.
FACTORES DE RIESGO COMUNES
Como se ha señalado antes existen diversos factores de riesgo comunes a la osteoporosis y la enfermedad vascular, como la depleción de estrógenos, el envejecimiento, el consumo de tabaco o el sedentarismo.
DEPLECIÓN DE ESTRÓGENOS
Tradicionalmente se ha considerado que la deficiencia de estrógenos es un factor de riesgo para el desarrollo de osteoporosis y arteriosclerosis.
La pérdida de masa ósea y el posible desarrollo de osteoporosis con la menopausia, ya señalados por Albright hace 60 años, son hechos bien establecidos. El efecto beneficioso de los estrógenos sobre la masa ósea está fuera de toda duda26, e incluso desde el estudio WHI se acepta su capacidad para disminuir las fracturas osteoporóticas27.
El aumento de incidencia de enfermedad vascular después de la menopausia parece sugerir también la intervención de la depleción de estrógenos en el desarrollo de arteriosclerosis en la mujer, aunque existen algunas dudas respecto a la misma. La existencia de un probable efecto perjudicial de la administración de dichas hormonas28 oscurece el papel patogénico de su déficit, y dificulta el establecimiento de relaciones entre la osteoporosis y la arterioesclerosis a través del mismo.
EDAD
La arteriosclerosis y la osteoporosis son procesos que acompañan al envejecimiento. La osteoporosis afecta a un 23% de mujeres españolas mayores de 50 años y a un 40% de las mayores de 7029. La prevalencia de enfermedad aterotrombótica aumenta también con la edad. Del 10% al 20% de las personas mayores de 60 años tiene enfermedad coronaria conocida30. Por lo tanto, los cambios que acompañan al envejecimiento podrían explicar simultáneamente la pérdida de masa ósea y el desarrollo de arteriosclerosis.
SEDENTARISMO
El sedentarismo es un factor de riesgo de fractura osteoporótica31. El ejercicio físico tiene un papel importante en la obtención del pico de masa ósea32,33, y parece prevenir la fractura osteoporótica no sólo por aumentar la masa ósea, sino también por aumentar la masa muscular, la mayor coordinación y estabilidad que proporciona34. Por otra parte se sabe que la actividad física regular se asocia con un descenso en la mortalidad por enfermedades cardiovasculares35. El sedentarismo es un importante factor de riesgo para la enfermedad cardiovascular36. Por lo tanto, la presencia de ambos factores, edad y sedentarismo, pueden constituir un nexo común entre ambas enfermedades.
TABACO Y ALCOHOL
El consumo de tabaco es un factor de riesgo bien conocido para el desarrollo de osteoporosis y arteriosclerosis.
El consumo de tabaco se relaciona con masa ósea baja y riesgo de fractura. En casi 12.000 mujeres de 47-56 años se demostró una asociación dosis-dependiente entre el consumo de cigarrillos y el riesgo de fractura37. Un metaanálisis38 publicado en el año 2001 que engloba 86 estudios sobre el consumo de tabaco como factor de riesgo de osteoporosis analiza la DMO en 40.753 personas (valorada mediante DXA o tomografía cuantitativa), llegando a la conclusión de que los fumadores de ambos sexos tienen disminuida la DMO en cadera, columna, antebrazo y calcáneo respecto a los no fumadores, con un incremento del riesgo de fractura vertebral del 13% en las mujeres y del 32% en los varones, y de fractura de cadera del 31% y el 40%, respectivamente. Por otra parte, las mujeres fumadoras tienen descenso en la absorción del calcio, niveles bajos de 25 OHD y aumento en la hormona parotiroidea (PTH) y en los marcadores de remodelación ósea (osteocalcina y NTx/Cr) con respecto a las no fumadoras39.
El papel del tabaco como factor de riesgo cardiovascular está también bien establecido40-42.
Podríamos pensar que el consumo de tabaco puede explicar, al menos en parte, la asociación entre osteoporosis y arteriosclerosis, pero la mayoría de los estudios realizados que relacionan la masa ósea con la enfermedad vascular han ajustado por este factor, por lo que parece que el consumo de tabaco no explica por sí sólo esta relación.
En cuanto al papel del consumo de alcohol como factor de riesgo de osteoporosis y arteriosclerosis es controvertido.
El alcohol inhibe la proliferación de células osteoblásticas en cultivo43. Su consumo prolongado y en exceso disminuye los metabolitos de la vitamina D y causa hipogonadismo secundario, lo que es perjudicial para el hueso44,45. Sin embargo, el consumo moderado parece ser beneficioso. Feskanich et al46 encuentran en 188 mujeres postmenopáusicas una mayor DMO en columna lumbar en las que consumen al menos 75 mg de alcohol a la semana, frente a las no bebedoras (0,951 frente a 0,849 g/cm2, p = 0,002), tras ajustar por variables como edad, índice de masa corporal (IMC), tiempo de menopausia, uso de estrógenos y tabaco. También Ganry et al47, en el estudio EPIDOS, encuentran una asociación positiva entre el consumo moderado de alcohol (1-3 vasos de vino/ día) y la DMO en trocánter en 7.598 mujeres, y resultados similares observaron May et al48 en un estudio con 458 varones. Respecto al desarrollo de enfermedad vascular, la ingesta moderada de alcohol parece reducir el riesgo de infarto de miocardio49, mientras que el consumo crónico elevado favorece el desarrollo de hipertensión arterial50 y aumenta la incidencia de enfermedad vascular periférica51.
DIETA
La dieta es un factor importante para el desarrollo de osteoporosis y arteriosclerosis52. Se sabe que la ingesta baja de calcio disminuye la DMO53,54, y se ha planteado la hipótesis de que la ingesta de calcio y vitamina D tenga influencia sobre la enfermedad cardiovascular. Estudios en animales de experimentación, y más recientemente en seres humanos, han demostrado que la ingesta elevada de calcio desciende los niveles de colesterol55-57 y presión arterial58. Reid et al59 realizaron en mujeres suplementos en la dieta de 1 g/día de citrato cálcico y encontraron al año unos niveles superiores de lipoproteína de alta densidad (HDL) y cociente HDL/LDL (lipoproteína de baja densidad) respecto al grupo placebo. Por otra parte, Bostick et al60 tras seguir a 34.486 mujeres (55-69 años) durante 8 años, encuentran una menor proporción de fallecimientos por causa cardiovascular (387) en las que presentaron mayor ingesta de calcio.
El consumo de lípidos con la dieta también podría constituir un nexo patogénico entre osteoporosis y arteriosclerosis. Se sabe que el consumo de ácidos grasos poliinsaturados reduce el riesgo de eventos y mortalidad coronaria en pacientes con cardiopatía isquémica previa61, pero se les atribuye también un efecto antiosteoporótico por su acción sobre la diferenciación celular ósea y el metabolismo óseo62, ya que aumentan la síntesis de óxido nítrico y favorecen la supresión de citocinas proinflamatorias (factor de necrosis tumoral alfa e IL-1, IL-6), lo que puede ser beneficioso para el hueso63. En cuanto a la dieta con alto contenido en ácidos grasos saturados sabemos que favorece el desarrollo de enfermedad coronaria64, y se piensa también que son perjudiciales para el hueso, entre otros motivos, por disminuir la absorción intestinal de calcio, lo que a la larga favorece el desarrollo de osteoporosis65.
Otros aspectos nutricionales se refieren a la albúmina, la vitamina C y la vitamina K. El papel de la albúmina en la osteoporosis y la enfermedad cardiovascular es controvertido. Por una parte existen discrepancias sobre su implicación en la patogenia de la osteoporosis. Algunos trabajos no han encontrado relación entre la albúmina y la densidad mineral ósea en mujeres sanas, pero sí en mujeres con hipoalbuminemia secundaria a alguna enfermedad66. Otro trabajo realizado en varones y mujeres no encontró asociación entre los valores de albúmina y la DMO67. Sin embargo hay estudios que sí relacionan la albúmina con la masa ósea y el riesgo de fractura. Concretamente, un estudio del año 2001 concluyó que los niveles de albúmina e IGF-1 predicen el riesgo de osteoporosis y fractura vertebral en mujeres postmenopáusicas68, y otro ha señalado que los niveles de albúmina se correlacionan positivamente con el contenido mineral óseo en el cuello del fémur69.
La implicación de la albúmina en la enfermedad cardiovascular es también compleja. Los niveles bajos de albúmina sérica parecen relacionarse con la enfermedad arterial coronaria y su mortalidad. Un estudio prospectivo realizado por Phillips et al70 encuentra que niveles de albúmina inferiores a 4,0 mg/dl aumentan el riesgo de muerte por todas las causas incluida la enfermedad cardiovascular, y en el mismo sentido, Gillum et al71 encuentran en pacientes con enfermedad coronaria, una reducción en la incidencia de eventos y mortalidad cardiovascular con niveles de albúmina iguales o superiores a 4,5 g/dl. Un trabajo más reciente, de Kuller et al72, describe también en pacientes coronarios una correlación inversa entre la albúmina y los eventos clínicos de la enfermedad arterial coronaria (infarto de miocardio y muerte), tras ajustar por diferentes factores de riesgo cardiovascular. El porqué niveles bajos de albúmina se relacionan con la enfermedad vascular no se sabe con seguridad. Por una parte parece que la albúmina se relaciona con la tensión arterial, y por otro la hipoalbuminemia se acompaña con frecuencia de un aumento de los reactantes de fase aguda que pueden desempeñar un papel en la progresión de la arteriosclerosis. Se habla también de un posible efecto antioxidante.
También la vitamina C tiene efectos sobre la masa ósea y el desarrollo de arteriosclerosis. Se sabe que pacientes con fractura de cadera, frente a sus controles, tienen niveles inferiores de ácido ascórbico73, y se ha señalado también una asociación positiva entre la DMO de cuello de fémur y niveles de vitamina C74, por lo que se ha planteado que la deficiencia de vitamina C puede ser un factor nutricional que influya en la masa ósea y en el riesgo de fractura. Sin embargo, otros trabajos no encuentran relación entre la masa ósea y los niveles de ácido ascórbico75. Se conoce bien la acción antioxidante de la vitamina C y su deficiencia se ha relacionado también con disfunción endotelial y la arteriosclerosis. Varios trabajos han comprobado la relación entre niveles bajos de vitamina C y la arteriosclerosis carotídea76,77, y parece que los niveles de vitamina C pueden predecir el riesgo de muerte en personas mayores78. Por lo tanto, parece que la deficiencia de vitamina C podría constituir también un nexo entre ambas enfermedades.
La vitamina K está implicada en la actividad biológica de los factores de coagulación y en la síntesis de proteínas del hueso como la osteocalcina y la proteína GLA de la matriz ósea. Los niveles de vitamina K en sangre podrían ser un factor común en la génesis de la osteoporosis y de la arteriosclerosis. Niveles bajos de vitamina K se asocian a baja masa ósea y calcificación vascular79, así como a aumento del riesgo de fractura de cadera80. Las mujeres con fractura vertebral, frente a las mujeres sin fractura, tienen niveles inferiores de vitamina K81. Además, se sabe que la deficiencia de vitamina K y los antagonistas de esta vitamina favorecen la calcificación vascular82. Jie et al83 han comprobado, en primer lugar, la asociación entre niveles bajos de vitamina K y calcificación de la aorta abdominal, y, en segundo lugar, que las mujeres con dicha calcificación presentan menores valores de DMO84. Estos y otros trabajos apoyan la idea de que la deficiencia de vitamina K puede favorecer la aparición y el desarrollo de ambas enfermedades.
METABOLISMO ÓSEO Y ENFERMEDAD VASCULAR
El hecho de que las arterias puedan calcificarse, y el de que se hayan descrito acciones vasculares para las hormonas calciotropas, ha dado lugar a que se haya planteado la existencia de una posible relación entre la enfermedad vascular y las alteraciones de la homeostasis mineral.
La calcificación vascular es un hecho transcendental en la evolución de la arteriosclerosis. Se sabe que la calcificación de la aorta predice la mortalidad por enfermedad cardiovascular85, y que en el 94% de las autopsias de pacientes con cardiopatía isquémica se encuentran las arterias coronarias calcificadas86.
Se ha llegado a pensar que la calcificación vascular es un proceso activo regulado por procesos similares a los de la mineralización ósea, con la influencia de varias moléculas implicadas en el metabolismo óseo87, entre ellas la osteopontina.
Esta glucoproteína fosforilada segregada por los macrófagos está involucrada en la formación y calcificación óseas. Se ha descrito en los miocitos de las placas ateromatosas aórticas ARNm de osteopontina88, y por técnicas inmunohistoquímicas se ha demostrado osteopontina en segmentos de arterias coronarias ateroscleróticas89, y en las placas calcificadas de las arterias coronarias90.
También la proteína Gla de la matriz ósea (MGP) es un factor regulador del metabolismo óseo y la calcificación vascular. Se sabe que esta proteína depende de la dotación del organismo en vitamina K, ya que debe sufrir un proceso de gamma-carboxilación previa para ser funcional, y en este proceso se usa vitamina K como cofactor. Por ello la deficiencia de vitamina K puede influir en la actividad de esta proteína91. Se ha descrito su presencia en las células musculares lisas del vaso92, y se la considera un inhibidor de la calcificación vascular93, de tal manera que en el ratón con deficiencia de esta proteína se observa una calcificación vascular extensa94. En cuanto a sus acciones en el hueso se ha descrito una acción neutralizante de la MGP sobre las proteínas morfogenéticas del hueso (BPM), promotoras de la formación ósea95, y una asociación entre los polimorfismos de la MGP con la DMO en mujeres96.
La osteoprotegerina (OPG) es una sustancia producida por los osteoblastos inmaduros y células del estroma de la médula ósea, cuya función es bloquear una proteína de superficie de estas mismas células (denominada RANKL), que es estimuladora de los osteoclastos. La implicación de la OPG en el sistema vascular parte de los estudios en ratones knockout, genéticamente deficitarios en OPG, que desarrollan osteoporosis y calcificación vascular97. Se ha demostrado expresión de ARNm de OPG en la capa media de grandes arterias98, y también se ha señalado la presencia de OPG y RANKL en las células endoteliales99. Además, la administración de OPG inhibe la calcificación vascular inducida por vitamina D y warfarina100. Sin embargo, los estudios epidemiológicos son contradictorios. En mujeres con vasculopatía diabética los niveles séricos de OPG son superiores a lo normal, y se relacionan con la mortalidad global y la de causa cardiovascular (OR de 1,4 por 1 DE de aumento en la OPG)101. También se ha descrito una relación positiva de la OPG con la gravedad de la enfermedad coronaria102, lo que ha planteado que pudiera tener un carácter compensador.
Otros nexos comunes entre calcificación vascular y hueso son el péptido relacionado con la hormona paratiroidea (PTHrp)103, detectado con técnicas inmunohistoquímicas en las células musculares lisas de arterias coronarias arterioscleróticas104, los cristales de hidroxiapatita (principal componente inorgánico del hueso) presentes en los depósitos minerales de las arterias calcificadas, o el hecho de que el colágeno tipo I, característico del hueso, sea el principal componente colágeno en la lesión arteriosclerosa.
La relación entre vitamina D y enfermedad vascular merece una mención especial. Numerosos trabajos asocian a la vitamina D con el desarrollo de arteriosclerosis. Estudios en animales de experimentación han demostrado que altas concentraciones de vitamina D en la dieta favorecen el desarrollo de arteriosclerosis coronaria y de aorta105. También estudios con vitamina D en cultivos celulares encuentran que la 1,25(OH)2D estimula el crecimiento de los miocitos vasculares106, y favorece el desarrollo de aneurismas de aorta abdominal, por inhibición de la producción de elastina107. Además, un estudio epidemiológico realizado por Moon et al108 observó que tras suplementar los alimentos con vitamina D en Estados Unidos aumentó la incidencia de enfermedad arteriosclerosa.
Sin embargo, otros trabajos plantean la relación en un sentido contrario. Así, en base a que la mortalidad por cardiopatía isquémica es mayor en los meses del invierno, cuando los niveles séricos de vitamina D disminuyen109, se ha sugerido que es la deficiencia de vitamina D lo que puede causar enfermedad vascular. Por otra parte, se han descrito niveles bajos de 25(OH)D en pacientes con infarto agudo de miocardio110,111, así como una relación inversa entre la 1,25(OH)2D y el grado de calcificación coronaria, valorada mediante tomografía con emisión de electrones (EBTC)112. Sin embargo, esta relación no ha sido encontrada por otros autores113.
La deficiencia de 25OHD y 1,25(OH)2D también se ha relacionado con distintos factores de riesgo cardiovascular. Estudios realizados en ambos sexos han establecido una relación inversa entre los niveles de calcitriol y la presión arterial sistólica114,115. Además, la suplementación con vitamina D parece reducir la presión arterial en pacientes hipertensos116, quizás en base a la relación inversa entre las concentraciones de 1,25(OH)2D y renina117. Por otra parte, las personas fumadoras tienen niveles inferiores de 25OHD y 1,25(OH)2D. Concretamente, un metaanálisis reciente en 2.015 mujeres perimenopáusicas relaciona inversamente la concentración de vitamina D con el consumo diario de cigarrillos118. También en los varones se describen resultados semejantes119, aunque no obstante, hay trabajos discrepantes120. La relación de la vitamina D con el colesterol también es controvertida. Se ha descrito un incremento de las c-LDL en mujeres postmenopáusicas tratadas con 300 UI/día de vitamina D3 durante tres años121, pero otros estudios no encuentran variaciones en las c-LDL tras administrar 100.000 UI de colecalciferol122, o en las cHDL tras suplementar con vitamina D3 a personas ingresadas en instituciones123.
También existen trabajos que relacionan las alteraciones en el metabolismo del calcio con la presión arterial. Estudios iniciales han encontrado niveles bajos de calcio sérico en pacientes con hipertensión arterial124 y asociación entre presión arterial y déficit de calcio en la dieta125. En cambio, el aumento del calcio intracelular sería causa de hipertensión arterial, mecanismo por el que actuaría la PTH126, que favorece su captación por las células musculares lisas del vaso. Sin embargo, el papel de la PTH en la hipertensión arterial es discutido. De hecho, las acciones de la PTH sobre la presión arterial son contradictorias. Por una parte, tiene un efecto hipotensor y vasodilatador agudo cuando se administra en animales de experimentación127, pero por otra, se ha señalado un efecto hipertensivo a largo plazo128, y se sabe que la perfusión continuada de PTH incrementa la presión arterial129.
En clínica se han encontrado valores de PTH más altos en sujetos hipertensos que en personas normales130,131, pero esta relación podría deberse al hecho de que la propia hipertensión induce hipercalciuria132.
También se ha descrito menor DMO en columna lumbar en mujeres133 y varones134 con hipertensión arterial esencial.
FACTORES REGULADORES DEL SISTEMA VASCULAR CON REPERCUSION SOBRE EL HUESO
La hiperlipidemia puede ser un factor de riesgo común para la enfermedad cardiovascular y la osteoporosis. Se ha demostrado en estudios in vitro que productos de la oxidación de lípidos presentes en el espacio subendotelial de las arterias del hueso inhiben la diferenciación osteoblástica135, y que en animales de experimentación los lípidos que se acumulan en el tejido óseo alrededor de los vasos promueven la resorción del hueso favoreciendo la diferenciación de precursores de los osteoclastos136. Por otra parte, se conoce bien la presencia de los productos de oxidación de las LDL en las placas arteriosclerosis137. De hecho, hay una cierta similitud entre el proceso de mineralización en el hueso y en los vasos, y diversos factores, como la LDL-oxidasa, pueden influir en el desarrollo de ambas enfermedades138, como se ha demostrado en ratones que recibieron una dieta rica en grasas139. También se han implicado los polimorfismos del gen de la apolipoproteína E en el descenso de la DMO140 y la fractura de cadera141.
La leptina parece también estar implicada en ambas enfermedades. Su relación con la DMO es probable que varíe con diversas circunstancias, como la forma y el momento de administración142. Estudios in vitro señalan que la leptina aumenta la diferenciación osteoblástica, lo que podría guardar relación con el hecho de que la leptina inhibe la dipocitogénesis, y con el de que existe una relación recíproca entre la diferenciación de las células del estroma de la médula ósea hacia adipocitos o hacia osteoblastos143. Por otra parte, se ha observado que la leptina inhibe el RANKL y estimula la producción de OPG144 y del antagonista del receptor de la IL-1145, lo que supone una disminución de la resorción ósea. En consonancia con estos datos, estudios in vivo han permitido observar que la administración subcutánea de leptina a ratas en las que se induce deficiencia estrogénica bloquea la pérdida de masa ósea146. Sin embargo, la administración de leptina por vía intraventricular desarrolla el efecto contrario, haciendo disminuir la masa ósea147.
Los estudios epidemiológicos realizados en el hombre tampoco han conducido a resultados consistentes. Yamauchi et al148 han encontrado en mujeres postmenopáusicas una asociación positiva entre la concentración de leptina en plasma y la DMO en el cuello de fémur. Además, observaron también que los niveles de leptina eran menores en las mujeres con fractura vertebral que en las no fracturadas. A conclusiones similares llegan Blain et al149 y Thomas et al150, pero no Odabasi et al151. En el varón, Thomas et al152 no comprobaron la relación que habían encontrado en las mujeres, pero en cambio Sato et al153 encontraron una relación inversa. Estos últimos autores han estudiado también la relación entre los niveles séricos de leptina y los de los marcadores de remodelación, observando una relación inversa con los marcadores de formación, pero no con los de resorción154. En cambio, Iawamoto et al155 han descrito una asociación directa entre la leptina y la fosfatasa alcalina, mientras que Goulding et al156 no han encontrado relación entre la leptina y los marcadores de remodelación ósea, tanto de resorción (desoxipiridinolina, hidroxiprolina) como de formación (osteocalcina).
En cuanto a la implicación de la leptina en la enfermedad vascular se ha descrito un efecto protombótico de la misma157,158, probablemente por su acción sobre receptores específicos de las plaquetas. También se la relaciona con procesos de calcificación vascular159, y se encuentra elevada en pacientes con enfermedad coronaria160.
Diferentes estudios sugieren que la arteriosclerosis puede producir osteoporosis por efecto directo de la isquemia sobre el hueso. En estudios anatomopatológicos se ha demostrado que las arteriolas del hueso pueden estar afectadas por la arteriosclerosis con lesiones histológicas comparables a la ateromatosis en otras localizaciones. En 1962 Ramseier et al161 estudiaron la vascularización ósea de 100 cadáveres demostrando lesiones arterioscleróticas. Se sabe que los varones con ateromatosis en uno de sus miembros inferiores tienen una DMO más baja en la extremidad afecta162, y que la arteriopatía periférica es causa de osteoporosis163, aunque en este caso pueden influir otros factores como el sedentarismo o el tabaquismo previo. Junto a la ausencia del efecto trófico de la sangre se ha implicado la intervención del propio débito sanguíneo intraóseo, que en caso de arteriosclerosis estaría ausente164.
TRATAMIENTOS
ESTATINAS Y HUESO
Las estatinas (inhibidoras de la HMG-CoA reductasa) previenen la enfermedad arterial coronaria a través de la reducción en las c-LDL. Recientes trabajos sugieren que podrían ser también beneficiosas en la osteoporosis, por efecto directo sobre el hueso, o a través de su acción en el metabolismo lipídico. Podrían tener un efecto modulador en la formación ósea, estimulando la expresión de las BPM, que son factores de crecimiento que inducen la diferenciación y maduración de los osteoblastos165,166. También se ha propuesto que las estatinas sean inhibidoras de la resorción ósea, mediante su actuación en el metabolismo del mevalonato, inhibiendo la actividad del osteoclasto, como se ha señalado para los bifosfonatos167. Por lo tanto, parece que las estatinas podrían aumentar la formación de hueso y disminuir su resorción.
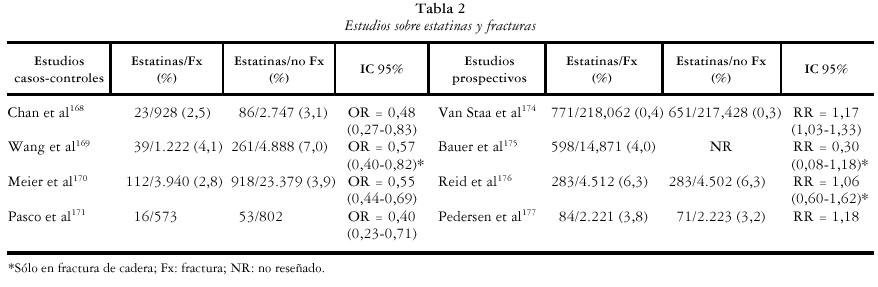
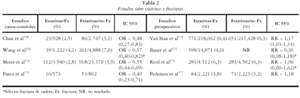
Por otra parte, diversos estudios epidemiológicos han analizado la posible influencia de las estatinas sobre la densidad mineral y las fracturas, así como sobre los marcadores de remodelación ósea. Los trabajos relacionados con el aumento de la masa ósea parecen señalar un aumento de la misma con estos fármacos. En 41 mujeres postmenopáusicas tratadas con estatinas, la DMO en columna lumbar y cadera fue un 8% y 11%, respectivamente, más alta que la DMO de un grupo control, tras ajustar por edad, peso, altura, tabaco y uso de terapia hormonal sustitutiva168. Este hallazgo se ha descrito también en pacientes con diabetes tipo 2169.
Respecto a su efecto sobre el desarrollo de fracturas, los trabajos muestran resultados dispares. En primer término, los trabajos de casos y controles tienden a observar un efecto protector de las estatinas sobre el desarrollo de fracturas, con una OR de 0,48170, 0,57171, 0,55172 y 0,40173. En cambio, los estudios prospectivos (diseño de cohortes) proporcionan valores no sólo no significativos, sino muy próximos a la unidad172-175.
En la tabla 2 resumimos diversos estudios realizados sobre el efecto de la estatinas en las fracturas.
También son dispares los resultados de los trabajos de cohortes que han estudiado el efecto de las estatinas sobre los marcadores de remodelación ósea. Stein et al176 estudiaron en pacientes con hipercolesterolemia los efectos de dos estatinas (simvastatina y atorvastatina) sobre un marcador de formación (fosfatasa alcalina ósea) y otro de resorción (telopéptido del colágeno tipo I), encontrando que la simvastatina, pero no la atorvastatina, descendía los niveles de fosfatasa alcalina en varones y mujeres, mientras que no modificaba el telopeptido. En cambio, Chan et al177, también en un estudio realizado con simvastatina en pacientes con hipercolesterolemia, describieron un aumento de los niveles de osteocalcina. Otro trabajo reciente no encuentra modificaciones en los marcadores de formación ósea en mujeres osteopénicas tratadas con simvastatina durante 12 semanas178. Tampoco la fluvastatina ha demostrado una influencia clara sobre los marcadores de remodelación ósea. Bjamason et al179 han estudiado el efecto de la administración de fluvastatina más vitamina C a 45 mujeres comparándolo con el de la administración de vitamina C sola a otras 23, encontrando que a las 12 semanas los marcadores de destrucción disminuían discretamente en ambos grupos por igual; los marcadores de formación no sufrieron modificaciones.
No queda claro, por lo tanto, el efecto de las estatinas sobre el hueso y su posible mecanismo de acción en la reducción del riesgo de fracturas, si es que éste es cierto.
BIFOSFONATOS Y ENFERMEDAD VASCULAR
Varios estudios sugieren que los bifosfonatos tienen una acción antiaterogénica. Ylitalo180 ha revisado los posibles mecanismos de acción de dicho efecto, y ha sugerido, entre otros, que los bifosfonatos inhiben la calcificación extraósea, reducen la acumulación de lípidos y la fibrosis en las lesiones arterioscleróticas y disminuyen los depósitos de calcio en las arterias por efecto directo sobre la musculatura lisa.
Trabajos realizados en animales de experimentación señalan que la administración de ibandronato o alendronato a dosis similares a las necesarias para inhibir la resorción ósea inhiben la calcificación arterial inducida con warfarina más dosis altas de vitamina D181. En esta misma línea de trabajo se ha demostrado en ratas que dosis tóxicas de vitamina D (12,5 mg colecalciferol * kg), más alendronato no producen calcificación arterial en ninguno de los tejidos examinados182, y altas dosis de clodronato inhiben la arteriosclerosis inducida por la dieta183.
En el hombre sólo hay un trabajo que se haya ocupado de analizar este fenómeno. Koshiyama et al184 han estudiado mediante ultrasonografía las carótidas de 57 pacientes con diabetes tipo 2 y osteopenia, que habían recibido tratamiento con 200 mg/día de etidronato oral dos semanas cada tres meses durante un año, comparando los resultados con los de un grupo control. Han observado un descenso significativo en el grosor de la pared de la carótida.
Por lo tanto, los bifosfonatos podrían ser beneficiosos no sólo en la osteoporosis, sino también en la enfermedad cardiovascular.
CONCLUSION
La asociación entre osteoporosis y arteriosclerosis está basada fundamentalmente en la existencia de estudios epidemiológicos que encuentran un aumento de la mortalidad por enfermedad cardiovascular en las personas con fractura. La presencia de factores de riesgo en común, como el envejecimiento o el consumo de tabaco, parecen desempeñar un importante papel, pero también existen otros posibles mecanismos de vinculación patogénica menos conocidos que relacionan ambas enfermedades.
La visión en conjunto de todos ellos puede hacer mas comprensible la compleja relación entre masa ósea y enfermedad vascular.