Evaluar nuestra experiencia en el procedimiento de localización prequirúrgica de lesiones de mama no palpables (LMNP) y del ganglio centinela (GC) con radiotrazadores.
Material y métodosSe incluyeron las LMNP localizadas prequirúrgicamente durante el período comprendido desde enero de 2001 a diciembre de 2011. La inyección del radiotrazador se realizó guiada con ecografía o mamografía. Se obtuvo comprobación con gammagrafía prequirúrgica en todos los casos. El cirujano localizaba en quirófano las LMNP y el GC axilar con una sonda detectora portátil. El estudio histológico del GC se realizó intraoperatorio para evitar reintervenciones si estaba indicada la linfadenectomía axilar.
ResultadosSe incluyeron 881 pacientes, de las cuales 226 presentaban lesiones benignas en las que estaba indicada la tumorectomía, y 655 presentaban lesiones malignas en las que estaba indicado el tratamiento quirúrgico conservador. La tasa de detección de las LMNP fue del 99,4%, consiguiendo reducir las reintervenciones por bordes afectos hasta un 7,4%.
ConclusiónEn nuestra experiencia la cirugía radioguiada de LMNP con radiotrazadores es una técnica sencilla y rápida que permite la extirpación con márgenes quirúrgicos suficientes y resultado estético óptimo, así como la biopsia del GC en la misma intervención.
To evaluate our experience with preoperative localization of non-palpable breast lesions (NPBL) with the injection of a radiotracer, or radioguided occult lesion localization technique, and with localization of NPBL and sentinel node (SN) with a single injection of radiotracer, or SN and occult lesion localization technique.
Material and methodsWe included NPBL in which excision was indicated during the period from January 2001 to December 2011. The radiotracer was injected under stereotactic or ultrasound guidance. Scintigraphy was carried out in all patients before surgery. The surgeon in the operating room had a hand-held gamma probe to locate the lesions in the breast and in the axilla. Intraoperative pathological examination of the SN was done to avoid reinterventions if there were indications for axillary lymphadenectomy.
ResultsWe included 881 patients: 226 benign lesions were localized in patients with indications for lumpectomy and 655 malignant lesions in patients scheduled for breast conserving treatment. The detection rate of NPBL was 99.4%. Reoperations were reduced to 7.4%.
ConclusionIn our experience, radioguided surgery of NPBL with radioguided occult lesion localization-SN and occult lesion localization is a quick and simple technique that allows tumor excision with adequate surgical margins and optimal cosmetic results, as well as SN biopsy during the same operation.
La localización prequirúrgica de las lesiones de mama no palpables (LMNP) supone un reto diario para los radiólogos especializados en patología mamaria, pues su localización correcta es imprescindible para conseguir la exéresis radical de la lesión con un resultado estético óptimo1.
La labor realizada en las Unidades de Detección Precoz de Cáncer de Mama2 y el avance de las técnicas de imagen en el estudio de la patología mamaria3–5 contribuyen significativamente al diagnóstico de las LMNP.
También hay que incluir las pacientes con cáncer de mama en tratamiento neoadyuvante en las que se observa con frecuencia respuesta parcial mayor o completa6.
Sirva como ejemplo de la relevancia de las LMNP el hecho de que en nuestro hospital, 3 de cada 4 cánceres de mama tratados con cirugía conservadora entre los años 2007-2011 han precisado localización prequirúrgica radioguiada por tratarse de LMNP.
La técnica radiológica que se utiliza con más frecuencia para localizar LMNP es la colocación de guías metálicas («arpón»). Sin embargo, en nuestro hospital utilizamos desde 2001 la técnica de localización con radiotrazadores, denominada genéricamente ROLL (radioguided occult lesion localization) para localizar LMNP, y SNOLL (sentinel node and occult lesion localization) para localizar LMNP y ganglio centinela (GC).
El objetivo de este trabajo es evaluar nuestra experiencia con técnica ROLL-SNOLL durante 11 años.
Material y métodosEstudio retrospectivo sobre el procedimiento y los resultados obtenidos en nuestro hospital con la aplicación de ROLL-SNOLL.
Desde enero de 2001 a diciembre de 2011 se incluyeron 881 pacientes con LMNP con una edad media de 57 años (rango 25-85 años), remitidas por la Unidad de Detección Precoz de Cáncer de Mama, Atención Primaria o consultas externas, independientemente del tamaño de las LMNP, situación, extensión, multifocalidad o multicentricidad o de su anatomía patológica, e indistintamente de la edad y los antecedentes personales de la paciente.
Tras el diagnóstico de cáncer de mama con biopsia con aguja gruesa 14G guiada con ecografía o biopsia asistida por vacío 9G guiada con estereotaxia, el 90% de las pacientes se estadificaron con resonancia magnética (RM) de mama.
El desarrollo de la técnica requirió la intervención de varios servicios hospitalarios, por orden de intervención: Radiología, Medicina Nuclear, Cirugía y Anatomía Patológica. Todos los casos se comentaron previamente en el Comité de Patología Mamaria para planificar la localización de la LMNP más adecuada.
RADIOLOGÍA. La localización de las LMNP se realizó en este servicio el mismo día de la intervención o el anterior.
Los radiotrazadores se inyectaron preferiblemente por guía ecográfica, por tratarse de un procedimiento más rápido y, por tanto, más práctico para la organización del trabajo, y permitir controlar el procedimiento en tiempo real.
Los ecógrafos utilizados fueron ESAOTE Technos MPX® (sonda 7,5-10Mhz), o SIEMENS Acuson S2000 Ultrasound System® (sonda 18Mhz).
Material necesario:
- -
Anestesia local (lidocaína al 2%).
- -
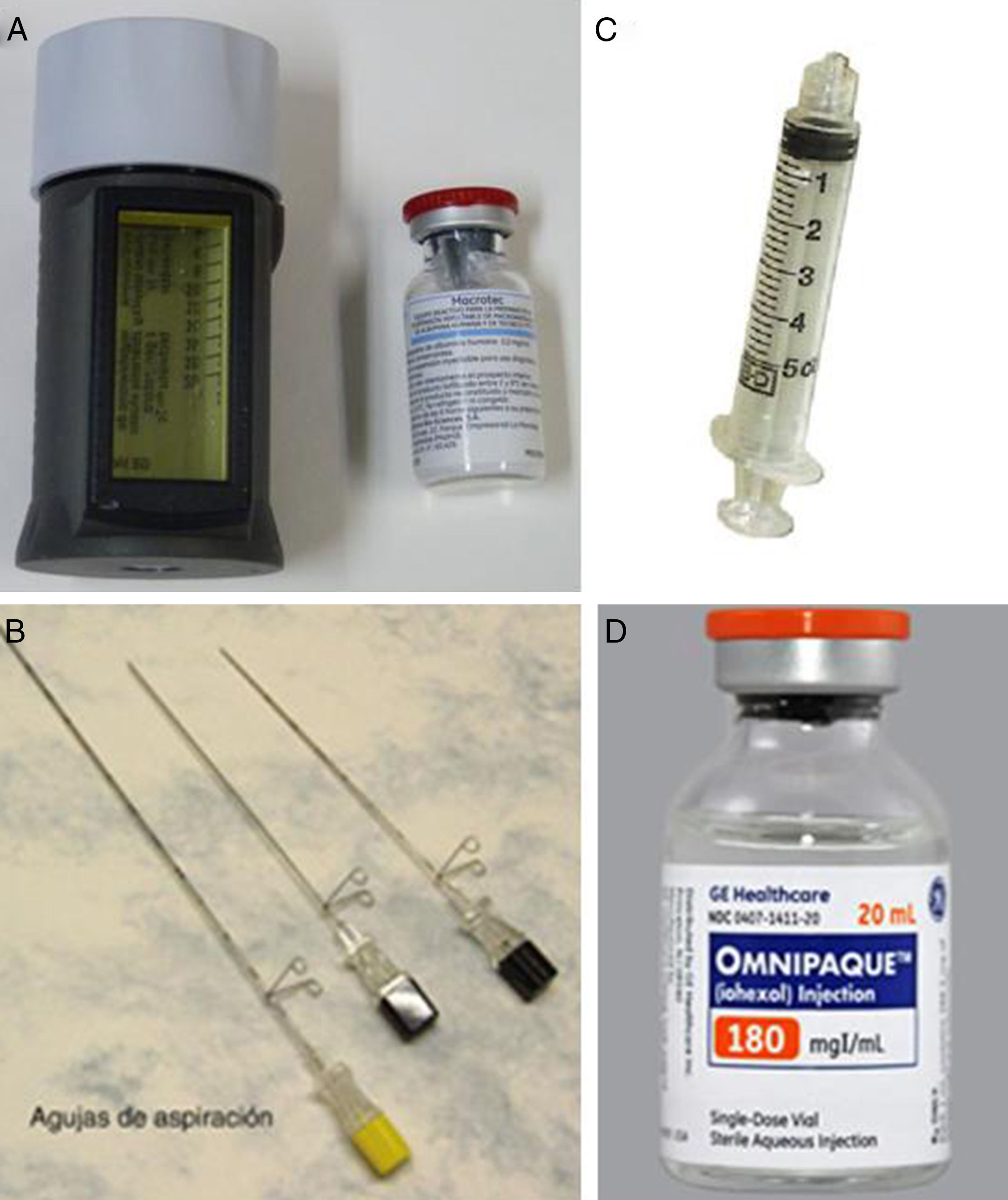
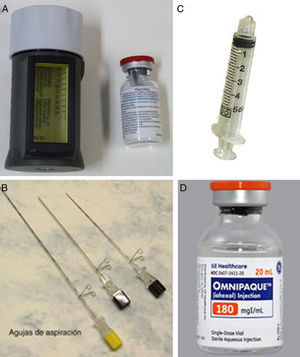
Radiotrazador (fig. 1A): macroagregado de albúmina-99mTc (0,5-1- mCi) MACROTEC GE Healthcare® para ROLL y nanocoloide de albúmina-99mTc (2-3- mCi) NANOCOLL GE Healthcare® para SNOLL. Se diluyó en suero salino (volumen total 0,2-0,4ml).
Figura 1.Material necesario para realizar la técnica radioguided occult lesion localization (ROLL) y la técnica sentinel node and occult lesion localization (SNOLL). A) El radiotrazador se prepara en Medicina Nuclear y consiste en una dosis de 0,5-1mCi de macroagregado de albúmina-99mTc MACROTEC GE Healthcare® para la técnica ROLL y de 2-3mCi de nanocoloide de albúmina-99mTc NANOCOLL GE Healthcare® para la técnica SNOLL. B) Aguja espinal 22G; se recomienda «centimetrada» si se va a utilizar guía mamográfica. C) Jeringa con rosca Lüer-Lock para evitar el reflujo del radiofármaco. D) Contraste yodado isoosmolar mezclado con ROLL-SNOLL en la misma jeringa si se va a utilizar la guía mamográfica, para comprobar la localización definitiva del radiotrazador respecto a la lesión.
(0,31MB). - -
Aguja espinal 22- G (fig. 1B).
- -
Jeringa con rosca Lüer-Lock para evitar el reflujo durante la inyección (fig. 1C), con pequeña burbuja de aire para asegurar el paso del radiofármaco a través de la aguja.
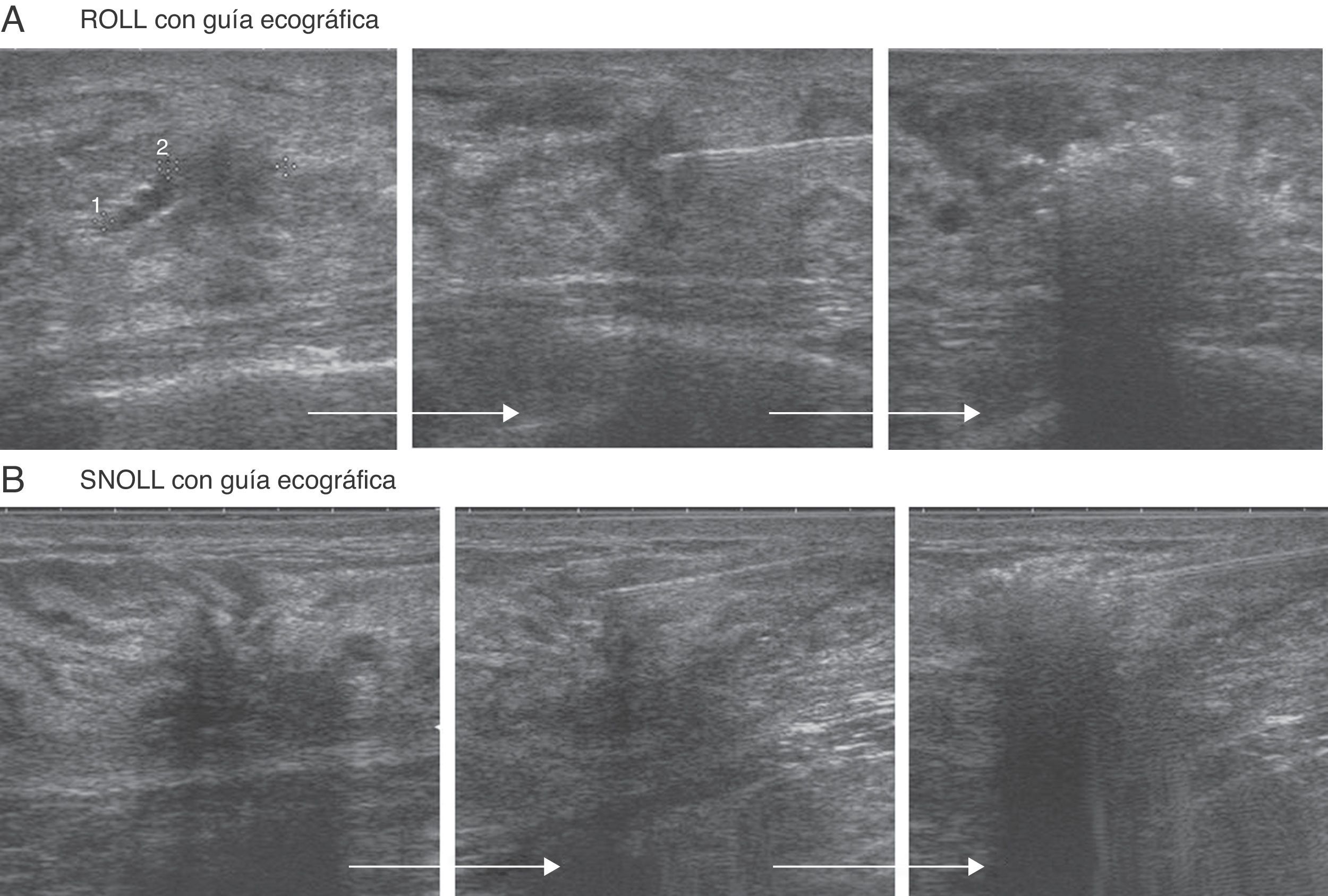
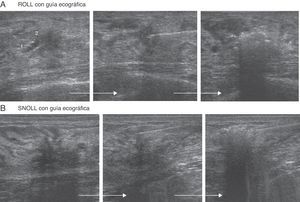
Cuando interesaba localizar la LMNP exclusivamente, utilizábamos ROLL (macroagregados), dejándolo en el centro de las lesiones (fig. 2A).
Si el objetivo era localizar la lesión y el GC (SNOLL, nanocoloide), el radiotrazador se dejaba en la superficie de la lesión para favorecer la migración del mismo al GC (fig. 2B).
Se controlaba en tiempo real cómo se producía un cambio en la ecogenicidad en el extremo de la aguja mientras se inyectaba ROLL-SNOLL (fig. 2). A continuación, con la paciente en decúbito supino y con el brazo en abducción de 90-110°, se dejaba una marca en la piel, localizándose la LMNP en profundidad respecto a la marca.
Los cirujanos conocían por los informes radiológicos la forma, el tamaño y la localización de la LMNP, y el punto donde se dejaba el radiotrazador respecto a la misma. Así calculaban las dimensiones de la pieza quirúrgica para incluir la lesión con márgenes suficientes.
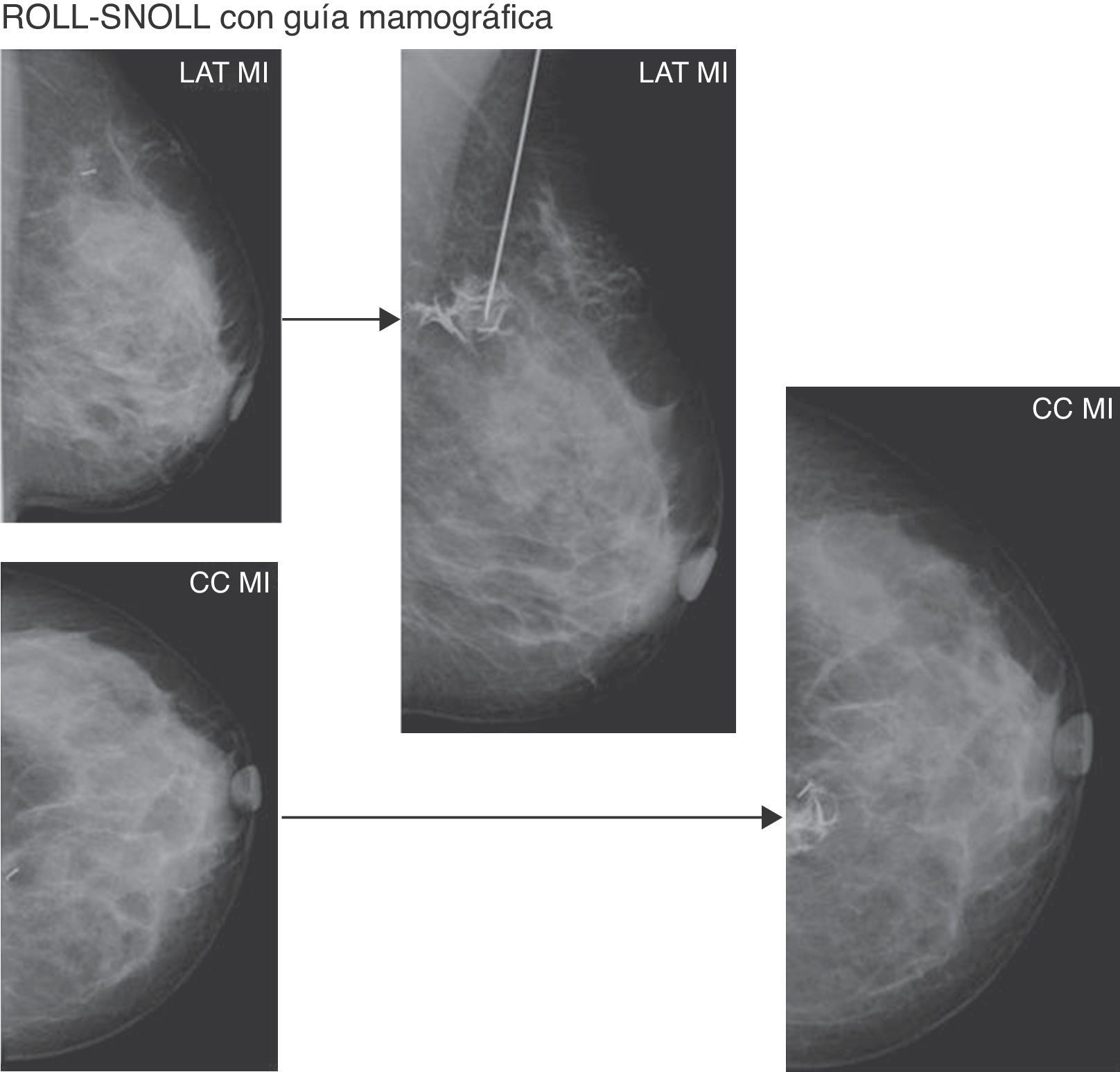
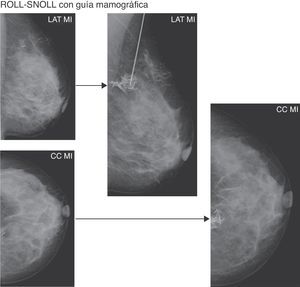
Se realizó ROLL-SNOLL con guía mamográfica en LMNP o clips que las marcaban solo visibles con esta técnica radiológica, con un mamógrafo INSTRUMENTARIUM IMAGING ALPHA RT.
Para la inyección del radiotrazador se utilizó una aguja espinal 22G «centimetrada» (fig. 1B), lo que nos permitía calcular la profundidad alcanzada con la mama comprimida, en proyección craneocaudal o lateral estricta. El radiotrazador se mezclaba con 0,2-0,4ml de contraste yodado isoosmolar (fig. 1D), con el fin de comprobar con mamografía la correcta localización del mismo. En pacientes alérgicas al contraste yodado se puede añadir una burbuja de aire para obtener esta comprobación, pero no fue necesario en ningún caso.
Se incidía sobre la lesión abordándola a través de un compresor fenestrado.
Antes de inyectar el radiotrazador con el contraste, se comprobó con 2 proyecciones mamográficas (craneocaudal y lateral estricta) la correcta localización del extremo de la aguja en la LMNP. Tras la inyección se repetían estas 2 proyecciones, confirmando que el radiotrazador y el contraste quedaban en el punto correcto (fig. 3).
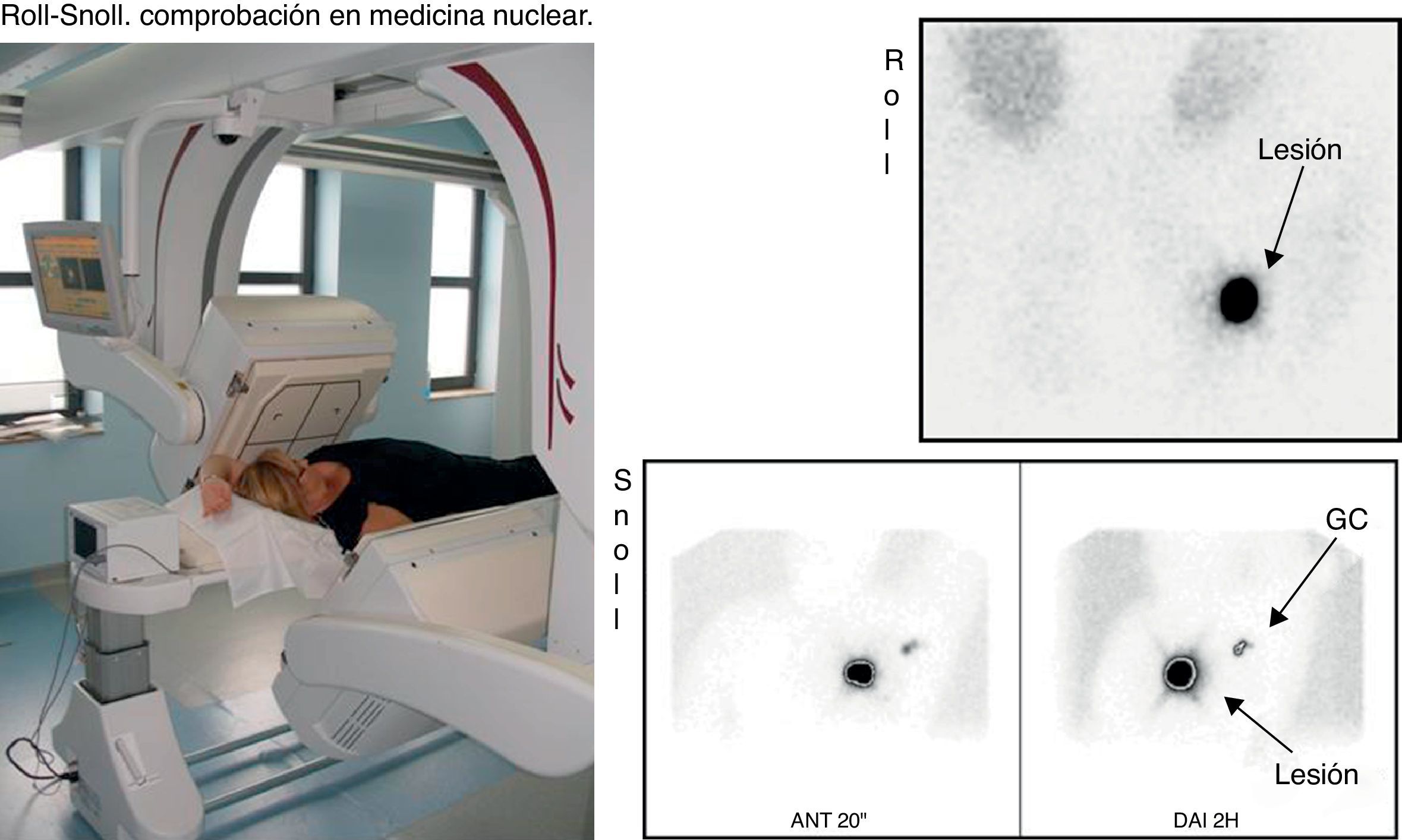
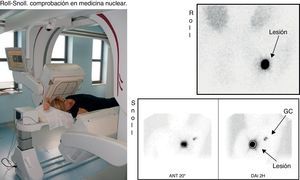
MEDICINA NUCLEAR. A continuación se realizaba una gammagrafía para comprobar la actividad en la mama en ROLL y en mama y axila en SNOLL (fig. 4).
Si se había realizado ROLL, la gammagrafía se podía obtener inmediatamente. Si se había realizado SNOLL había que esperar al menos 2h para que el nanocoloide migrara al GC; si transcurrido este tiempo no se detectaba actividad en el GC, se realizaba reinyección subdérmica de nanocoloide y se obtenía una nueva comprobación.
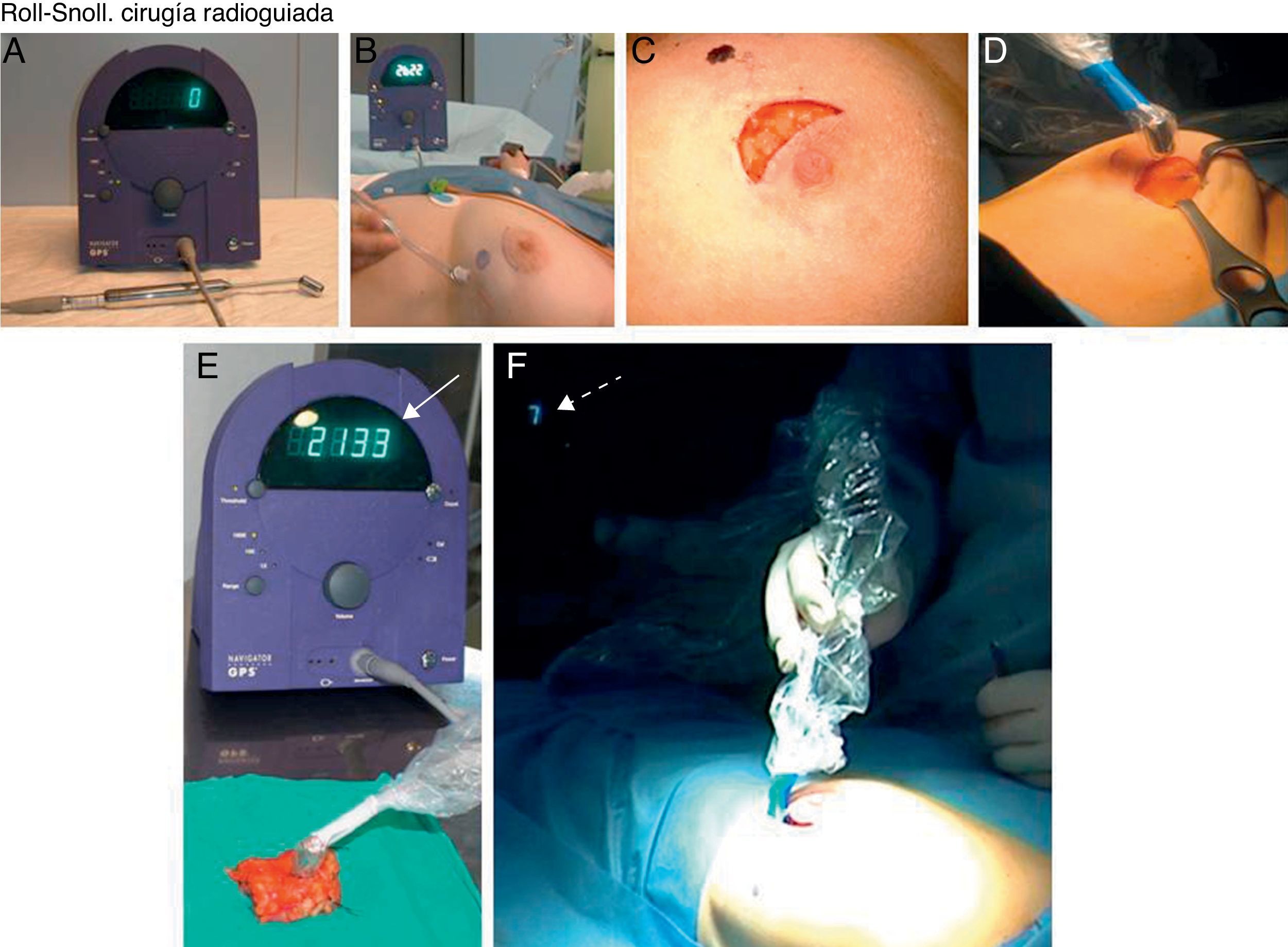
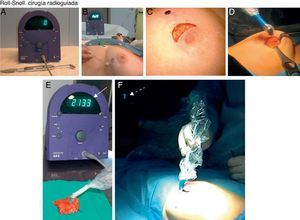
CIRUGÍA. La cirugía se realizó bajo anestesia general. Para la detección de las lesiones y el GC se disponía de una sonda detectora Navigator GPS (RMD Instruments Corp) (fig. 5A). Con esta sonda el cirujano proyectaba en la piel el punto de máxima actividad, decidiendo la incisión más adecuada y cosmética (fig. 5B, C). Durante la intervención, la sonda localizaba tridimensionalmente el punto de máxima actividad, ayudando así a establecer los márgenes de resección (fig. 5D).
A) Sonda detectora portátil. B) El cirujano proyecta en la piel de la mama y axila el punto de máxima actividad. C) Planifica la vía de abordaje para alcanzar la lesión de mama no palpable y el ganglio centinela con el mejor resultado estético. D) Con la sonda siempre tiene localizado el punto de máxima captación en la mama y en la axila. E) Una vez realizada la tumorectomía o cuadrantectomía y extirpación del ganglio centinela, el punto de máxima actividad se detecta en la pieza quirúrgica. F) Sin embargo, la actividad en la mama o en la axila es prácticamente nula.
El tamaño de la pieza quirúrgica para obtener márgenes suficientes dependía de la forma, el tamaño y la localización de la LMNP descritos en los informes radiológicos, y no de la actividad dispersa detectada por la sonda Navigator, porque esta última varía en función de la dosis y el tiempo transcurrido desde el momento de la inyección del radiotrazador. Para localizar las LMNP en el quirófano, la referencia más importante para los cirujanos era el punto de máxima actividad en la mama, que se obtenía ajustando la sonda por el propio cirujano, coincidiendo este punto con la localización del extremo de la aguja espinal durante la inyección del radiotrazador. Dicha localización se planifica previamente entre cirujanos y radiólogos en los Comités de Patología de Mama, individualizando cada caso.
Tras la exéresis el cirujano comprobaba el punto de máxima actividad en la pieza quirúrgica (fig. 5E) y la ausencia de actividad en la mama (fig. 5F).
ANATOMÍA PATOLÓGICA. La pieza quirúrgica se remitía a Anatomía Patológica. En el caso de LMNP marcadas con clips metálicos o microcalcificaciones se realizaba previamente una comprobación mamográfica de la pieza.
En SNOLL el análisis anatomopatológico del GC era intraoperatorio, realizándose la linfadenectomía axilar en la misma intervención si el resultado era positivo para malignidad.
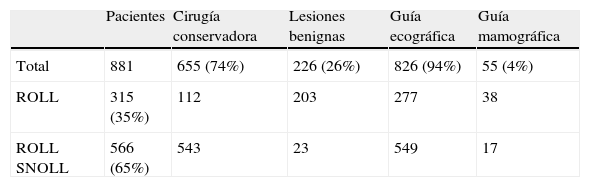
ResultadosDurante un período de 11 años se localizaron prequirúrgicamente en nuestro hospital LMNP en 881 pacientes con ROLL-SNOLL (tabla 1).
Resultados de la cirugía guiada con radiotrazadores de las lesiones de mama no palpables en 11 años
| Pacientes | Cirugía conservadora | Lesiones benignas | Guía ecográfica | Guía mamográfica | |
| Total | 881 | 655 (74%) | 226 (26%) | 826 (94%) | 55 (4%) |
| ROLL | 315 (35%) | 112 | 203 | 277 | 38 |
| ROLL SNOLL | 566 (65%) | 543 | 23 | 549 | 17 |
El procedimiento fue bien tolerado por todas ellas y no se registró ninguna reacción alérgica.
De las 881 pacientes, 655 (74%) presentaban lesiones malignas, mientras que 226 (26%) presentaban lesiones benignas. El resultado anatomopatológico se resume en la tabla 2. El tamaño de las LMNP localizadas fue de 4 a 52 mm, siendo el tamaño tumoral medio de 13 mm.
Resultado anatomopatológico definitivo de las lesiones de mama no palpables localizadas con radiotrazadores
| Lesiones benignas (226) | |
| Mastopatía fibroquística | 94 (42%) |
| Fibroadenoma | 75 (33%) |
| Papiloma | 25 (11%) |
| Cicatriz radial | 16 (7%) |
| Otros | 16 (7%) |
| Lesiones malignas (655) | |
| Carcinoma ductal infiltrante | 458 (70%) |
| Carcinoma ductal in situ | 118 (18%) |
| Carcinoma lobulillar infiltrante | 33 (5%) |
| Mixtos | 13 (2%) |
| Otros | 33 (5%) |
En las pacientes con cáncer de mama la técnica más frecuentemente utilizada fue ROLL SNOLL (83%) porque el objetivo era no solo localizar la LMNP, sino también el GC.
A las pacientes con cáncer de mama y axila positiva para malignidad (17%) se les realizó quimioterapia neoadyuvante previamente al tratamiento quirúrgico. En estas pacientes se indicó resección de la lesión maligna localizada con ROLL y linfadenectomía axilar en la misma intervención.
Las lesiones benignas se localizaron en la mayoría de los casos con ROLL (90%), pues estaba indicada la tumorectomía. En las pacientes con sospecha radiológica de lesión probablemente maligna o lesión maligna sin confirmación histológica tras biopsia percutánea, se realizó SNOLL con resultado de benignidad en 10% de los casos. Desde la utilización de agujas de mayor calibre (hasta 9G) no hemos registrado ningún caso de SNOLL con resultado definitivo de benignidad.
Independientemente de ROLL-SNOLL, se utilizó guía ecográfica en la mayoría de las pacientes (94%).
Se localizaron 2 o más lesiones en la misma intervención en el 9% de las pacientes. En lesiones malignas de gran tamaño también podíamos localizar los extremos medial y/o lateral o bien superior y/o inferior con ROLL múltiples, previo consenso con el cirujano.
La tasa de detección de las LMNP fue del 99,4%, registrándose con guía ecográfica 3 fallos en 822 pacientes (0,36%) y con guía mamográfica 3 fallos en 55 pacientes (5,45%). En estos casos se indicó una segunda intervención, localizándose de nuevo las lesiones con ROLL-SNOLL.
La localización y biopsia del GC ha sido posible en el 99% de las pacientes.
Nuestras reintervenciones por márgenes insuficientes con ROLL-SNOLL las dividimos en 2 períodos:
- -
Desde 2001 hasta 2004 fue necesaria la reintervención en el 14% de las pacientes (margen insuficiente≤5mm).
- -
A partir de 2004 margen insuficiente≤1mm, disminuyendo el porcentaje de reintervenciones a 7,4% en el año 2011.
El éxito de la cirugía conservadora en el tratamiento del cáncer de mama no solo depende de una selección adecuada de las pacientes, sino también de la combinación de unos márgenes quirúrgicos adecuados con un resultado estético aceptable. El logro de márgenes quirúrgicos negativos influye en la incidencia de recidiva local de la enfermedad e, indirectamente, en la supervivencia global de estas pacientes1. Por todo ello, la correcta localización prequirúrgica de las LMNP es imprescindible para conseguir una exéresis radical de la lesión con tratamiento quirúrgico conservador y con resultado estético óptimo1,7.
Existen varias técnicas para localizar LMNP: colocación de un arpón, inyección de radiofármacos (ROLL-SNOLL), ecografía intraoperatoria, etc. La más frecuentemente utilizada es la colocación de un arpón dirigida con mamografía o ecografía. Esta técnica permite en la actualidad la extirpación de las LMNP en la mayoría de los hospitales porque presenta mayor disponibilidad y fácil aprendizaje. En la bibliografía se describen las siguientes limitaciones con el uso de arpones: mayor manipulación sobre las mujeres; el arpón se puede movilizar con facilidad durante la intervención, perdiendo así la referencia respecto a la lesión; puede artefactar las lesiones cuando las atraviesa, dificultando el estudio anatomopatológico; y se describen tasas importantes de reintervenciones por márgenes quirúrgicos insuficientes (hasta un 50%)8–13. En nuestra experiencia de cirugía guiada con arpón (hasta 2001), la tasa de reintervenciones por margen quirúrgico insuficiente fue del 38%, considerándose entonces margen afecto la distancia de la lesión al borde de la pieza≤5mm y teniendo en cuenta que en ese período no se estadificaba el cáncer de mama con RM4,5.
La localización intraoperatoria guiada con ecografía14 tiene el inconveniente de requerir la presencia en quirófano de un cirujano experto en ecografía o de un radiólogo. En nuestro hospital no hemos recurrido a esta técnica de localización prequirúrgica.
La cirugía guiada con ROLL fue desarrollada en el Instituto Europeo de Oncología de Milán y descrita en 1998 por Luini et al.15. Consiste en la inyección intralesional o perilesional de un radiotrazador con guía ecográfica o mamográfica13,15–17. Por otro lado, está demostrado que la localización y biopsia del GC es una alternativa correcta a la linfadenectomía axilar, por lo que, aplicando la técnica SNOLL, no solo localizamos la LMNP, sino también el GC con una única inyección de radiotrazador18,19.
La principal ventaja de la técnica ROLL-SNOLL es que permite al cirujano controlar en todo momento dónde se localiza la LMNP, así como el GC, consiguiendo extirpar menos tejido sano y con márgenes suficientes. Con ello, disminuye el número de reintervenciones por bordes afectos1,16.
En nuestra serie, la tasa de detección de LMNP con ROLL-SNOLL fue del 99,4%. La localización de LMNP con ROLL ecodirigido ha sido del 99,7%, mientras que con mamografía ha sido del 94,5%. Interpretamos que el mayor número de fallos con mamografía se debe a que se han localizado LMNP más pequeñas (≤5mm) y la inyección no se ha controlado en tiempo real. La técnica se ha aplicado igualmente en el caso de LMNP extensas o multifocales y/o multicéntricas (9% de los casos), donde puede ser necesaria más de una inyección de radiotrazador, así como en LMNP intraductales o intraquísticas o lesiones marcadas con clips metálicos. Con la aplicación de esta técnica en el tratamiento quirúrgico conservador del cáncer de mama se ha conseguido disminuir el número de reintervenciones por bordes afectos (7,4% en el año 2011). Cabe destacar que la aplicación de la técnica ROLL en nuestro hospital coincidió con la incorporación de la RM para estadificar el cáncer de mama4,5.
Sin embargo, en la literatura se describen factores que pueden condicionar fallos en la técnica, como son la falta de experiencia del cirujano o del radiólogo, LMNP de tamaño≤5mm de diámetro y lesiones localizadas en el cuadrante central de la mama20. Además, se describe la posibilidad de contaminación del trayecto de la aguja (19% de casos), aunque esto no es problema si se ajusta la sonda detectora para localizar el punto de máxima actividad; en el caso de contaminación cutánea (0,6%), se soluciona lavando la piel21.
También se describe como limitación el hecho de que el radiotrazador es transparente en la mamografía, pero se resuelve mezclándolo con una pequeña cantidad de contraste yodado22. Por otra parte, en LMNP intraductales23 se debe dejar el radiotrazador adyacente al ducto para evitar su dispersión por los conductos galactóforos.
Existe discrepancia entre la inyección perilesional o intralesional del radiotrazador. En el Instituto Europeo de Oncología de Milán24 dejan macroagregados intralesionales para marcar la LMNP y nanocoloide subdérmico para localizar el GC. En nuestro hospital, dejamos macroagregados intralesionales para tumorectomía, y nanocoloide sobre la lesión maligna para su exéresis radical y cirugía del GC con una única punción.
En otros grupos de trabajo no se han encontrado diferencias significativas entre el uso de radiotrazadores vs. arpón, con tasas de reintervención por bordes afectos de 12% con radiotrazadores y 10% con arpón25,26, en 162 y 152 pacientes, respectivamente. Como explican en su trabajo, tenían una amplia experiencia con el uso de arpones frente al de radiotrazadores. En nuestras primeras 118 pacientes localizadas con radiofármacos, el número de reintervenciones por bordes afectos también fue del 12,7%13, pero con la habilidad adquirida hemos conseguido bajar este porcentaje al 7,4% en el año 2011.
En nuestra experiencia, la cirugía guiada con radiotrazadores de las LMNP es una técnica sencilla y rápida, bien tolerada por las pacientes, cuyo requisito indispensable es disponer de un servicio de Medicina Nuclear en el propio hospital o en un hospital de referencia cercano, así como del trabajo en equipo de todo el personal implicado. En nuestro hospital, con una correcta estadificación de la enfermedad, incluyendo el estudio con RM de mama, y la técnica ROLL-SNOLL se ha disminuido significativamente el número de reintervenciones por bordes afectos en la cirugía conservadora y se ha conseguido localizar la LMNP y el GC con una única inyección de radiofármaco.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Verónica Ricart Selma: concepción y diseño del trabajo, obtención de datos, búsqueda bibliográfica, redacción y revisión.
- 2.
Pedro Juan González Noguera: concepción y diseño del trabajo, búsqueda bibliográfica, redacción y revisión.
- 3.
Carmen Martínez Rubio: concepción y diseño, redacción y revisión del trabajo.
- 4.
Julia Camps Herrero: concepción y diseño, redacción y revisión del trabajo.
- 5.
Miquel Forment Navarro: diseño, redacción y revisión del trabajo.
- 6.
Julia Cano Gimeno: diseño, redacción y revisión del trabajo.
- 7.
Juan Blas Ballester Sapiña: diseño, redacción y revisión del trabajo.
- 8.
Ana Tembl Ferrairo: diseño, obtención de datos, redacción y revisión del trabajo.
- 9.
Todos los autores han dado su aprobación final al manuscrito.
Los autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Almudena Vera González la revisión del manuscrito, a D. Juan María de la Cámara de las Heras, nuestro bibliotecario, por completar la bibliografía, y a D. Javier Company Company por su apoyo incondicional y su colaboración en la realización y envío del trabajo.