Los STUMPs (tumoraciones mesenquimales de músculo liso uterino de potencial incierto) son tumoraciones infrecuentes, que pertenecen a las tumoraciones mesenquimales de músculo liso uterino. Estas tumoraciones no pueden definirse ni como totalmente benignas ni malignas.
Presentamos un caso clínico de una paciente de 27 años que consultó por sensación de plenitud, aumento del perímetro abdominal y polaquiuria de 6 meses de evolución. Ecográficamente se visualizó una masa intramural-subserosa de 9 cm en fondo uterino, con sospecha de degeneración hialina, que fue extirpada quirúrgicamente. El estudio anatomopatológico reveló el diagnóstico de tumoración muscular lisa de potencial maligno incierto, variante epiteloide.
ConclusiónLos STUMPs se diagnostican anatomopatológicamente, siendo este proceso complejo y requiriendo, en gran número de ocasiones, técnicas inmunohistoquímicas para conseguir un diagnóstico y pronóstico más preciso. El tratamiento es quirúrgico, pudiendo realizar una histerectomía o bien, siendo más conservadores, la exéresis de la tumoración, ya que la mayoría tienen un comportamiento benigno.
Uterine smooth-muscle tumours with unusual growth patterns represent an histologically heterogeneous and uncommon group of uterine smooth-muscle tumours that cannot be diagnosed as either benign or malignant.We report the case of a 27year-old woman who consulted for a 6-month history of bladder fullness sensation, abdominal distension and polaquiuria. Transvaginal ultrasound showed a 9cm intramural mass at the uterine fundus that was surgically excised. The anatomopathological diagnosis of uterine smooth-muscle tumour with growth pattern, epithelioid variant, was reported.
ConclusionsThe diagnosis of uterine smooth-muscle tumours may create great challenges for the pathologist who classifies these tumours by their histological features. The immunohistochemical staining may be helpful to establish their behaviour and prognosis. The clinical management remains a dilema and surgical treatment of choice has not been well defined, due to their uncertain clinical behaviour. Most of these tumours have a benign clinical course but these patients should receive long-term follow-up.
Las tumoraciones mesenquimales de músculo liso uterino abarcan gran variedad de neoplasias; entre ellas se encuentran los leiomiomas, las tumoraciones mesenquimales de músculo liso de malignidad incierta (STUMP) y sus subtipos, y los leiomiosarcomas. Su diagnóstico suele ser sencillo, pero ciertos tumores, como los STUMP, son todo un reto para el patólogo; de ahí que se haya propuesto un estudio inmunohistoquímico para dilucidar su comportamiento y pronóstico. Actualmente la OMS clasifica los STUMP como aquellas tumoraciones mesenquimales de músculo liso uterino que no pueden definirse ni como totalmente benignas ni malignas.
Aun siendo tumores infrecuentes y de pronóstico incierto, se llevan estudiando desde hace años, como muestran Bell et al.1 en el estudio clinicopatológico de 213 casos. Debido a que el comportamiento de este tipo de tumores es impreciso, es importante realizar un seguimiento estrecho, aunque según la literatura, la mayoría tiene un curso benigno.
Caso clínicoSe trata de una paciente de 27años, de raza blanca, que consultó por sensación de plenitud, aumento del perímetro abdominal y, ocasionalmente, polaquiuria de 6 meses de evolución.
No tenía antecedentes médicos reseñables, salvo una amigdalectomía y alérgica a macrólidos (josamina). Antecedentes ginecoobstétricos: diagnosticada de mioma, no gestaciones.
En la exploración ginecológica se detectó un útero aumentado de tamaño en anteversoflexión, con cérvix de nulípara cerrado y formado, no doloroso a la palpación. No se palpaba afección anexial. Exploración no dolorosa.
Se realizó una ecografía vaginal y abdominal en la que se objetivaba un útero en anteversoflexión, con un endometrio en fase proliferativa. Se visualizó un nódulo intramural subseroso de 9 cm de diámetro en el fondo uterino, con áreas anecoicas en su interior, indicativo de mioma con degeneración hialina o grasa en su porción más central. Ambos ovarios se visualizaban de tamaño y ecoestructura normales, sin líquido libre en el espacio de Douglas.
Con el diagnóstico presuntivo de mioma de 9 cm de tamaño en fondo uterino, se decide realizar la exéresis de la tumoración debido a la edad de la paciente y los deseos genésicos.
Se realiza una ecografía previa al ingreso, objetivando un crecimiento del mioma de 3-4 cm en las últimas 4 semanas, siendo su diámetro de 12 cm.
Tras el estudio preoperatorio normal, la paciente ingresa en nuestro hospital para cirugía. Se realizó una miomectomía por laparotomía, mediante incisión de Pfannenstiel y reparación uterina con puntos sueltos, sin apertura de cavidad durante el procedimiento. Peritonización visceral, revisión de hemostasia y lavado de la cavidad.
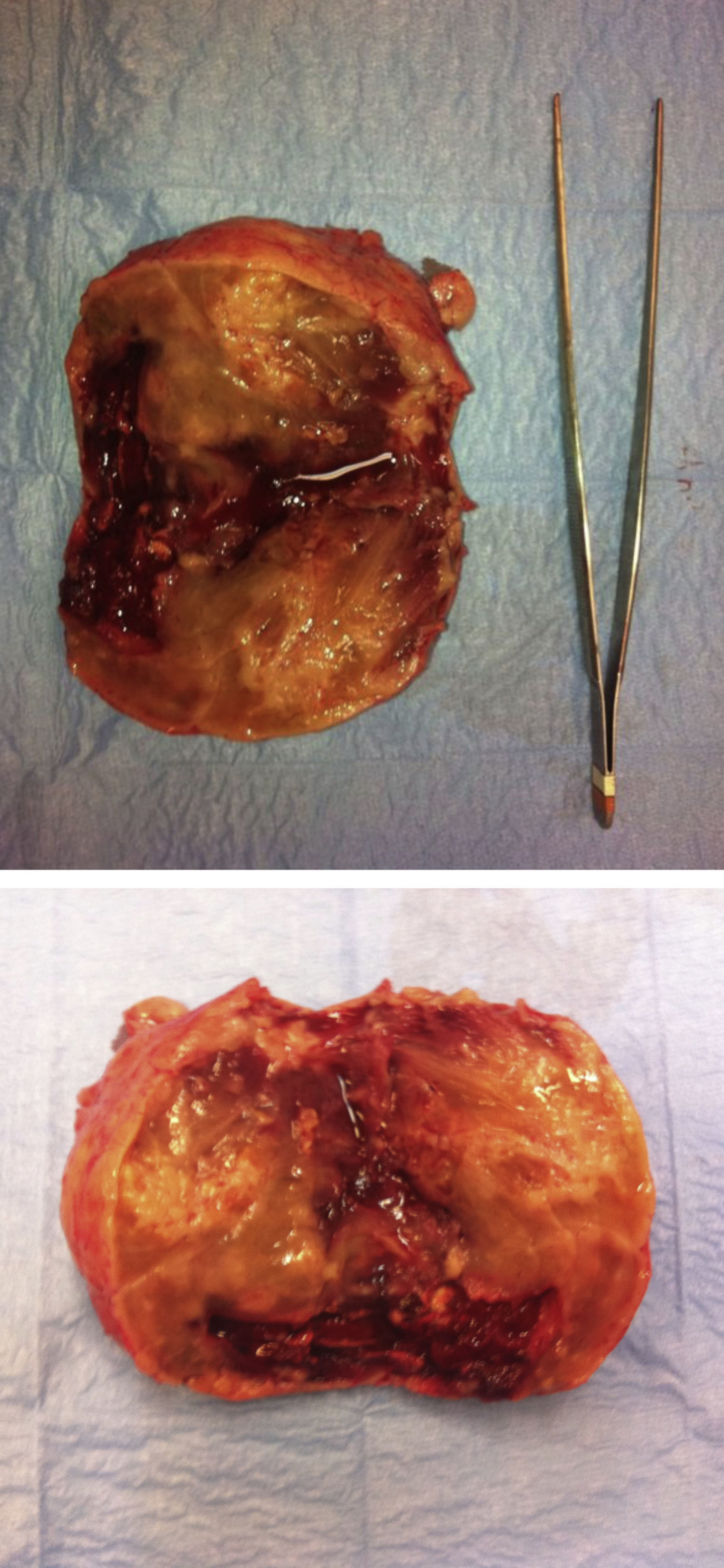
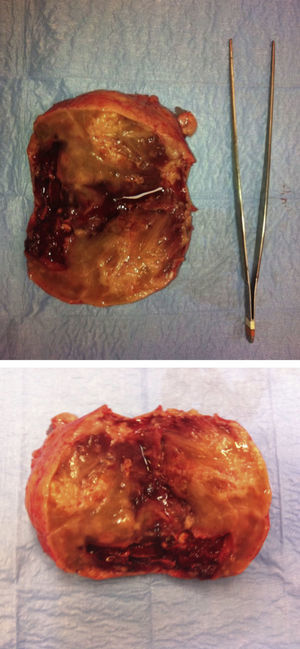
Se extrajo una tumoración de contorno nodular de 120×90×80 mm y de 384 g de peso, de fondo uterino de consistencia carnosa, que al corte estaba constituida por tejido blanco-rosado de aspecto fasciculado, con áreas más blandas de apariencia gelatinosa en las que existían zonas de degeneración quística junto con áreas de aspecto hemorrágico. No se identificaron áreas de necrosis macroscópicamente (figs. 1 y 2).
El estudio anatomopatológico reveló la presencia de una proliferación de células musculares lisas de potencial maligno indeterminado o incierto, variante epitelioide.
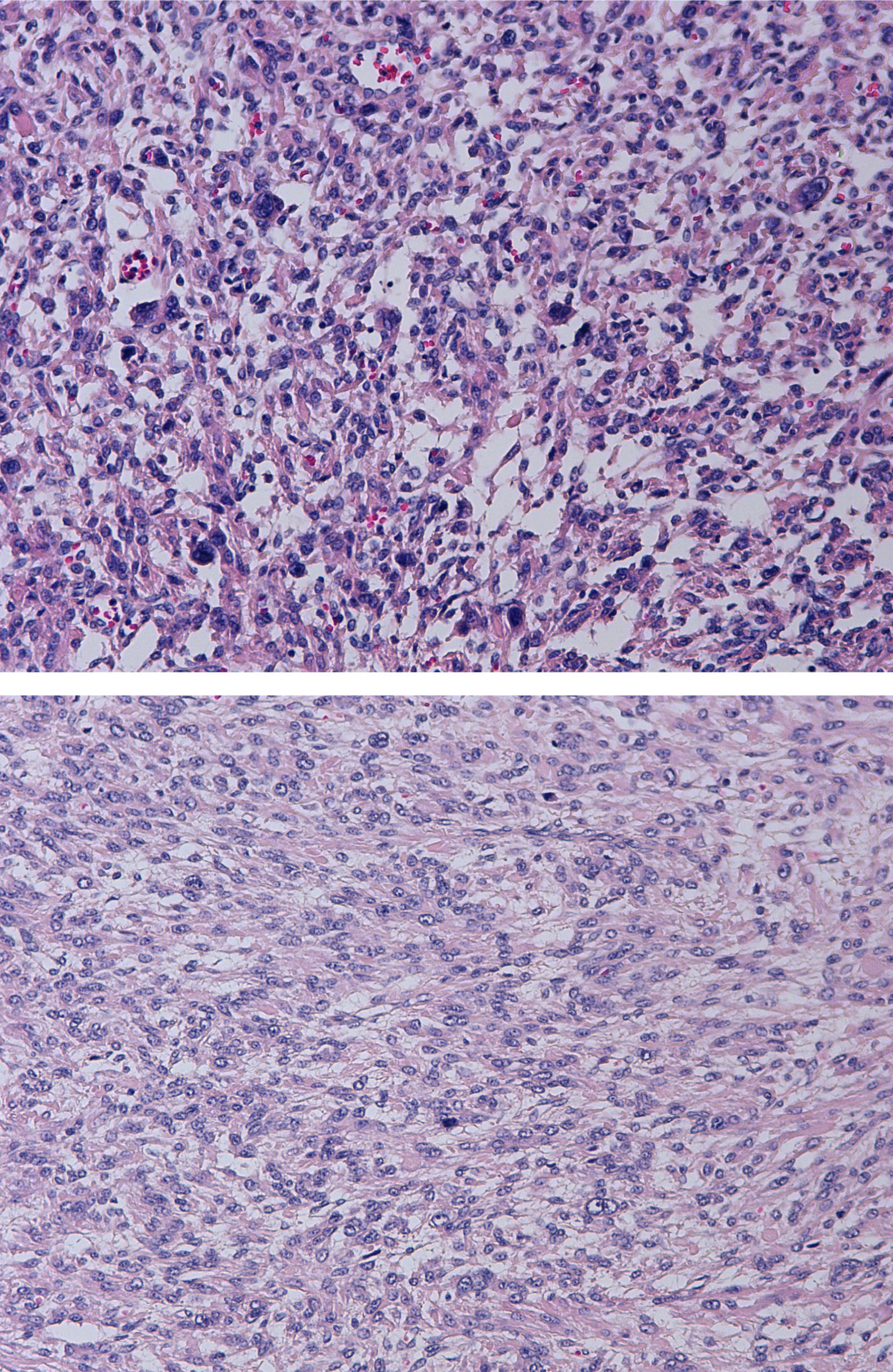
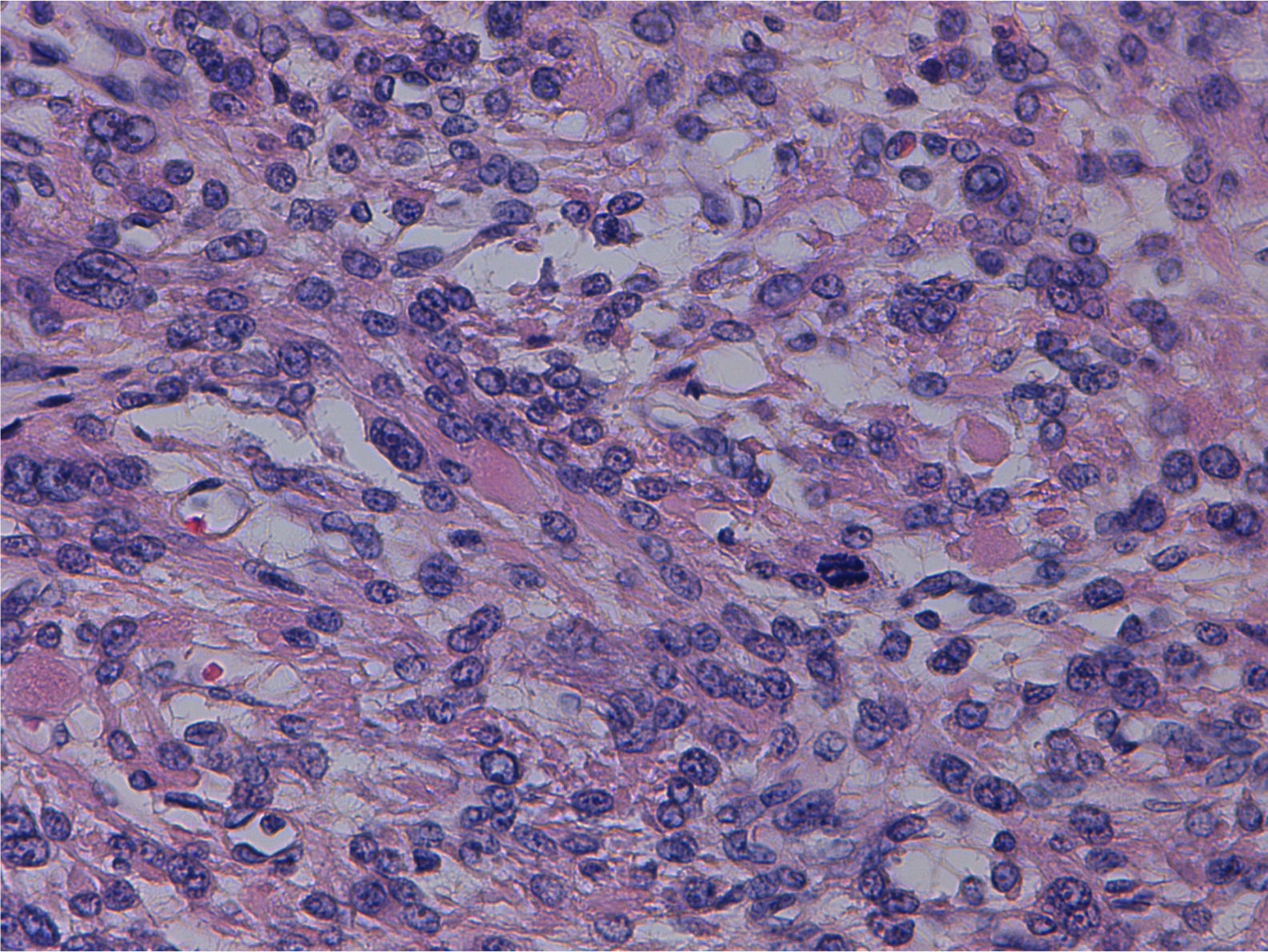
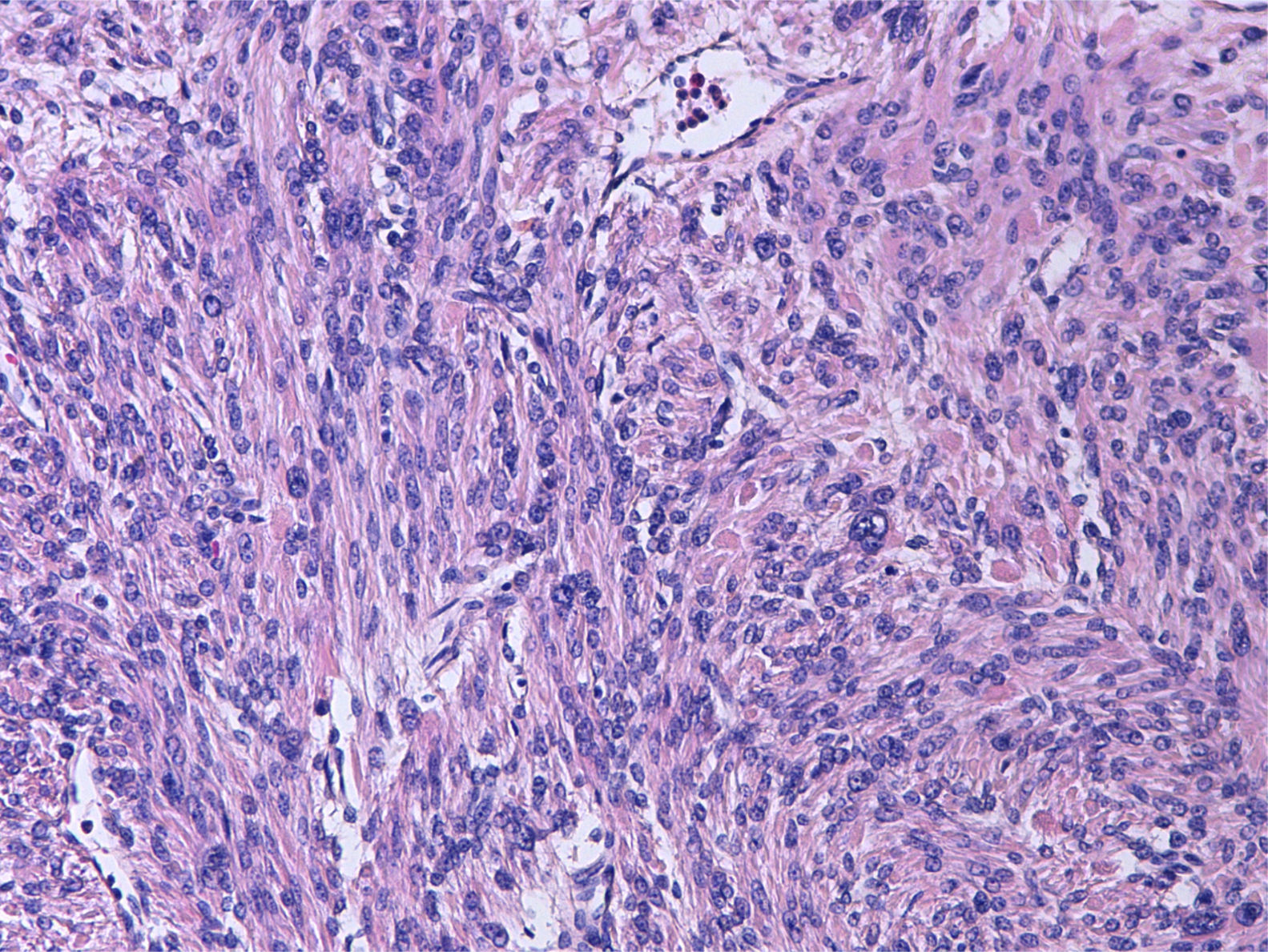
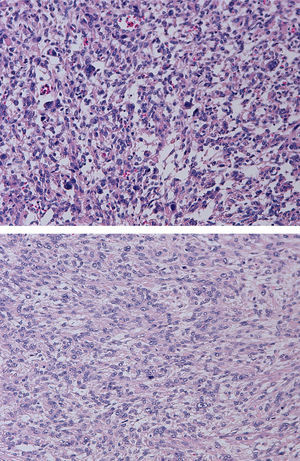
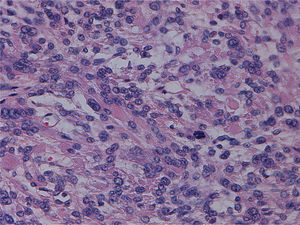
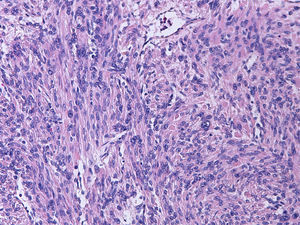
Tras la inclusión de múltiples secciones histológicas de la tumoración, se observa una proliferación de estirpe mesenquimal, de alta densidad celular, constituida por elementos de morfología tanto fusiforme como más poligonal, dotadas de núcleos aumentados de tamaño, pleomorfos, con núcleo prominente y citoplasmas acidófilos, algunos de contorno globuloso y aspecto fibrilar que da a la célula apariencia «seudogangliónica» (figs. 3 y 4). Las células se disponen en fascículos paralelos y entrecruzados, generando agregado nodulares y se acompañan de una profusa red de vasos sanguíneos de calibre pequeño y mediano, algunos de pared muscularizada (fig. 5). Se identifican células dotadas de núcleos grandes, poliglobulados, pizarros e hipercromáticos que, aunque presentes de forma salpicada, son identificables en todos los cortes histológicos, en número significativo. En las anomalías citológicas descritas, el recuento mitótico máximo, realizado en todas las secciones histológicas examinadas, oscila entre 2 y 10 figuras de mitosis por campos de gran aumento (fm/cga). Se observan imágenes ocasionales de picnosis y cariorrexis nuclear. La neoplasia muestra zonas de degeneración mixoide del estroma, con formación de pequeñas cavidades quísticas, así como áreas hemorrágicas, pero no se identifica en ninguno de los cortes áreas de necrosis coagulativa franca. Muestra además buena delimitación del miometrio circundante. No se observan imágenes de invasión linfovascular.
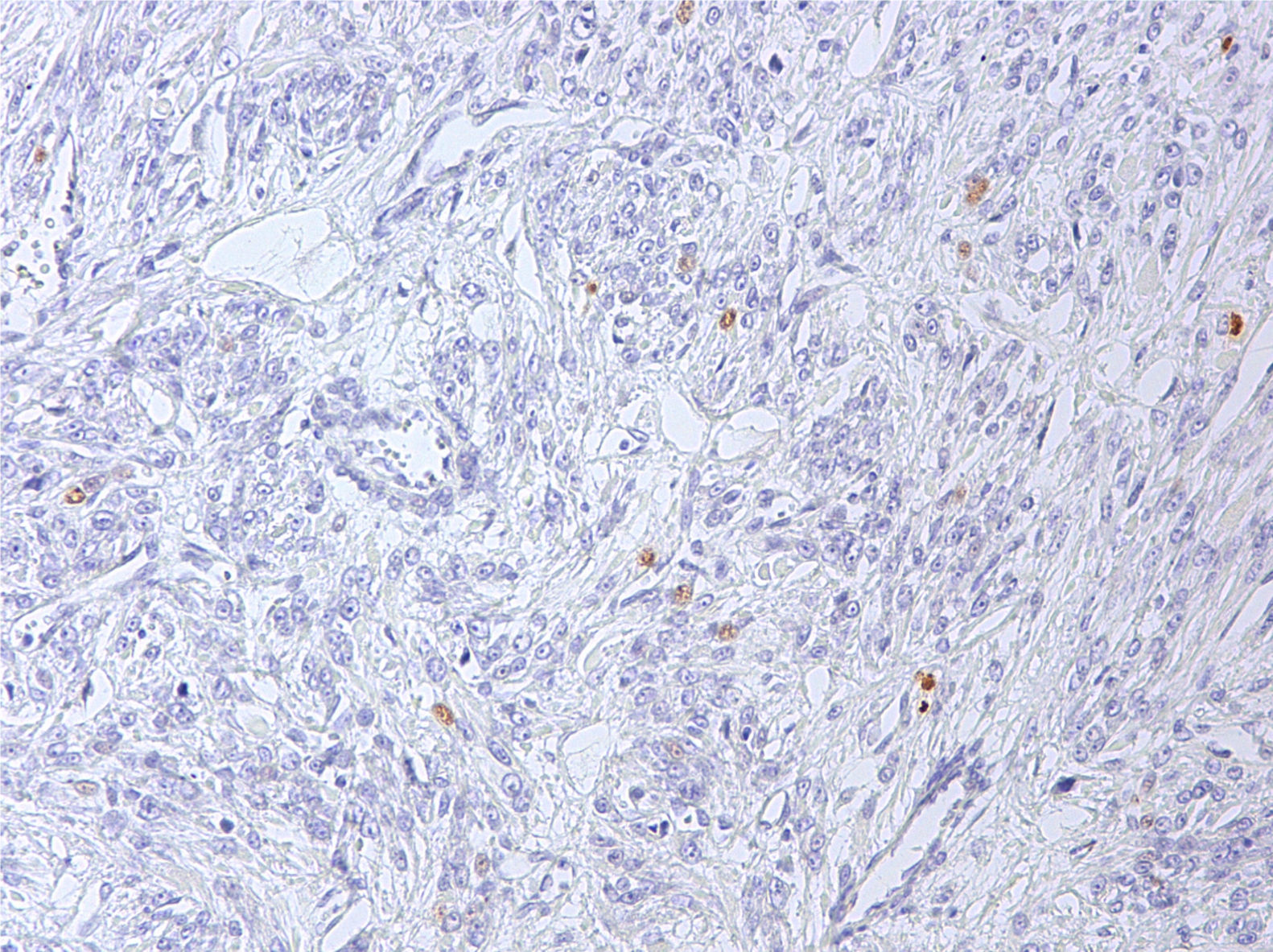
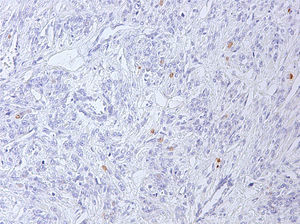
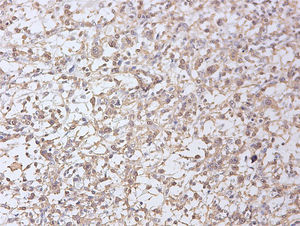
Al existir una relación entre la sobreexpresión de p16 y p53 y el comportamiento biológico de estos tumores, se realizó un estudio inmunohistoquímico de ambos marcadores2. Se observó expresión de p53 en un 5% de las células neoplásicas (fig. 6), observándose inmunorreactividad parcheada focal para p16 (fig. 7), considerándose ambas negativas, debido a su tinción de intensidad débil.
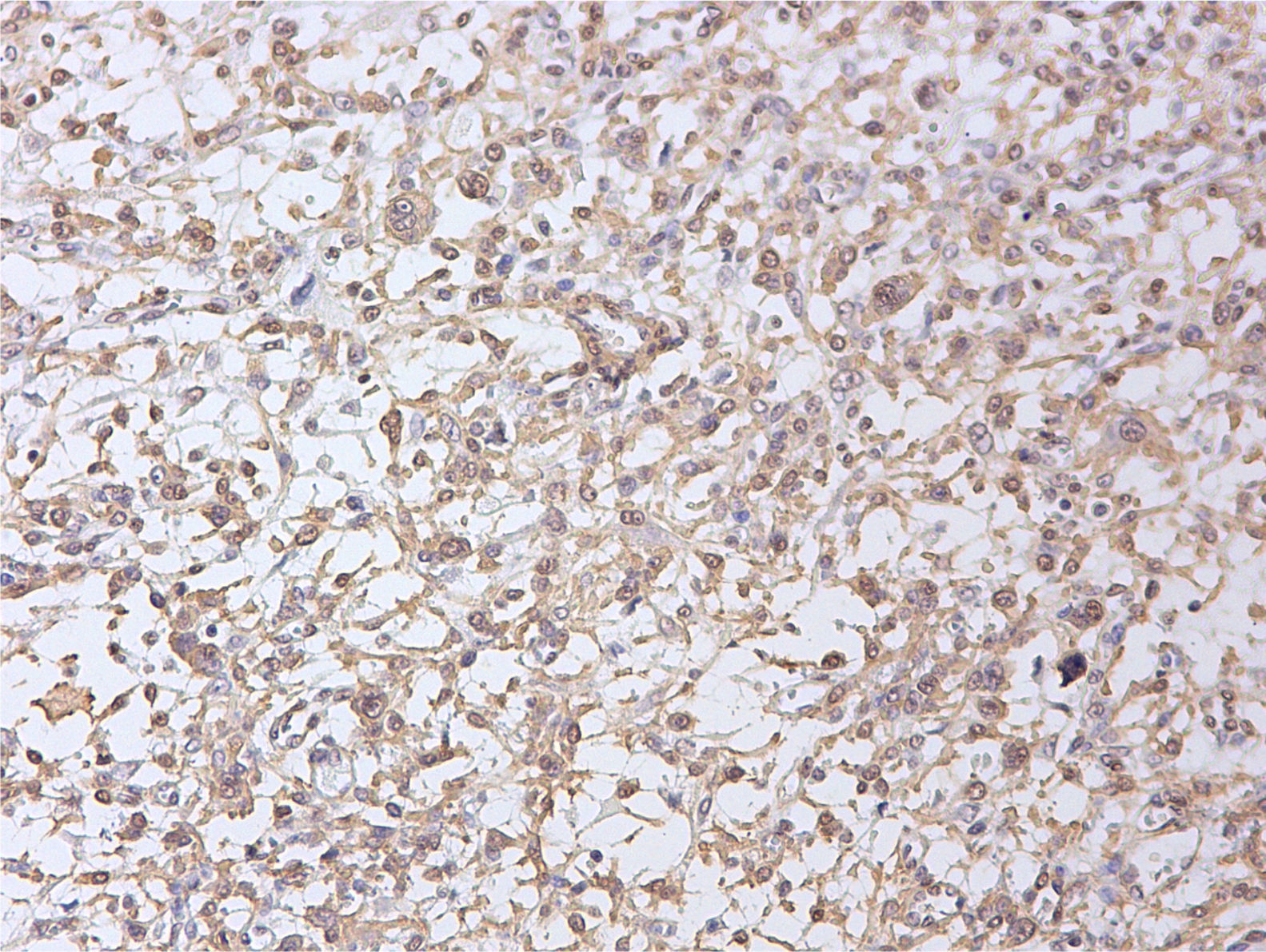
Además, se realizó estudio de la sobreexpresión de los receptores de estrógenos y progesterona, mostrando ambos una positividad difusa.
Al alta, la paciente se encuentra asintomática, con anemia leve que requirió tratamiento con hierro por vía oral.
Actualmente, tras 10 meses desde la intervención, la paciente se encuentra asintomática, con revisiones semestrales, mostrando en la última una radiografía de tórax sin alteraciones, y exploración y ecografía ginecológica sin alteraciones.
DiscusiónLas tumoraciones mesenquimales de músculo liso uterino son las tumoraciones más frecuentes en el tracto genital femenino. Dentro de estas tumoraciones encontramos las que se definen como histológicamente benignas, malignas y otras que son tumoraciones mesenquimales de músculo liso uterino de significado incierto, que serán aquellas que no podamos clasificarlas en ninguno de los 2 grupos anteriores.
El diagnóstico de este tipo de tumoraciones es anatomopatológico y se basa en el recuento mitótico, la presencia de atipia (focal o difusa, leve, moderada o intensa) y la presencia o ausencia de áreas de necrosis coagulativa y en la morfología celular (fusiforme o epitelioide) de la tumoración3,4.
El recuento mitótico (RM) se define como el número de fm por 10 cga. La atipia puede ser «significativa» (atipia entre moderada y severa) y «no significativa» (ausente o leve)5. La presencia de áreas de necrosis coagulativa es habitual en tumores malignos y constituye un importante dato predictivo de comportamiento biológico agresivo. Se caracteriza por una transición abrupta entre las células viables y un área de necrosis6-9. Finalmente, algunos tumores de músculo liso pueden mostrar diferenciación epitelioide o mixoide; estas son más habituales en tumores de comportamiento biológico agresivo o incierto, lo que obliga a un exhaustivo examen de la tumoración a fin de confirmar o descartar su posible malignidad.
De esta manera, podremos definir los leiomiomas como aquellas tumoraciones macroscópicamente sólidas, de consistencia elástica, de límites netos que microscópicamente muestran recuentos menores de 5 fm/10 cga y carecen de necrosis coagulativa y de atipia, y los leiomiosarcomas como tumoraciones con 2 o más de las siguientes características: RM>10 mitosis/cga, presencia de necrosis coagulativa y/o de atipia citológica difusa. La necrosis coagulativa tumoral es indicativa de la malignidad en la mayoría de los casos, aunque algunos autores también hablan de la clara relación de la atipia severa con la malignidad.
Por todo ello, las tumoraciones que no cumplen criterios de inclusión en los 2 grupos anteriores las clasificaremos como STUMP. Bell et al.1 subdividieron este último grupo en distintos subtipos:
- -
Leiomioma con atipia, pero con limitada experiencia (atypical leiomyoma with limited experience): aquel con atipia focal severa, < 20mf/10 cga y sin necrosis celular coagulativa;
- -
Leiomioma atípico con bajo riesgo de recurrencia (atypical leiomyoma, low risk of recurrence): aquel con atipia difusa moderada-severa, < 10 mf/10 cga y sin necrosis celular coagulativa;
- -
Leiomioma con RM incrementado pero baja LE (mitotically active leiomioma, limited experience): aquel sin atipia, > 20 fm/10 cga y sin necrosis celular coagulativa;
- -
Tumor de músculo liso con bajo potencial maligno (smooth muscle tumor of low malignant potencial): aquel con atipia leve o sin atipia con < 10 mf/10 cga y necrosis coagulativa.
Algunos estudios apuntan a que la evaluación combinada de sobreexpresión de p53 y p16 puede ser útil para identificar, entre los STUMP, aquellas tumoraciones de comportamiento biológico más agresivo. Parece por ello aconsejable realizar en estas neoplasias, técnicas inmunohistoquímicas complementarias, especialmente en aquellas tumoraciones de difícil clasificación, siendo los más fiables la medición del índice de proliferación (IP) con MIB-1 (ki67) y la sobreexpresión de p53 y p16. No obstante, los datos son escasos y ciertos autores, como Chen y Yang10, demuestran en su estudio superponibilidad en los resultados inmunohistoquímico frente a p16 y p53 en el caso de los leiomiosarcomas, leiomiomas atípicos y STUMP. Por ello, el estudio inmunohistoquímico debe interpretarse con cautela. Múltiples estudios sugieren además que el perfil inmunohistoquímico de los STUMP está mucho más próximo a los leiomiomas que a los leiomiosarcomas11-13.
La expresión de receptores de estrógenos y progesterona puede ser de ayuda a la hora del diagnóstico diferencial. Se ha descrito que la pérdida de expresión de los receptores de progesterona ocurre en la mayoría de los leiomiosarcomas, mientras que no sucede lo mismo en los STUMP6. De hecho, la expresión de los receptores hormonales (estrógenos y progesterona) suele estar conservada en los STUMP, independientemente de su comportamiento biológico, por lo que estos marcadores no son útiles para subclasificar a los STUMP como de alto o bajo riesgo.
Algunos autores demuestran correlación estadísticamente significativa del IP con MIB-1 con el STUMP, aunque más baja que la observada en los leiomiosarcomas. Otros concluyen que el IP no estima de forma real la actividad mitótica en los STUMP ni sus variantes, pero sí en los leiomiosarcomas. En un estudio reciente, Mayerhofer et al.14 detectaron expresión significativa de Ki-67 en el 50% de los tejidos incluidos en parafina de 20 pacientes con leiomiosarcoma uterino, pero solo en el 8% de los 25 casos de leiomiomas y en ninguno de los 22 casos de STUMP. La diferencia respecto al índice de expresión de Ki-67 entre los leiomiosarcomas y los STUMP, y los leiomiosarcomas y los leiomiomas fue altamente significativa (p=0,0001 y p=0,002, respectivamente).
La sobreexpresión de p16 se observa más frecuentemente en los leiomiosarcomas que en los STUMP y en estos mayor expresión que en los leiomiomas, en los que se han descrito casos con expresión de p16 pero de manera focal y no difusa. También se ha observado mayor frecuencia de recidiva en aquellos STUMP en los que p16 está sobreexpresada de manera difusa en el tejido neoplásico15-17.
Con respecto a la sobreexpresión de p53, una de las alteraciones genéticas más frecuentes en la carcinogénesis y asociada con comportamiento biológico más agresivo, los resultados en tumoraciones de músculo liso son variables; su sobreexpresión es menos frecuente que la de p16. La sobreexpresión de p53 en leiomiosarcomas oscila entre el 13 y el 56,6%, según las series18. En los STUMP se ha observado la existencia de correlación entre la expresión nuclear intensa en > 50% de las células tumorales y un curso clínico más agresivo.
Se puede decir, de manera global, que el estudio inmunohistoquímico de ciertos marcadores en las neoplasias de músculo liso puede ser de ayuda a la hora de prever un comportamiento maligno. La combinación de la sobreexpresión de p53 y p16 puede ayudar a identificar los STUMP clínicamente más agresivos o con mayor riesgo de recidiva, siendo de ayuda para su diagnóstico diferencial con los leiomiosarcomas19,20, sin olvidar que la base del diagnóstico es el estudio de las características morfológicas del tumor con la técnica convencional de hematoxilina- eosina.
No existen guías clínicas sobre el manejo clínico de este tipo de tumores puesto que los STUMP son tumores poco frecuentes y de difícil clasificación debido a la incertidumbre sobre su potencial maligno. De hecho, la mayoría de los leiomiosarcomas son neoplasias surgidas de novo y no el resultado de una transformación de tumor benigno a maligno21.
Uno de los problemas es que la mayoría de los STUMP son clasificados prequirúrgicamente como tumores con bajo riesgo de malignidad, como en el caso aquí presentado. De hecho, aunque prequirúrgicamente estuviesen clasificados como STUMP, sería difícil decidir la radicalidad de la cirugía.
Finalmente, incluso el manejo es difícil, aun ya teniendo el diagnóstico postoperatorio, debido a que el curso de este tipo de tumores es muy dispar.
Muchos autores abogan por la vía conservadora (extirpación quirúrgica) y un seguimiento apropiado y meticuloso semestral o anualmente, incluyendo revisión ginecológica y al menos una vez al año: radiografía de tórax (por su proximidad biológica a los sarcomas uterinos), ecografía pélvica (ginecológica), tomografía computarizada o resonancia magnética.
En mujeres en las que el diagnóstico fue posquirúrgico tras una miomectomía y no tienen deseos genésicos, deberemos proponerles una histerectomía, puesto que este tipo de tumores pueden recidivar. En aquellas que tenían deseos genésicos, se han descrito gestaciones exitosas tras la miomectomía, pero estas pacientes deben estar bien informadas de la posibilidad de recidiva y deben seguir una vigilancia exhaustiva22.
Puesto que no se han visto diferencias significativas en cuanto al pronóstico y la supervivencia entre un tratamiento u otro, se puede decir que es válido desde una tumorectomía hasta una histerectomía con doble anexectomía.
Los datos pronósticos son controvertidos y no uniformes. Es de gran dificultad interpretar las tasas de recidiva debido a que los casos descritos son escasos y la definición de STUMP es muy variable. Si bien es un hecho establecido que tienen mejor pronóstico, menores tasas de recidiva y más tardíamente que los leiomiosarcomas, su potencial biológico continúa siendo incierto; se han descrito casos de diseminación hematógena y linfática muchos años después de la extirpación quirúrgica inicial23-25.
En la serie de Peters et al.,26 que constaba de 15 pacientes diagnosticadas y tratadas de STUMP y 32 pacientes de leiomiosarcoma, las tasas de recidiva fueron del 28 y el 66%, respectivamente, sin especificar el tipo histológico de la misma. La supervivencia a los 5 años para los STUMP fue del 92% y la de los leiomiosarcomas del 40%27.
En la serie de Berreta el al.28 de 3 casos, uno metastatizó en pulmón a los 9 años tras seguimiento.
Por todo ello, estas pacientes deben tener un seguimiento estrecho, independientemente al tratamiento realizado, aunque hay que tener en cuenta que la mayoría de ellos tienen un curso benigno.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.