La rotura uterina es un fenómeno poco frecuente pero que puede tener graves consecuencias para la vida materna y fetal. Nuestro equipo presenta una rotura uterina espontánea en una gestante de 37 semanas antes del inicio del trabajo de parto. La ecografía obstétrica fue clave en el diagnóstico y se mostró más resolutiva que las imágenes de la ecografía abdominal y de la resonancia magnética. La realización inmediata de una laparotomía obtuvo como resultado un recién nacido sano y permitió la reparación uterina. En la exhaustiva anamnesis posterior, el único factor de riesgo encontrado fue el antecedente de dos legrados en gestaciones anteriores.
Uterine rupture is an uncommon event but can cause serious damage to both the mother and fetus. We report a case of spontaneous uterine rupture in a 37-week pregnant woman that occurred before the onset of labor. Obstetric ultrasound was the key to diagnosis, providing information not given by abdominal ultrasound or magnetic resonance imaging. Early laparotomy allowed a healthy newborn to be delivered and the uterine defect to be corrected. Subsequently, an exhaustive history was taken, revealing the antecedent of two curettages performed in two previous pregnancies as the only risk factor for this complication.
La rotura uterina es un fenómeno poco frecuente. Afecta al 1% de las gestantes con cesárea anterior y casi al 0,006% de las gestantes sin antecedentes de cesárea1. La mortalidad materna en casos de rotura oscila del 1 al 13%, mientras que la mortalidad fetal está entre el 74 y el 92%1. Estos porcentajes son mayores en los casos de rotura uterina en mujeres sin cesárea previa, en que la mortalidad materna es del 20 al 40%2.
El factor de riesgo más importante para la aparición de rotura uterina en países desarrollados es la cicatriz de la cesárea anterior1. Otros factores de riesgo son las cirugías uterinas, las malformaciones uterinas, gran multiparidad (más de 4 partos), la macrosomía fetal, la desproporción cefalopélvica, anomalías de placentación, los partos instrumentalizados, las versiones extrínsecas, las inadecuadas inducciones con prostaglandinas u oxitocina3.
Las roturas uterinas suelen tener lugar durante el trabajo de parto3. El síntoma más común es la aparición brusca de dolor abdominal, que puede ir acompañada de taquicardia materna, hipotensión, sangrado vaginal, taquisistolia en la monitorización cardiotocográfica o bradicardia fetal2.
Presentamos un caso de rotura uterina a nivel fúndico anteparto, donde la ecografía fue clave para un rápido diagnóstico. La inmediata intervención y la estabilidad hemodinámica tuvieron como resultado un recién nacido sano y la reparación uterina.
Caso clínicoMujer de 33 años, sin antecedentes familiares de interés, diagnosticada de fibromialgia, sin tratamiento. Refería historia de dos legrados extraclínicos previos por abortos diferidos en semanas 5.a y 12.a, el último de ellos 15 meses antes del ingreso. El embarazo fue controlado en nuestras consultas externas y estaba dentro de la normalidad. Se realizó el cribado de aneuploidías del segundo trimestre, que fue de bajo riesgo. Las ecografías realizadas en semanas 16.a, 21.a y 32.a mostraban un crecimiento acorde con la edad gestacional, con un líquido amniótico normal y una placenta normoinserta en cara posterior.
Acudió a urgencias en la semana 37.a de gestación por dolor abdominal de tipo cólico, de inicio brusco, de unas 2h de evolución. En la exploración abdominal presentaba un abdomen blando, depresible y escasamente doloroso a la presión profunda en el hemiabdomen superior; llamaba la atención un abdomen muy distendido y timpánico. Presentó una presión arterial de 123/73 mmHg y un pulso de 68 latidos por minuto. La analítica urgente informó de una hemoglobina de 13,8g/dl, hematocrito de 39,9%, 17.210 leucocitos/mm3 con 81% de neutrófilos y pruebas de coagulación normal. El sedimento y el análisis elemental de orina estuvieron dentro de la normalidad. En la prueba no estresante se constató un registro reactivo y sin dinámica uterina. En la exploración vaginal no se observó sangrado en la vagina ni emisión de líquido amniótico con la maniobra de Valsalva. El cérvix era permeable a un dedo y se tactó bolsa amniótica, con una puntuación de 4 en la prueba de Bishop. Con el diagnóstico de dolor abdominal inespecífico en gestante, se decidió realizar un tratamiento con analgésico por vía intravenosa y observación.
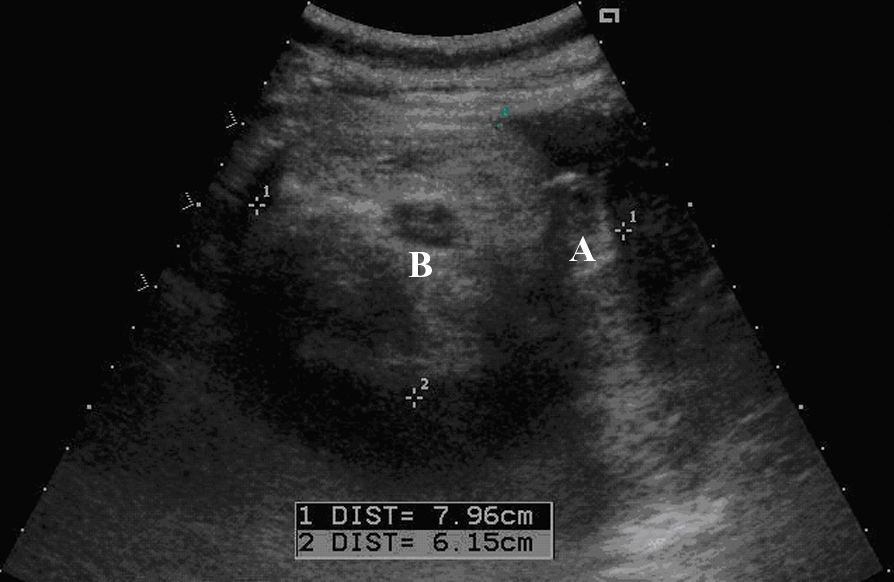
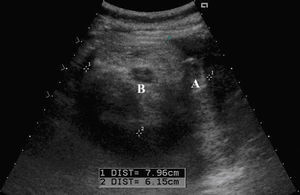
Una hora después del ingreso y ante la ausencia de mejoría clínica, se solicitó una ecografía abdominopélvica urgente que informó de una masa quística de 9×5cm inmediatamente superior al útero, de pared imperceptible y ecos en su interior. No se apreció líquido libre en la pelvis. Estas imágenes se interpretaron como compatibles con quiste mesentérico, linfangioma quístico o quiste de duplicación, por lo que se aconsejó la realización de una resonancia magnética urgente.
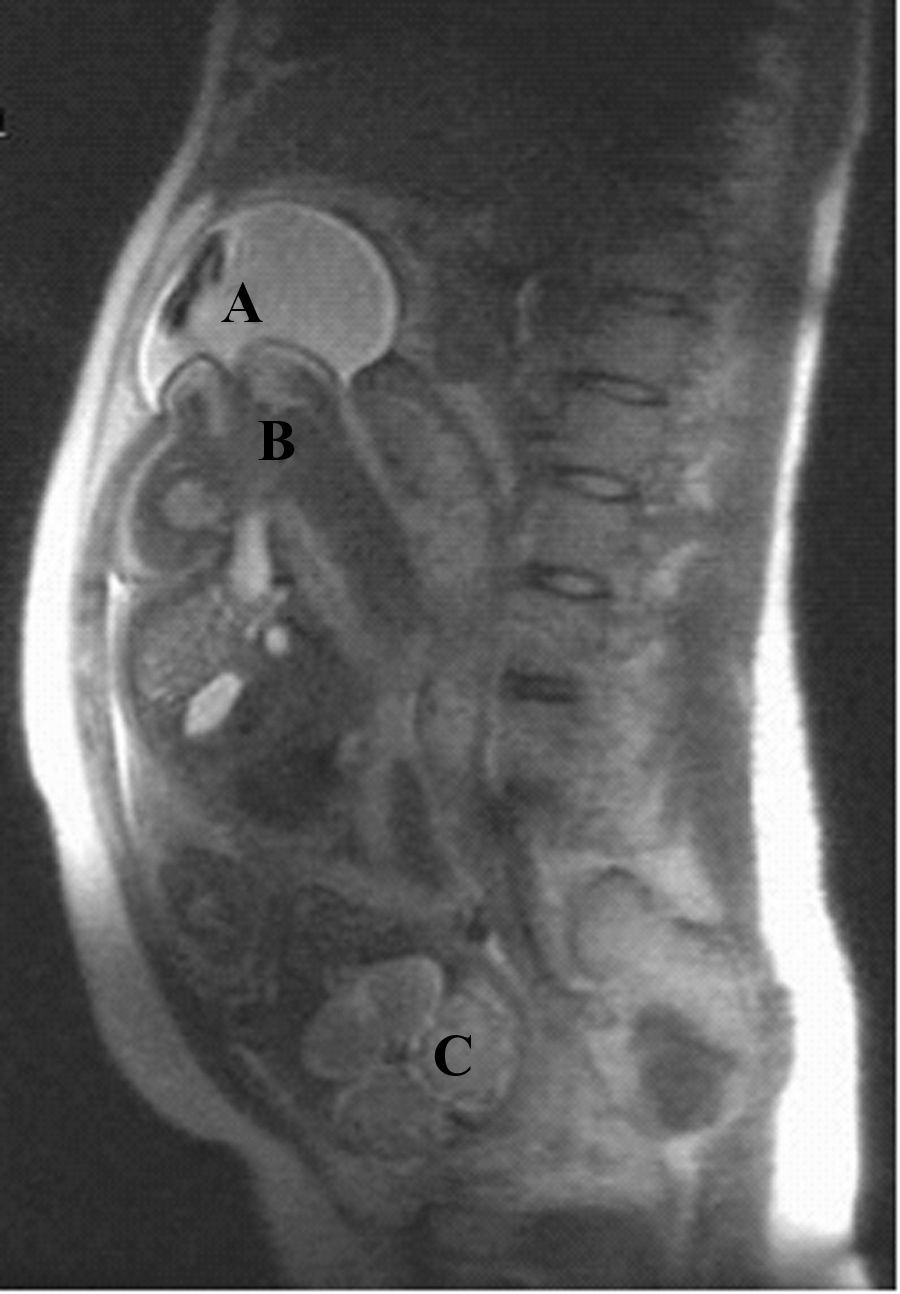
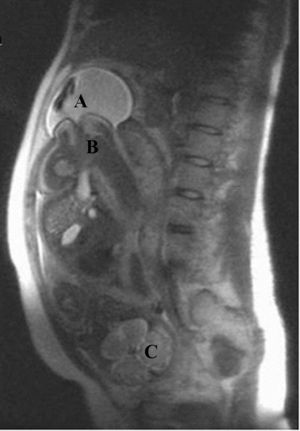
La resonancia reveló en el reborde superior fúndico una saculación de 8×11×6cm, con una pared marcadamente adelgazada a modo de divertículo, con líquido e imágenes de vacío de señal que sugerían flujo de líquido amniótico en su interior, con un cuello ancho de 5cm en el que se insinuaba la región glútea del feto (fig. 1). Los hallazgos son sugestivos de una saculación uterina.
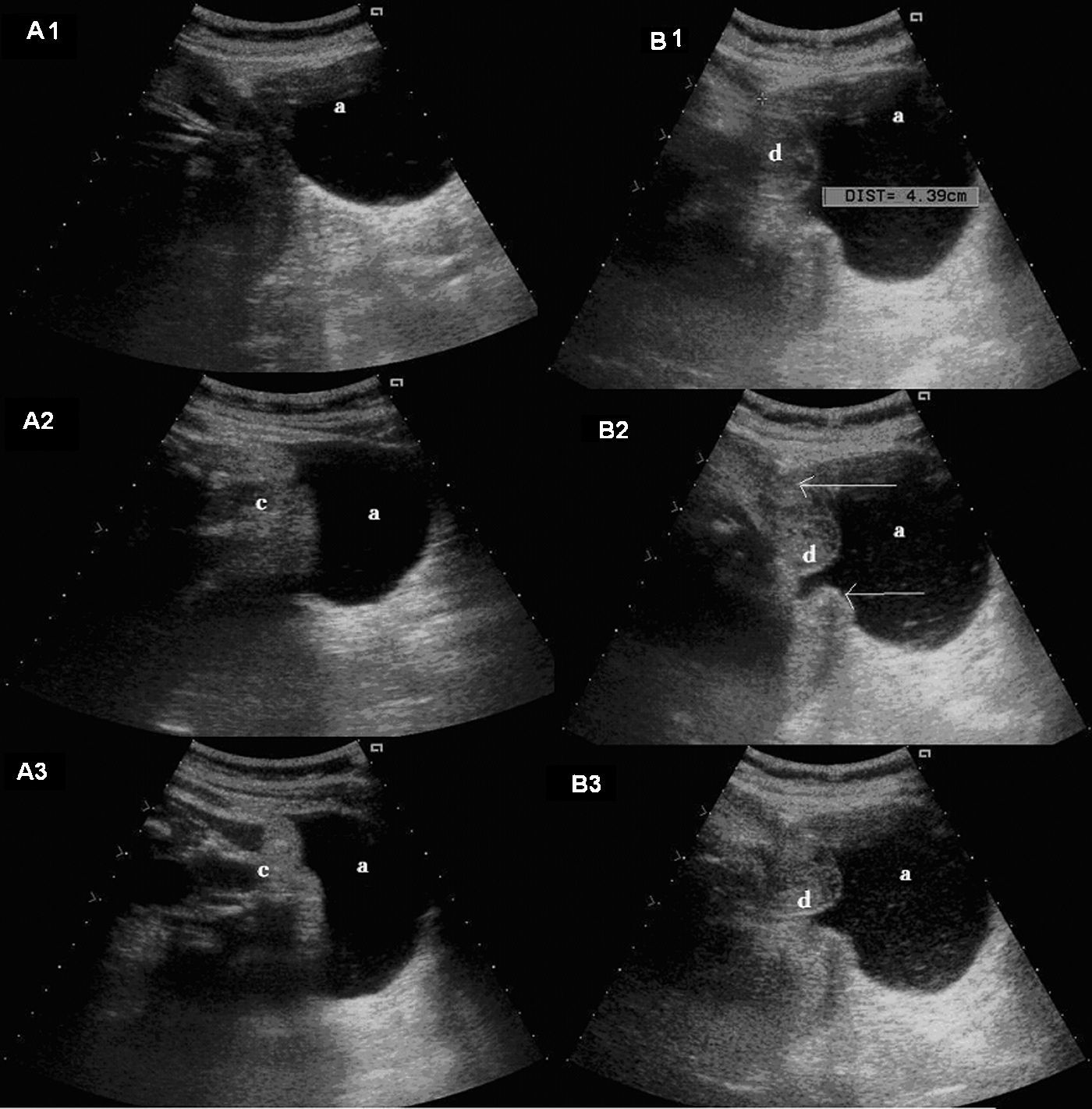
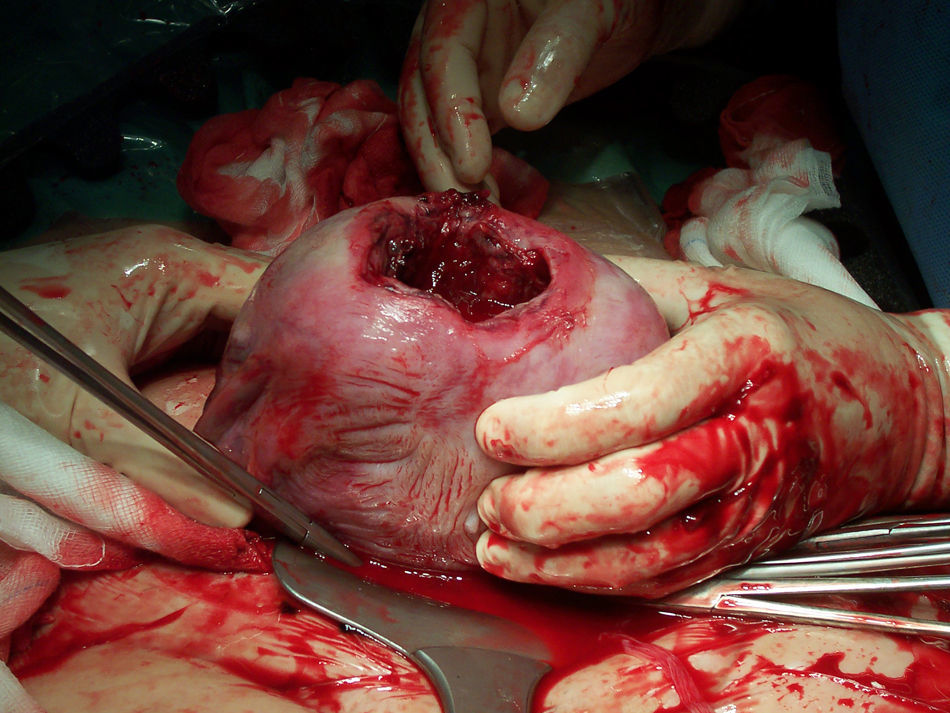
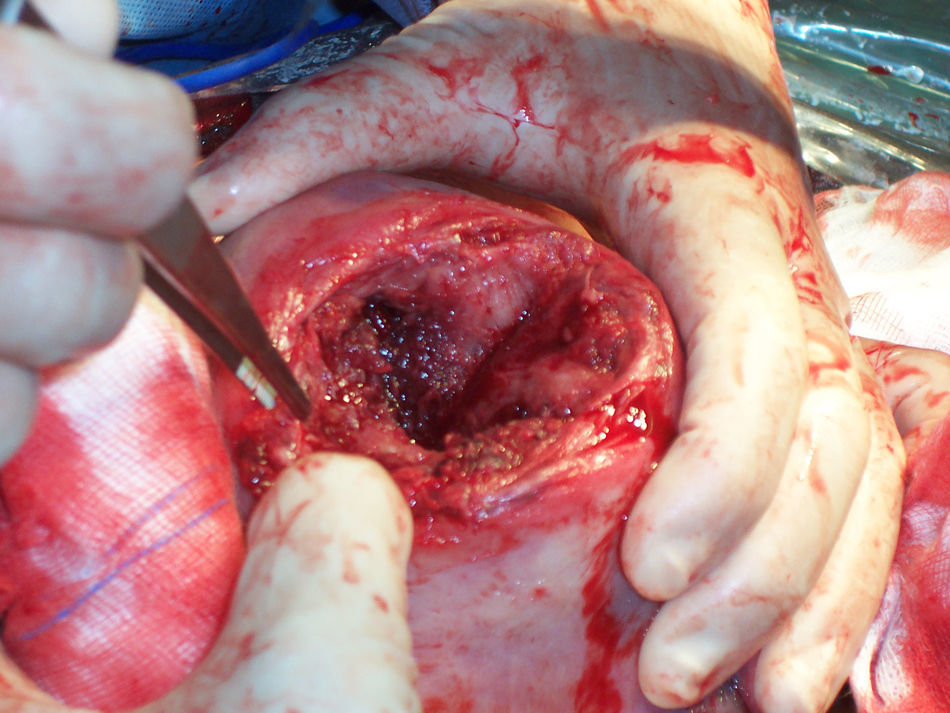
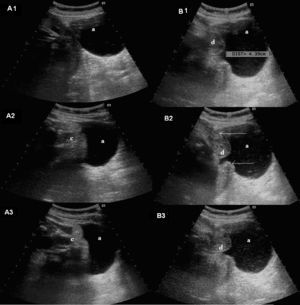
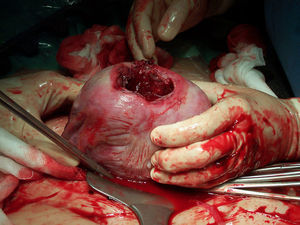
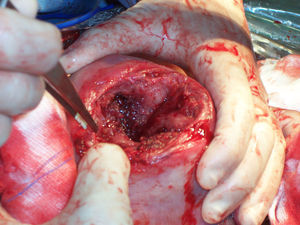
En la ecografía obstétrica de tercer nivel realizada de forma inmediata se apreció un feto único, en situación longitudinal y presentación cefálica, con latido cardíaco y movimientos fetales positivos. La placenta estaba inserta en la cara posterior y llamó la atención la presencia de oligoamnios. Se observó una eventración de la bolsa de líquido amniótico y feto a través de un defecto uterino fúndico de 7×6×8cm (figs. 2 y 3). La exploración en tiempo real permitió observar cómo el polo podálico fetal se insinuaba a través del defecto fúndico. Ante los hallazgos descritos y con el diagnóstico de sospecha de rotura uterina, se realizó de forma inmediata una cesárea urgente, donde se confirmó la existencia de una rotura uterina de unos 5cm de diámetro por donde asomaba la bolsa amniótica íntegra (fig. 4). En el acto quirúrgico no se observó líquido libre peritoneal. Se extrajo un recién nacido varón de de 2.570g de peso y una puntuación en la prueba de Apgar de 9 a los 5min. Se tomaron biopsias de los bordes de la rotura, informados intraoperatoriamente como fragmentos de fibrina y miometrio sin signos de proliferación neoplásica (fig. 5). Se corrigió el defecto fúndico con sutura en doble capa. Se realizó un tratamiento posquirúrgico habitual según protocolo de nuestro servicio.
Al sexto día poscirugía, con buena evolución y sin complicaciones, la paciente recibió el alta hospitalaria. Se recomendó evitar la gestación durante un mínimo de dos años y, en caso de nueva gestación, se indicó el seguimiento de ésta en la consulta de alto riesgo, con la práctica de una cesárea electiva en semana 37-38 o antes de iniciar el trabajo de parto.
La ecografía de control realizada en nuestras consultas a los 2 meses poscirugía mostró un útero de tamaño, morfología y consistencias normales, y no se objetivaron defectos en la pared de éste.
DiscusiónLa rotura uterina espontánea es un fenómeno extremadamente raro4. Estas roturas afectan al segmento inferior en el 92% de los casos y no existen diferencias entre úteros con cicatriz y úteros intactos; el cérvix se afecta en el 33% de las roturas sin cicatriz y en el 7% de los úteros con cicatriz5. La clínica se manifiesta habitualmente durante el trabajo de parto3. En este caso, vemos una rotura en la que se afectó la región fúndica y se presentó anteparto.
En casos de rotura asintomática o paucisintomática, la presencia de un oligoamnios severo6–8 de aparición brusca, en ausencia de historia de rotura de membranas, puede ser uno de los signos que nos haga sospechar una rotura uterina. En este caso, la paciente se presentó sin dinámica uterina y se observó un oligoamnios, a expensas de la migración del líquido a la bolsa eventrada a través del fondo uterino. Las imágenes de la ecografía obstétrica, así como la experiencia del obstetra, son aspectos fundamentales para el diagnóstico de este y otros cuadros que afectan de forma infrecuente a una gestación. La ecografía, a diferencia de la resonancia, permite valorar las imágenes en tiempo real. En este caso, permitió observar cómo las nalgas se insinuaban, a través del defecto fúndico, en la bolsa amniótica prolapsada a través de éste.
La inmediata intervención tras el diagnóstico es fundamental para conseguir buenos resultados, tanto maternos como fetales. Esta intervención debe consistir en una laparotomía inmediata para la extracción fetal. En función del defecto y el grado de hemorragia, deberá optarse por la histerectomía puerperal, solución en el 58-87% de los casos5, o la reparación del defecto9. La estabilidad hemodinámica de la paciente y la ausencia de un sangrado importante permitieron un manejo conservador del defecto, con una sutura en doble capa9. En los casos en que es posible la reparación, el riesgo de recurrencia es del 4,3 al 19%5. En embarazos posteriores, se debe programar una cesárea antes del inicio del trabajo de parto5.
Este caso ilustra de forma práctica la importancia de la anamnesis10. Interrogada posteriormente sobre los legrados anteriores, la paciente relató un episodio de posible perforación uterina, del que no disponemos del informe. El riesgo de perforación en un legrado uterino es del 1%7. La mayoría de estas perforaciones se solucionan de forma espontánea tras un tratamiento antibiótico profiláctico. Pequeñas perforaciones realizadas durante cirugías menores uterinas, como histeroscopia11, laparoscopia12 o legrado7, pueden ser causa de roturas uterinas durante la gestación. Al realizar la anamnesis, debe interrogarse a la paciente sobre posibles complicaciones en estas intervenciones.
Las biopsias realizadas de los bordes de la lesión eran de características normales, lo que nos permite, junto con la historia de la paciente, descartar las alteraciones del tejido conjuntivo como causa de la lesión13.
Aunque es un fenómeno poco frecuente, la rotura es una posible etiología que se debe tener en cuenta en caso de oligoamnios severos en gestantes sin historia de rotura de membranas, sobre todo en caso de cirugías uterinas previas o cuando se acompaña de otra sintomatología, como el dolor, la hemorragia o el shock hipovolémico. Para nuestro grupo, la ecografía es uno de los métodos fundamentales en el diagnóstico obstétrico que deberá, en caso necesario, acompañarse de otras exploraciones complementarias. En los casos de rotura en paciente hemodinámicamente estable es posible el manejo conservador en función del tamaño del defecto y del sangrado.