Evaluar la eficacia y seguridad de 5mg o 10mg diarios de mifepristona durante 3 meses para el tratamiento del fibroma.
Material y métodos90 mujeres con fibromatosis uterina sintomática se asignaron aleatoriamente a recibir 5 o 10mg de mifepristona (45 por grupo). Mediante ultrasonografía abdominal se calcularon los volúmenes del fibroma y del útero. La eficacia se estimó por la reducción de los volúmenes del fibroma, del útero y la prevalencia de los síntomas.
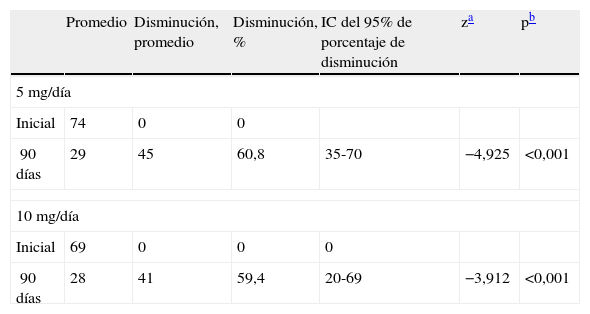
ResultadosEl fibroma se redujo en 60,8% (p<0,001) y 59,4% (p<0,001) en los grupos de 5 y 10mg, respectivamente. Hubo disminuciones muy significativas de los síntomas del fibroma en cada grupo de tratamiento. En los grupos de 5 y 10mg estaban amenorreicas el 86,4 y el 93,0% de las mujeres, respectivamente. No hubo ninguna hiperplasia endometrial.
ConclusionesAmbos tratamientos fueron eficaces en el tratamiento del mioma uterino.
To estimate the efficacy and safety of 5mg or 10mg mifepristone daily in the treatment of leiomyoma.
Material and methodsNinety women with symptomatic uterine myomas were randomised to receive 5mg or 10mg of mifepristone (45 per group). Leiomyomata and uterine volumes were evaluated by ultrasonography. Efficacy was estimated by the reduction of the leiomyomata and uterine volumes and the prevalence of symptoms.
ResultsAfter treatment, in the 5mg group there was a 60.8%, (P<.001), reduction in the fibroid volume and it was 59.4%, (P<.001), in the 10mg group. The prevalence of symptoms decreased significantly. After treatment, 93.8% subjects from the 10mg mifepristone group and 86.4% subjects from the 5mg group were amenorrheic, respectively.
ConclusionsBoth treatments were effective for treating uterine fibroids.
El fibroma uterino es uno de los tumores pélvicos benignos más frecuente; se presenta en un 35% de las mujeres mayores de 35 años y es la causa de hasta el 40% de todas las histerectomías1–4.
Los análogos de la GnRH consiguen una disminución del 36% del tamaño del fibroma y una significativa disminución de los síntomas asociados a este5. Sin embargo, a los 6 meses de tratamiento el tamaño del fibroma vuelve a ser el mismo y los síntomas asociados recidivan6.
Diferentes estudios sugieren que el crecimiento del leiomioma es hormonodependiente7 y que la actividad mitótica del fibroma es más grande en la fase lútea8.
El antiprogestágeno conocido como mifepristona ha demostrado tener similar o superior eficacia a los análogos de la GnRH en el tratamiento del fibroma9,10.
Murphy et al11,12 obtuvieron un 44 y 51% de disminución del tamaño del fibroma utilizando dosis de 25 y 50mg de mifepristona diarias durante 3 meses, respectivamente.
Eisinger et al13,14 obtuvieron resultados similares usando dosis diarias de 5 y 10mg de mifepristona en períodos de 6 meses, pero informaron de una alta tasa de hiperplasia endometrial al final del tratamiento, aunque en su siguiente estudio, utilizando las mismas dosis pero durante períodos de 12 meses, esta tasa de hiperplasias disminuyó significativamente al realizar un segundo examen diagnóstico.
Gommier et al15, utilizando dosis de 10mg de mifepristona, informan de resultados similares a los de Eisinger et al, con un 10% de hiperplasias simples endometriales postratamiento.
Fiscella et al16 demostraron una mejoría en la calidad de vida en pacientes tratadas con mifepristona durante 6 meses y no se registró ningún caso de hiperplasia simple.
En nuestro anterior estudio, utilizando dosis de 5 y 10mg de mifepristona diarias durante 3 meses, se obtuvieron reducciones significativas del tamaño del fibroma del 57 y el 45%, respectivamente, junto a una gran mejoría sintomática17.
Los objetivos del estudio fueron evaluar la eficacia y la seguridad de la administración de dosis diarias de 5 y 10mg de mifepristona durante períodos de 3 meses en el tratamiento del fibroma uterino.
Sujetos y métodosEste es un estudio clínico, aleatorizado, doble ciego, con dos grupos de tratamiento. El estudio fue aprobado por el Comité Científico del Hospital Alemán de Managua, Nicaragua, y se llevó a cabo según el contenido de las Declaraciones de las Asambleas Médicas Mundiales de Helsinki (1964), Hong Kong (1989) y Tokio (2004), y acorde con las leyes vigentes en la República de Nicaragua.
Las mujeres fueron reclutadas a partir de las referidas por los centros de salud, clínicas privadas y la consulta de clasificación de ginecología del hospital en que se realizó la investigación.
Los criterios de inclusión fueron: a) fibromatosis uterina sintomática; b) edad reproductiva; c) aceptar el uso de contracepción no hormonal; d) conformidad en llevar un diario mensual de todos los episodios de sangramiento vaginal durante el tratamiento y de los efectos secundarios de la mifepristona; e) estar de acuerdo en la realización de exámenes ultrasonográficos en cada consulta de evaluación y de seguimiento, y f) estar de acuerdo con la realización de dos biopsias endometriales: una antes del inicio del tratamiento y otra en los 10 días siguientes a la terminación de este. Criterios de exclusión: a) embarazo o intentos de quedar embarazada; b) lactancia; c) contracepción hormonal o cualquier terapia hormonal recibida en los 3 últimos meses antes del tratamiento; d) signos o síntomas de enfermedad pélvica inflamatoria; e) tumores anexiales; f) sangrado uterino anormal o inexplicado; g) sospecha o diagnóstico de enfermedad neoplásica maligna; h) signos o síntomas de enfermedad mental; i) enfermedad adrenal; j) anemia por hematíes falciformes; k) enfermedad hepática; l) enfermedad renal; m) coagulopatía; n) cualquier otra enfermedad severa o importante, y o) cualquier contraindicación para recibir antiprogestágenos. Después de brindar toda la información necesaria para la participación, se firmó el documento de consentimiento informado.
Se decidió no utilizar un grupo placebo para no privar a las mujeres de cualquier posibilidad terapéutica, dado que hay evidencia de que la utilización de dosis pequeñas de mifepristona reduce el volumen del fibroma, alivian los síntomas asociados y mejoran el estado general de la mujer.
Productos utilizadosLa mifepristona fue proveniente de ZIZHU PHARM Laboratories, Co. Ltd., Beijing, China. Las cápsulas de 5 y 10mg de mifepristona fueron preparadas por el farmacéutico del estudio.
Grupos de tratamientoGrupo I (mifepristona 10mg): 10mg por vía oral diarios de mifepristona durante 3 meses.
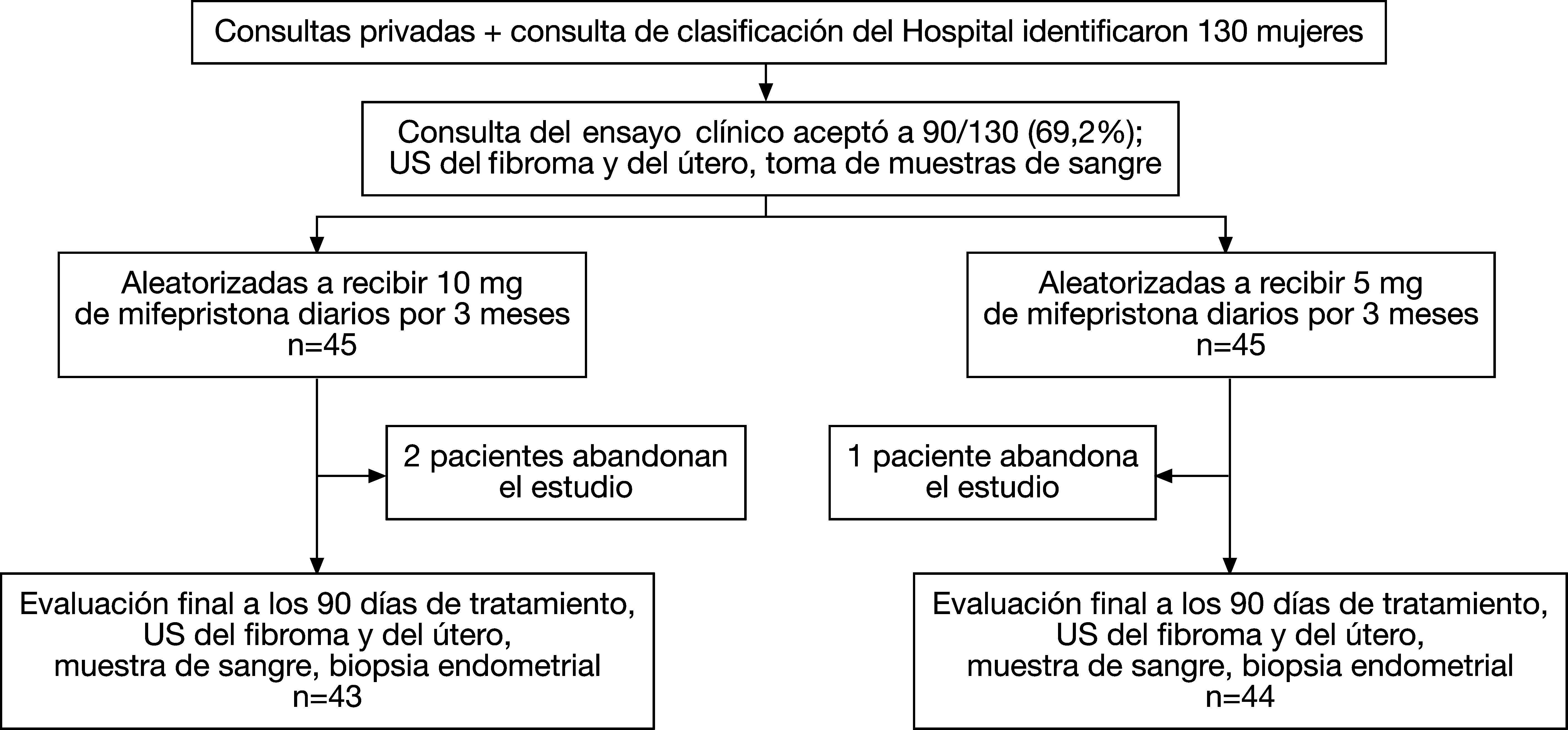
Grupo II (mifepristona 5mg): 5mg por vía oral diarios de mifepristona durante 3 meses. Las mujeres se evaluaron al inicio y a los 3 meses de tratamiento (fig. 1).
Exámenes realizadosSe realizó una ultrasonografía abdominal del útero antes del inicio y al final del tratamiento. El volumen del fibroma fue calculado mediante la fórmula: 4Πabc/3 donde a, b y c son los radios de la esfera en cada uno de los tres planos y se expresó en centímetros cúbicos18. Cuando había más de un mioma, se midió el mayor y las variaciones de este se utilizaron para estimar la eficacia del tratamiento. El volumen uterino total se midió empleando también la fórmula descrita antes. El grosor endometrial se midió en milímetros por medio de la ultrasonografía. Los exámenes ultrasonográficos se realizaron con un equipo Siemens Sonoline SI-200, Transductor Convexo Multifrecuencia de 3,5-5 MgH, Alemania.
Se tomaron muestras de sangre antes del inicio y al final del tratamiento para determinar los valores de hemoglobina y transaminasas hepáticas. A priori, se decidió que cualquier mujer que presentara alteraciones significativas en los valores de las transaminasas hepáticas sería separada del estudio.
Las muestras para biopsia endometrial se tomaron después de concluido el tratamiento con mifepristona. La biopsia se realizó en la consulta del hospital utilizando un recolector de muestras endometriales por aspiración CITOVAC-4, COVACA, S.A., Madrid, España. Las muestras del tejido endometrial fueron examinadas, leídas e informadas por el equipo de anatomía patológica del hospital. No se tomaron biopsias endometriales pretratamiento por impedimentos técnicos y económicos, y se decidió asumir las posibles consecuencias de esto dados la baja incidencia y el leve significado pronóstico de la hiperplasia simple. Las biopsias postratamiento se interpretaron sin conocimiento previo de la dosis de mifepristona utilizada. La interpretación histológica de las muestras de endometrio se realizó sin que el patólogo conociera los aportes hechos por varios estudios previos sobre los cambios que ocurren en el endometrio debidos a la acción de la mifepristona administrada durante largos períodos de tratamiento19,20. La biopsia endometrial se clasificó como normal si el endometrio se encontraba en fase secretora o proliferativa. La hiperplasia se definió según los criterios de la Organización Mundial de la Salud21,22. Las biopsias de endometrio patológicas se evaluaron para la presencia de neoplasia intraepitelial según los criterios descritos por Mutter23. A posteriori, se decidió enviar a Cuba las muestras histológicas etiquetadas de hiperplasia para una segunda lectura diagnóstica a doble ciego en el hospital Eusebio Hernández de La Habana, Cuba.
Variables estudiadasEn ambos grupos de tratamiento, la principal variable utilizada para estimar la eficacia fue el porcentaje de reducción del volumen del mioma con respecto al volumen antes del inicio del tratamiento con mifepristona. El porcentaje de reducción del volumen uterino con respecto al de antes del inicio del tratamiento fue utilizado como variable colateral para evaluar la eficacia.
Otras variables para la estimación de la eficacia fueron:
- 1.
Cambios en la prevalencia de los síntomas atribuibles al mioma uterino: dolor pélvico, dolor lumbar, dolor rectal, presión pélvica, síntomas urinarios, dispareunia, hipermenorrea y metrorragia. La prevalencia de ellos se midió antes del inicio del tratamiento y al final de este.
- 2.
Cambios en los valores de hemoglobina y transaminasas hepáticas al final del tratamiento con respecto a los iniciales.
- 3.
Efectos secundarios de la mifepristona: amenorrea, sofocos, nauseas y vómitos.
Las mujeres fueron asignadas a uno u otro grupo de tratamiento según una lista aleatoria generada por un ordenador. Personal ajeno al estudio preparó sobre opacos sellados, numerados en orden consecutivo; cada sobre contenía una tarjeta que indicaba el tratamiento al que se asignaba la mujer. El sobre correspondiente con el número de entrada de la mujer en el estudio fue abierto por uno de los médicos investigadores y se incluyó a la mujer en el grupo indicado por la tarjeta contenida en el sobre; en la tarjeta estaba escrito «mifepristona A» o «mifepristona B», donde A y B significaban 10 y 5mg de mifepristona, respectivamente. Solo el monitor del estudio conocía la dosis correspondiente a cada mujer y esta información se mantuvo en secreto hasta que concluyeron el procesamiento y el análisis de los datos del estudio. Los investigadores y las mujeres no supieron la dosis de mifepristona que se utilizó. No se consideró necesario establecer reglas de parada del estudio ni se planificó la realización de análisis intermedios.
Predeterminación del tamaño de la muestraLa disminución esperada del volumen del mioma se utilizó para estimar el número de mujeres que se debía incluir en el estudio. Se tomó el trabajo de Eisinger et al13 como referencia y se asumió que era posible esperar un 40% de reducción en el tamaño del mioma con respecto al valor antes del tratamiento utilizando dosis de 5 o 10mg de mifepristona, basados en las cifras reportadas en el cuarto mes de tratamiento con cada una de las dosis estudiadas. Un análisis de la potencia indicó que con 40 mujeres en cada grupo de tratamiento se tendría una potencia del 80% para detectar un 40% de diferencia en el cambio del volumen del mioma con respecto al valor inicial con un nivel de significación del 0,05 después de 3 meses de tratamiento con 10mg o con 5mg de mifepristona24. El número de sujetos que se debía incluir se incrementó en aproximadamente un 10% (45 mujeres en cada grupo de tratamiento, con un total de 90 mujeres), para prever posibles salidas debidas a pérdidas de seguimiento o por violaciones del protocolo.
EstadísticaLos resultados se presentan como porcentajes, promedios, desviaciones estándar e intervalos de confianza (IC) del 95% para los promedios. La suposición de normalidad de las variables continuas se realizó mediante gráficos y la prueba de Kolmogorov-Smirnov con corrección de Lilliefors para la significación. Cuando se asumió la normalidad, la prueba de la t de Student se utilizó para la comparación de los promedios de las variables cuantitativas. Cuando no se aceptó la hipótesis de normalidad, se utilizó la prueba no paramétrica U de Mann-Whitney para las comparaciones entre los grupos de tratamiento. La prueba de los rangos de Wilcoxon para muestras pareadas se utilizó para comparar los volúmenes finales del fibroma y del útero con sus respectivos valores antes del tratamiento. La prueba de la χ2 de Pearson y la prueba de la t de Student para muestras independientes se emplearon para evaluar la homogeneidad entre los grupos de tratamiento. La aproximación normal para proporciones se usó para la comparación de la prevalencia de síntomas y efectos secundarios entre los grupos. Todas las pruebas fueron de dos colas y se consideró estadísticamente significativo un valor de p<0,05. El análisis estadístico se realizó por medio del SPSS 11,05.
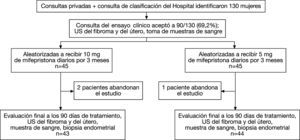
ResultadosEntre abril 2007 y noviembre 2008, 130 mujeres fueron remitidas a la consulta de la investigación, 40 de ellas no cumplieron los criterios de inclusión del estudio y, por tanto, se incluyó a 90/130 (69,2%) mujeres. Hubo 3 mujeres que abandonaron el estudio durante el primer mes de tratamiento, 2 del grupo de 10mg de mifepristona y 1 del grupo de 5mg; las 3 mujeres optaron por la realización de una histerectomía. El análisis se realizó según intención de tratar y sólo se excluyeron esos 3 casos cuando se evaluó la eficacia de los tratamientos.
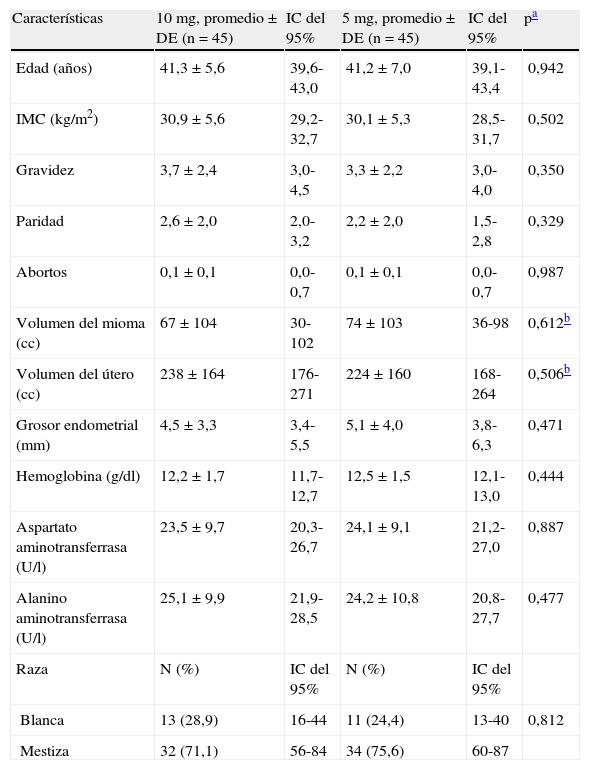
Las características de los sujetos según grupos de tratamiento se presentan en la tabla 1. No se obtuvieron diferencias significativas entre los grupos de tratamiento para ninguna de las variables. Dos pacientes estaban diagnosticadas de infertilidad en relación con el mioma y en la aleatorización ambas resultaron asignadas al grupo de 5mg de mifepristona.
Características de los sujetos según grupos de tratamiento
| Características | 10mg, promedio±DE (n=45) | IC del 95% | 5mg, promedio±DE (n=45) | IC del 95% | pa |
| Edad (años) | 41,3±5,6 | 39,6-43,0 | 41,2±7,0 | 39,1-43,4 | 0,942 |
| IMC (kg/m2) | 30,9±5,6 | 29,2-32,7 | 30,1±5,3 | 28,5-31,7 | 0,502 |
| Gravidez | 3,7±2,4 | 3,0-4,5 | 3,3±2,2 | 3,0-4,0 | 0,350 |
| Paridad | 2,6±2,0 | 2,0-3,2 | 2,2±2,0 | 1,5-2,8 | 0,329 |
| Abortos | 0,1±0,1 | 0,0-0,7 | 0,1±0,1 | 0,0-0,7 | 0,987 |
| Volumen del mioma (cc) | 67±104 | 30-102 | 74±103 | 36-98 | 0,612b |
| Volumen del útero (cc) | 238±164 | 176-271 | 224±160 | 168-264 | 0,506b |
| Grosor endometrial (mm) | 4,5±3,3 | 3,4-5,5 | 5,1±4,0 | 3,8-6,3 | 0,471 |
| Hemoglobina (g/dl) | 12,2±1,7 | 11,7-12,7 | 12,5±1,5 | 12,1-13,0 | 0,444 |
| Aspartato aminotransferrasa (U/l) | 23,5±9,7 | 20,3-26,7 | 24,1±9,1 | 21,2-27,0 | 0,887 |
| Alanino aminotransferrasa (U/l) | 25,1±9,9 | 21,9-28,5 | 24,2±10,8 | 20,8-27,7 | 0,477 |
| Raza | N (%) | IC del 95% | N (%) | IC del 95% | |
| Blanca | 13 (28,9) | 16-44 | 11 (24,4) | 13-40 | 0,812 |
| Mestiza | 32 (71,1) | 56-84 | 34 (75,6) | 60-87 |
DE: desviación estándar; IC: intervalo de confianza; IMC: índice de masa corporal.
Había solo un mioma en 10/45 (22,2%) de mujeres del grupo de 10mg de mifepristona y en 15/45 (33,3%) de las del grupo de 5mg (p=0,120). En total, el 41% de los fibromas uterinos medidos eran subserosos, el 55,6% eran intramurales y el 3,4% eran submucosos; no hubo diferencias significativas entre los grupos (p=0,448).
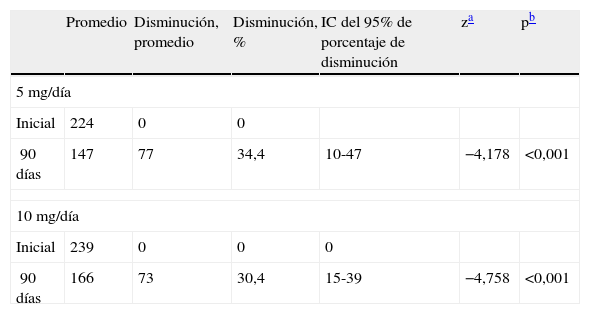
En las tablas 2 y 3 se muestran los cambios ocurridos en los volúmenes del mioma y del útero a los 3 meses de tratamiento con respecto a los valores antes de iniciar el mismo.
Cambios en los volúmenes de los fibromas (cc) en cada grupo de tratamiento
| Promedio | Disminución, promedio | Disminución, % | IC del 95% de porcentaje de disminución | za | pb | |
| 5mg/día | ||||||
| Inicial | 74 | 0 | 0 | |||
| 90 días | 29 | 45 | 60,8 | 35-70 | −4,925 | <0,001 |
| 10mg/día | ||||||
| Inicial | 69 | 0 | 0 | 0 | ||
| 90 días | 28 | 41 | 59,4 | 20-69 | −3,912 | <0,001 |
IC: intervalo de confianza.
Cambios en los volúmenes uterinos (cc) en cada grupo de tratamiento
| Promedio | Disminución, promedio | Disminución, % | IC del 95% de porcentaje de disminución | za | pb | |
| 5mg/día | ||||||
| Inicial | 224 | 0 | 0 | |||
| 90 días | 147 | 77 | 34,4 | 10-47 | −4,178 | <0,001 |
| 10mg/día | ||||||
| Inicial | 239 | 0 | 0 | 0 | ||
| 90 días | 166 | 73 | 30,4 | 15-39 | −4,758 | <0,001 |
IC: intervalo de confianza.
A los 3 meses de tratamiento, en el grupo de 10mg el volumen promedio del fibroma fue 28±48cm3 (IC del 95%, 9-37) y en el de 5mg fue 29±51cm3 (IC del 95%, 11-37) (p=0,874). El volumen del útero a los 3 meses de tratamiento en el grupo de 10mg fue 166±123cm3 (IC del 95%, 120-189) y en el grupo de 10mg ese volumen fue 147±110cm3 (IC del 95%, 112-18) (p=0,430). Al final del tratamiento, el grosor endometrial promedio fue 5,2±3,3mm (IC del 95%, 4,2-6,3) en el grupo de 10mg y de 6,4±4,0mm (IC del 95%, 4,9-8,0) en el grupo de 5mg.
No hubo disminución en el volumen del fibroma con respecto a su valor inicial en 9/43 (20,1%) casos del grupo de 10mg y en 6/44 (13,6%) sujetos del grupo de 5mg, respectivamente (p=0,184). No hubo disminución en el volumen uterino con respecto a su valor inicial en 7/43 (16,3%) casos del grupo de 10mg y en 10/44 (22,7%) sujetos del grupo de 5mg, respectivamente (p=0,224).
En el grupo de 10mg de mifepristona, el grosor endometrial promedio antes del tratamiento fue 4,5±3,3mm (IC del 95%, 3,4-5,5) y al final de este fue de 5,1±4,0mm (IC del 95%, 4,2-6,3), con un aumento de 13,3% con respecto al valor inicial. En el grupo de 5mg de mifepristona, el grosor endometrial promedio antes del tratamiento fue de 5,1±4,0mm (IC del 95%, 3,8-6,3) y a los 3 meses fue de 6,4±4,9mm (IC del 95%, 4,9-8,0), con un aumento de 25,5% con respecto al valor inicial.
En la visita de evaluación, a los 90 días después de haber iniciado el tratamiento, 40/43 (93,0%) mujeres del grupo de 10mg de mifepristona y 38/44 (86,4%) del grupo de 5mg estaban amenorreicas, respectivamente (p=0,504).
En esa visita, los sofocos fueron referidos por 10/43 (23,3%) mujeres del grupo de 10mg de mifepristona y en el grupo de 5mg por 10/44 (22,7%) sujetos (p=0,447).
Con respecto a los efectos secundarios atribuibles a la mifepristona informados por las mujeres en la visita de los 3 meses, se obtuvo lo siguiente: 5/43 (11,6%) de náuseas en el grupo de 10mg y 2/44 (4,5%) en el grupo de 5mg (p=0,112); los vómitos fueron reportados por 1/43 (2,3%) de las mujeres del grupo de 10mg y por 1/44 (2,3%) de las del grupo de 5mg (p=0,493).
En la tabla 4 se presentan las prevalencias de los síntomas del fibroma antes y después del tratamiento, y para cada grupo del mismo.
Prevalencia de los síntomas del fibroma antes y al final del tratamiento según grupos
| Síntomas del fibroma | 10mg (n=43) | 5mg (n=44) | p* |
| Dolor pélvico | |||
| Antes del tratamiento | 38 (88,4%) | 37 (84,1%) | 0,280 |
| 3 meses | 6 (14,0%) | 4 (9,1%) | 0,191 |
| Presión pélvica | |||
| Antes del tratamiento | 30 (69,7%) | 30 (68,2%) | 0,437 |
| 3 meses | 8 (18,6%) | 4 (9,1%) | 0,099 |
| Síntoma urinarios | |||
| Antes del tratamiento | 31 (72,1%) | 29 (65,9%) | 0,267 |
| 3 meses | 11 (25,6%) | 14 (31,8%) | 0,260 |
| Dolor lumbar | |||
| Antes del tratamiento | 38 (88,4%) | 35 (79,5%) | 0,131 |
| 3 meses | 8 (18,6%) | 6 (13,6%) | 0,264 |
| Dolor rectal | |||
| Antes del tratamiento | 11 (25,6%) | 6 (13,6%) | 0,080 |
| 3 meses | 0 (0,0%) | 0 (0,0%) | – |
| Dispareunia | |||
| Antes del tratamiento | 17 (39,5%) | 15 (34,1%) | 0,299 |
| 3 meses | 6 (14,0%) | 9 (20,5%) | 0,211 |
| Hipermenorrea | |||
| Antes del tratamiento | 34 (79,1) | 31 (70,5%) | 0,178 |
| 3 meses | 2 (4,7%) | 1 (2,3%) | 0,272 |
| Metrorragia | |||
| Antes del tratamiento | 35 (81,4%) | 34 (77,3%) | 0,318 |
| 3 meses | 2 (4,7%) | 0 (0,0%) | 0,074 |
En total, 11 (12,6%) mujeres presentaron elevaciones de las transaminasas hepáticas al final del tratamiento y tales valores se encontraban entre 50 y 99 U (valores normales: 41 y 38 U para ASAT y ALAT, respectivamente). En 6/43 (14,0%) se había utilizado 10mg de mifepristona.
En total, el 6,9% de las mujeres tenían valores de hemoglobina <10,0g/dl en el momento de la inclusión en el estudio. Una vez concluido el tratamiento, sólo una mujer tenía una hemoglobina de 9,5g/dl y cuando fue incluida en el estudio tenía 11,6g/dl de hemoglobina. En total, a la inclusión, el 29,9% de las mujeres tenían valores de hemoglobina <12,0g/dl; cuando el estudio concluyó, el 20,7% del total tenía aun valores de hemoglobina <12,0g/dl (p=0,082).
Después de finalizado el tratamiento, se obtuvieron 81/87 (93,1%) muestras para biopsia endometrial, en 13/81 (16%) de las cuales no se obtuvo suficiente material para diagnóstico; en las 68 biopsias endometriales útiles se diagnosticaron 16/68 (23,5%) endometrios proliferativos: 9/36 (25%) en el grupo de 10mg y 7/32 (21,9%) en el de 5mg; 13 (19,1%) endometrios secretores: 7/36 (19,4%) en el grupo de 10mg de mifepristona y 6/32 (18,8%) en el grupo de 5mg; 6/68 (8,8%) endometrios mixtos: 4/36 (11,1%) en el grupo de 10mg y 2/32 (6,3%) en el de 5mg; en 13/68 (19,1%) presencia de pólipos fibroglandulares: 3/36 (8,3%) en el grupo de 10mg y 10/32 (31,3%) en el de 5mg; en 13/68 (19,1%) había dilatación quística de las glándulas endometriales: 8/36 (22,2%) en el grupo de 10mg y 5/32 (15,6%) en el de 5mg. Se diagnosticaron 5 hiperplasias simples y 1 compleja, 3 en el grupo de 10mg de mifepristona (entre ellas la compleja) y 3 en el grupo de 5mg. En la segunda lectura diagnóstica realizada en Cuba de las laminillas histológicas que habían sido etiquetadas de «hiperplasia» en Nicaragua, se obtuvieron los siguientes resultados: 1 caso fue clasificado como no útil para diagnostico por uno de los patólogos y de «escasas glándulas con artefactos» por el otro. Tres casos fueron diagnosticados de «endometrio proliferativo tardío o secretor temprano» por ambos patólogos. Otro caso fue diagnosticado de «endometrio secretor con glándulas quísticas» por los dos patólogos, y el otro fue etiquetado de endometrio con pólipo endometrial.
En el curso de 3 meses después de finalizado el tratamiento, se realizó una histerectomía a 5 mujeres, 3 del grupo de 10mg y 2 del grupo de 5mg de mifepristona. Tres de ellas solicitaron la histerectomía por voluntad propia y en las otras 2 mujeres fue por indicación médica por sangramiento abundante y dolor. Las 5 mujeres tenían entre 40 y 45 años de edad y varios partos. También, una vez concluido el tratamiento, 2 mujeres del grupo de 5mg de mifepristona quedaron embarazadas y fueron las que tenían diagnosticada infertilidad asociada al mioma. En el momento de escribir este informe los embarazos cursaban con normalidad.
DiscusiónLa ausencia de un grupo placebo fue una de las carencias más importantes de este estudio. El estudio tuvo una aceptable validez externa: 7 de cada 10 pacientes fueron incluidas en él. No hubo diferencias significativas entre los dos grupos de tratamiento en lo que respecta a las siguientes variables: a) volumen del fibroma; b) volumen del útero; c) prevalencia de los síntomas atribuibles al fibroma, y d) efectos secundarios atribuibles a la mifepristona.
Respecto a nuestro estudio anterior, se observó una reducción porcentual similar del volumen del fibroma del 60,8 frente al 57% en el grupo de 5mg, pero no así en el grupo de 10mg (el 59,4 frente al 45%)17.
Respecto a la disminución del volumen uterino los porcentajes, son bastante similares: el 30,4 frente al 40% en el grupo de 10mg y el 34,4 frente al 36% en el grupo de 5mg17.
Las disminuciones de los volúmenes del fibroma y del útero obtenidas en este estudio están dentro de rangos similares a los obtenidos en la mayoría de los estudios que utilizan las mismas dosis de mifepristona que en el nuestro13,14,25.
Es muy llamativo que los volúmenes del fibroma y del útero de base de los que parte nuestro estudio son 2-3 veces inferiores a los del nuestro estudio anterior realizado en Cuba17, es decir, se trata en este caso de miomas bastante más pequeños. El porcentaje de pacientes en que no disminuyeron los volúmenes del fibroma y del útero en este estudio son casi idénticos a los del nuestro previo17.
Igual que en nuestro estudio anterior, se produjo una casi espectacular mejoría sintomática en la mayoría de las pacientes, que motivó además una gran adhesión al tratamiento por parte de ellas, al igual que ocurrió en nuestro anterior estudio17. Hay que resaltar que aquí las prevalencias de los síntomas postratamiento fueron sensiblemente superiores a los de nuestro anterior estudio, pero debido probablemente a que las prevalencias iniciales de este estudio son también bastante superiores a los del anterior, a excepción hecha de la dispareunia e hipermenorrea17. Estas altas prevalencias de los síntomas contrastan con el pequeño tamaño promedio de los fibromas de este estudio, ya que a fibroma más pequeño debería corresponder una menor sintomatología. Esta mayor prevalencia de síntomas pretratamiento pudiera tener alguna relación con la mayor prevalencia de miomas subserosos (el 41 frente al 28%) que en nuestro anterior estudio17.
A diferencia de la hipermenorrea, que prácticamente desaparece después del tratamiento, la prevalencia de la dispareunia en este estudio permanece muy alta después d este, a diferencia del anterior estudio, probablemente debido a factores obstétricos en relación con la alta paridad de la muestra del presente estudio (2,4 frente a 1,1 en el anterior)16, lo cual debe provocar un mayor número de prolapsos uterinos, cicatrices, etc., que lógicamente no mejoran con la disminución del tamaño del fibroma. Lo mismo debe ocurrir con la alta prevalencia postratamiento de los síntomas urinarios, ya que en las pacientes que, habiendo disminuido el fibroma, siguen teniendo síntomas urinarios, estos pueden deberse a causas obstétricas y no al factor fibromatoso.
Es llamativo que el 15/87 (17,2%) de los casos en que el fibroma uterino no disminuyó, 12/15 (80%) mujeres sí experimentaron mejoría sintomatológica, y sólo en 3 casos persistieron los síntomas: 1 de ellos acabó en histerectomía, otro sigue con intensa dispareunia y otro fue una pérdida de seguimiento. Es decir, la mifepristona mejoró la situación clínica de las pacientes, independientemente de que el fibroma se redujera o no.
El porcentaje de amenorrea obtenido en este estudio es casi idéntico al nuestro anterior y muy parecido a los obtenidos por el resto de autores que utilizan dosis de mifepristona similares a las nuestras, aunque hay una tendencia a que estos porcentajes disminuyan sensiblemente conforme se alargan los periodos de tratamiento9,10,13,14,16,17,25. Este efecto amenorreico beneficioso está en relación con la mejoría hemoglobínica y sintomática que experimentan las pacientes. A diferencia de nuestro estudio anterior, los sofocos debidos a la mifepristona son similares en ambos grupos de tratamiento (el 23,3 y el 22,7%, respectivamente). Respecto al resto de efectos secundarios producidos por la mifepristona (náuseas, vómitos, etc.), nuestros resultados no difieren del resto de estudios9,10,13,14,16,17,25.
El 11% de casos con las enzimas hepáticas elevadas en este estudio fue superior a los resultados obtenidos en el nuestro anterior (5%)17 y cercano al 8% obtenido por Eisinger et al13. En cualquier caso, fue mínima la significación clínica de estas elevaciones y la mayoría de ellas revirtieron espontáneamente.
En la primera lectura diagnóstica realizada en Nicaragua se obtuvo 6/68 (8,8%) hiperplasias: 5 simples y 1 compleja. Este 8,8% obtenido en este estudio es inferior al 28% obtenido por Eisinger et al13,14, en la primera lectura diagnóstica que hicieron, y cercano al 14% de su segunda lectura diagnóstica, con la diferencia de que en este estudio sí hubo hiperplasias en el grupo de 5mg. El 0% de hiperplasia obtenido en la segunda lectura diagnóstica a doble ciego realizada por el equipo de Cuba contrasta fuertemente con el 8,8% de hiperplasias obtenido en Nicaragua. Somos conscientes de que releer sólo los casos diagnosticados de hiperplasia fue en sí mismo un sesgo, pero fue imposible por cuestiones protocolarias enviar a Cuba las 68 muestras obtenidas en Nicaragua. Igualmente, somos conscientes de que el hecho de no haber realizado una biopsia previa a la inclusión en el estudio podría cambiar el porcentaje de hiperplasias obtenido, aunque ello es poco probable dada la baja incidencia de hiperplasia simple en la población general. También hay que considerar que sólo se obtuvieron resultados diagnósticos del 79,8% del total de mujeres tratadas.
Para comprender mejor estos resultados, hay que tener en cuenta que los criterios para distinguir la hiperplasia endometrial simple de los desórdenes proliferativos del endometrio no están bien definidos. Por ejemplo, mientras algunos autores aceptan como hiperplasia cualquier endometrio proliferativo con una relación glándulas/estroma de 1:1, otros autores exigen que esta relación sea > 3:126.
Otra gran carencia de este estudio es no haber incluido en el diseño del protocolo un seguimiento postratamiento de una duración de 6 a 12 meses para poder evaluar por cuánto tiempo se mantienen los efectos terapéuticos de la mifepristona y poder decidir cada qué tiempo hay que repetir un nuevo ciclo de tratamiento. Este estudio comenzó al mismo tiempo y con protocolo casi idéntico al nuestro primer y único estudio publicado17 y, por tanto, presenta los mismos defectos y virtudes.
A modo de conclusión, podríamos decir que ambos grupos de tratamiento fueron eficaces en el tratamiento del mioma uterino. Es necesario determinar con más detalles los aspectos histológicos de este tratamiento y en particular la incidencia de hiperplasia simple.
AgradecimientosA Miguel Errasti Santa Cruz, por su inestimable colaboración.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.