Las metástasis en los orificios de los trocares son una recurrencia tumoral precoz y localizada en la pared abdominal en el orificio de algún trocar laparoscópico. Esta complicación es infrecuente y tanto la incidencia como las causas de su aparición siguen siendo desconocidas.
Presentamos un caso clínico de una paciente de 65 años diagnosticada de un adenocarcinoma de endometrio moderadamente diferenciado (G2), con áreas de patrón seroso papilar, estadio ib. Se realizó una histerectomía total y un lavado peritoneal con linfadenectomía pélvica bilateral y paraaórtica robótica, que tuvo que reconvertirse a laparotomía por sangrado profuso incontrolable con utensilios robóticos. A los 12 meses poscirugía, durante el seguimiento de la paciente, se diagnostican 2 nódulos en los orificios del trocar. Se realizó la exéresis de los mismos, informando la anatomía patológica de adenocarcinoma de tipo seroso.
En la actualidad, debido al escaso número de casos, no es posible definir con claridad las medidas preventivas, el manejo ni el pronóstico de esta complicación.
Laparoscopic port-site metastases are early recurrent tumoral lesions developing locally in the abdominal wall within the scar tissue of one or more trocar sites. This complication is rare; the incidence and the pathogenesis and development of these tumors are unknown.
We present the case of a 65-year-old women diagnosed with a moderately-differentiated endometrial adenocarcinoma (G2), serous papillary pattern, stage Ib. After clinical and imaging evaluation, the patient underwent robotic surgery consisting of radical hysterectomy, peritoneal lavage, and pelvic and paraaortic lymphadenectomy. Due to uncontrollable heavy bleeding during surgery, we were forced convert to open surgery. After a 12-month follow-up, the patient was diagnosed with two abdominal wall masses under the port-site. The lesions were surgically excised. Pathologic examination revealed serous adenocarcinoma.
Currently, due to the limited number of cases, the incidence, prevention, management and prognosis of this complication are unclear.
Las metástasis en los orificios de los trocares son una recurrencia tumoral precoz y localizada en la pared abdominal en el orificio de algún trocar. Hace unas décadas, las cirugías ginecológicas oncológicas se realizaban mediante laparotomías; en los últimos años, los ginecólogos han introducido la laparoscopia y, posteriormente, la robótica para este tipo de intervenciones. Con el aumento del número de cirugías mínimamente invasivas ha habido mayor desconcierto sobre las recurrencias de la enfermedad en los orificios de los trocares; complicación de baja incidencia pero que conlleva un peor pronóstico de estas pacientes a largo plazo. Existen en la actualidad descritos tan solo 3 casos de metástasis en el orificio del trocar tras cirugía robótica, como sucedió en el caso clínico expuesto a continuación.
Caso clínicoPresentamos un caso clínico de una paciente de 65 años, multípara (G4P3C1) sin antecedentes de tratamiento con terapia hormonal sustitutiva y con obesidad. Como antecedentes familiares de interés, su hermana había presentado cáncer de endometrio. Acude a consultas de ginecología por metrorragia posmenopáusica. En la exploración se aprecian genitales externos y vagina atróficos, cérvix atrófico de multípara, y no se palpan masas ni sangrado durante la exploración. Se realiza una ecografía ginecológica en la que se observa un endometrio dishomogéneo, engrosado (24mm), con alguna imagen anecoica en su espesor, con mapa color en espesor y zona periférica con vasos de IR bajo (0,42-0,45), que parece invadir el miometrio (> 50%) en la cara interior y fondo con distancia a serosa uterina de 3mm. Ambos ovarios de tamaño y ecoestructura normal. La histeroscopia muestra una masa filiforme, desflecada e hipervascularizada que ocupa toda la cavidad y que se biopsia, y que informa de adenocarcinoma de endometrio moderadamente diferenciado (G2), la radiografía de tórax informa de normal y la resonancia magnética de masa de bordes irregulares con infiltración miometrial mayor del 50%, sin evidencia de invasión de estructuras adyacentes.
Tras consenso en el comité de tumores de nuestro hospital, se decide, sobre la base del protocolo establecido en nuestro hospital para los tumores G2 y G3, la realización de histerectomía total con doble anexectomía y lavado peritoneal con linfadenectomía pélvica bilateral y paraaórtica robótica.
Se inicia la cirugía robótica mediante técnica abierta, con incisión infraumbilical, con trocar de Hasson, evidenciando un útero en retroversión de aspecto macroscópicamente normal, múltiples y fuertes adherencias a la plica vesical y desde la pared posterior al recto. Se realizan 4 incisiones más, 3 de ellas de 8mm para los brazos robóticos y otra en el hipocondrio derecho de 10mm para la ayuda laparoscópica del robot. La cirugía inicialmente se planteaba para posterior redocking (recolocación del robot) para el campo paraaórtico. La presión máxima del neumoperitoneo utilizada es de 12mmHg.
Se realiza lavado peritoneal. En un primer tiempo se realiza la coagulación bipolar de las trompas para evitar el trasvase de células tumorales a la cavidad peritoneal. Durante el proceso de liberación del útero, en la cara anterior se produce la apertura de cavidad uterina, con salida de material tumoral y con sangrado profuso, que es imposible de controlar con instrumental robótico, por lo que se decide reconvertir a laparotomía. Se realiza la histerectomía total con doble anexectomía, así como la linfadenectomía pélvica y paraaórtica. Durante el tiempo de cirugía robótica (escasamente 30min), hubo poca movilización de los trocares, sin evidenciar fugas de gas a través de los orificios; se utilizo CO2 a presiones y flujos correctos, se extrajo todo el líquido restante de la cavidad peritoneal, se retiraron los trocares previa extracción del neumoperitoneo y, tras la laparotomía y la cirugía completa, se suturó la fascia en aquellos orificios ≥ 10mm y el cierre de piel fue con grapas.
La anatomía patológica de la pieza informa de adenocarcinoma de endometrio moderadamente diferenciado (G2), con áreas de patrón seroso papilar de una invasión del 85% del espesor e invasión de la serosa en la cara anterior del útero; lavado peritoneal negativo y ganglios pélvicos y paraaórticos sin evidencia de neoplasia (7 ganglios pélvicos y 4 ganglios paraaórticos extradios). Según la estadificación de la FIGO (2009), se trata de un estadio iiiA G2.
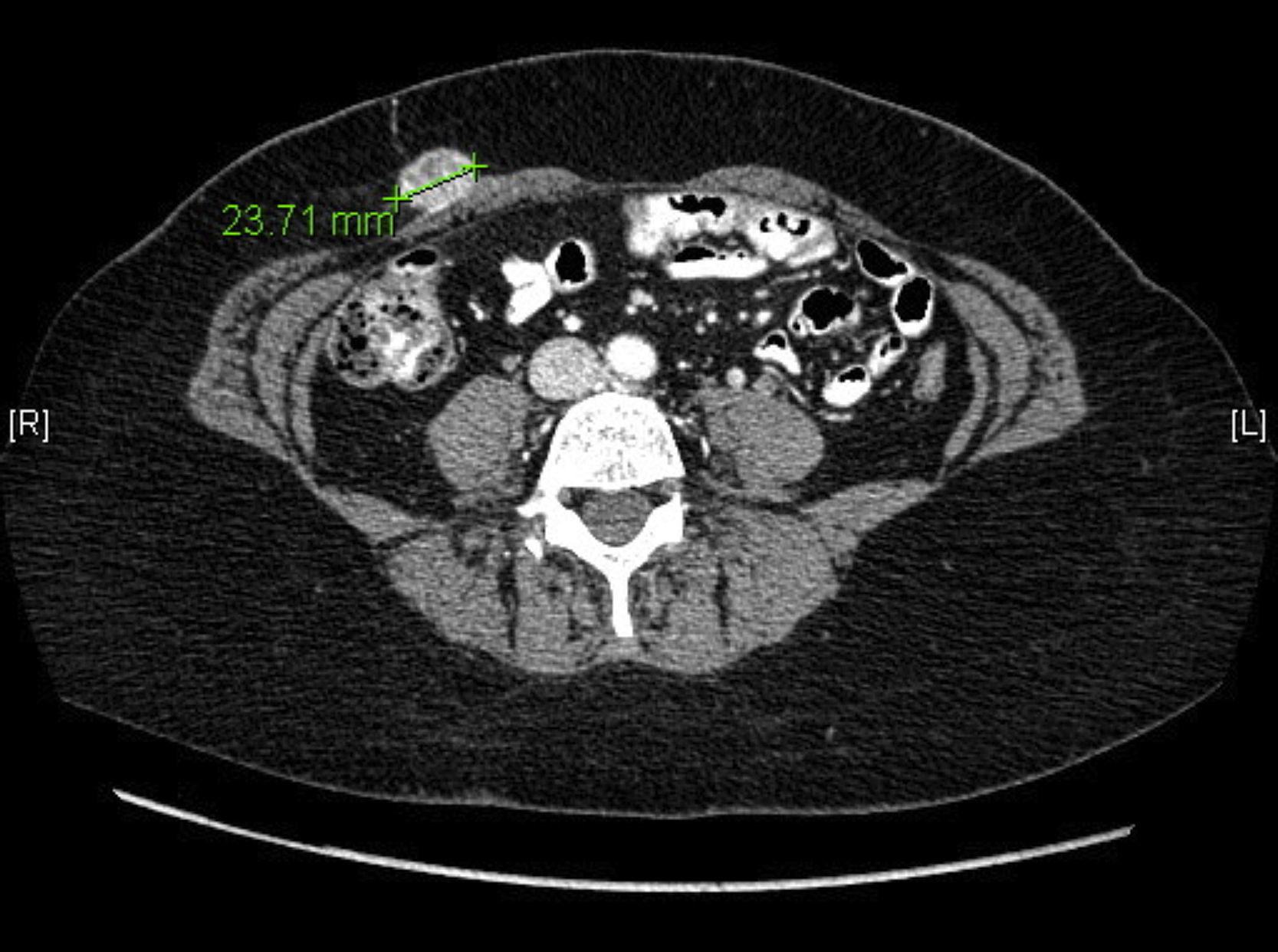
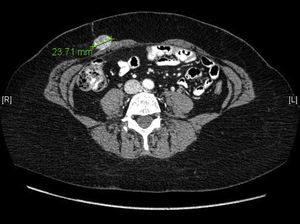
Se inicia tratamiento complementario con radioterapia externa y braquiterapia, que finaliza a los 4 meses tras la cirugía. A los 6 meses poscirugía, se realiza una TC de control sin hallazgos. A los 12 meses poscirugía, la paciente refiere astenia, coitorragia y dolor abdominal, con exploración ginecológica normal, y no se palpan masas abdominales a nivel de la pelvis. Se realiza una TC de control y marcadores tumorales, con los siguientes resultados: masa de 26×24mm en grasa subcutánea en la pared anterior del abdomen sobre recto anterior derecho, masa de 24mm en el recto abdominal anterior izquierdo y una última dudosa de 6mm (las 2 primeras localizadas en las incisiones de los trocares) y CA 125 de 131 U/ml y CEA 1,37 U/ml (fig. 1).
Se realiza punción aspirativa con aguja fina de las lesiones, que Anatomía Patológica informa de adenocarcinoma de probable origen ginecológico.
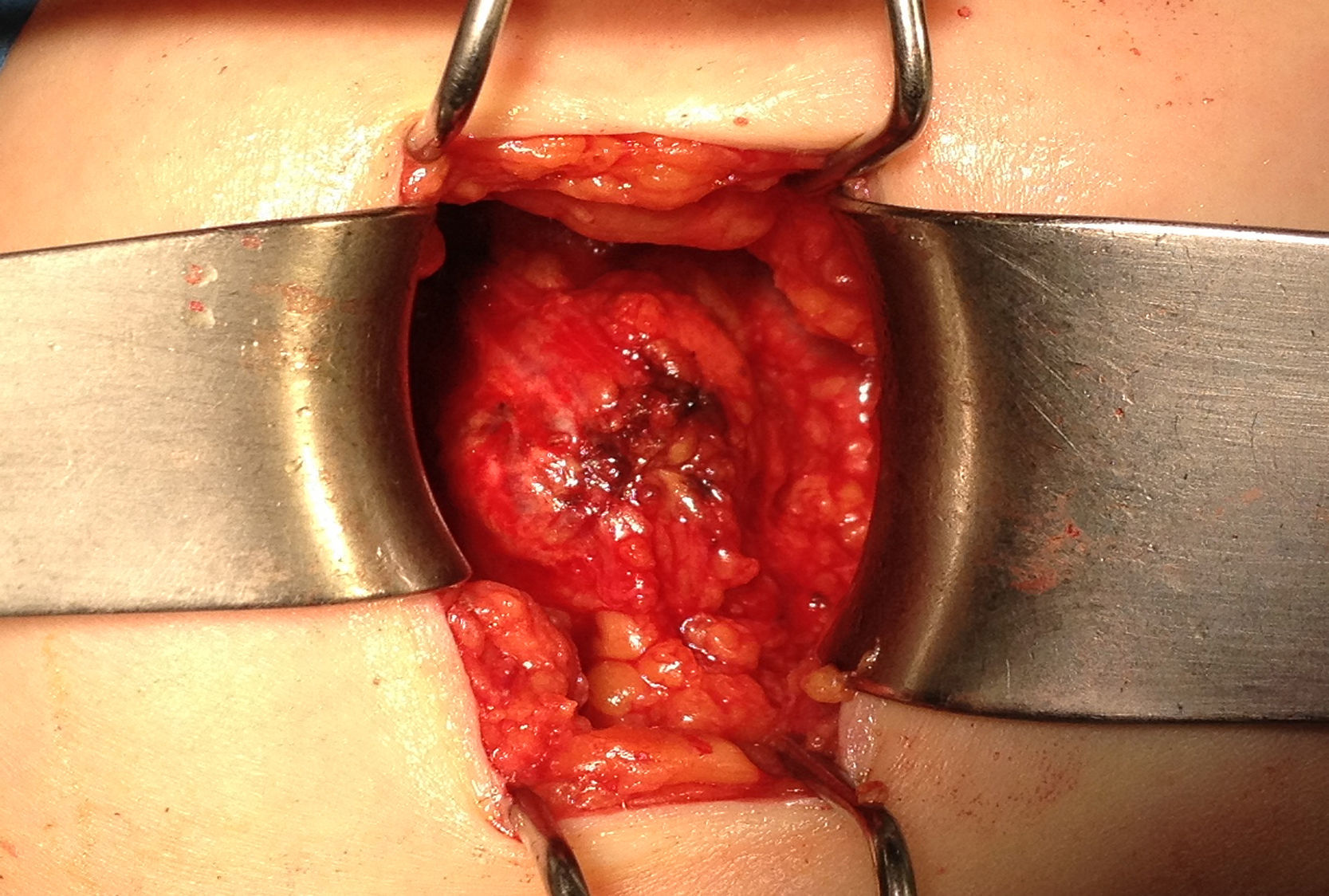
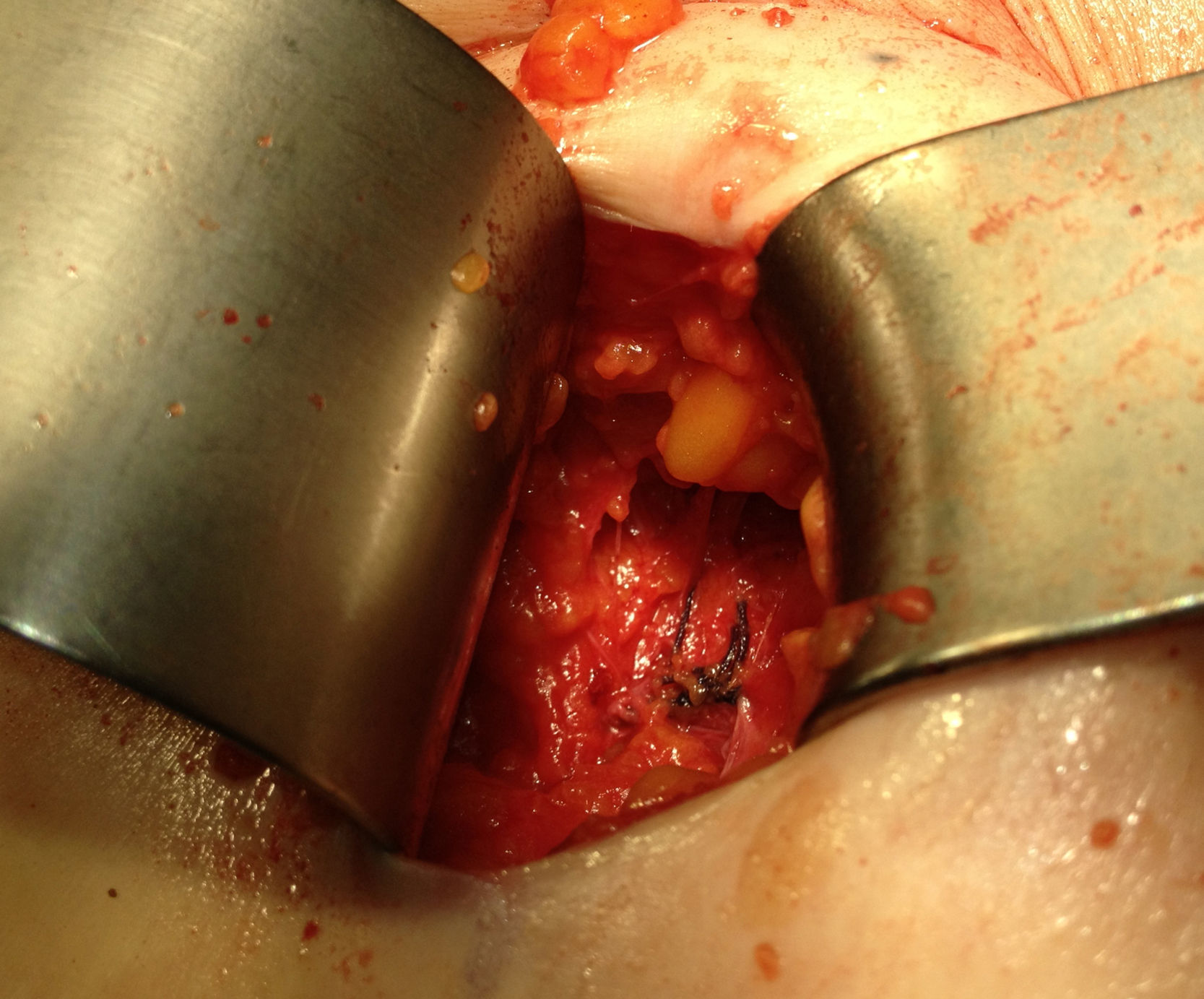
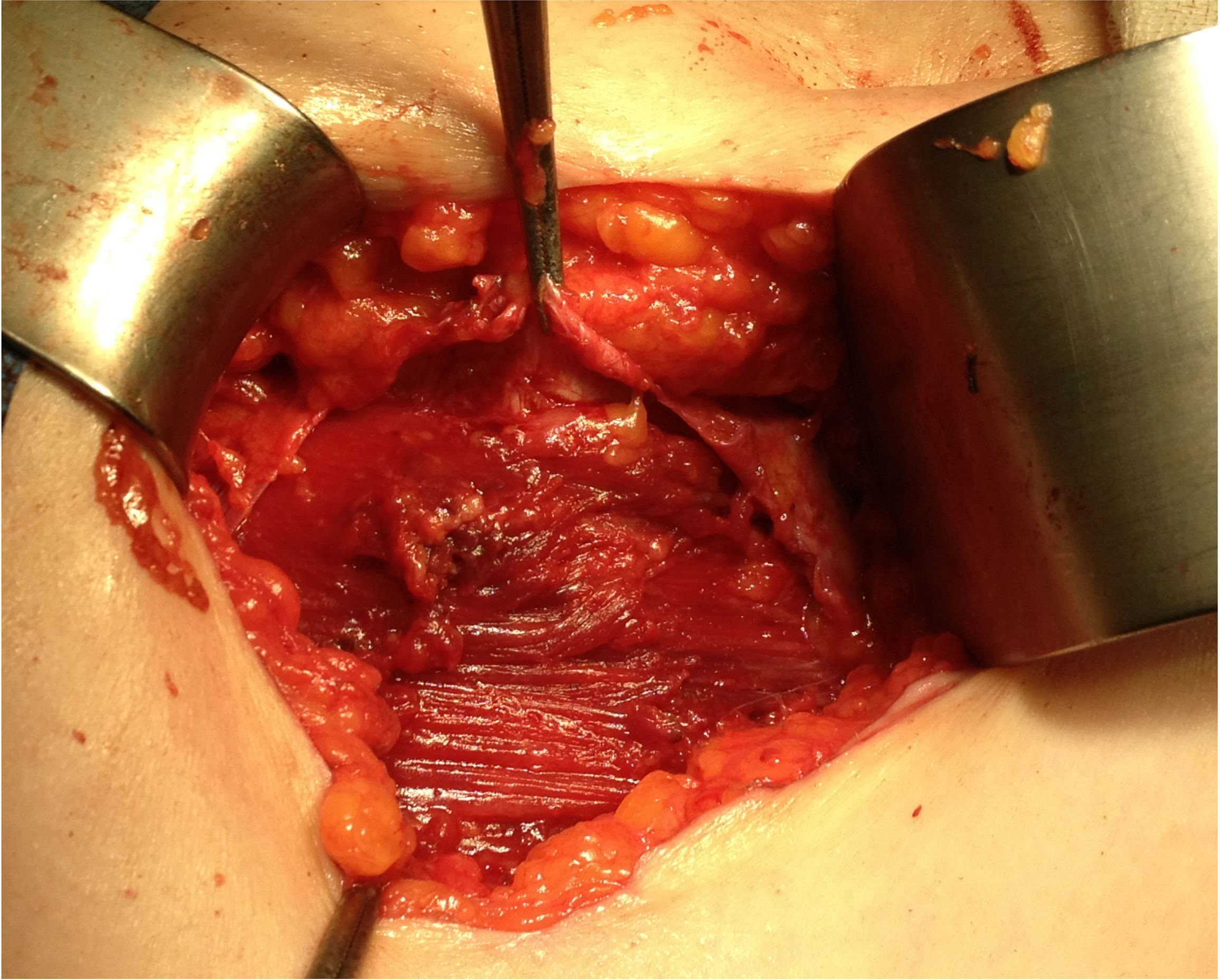
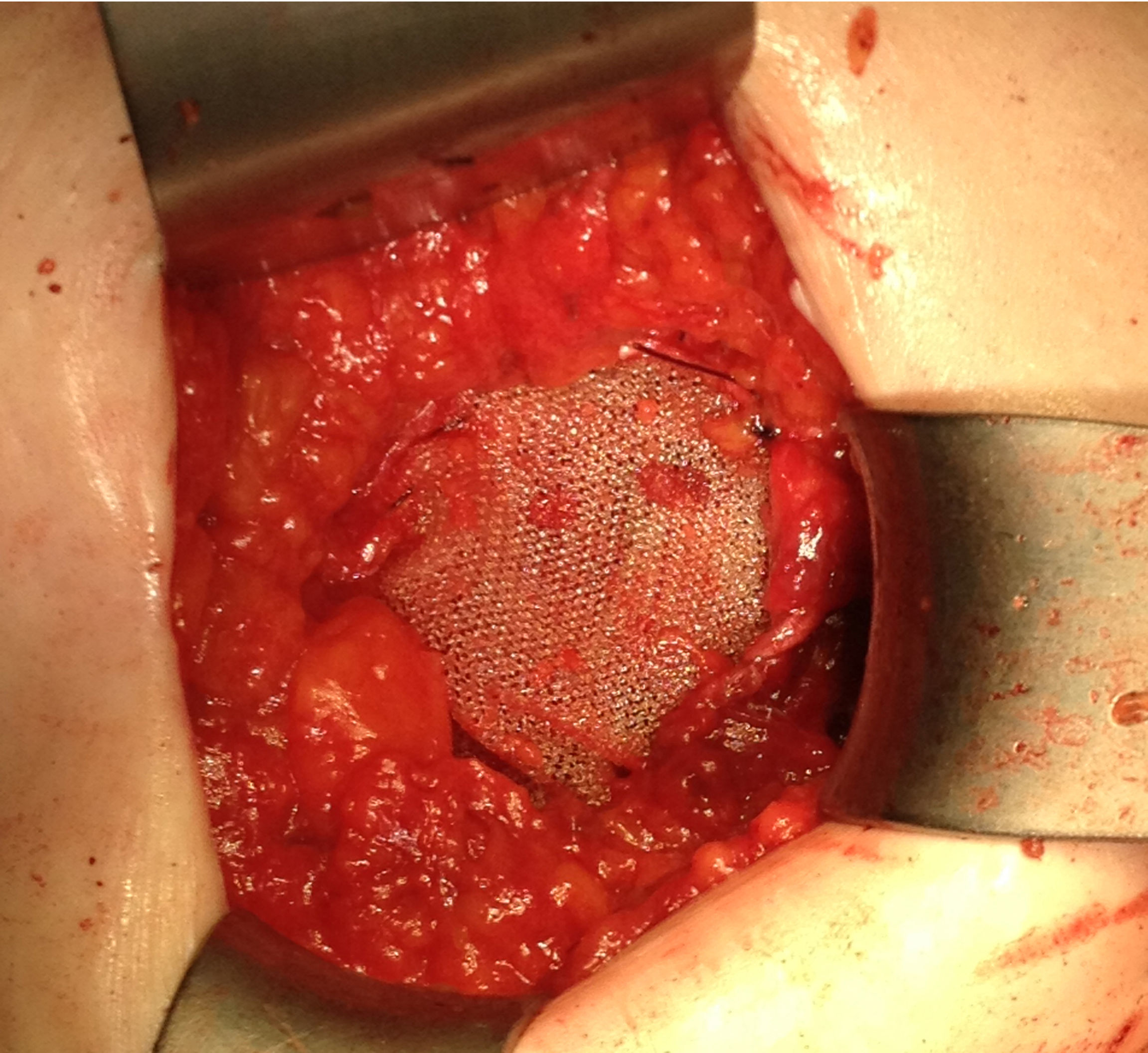
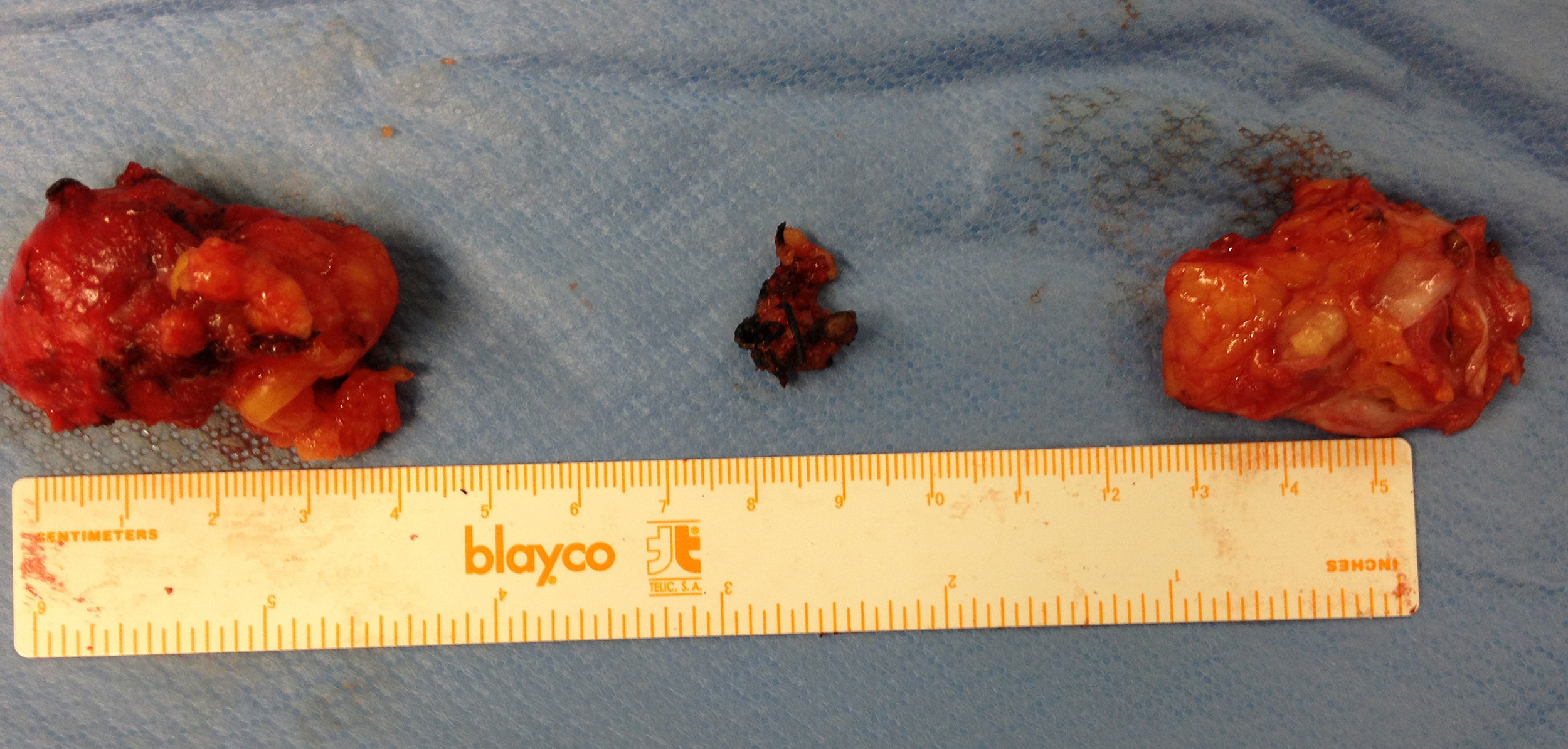
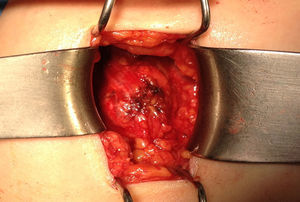
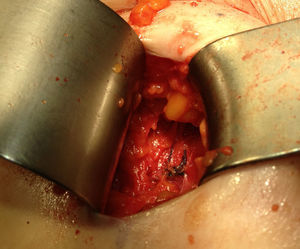
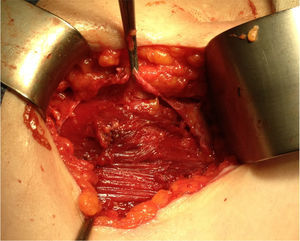
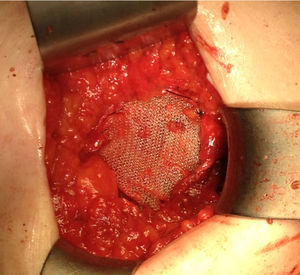
Ante la sospecha de port-site metástasis, como primer paso y para una correcta valoración de la cavidad abdominal, se realiza una laparoscopia diagnóstica. La vía de acceso fue abierta a través de la incisión infraumbilical de la cirugía previa con trocar de Hasson (utilizando presiones menores de 12mmHg). No se aprecia ningún implante peritoneal ni ascitis, por lo que, en un segundo paso de la cirugía, se procede a la escisión de ambas masas tumorales de mayor tamaño, incluyendo tejido subcutáneo y fascia muscular (fig. 2). Ninguna de las 3 invade el músculo subyacente. La tercera lesión evidenciada en la TC resultó ser un granuloma formado alrededor de un punto (fig. 3).Debido al defecto en la pared abdominal secundario a la resección de los nódulos tumorales, se colocan en ambos defectos una malla de polipropileno de baja densidad a nivel de la fascia (figs. 4 y 5). Se deja un drenaje en cada malla, se realiza el cierre de piel con grapas.
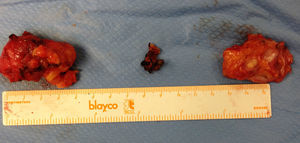
La anatomía patológica informo de 2 nódulos de 5,5×3×2cm y 4,5×3×1cm, morfológicamente congruentes con adenocarcinoma de tipo seroso, con bordes libres. El tercer nódulo, de 1,5×1cm, se informa con fibrosis densa hialinizada (fig. 6).
Tras la cirugía, se llega al consenso de no realizar radioterapia localizada en las lesiones, debido a la falta de experiencia para recomendar dicho tratamiento. Se inicia tratamiento quimioterápico con carbo-taxol de 4 a 6 ciclos en función de la tolerancia de la paciente.
En la actualidad, la paciente esta libre de enfermedad.
DiscusiónTradicionalmente, las cirugías ginecológicas oncológicas se realizaban por laparotomía; en los últimos años, los ginecólogos han introducido la laparoscopia para este tipo de intervención. Con el aumento del número de cirugías oncológicas por vía laparoscópica ha habido mayor desconcierto sobre las recurrencias de la enfermedad en los orificios de los trocares. El primer caso fue descrito en 1978 por Dobronte et al.1, tras una laparoscopia diagnóstica.
La incidencia de esta complicación es baja, aunque es difícil obtener datos exactos debido a los pocos casos descritos en la literatura. Ramirez et al.2 hablan de cifras entorno al 1-2%. Y Nodofor et al.3, de menos del 1,1%.
En la serie con mayor número de casos (Zivanovic et al.4) señalan una incidencia del 1,18%, de las cuales un 95% presentaba carcinomatosis o metástasis en otros lugares simultáneamente. Por ello, muchos autores consideran que las metástasis en los orificios de los trocares son debidas al estadio avanzado del tumor.
Por otro lado, hay que mencionar que la definición de la metástasis en los orificios de los trocares es la recurrencia tumoral precoz y localizada en la pared abdominal en uno o varios orificios de los trocares, tras una laparoscopia, que no está asociada a carcinomatosis peritoneal y que, si existe esta última, debería considerarse otra entidad o complicación dentro de un expansión tumoral abdominal generalizada5.
En la actualidad, existen únicamente 3 casos clínicos descritos de metástasis en el orificio del trocar «aislada» tras cirugía gineco-oncológica robótica en la literatura internacional6-8. Hasta la fecha, de todos los casos publicados tras cirugía laparoscópica, solo 4 han sido descritos tras linfadenectomía paraaórtica retroperitoneal9-12, 3 de ellos en pacientes con adenocarcinoma de cérvix y uno con cáncer renal.
La fisiopatología de esta complicación no está aún bien definida. Probablemente, no es debida a una sola causa, sino al resultado de múltiples factores. Se han descrito distintos mecanismos de diseminación, como la hematógena (aunque solo un 1% de las células alcanzaran el torrente sanguíneo y de ellas el 0,1% tienen capacidad de inducir una metástasis2), contaminación directa debido a algún implante en la pared abdominal, hipoxia del tejido subcutáneo cercano al trocar y la subsecuente inducción de la angiogénesis12, el efecto del CO2 del neumoperitoneo, el efecto chimenea (células tumorales nebulizadas por los orificios de los trocares), reacción inmunitaria local y, sobre todo, variables dependientes de la técnica quirúrgica13.
Se piensa que ciertos procedimientos durante el acto quirúrgico están involucrados en la mayor frecuencia de esta entidad. Así, se han señalado la rotura de la pieza tumoral en la cavidad peritoneal (como el caso que nos ocupa), los márgenes tumorales afectados, la contaminación de los instrumentos quirúrgicos, la manipulación y la movilidad de los trocares, la extracción del neumoperitoneo tras la extracción de los trocares en lugar de extraer el neumoperitoneo por los trocares y la utilización de trocares lisos y no espirales6. Tampoco hay que olvidarse de que los estadios tumorales avanzados, los grados histológicos indiferenciados y ciertos tipos de tumor son más propicios a tener este tipo de complicación. Además, como otro factor de riesgo, se ha descrito el enfisema subcutáneo.
Debido a todo ello, las últimas actualizaciones hablan de ciertas medidas profilácticas a tener en cuenta, como la irrigación de los trocares y los orificios de entrada con povidona yodada, realizar incisiones acordes con el tamaño del trocar y fijar los trocares a la pared abdominal para evitar fugas de CO2, realizar una cirugía con el mínimo trauma tisular posible, la utilización de CO2 a presiones y flujos correctos, resecar la lesión tumoral con márgenes de seguridad, la utilización de bolsas para extracción de la pieza, la extracción de todo el líquido restante de la cavidad peritoneal, la utilización de trocares con paredes espirales y no lisas, retirar el neumoperitoneo previa extracción de trocares, suturar la fascia en aquellos orificios ≥ 10mm o, según otros autores, incluso los orificios de 5 mm o más4 y, por último, otros autores hacen referencia a la utilización de quimioterapia intraperitoneal2,14,15.
El tratamiento de estas lesiones es su escisión quirúrgica, a la que se le puede unir la radioterapia o tratamiento quimioterápico15,16.
Cabe cuestionarse si estas metástasis «aisladas» en realidad lo son o existe una diseminación tumoral «escondida», con posibles micrometástasis no diagnosticadas. Zivanovic et al.4 hablan de que el pronóstico de aquellas pacientes en las que esta complicación aparece antes de los 7 meses de la cirugía tiene una media de supervivencia de 12 meses, mientras que aquellas pacientes en las que apareció más tarde tienen una media de supervivencia de 37 meses. Aunque hay descrito en la literatura algún caso con una supervivencia de 4 años17.
Tras este caso clínico, en nuestro servicio hemos tomado aquellas medidas preventivas que no solíamos tomar con anterioridad, como irrigar povidona yodada en los orificios de los trocares y a los trocares, fijarlos a la pared abdominal, además de suturar la fascia de todos los orificio de los trocares.
ConclusiónEn la actualidad, no es posible definir con claridad la incidencia, los factores de riesgo, las medidas preventivas, el manejo ni el pronóstico de esta complicación. De todo ello, quizás lo más descorazonador es el desconocimiento de la fisiopatología, lo que conlleva no poder tomar medidas preventivas. Se debe destacar que en cirugía robótica tenemos, además, el hándicap de que los trocares robóticos son lisos (no espirales), hecho que, como hemos visto, se incluye entre los factores de riesgo.
Es probable que, en los próximos años, el número de metástasis en el orificio del trocar aumenten debido al incremento de las cirugías oncológicas por vía laparoscópica y, sobre todo, robóticas por la cada vez mayor utilización de esta técnica.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.